1ª PONENCIA
MEDICINA DE LA EVIDENCIA EN PERINATOLOGÍA
Hasta qué punto es válido el estudio con pulsioximetría
J. Mínguez
R. Sánchez Sánchez
A. Perales
J. Monleón Sancho
R. Domínguez
J. Monleón
Hospital Universitario La Fe. Valencia
Perinatal y asfixia son términos utilizados en el lenguaje obstétrico-legal. Así mucha gente considera la hipoxia al nacimiento como única causa de daño neurológico en los niños. Sin embargo, es difícil establecer en su justo término el papel de la hipoxia en la génesis de la parálisis cerebral, pues ésta se mantiene constante en los países civilizados entre un 1-2 por 1.000 a pesar de los avances de los métodos de control ante e intraparto y de haber multiplicado por 25 el número de cesáreas realizadas por indicación fetal(1).
Hay que ser conscientes de que el feto crece y se desarrolla en un medio relativamente hipóxico pero con suficiente O2 para cubrir sus necesidades(2), y ante una disminución de él dispone de unos mecanismos de adaptación y otros de compensación que constituyen la llamada «Reserva fetal» (Fig. 1).
RESERVA FETAL |
| A. ADAPTACIONES FETALES A LA HIPOXIA |
| * Mayor afinidad por O2 de la hemoglobina fetal. |
| * Mayor capacidad de los tejidos para extraer O2. |
| * Mayor resistencia tisular a la acidosis. |
| B. MECANISMOS DE COMPENSACION DE LA ASFIXIA |
| * Redistribución del flujo sanguíneo. |
| * Bradicardia. |
| * Menor consumo de O2. |
| * Glucolisis anaerobia. |
A + B = RESERVA FETAL |
Figura 1.Reserva fetal.
Ante una disminución del aporte de O2, un feto sano responde redistribuyendo el flujo sanguíneo con aumento de él en corazón, cerebro y suprarrenales, y una disminución en riñón, músculos y piel(3) y unido a un ahorro de energía por cese de sus movimientos, consigue una disminución del consumo de O2 por la sumación de factores tal como se esquematiza en la figura 2.
Figura 2. Redistribución del Flujo.
Si esta disminución de O2 persiste en el tiempo se produce un fallo de los mecanismos de compensación fetales y se origina:
Pérdida de la redistribución de flujo.
Hipotensión(4), fallo del gasto cardíaco(5) y disminución de la perfusión cerebral y posible lesión, que parece estar más relacionada con la caída de la presión arterial que con la hipoxia o la acidosis(6).
Esta asfixia perinatal va a estar relacionada con el daño cerebral, aunque hay que ser cautos al establecer esta relación. La academia Americana de Pediatría (APP) y el Colegio Americano de Obstetras y Ginecólogos (ACOG) en sus comités de Medicina Materno-fetal definieron los criterios para que la asfixia perinatal pueda causar daño neurológico(7) (Fig. 3). Si no se evidencia lo anteriormente expuesto no es posible concluir la existencia de asfixia perinatal.
CRITERIOS ACOG |
| * Acidosis metabólica o mixta (pH < 7,20) A.U. |
| * Apgar < 3 al 1.er minuto. |
| * Secuelas neurológicas: convulsiones, hipotonía, coma. |
| * Evidencias de disfunción multiorgánica en el período neonatal inmediato. |
Figura 3.Criterios ACOG.
Diagnosticar antes del nacimiento la existencia de una hipoxia es un reto formidable para el perinatólogo, aunque no hay acuerdo sobre cuál es la mejor manera de hacerlo intraútero. La mayoría de las pruebas hoy admitidas tienen una serie de características comunes: una alta sensibilidad que oscila entorno al 90% pero con una baja especificidad, por lo que el número de falsos positivos es muy elevado.
Es importante, además, no sólo diagnosticar la hipoxia, sino tratar de identificar valores de la misma que impliquen una amenaza de lesión neurológica, así como minimizar al máximo los riesgos de estas acciones diagnósticas(9).
Es importante conocer las características y limitaciones de las mismas pues «la percepción históricamente fuera de lugar de la contribución importante de la hipoxia intraparto como causa de parálisis cerebral, unido al uso de parámetros con poco valor predictivo ha hecho un daño enorme»(10).
Aunque con dificultad, debido a la protección que la evolución de los mamíferos ha puesto al feto humano, las pruebas existentes en la actualidad se basan en poner de manifiesto esas adaptaciones fetales a la hipoxia así como el momento en que comienzan a fallar.
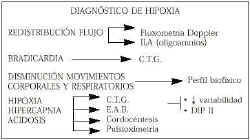
En la figura 4 hemos intentado resumir los mecanismos de adaptación del feto a la hipoxia así como la posibilidad clínica de detectarlos(11). Básicamente se dividen en dos grandes grupos llamados: métodos biofísicos, y métodos bioquímicos; de los primeros no haremos mención por pertenecer a otra parte de esta ponencia. Nos centraremos en los métodos de control intraparto, haciendo especial énfasis en el estudio de uno de ellos, la Pulsioximetría.
Figura 4. Diagnóstico de hipoxia.
En el transcurso del parto el método más admitido universalmente es el estudio del equilibrio ácido-base (EAB). Su objetivo es el diagnóstico de asfixia fetal, partiendo de la hipótesis de que la intensidad de la acidosis refleja el grado de asfixia. En el ser humano existe una buena correlación entre los parámetros del EAB de la sangre de cuero cabelludo obtenido mediante la técnica de Saling antes del nacimiento con la obtenida en los vasos umbilicales antes de la primera respiración del niño(12).
Cuando ocurre un episodio de hipoxia los cambios del EAB fetal son, un descenso de pH, de pO2 y un aumento de pCO2 y del déficit de bases. Pero el estudio del EAB no es completo sin la medida de O2 en sangre fetal. Los parámetros para esta medida son la pO2 y la saturación de O2.
La pO2 es una medida de presión y la saturación de O2 refleja la cantidad de oxígeno disponible para el metabolismo del feto, siendo mejor medidor de la oxigenación fetal y reserva que la pO2.
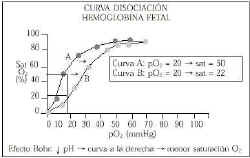
Debido al curva de disociación de la hemoglobina fetal (sigmoidea), pequeñas variaciones de pO2 representan grandes cambios en la saturación de O2(13). Además, el efecto Bohr hace que en casos de acidosis la curva se desplace hacia la derecha, por lo que tenemos decrementos de la saturación de O2 de hasta el 18% sin modificar la pO2, lo que nos daría una falsa sensación de seguridad (Fig. 5).
Figura 5.Curva Disociación Hemoglobina Fetal.
Por ello la medida de la saturación de O2 (cantidad de O2 unido a la hemoglobina que contiene la sangre, expresada porcentualmente) proporciona una mejor información sobre la oxigenación y reserva fetal, además de una alerta precoz en el desarrollo de la hipoxia permitiendo una actuación precoz. No nos da, no obstante, información sobre la facilidad para eliminar CO2, por lo que su uso no es exclusivo, sino complementario del estudio del EAB.
PULSIOXIMETRIA
Es una técnica de reciente incorporación a la medicina Materno-fetal que permite medir directamente la saturación de oxígeno de la hemoglobina fetal. Es pues complementaria de los métodos biofísicos y de la determinación del EAB, como ya hemos comentado.
El pulsioxímetro es un aparato que mide la cantidad de luz absorbida por un lecho vascular pulsátil. Consta de un diodo fotoemisor y de una célula fotosensible que registra los cambios de luz producidos al atravesar un campo el haz emisor.
Hay dos tipos de pulsioxímetros, los transmisores y los reflectantes. En los primeros la célula fotosensible está en oposición al diodo emisor, son los usados en anestesia y neonatología. En los diodos reflectantes el diodo emisor y la célula fotosensible están en la misma superficie.
Una revisión de los fundamentos ópticos en que se basa la pulsioximetría ha sido publicada por Mannheimer(14). En esencia la medida del O2 se basa en la diferencia de absorción de la hemoglobina oxigenada (HbO2) y de la no oxigenada o reducida (Hb). Estas hemoglobinas difieren en su capacidad para absorber la luz en función de su longitud de onda; la oxigenada absorbe más luz roja y la reducida más infrarroja. La proporción de absorbancia roja-infrarroja representa el contenido de O2 de la hemoglobina (Fig. 6).
Figura 6.Esquema Pulsioximetría.
Durante la sístole un pulso de sangre arterial entra en el lecho aumentando el volumen sanguíneo local e incrementando la absorción de luz. En la diástole la absorción es de menor intensidad. Utilizando el ratio de cambio de luz durante sístole y diástole de las dos longitudes de onda, el oxímetro realiza las medidas. Por convención se usa el término SpO2 para describir la saturación de O2 medida por pulsioximetría.
Como ya comentábamos antes los oxímetros fetales usan un método sensor de reflectancia en el que el diodo emisor y el fotodetector están adyacentes en la misma área de la piel y la absorción se determina a partir de la luz que se dispersa de vuelta a la superficie cutánea(15).
La técnica se presentó y probó en Japón en 1975(16), siendo a finales de los 70 cuando se comercializan los primeros pulsioxímetros que han llegado a ser usados ampliamente, sobre todo, en Anestesiología y Cuidados Intensivos.
Buschmann(17) adoptó los pulsioxímetros reflectantes a las necesidades obstétricas. En la actualidad constan de una cabeza emisora-receptora unida a un cable que conecta con el oxímetro y el cardiotocógrafo.
En la cabeza hay tres electrodos para detectar la impedancia fetal, un diodo emisor de luz roja-infrarroja, y un fotodetector. Todo ello constituye el sensor que se introduce por vía vaginal y va incluido en un cuerpo de silicona de 7*1*0,5 cm de longitud, amplitud y espesor, respectivamente. Al sensor se le adapta un fiador metálico que facilita su colocación intraútero y que se retira luego de ser colocado en la presentación fetal (Fig. 7).
Figura 7.Sensor Pulsioxímetro.
La señal captada es transmitida al oxímetro y cuando éste se halla conectado a un cardiotocógrafo, los valores de SpO2 se registran de forma continua. Los valores de frecuencia cardíaca fetal (FCF) que registra el oxímetro y los del cardiotocógrafo son muy próximos, aunque hay veces que no coinciden. Esto es debido a que se obtienen por procedimientos distintos,; un fenómeno parecido al que ocurre cuando se obtiene la FCF por electrocardiotocografía fetal o por ultrasonidos.
Actualmente cardiotocógrafo y oxímetro son aparatos distintos, pero en un futuro próximo se integrarán en uno sólo, de manera que al introducir la señal del sensor en un cardiotocógrafo preparado se obtendrá, además de la FCF y la presión amniótica, un registro continuo de saturación de hemoglobina fetal. El registro de saturación obtenido se inscribe en el papel del cardiotocógrafo en la zona de la dinámica uterina, aprovechando su escala y expresado en porcentaje (Fig. 8).
Figura 8. Cardiotocógrafo y Pulsioxímetro.
Modo de empleo
Para obtener un registro de pulsioximetría correcto hemos de introducir el sensor hasta colocarlo en la presentación fetal. Se consigue colocar con una dilatación de 2-3 cm y membranas rotas(18), aunque está descrito su uso con membranas íntegras(19); esto último haría la técnica mucho más versátil, aunque nosotros no tenemos ninguna experiencia.
Hay una serie de factores que afectan los resultados del pulsioxímetro y que trataremos de esquematizar (Fig. 9):
FACTORES QUE AFECTAN LOS RESULTADOS |
| 1. Características fisiológicas. |
| 2. Localización del sensor. |
| 3. Caput. |
| 4. Meconio en líquido amniótico. |
| 5. Dishemoglobinas. |
| 6. Proporción hemoglobina fetal. |
Figura 9.Factores que afectan los resultados.
1. Características fisiológicas.
2. Lugar de localización del sensor.
3. Caput.
4. Meconio en líquido amniótico (LA).
5. Dishemoglobinemias.
6. Proporción de hemoglobina fetal.
Iremos a continuación exponiendo cada uno de ellos.
1. Problemas fisiológicos
La forma sigmoidea de la curva de la hemoglobina implica que la relación entre la saturación de O2 y la pO2 depende de sus valores. En la zona intermedia de la curva la relación es lineal, es decir, a cada valor de saturación corresponde uno de pO2; pero en las zonas extremas (alta y baja de la curva) se pierde esa relación, por ello la saturación de la hemoglobina resultará insensible a los cambios de pO2 tal y como se esquematiza en la figura 10. Vemos como permanece constante la saturación aunque la pO2 baje del nivel crítico (18 mmHg.) y comiencen a aparecer deceleraciones de la FCF. En la clínica puede ocurrir en situaciones en que existe vasoconstricción (respuesta fetal a la hipoxia), anemia fetal(20).
Figura 10. Características Curva Hemoglobina Fetal.
2. Lugar de colocación del sensor
Estudios publicados por Dassel y cols.(21) encuentran diferencias de saturación de O2 con valores inferiores cuando el sensor está colocado sobre las fontanelas, zona occipital y área temporal. Esto depende de las diferencias ópticas (dispersión y absorción) del tejido localizado bajo el sensor. Esto puede mediatizar los resultados sobre todo si la dilatación es pequeña y no se puede colocar el sensor en el lugar adecuado (mejilla fetal).
3. Caput
Su influencia sobre los valores obtenidos de saturación ha sido estudiada, viéndose que los valores hallados se reducen en un 15%(22). Este efecto se debe a que en el caput hay un aumento del componente extracelular que reduce la proporción de luz absorbida por el lecho vascular de la piel fetal.
4. Meconio
El efecto del meconio sobre los resultados obtenidos por pulsioximetría ha sido estudiado in vivo e in vitro(23). Cuando el meconio impregna la piel se produce una disminución de los valores de pulsioximetría pues el meconio absorbe más luz roja que infrarroja. Esto ocurre con las membranas íntegras, al romperlas, se obvia este problema pues el sensor se sitúa directamente sobre la piel fetal.
Sólo en los casos en que se produce una aspiración meconial se encuentra una significativa disminución de la saturación de O2, lo que nos hace pensar que es probable que la aspiración meconial se asocie con hipoxia fetal más que con acidosis(24).
5. Dishemoglobinemias
El pulsioxímetro valora sólo las longitudes de onda de la hemoglobina (oxigenada y reducida), por ello cuando existen otras formas como la carboxihemoglobina (COHb) o la metahemoglobina (MetHb) los resultados obtenidos se encuentran falseados(25).
Las dishemoglobinas fetales, si bien en raras ocasiones, pueden estar presentes en diversas situaciones clínicas:
Enfermedad hemolítica.
Exposición materna al CO.
Fumadoras crónicas en cuyo caso la concentración de COHb en los fetos es de aproximadamente el 2%, aunque se admite que el error obtenido en la saturación de hemoglobina sólo sufre importantes variaciones cuando la COHb es superior al 10%.
6. Influencia de la proporción de hemoglobina fetal y adulta
La proporción de hemoglobina fetal varía con la edad gestacional, disminuyendo a medida que ésta avanza, de manera que se admite en el feto a término una proporción de hemoglobina F de 75% y de hemoglobina A de un 25%(26).
Existe una diferente longitud de onda para la hemoglobina fetal y la del adulto, pero se ha observado que el espectro de absorción es prácticamente idéntico en ambas longitudes de onda 650-100 nm. Que es la zona utilizada habitualmente en pulsioximetría.
Diferentes estudios(27) indican que la elevada proporción de hemoglobina F no altera significativamente la precisión de la pulsioximetría aun en la situación más desfavorable de un 100% de hemoglobina F. De todas maneras el tema relativo a evaluar la influencia de la hemoglobina fetal en humanos sigue siendo una cuestión sin dilucidar.
Creemos importante, antes de comenzar a exponer los resultados obtenidos por nosotros con esta técnica, así como la forma de actuación en función de los mismos, realizar unas consideraciones en torno a la calibración del electrodo-oxímetro.
Calibración del electrodo-oxímetro
La utilización clínica de la monitorización de la saturación de O2 fetal estriba ante todo en la capacidad de esta técnica para distinguir entre los valores normales y los hipóxicos del feto humano durante el trabajo de parto (dilatación) y en el período expulsivo. Es preciso definir con exactitud el nivel crítico de saturación de O2 que puede dar lugar a una acidosis fetal.
* Cómo se ha establecido el nivel crítico de saturación de O2.
Se ha realizado siguiendo cuatro criterios bien establecidos que esquematizamos en la figura 11 y comentamos detalladamente a continuación:
METODOLOGIA PARA ESTABLECER UMBRAL CRITICO DE SAT O2 |
| * 1. Revisión retrospectiva de publicaciones científicas. |
| * 2. Estudio prospectivo en animales. |
| * 3. Examen retrospectivo de valores observados en fetos humanos en parto con resultados normales. |
| * 4. Estudio para confirmar correlación entre saturación y pH en cuero cabelludo fetal. |
Figura 11.Criterios para establecer Nivel Crítico de Sat O2.
1. Revisión de publicaciones científicas
Richardson(28,29), a finales de los 80, estudió 11 fetos de carnero no anestesiados a los que sometió a una hipoxia prolongada y gradual. La disminución de O2 no produjo acidosis por encima del 40% de O2, entre 40-30% una acidosis leve, y por debajo del 30% se detectó una acidosis evidente y significativa acompañada de cambios en la actividad eléctrica cortical, en la actividad electro-ocular y en los movimientos respiratorios.
Sus estudios concluyen que una saturación de O2 igual o inferior al 30% constituye un valor umbral crítico.
2. Estudio prospectivo en animales
Nijland y cols. en 1995(30), realizaron un estudio en ovejas en las que se redujo el flujo de sangre en el espacio útero-placentario ocluyendo la arteria ilíaca común con un oclusor flexible e inflable. Se determinaron los valores de saturación con un pulsioxímetro N-400 y se verificaron los valores con mediciones en laboratorio de saturación de O2 en tomas de muestras sanguíneas. A medida que se producía una disminución de la saturación de O2 se producía un descenso moderado y progresivo del pH.
Experimentalmente se comprobó que cuando la saturación de O2 se encuentra en niveles superiores al 30% el metabolismo oxidativo puede mantenerse, al descender a valores entre 30 y 20% se produce un descenso del pH en algunos casos, mientras que en otros tiene lugar una estabilización. Esto significa que algunos fetos pueden compensar las saturaciones de O2 que se encuentran entre 20-30%, mientras que otros se deterioran a este nivel.
Si la saturación de O2 disminuye por debajo del 20% el metabolismo oxidativo no es capaz de mantenerse, lo que produce inevitablemente un descenso progresivo del pH y alteraciones en el exceso de bases.
3. Valores observados en fetos humanos en partos con resultados normales
Consiste en describir de forma retrospectiva la distribución de los valores de saturación de O2 observadas durante el trabajo de parto humano en fetos que presentaban unos resultados normales, esto es:
* Apgar > 7 al 5° minuto;
* pH de arteria umbilical > 7,15;
* pH de vena umbilical > 7,20;
* sin necesidad de reanimación superficial;
* que esté vivo al alta.
«El método para definir la línea divisoria entre valores normales y anormales de saturación de O2 consiste en definir el umbral crítico en un lugar igual o inferior al quinto percentil de la distribución de la saturación de O2.»
Se realizó el estudio de los valores observados durante 267 horas de estudio en un grupo de 87 fetos que cumplían las condiciones descritas.
4. Relación entre saturación de O2 y pH de cuero cabelludo fetal en trabajo de parto
Kühnert(31), en 1996, hizo un estudio multicéntrico prospectivo para tratar de cuantificar la coincidencia de predicción (si es que la hay) entre la saturación de O2 y el pH fetal obtenido por la técnica de Saling.
Los criterios para obtener los datos fueron, que el feto estuviera monitorizado con el sistema N-400, con monitorización de FCF, y que los investigadores consideraran cuando el patrón de FCF estaba alterado y era necesario la determinación de pH. Los valores de saturación de O2 se calcularon a partir de la inspección visual del diagrama de línea obtenido en los 10 minutos anteriores a la recogida de la muestra de pH.
Los criterios para la inclusión de los pares de datos fueron:
Inspección visual de la línea de saturación de O2.
No pérdida de señal 10 minutos antes de la toma de pH.
Valor correcto de pH (muestra válida).
Los resultados de 50 pares de lecturas de saturación de O2 y simultáneos valores de pH de 46 pacientes demostraron que fijando el umbral crítico de saturación de O2 en 30%, se obtenía una sensibilidad del 80% y una especificidad del 100%. Así, un valor del 30% de saturación de O2 era pronóstico de un pH en cuero cabelludo superior a 7,20.
Con lo expuesto hasta ahora consideramos suficientemente demostrado el valor de nivel de 30% de saturación de O2 como nivel crítico. Es el aceptado universalmente y el que a partir de ahora consideraremos cuando pasemos a exponer los resultados de nuestro estudio así como la pauta a seguir en su utilización clínica.
Con todo lo que hemos comentado hasta ahora, y a la luz de las pautas marcadas por la conocida como «Medicina basada en la evidencia», siendo conscientes de que lo que de veras nos importa es tratar de diagnosticar precozmente una hipoxia que pueda ser causa de daño cerebral fetal, y conociendo por los resultados de múltiples estudios multicéntricos que:
el índice de Apgar es un mal indicador de hipoxia,
que el estudio del cardiotocograma (CTG) tiene un elevado número de falsos positivos,
que el estudio del equilibrio ácido base fetal es un buen indicador del estado fetal, pero dentro de los límites (pH 7,15-7,35) y además tampoco es un buen predictor de lesión neurológica,
pensamos que la medida de la saturación de O2 puede ser un buen parámetro indicador de hipoxia. Además, creemos que cuantas más pruebas hagamos intervenir en el diagnóstico, mejores serán nuestros resultados.
Para ello, en nuestro medio, hemos realizado un estudio, primero para poner a punto las técnica ver los valores de normalidad, comprobar su validez y tratar de incorporarla a nuestro arsenal diagnóstico.
Nosotros usamos el oxímetro de pulso fetal NELLCOR N-400 y un sensor FS-14. Ya hemos comentado anteriormente las características del mismo, así como su modo de empleo y los factores que alteran los resultados obtenidos.
Para disminuir los errores por interferencias (movimientos fetales o maternos) el oxímetro permite medir la calidad del registro, así, no da valor de saturación de O2 si la señal detectada no tiene las características de una curva de pletismografía arterial fetal y no hay un buen contacto.
Para que el monitor acepte una lectura de saturación como de buena calidad, la señal recibida debe ser mayor o igual al 50%; es entonces cuando queda inscrita en la zona de la dinámica uterina.
Calidad del registro
Existen varias formas de interpretar la calidad del registro obtenido. Gardosi(32) comunica que basta con tener una señal adecuada para considerar el caso como un éxito.
McNamara(33) admite que se alcanza el éxito si se obtiene un trazado aceptable 30 minutos antes del parto. Nosotros, siguiendo a Dildy(34) usamos un índice que se obtiene dividiendo el tiempo correspondiente al tramo de buena señal entre el tiempo total del registro y multiplicando el resultado por 100. Si el valor supera el 50% se puede hablar de éxito (Fig. 12).
| CRITERIOS DE CALIDAD DEL REGISTRO | |
| Gardosi (1991) Obtener señal adecuada. | |
| McNamara (1992): 30 minutos antes del parto. | |
| Tiempo de buena señal x 100 = > 50% | |
| Dildy (1993): | |
| Tiempo total | |
Figura 12.Criterios de Calidad del Registro.
Efectos secundarios
No se ha encontrado diferencias ni en la morbilidad ni en la mortalidad entre las mujeres en que se ha empleado esta técnica con un grupo control(35); así mismo tampoco se encontraron aumento de infecciones(36) ni en los partos cefálicos ni en los podálicos(37). Nosotros, con una ya amplia experiencia, no tenemos ningún tipo de lesión materna ni fetal.
RESULTADOS PROPIOS DE PULSIOXIMETRÍA
Partos con presentación cefálica
En la figura 13 se muestran los valores normales de pulsioximetría en partos cefálicos que hemos obtenido y que coinciden con las de otros autores. Como podemos observar permanecen constantes a lo largo de todo el parto, incluso al final del período expulsivo, no encontrándose diferencias estadísticamente significativas entre los valores de los distintos períodos. Destacar que si restamos la desviación estándar a la media aritmética de cada grupo, las cifras que obtenemos están en todo momento por encima del 30%.
VALORES DE PULSIOXIMETRIA A LO LARGO DEL PARTO CEFALICO | ||
| 5 cm de dilatación | dilatación completa | final del expulsivo |
| 44 ± 11 | 43 ± 10 | 44 ± 11 |
| Diferencias no significativas | ||
Figura 13.Valores de Pulsioximetría Parto Cefálico.
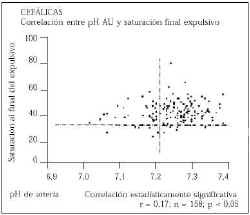
Hemos estudiado la correlación entre los resultados obtenidos con pulsioximetría y los obtenidos mediante el estudio del EAB. Encontramos correlaciones estadísticamente significativas entre los valores del estudio de EAB y la saturación de O2 en todos los períodos del parto. En las figuras 14 y 15 vemos las gráficas de dispersión que correlacionan los valores de pH y saturación en el período expulsivo, y el pH de arteria umbilical con la saturación al final del expulsivo, respectivamente, y cómo se distribuyen en los cuatro cuadrantes delimitados por las dos líneas de corte que fijan los valores de normalidad de pH (mayor o igual a 7,20) y de saturación (mayor o igual a 30%).
Figura 14. Correlación pH Saturación Período Expulsivo.
Figura 15. Correlación pH Arteria Umbilical y Saturación al final del Expulsivo.
En la figura 16 se resumen las medias de valores de pH en período expulsivo, según la saturación se considere normal (mayor o igual al 30%) o patológica (menor del 30%), las medias de pH son distintas (p < 0,005), siendo más baja (y patológica) cuando la saturación es patológica.
Figura 16.Valores Saturación y pH (Cefálicas).
Partos con presentación podálica
Hemos hecho lo mismo con los partos en presentación podálica, y en la figura 17 vemos la evolución de los valores de pulsioximetría a lo largo del parto podálico. Cabe destacar que en este caso sí que existen diferencias entre los valores del período de dilatación y del expulsivo, siendo en este período y al final del mismo, significativamente más bajos que durante la dilatación. Creemos importante destacar en este punto que si bien al inicio de nuestro estudio no encontrábamos diferencias significativas entre los valores obtenidos en los partos de nalgas y los obtenidos en los partos en cefálica; actualmente, contando con un número mayor de casos, encontramos que los valores de saturación en el período expulsivo y al final del mismo son significativamente más bajos en los partos en podálica que en los partos en cefálica.
Figura 17.Valores Pulsioximetría Parto Podálico.
Las correlaciones obtenidas en este tipo de partos entre los valores de pH y de saturación sólo son significativas en el período expulsivo (Fig. 18), y al igual que en las cefálicas, las medias de pH son diferentes según la saturación esté por encima o por debajo del 30% (Fig. 19).
Figura 18. Correlación pH y Saturación en Expulsivo.
Figura 19.Valores Saturación y pH (Podálicas).
Comentario especial merece el hecho de que durante el período expulsivo (máxima correlación) de las presentaciones de nalgas, si se lleva cuidado, se pueden obtener registros magníficos de pulsioximetría, incluso hasta la expulsión del tronco fetal, permitiendo así un control hasta el último momento del parto.
CONDUCTA OBSTÉTRICA EN FUNCION DE LOS RESULTADOS
Los valores obtenidos de pulsioximetría, siguiendo a Saling(38), los podemos clasificar en cuatro apartados y en función de ellos adaptaremos una conducta obstétrica determinada (Fig. 20).
Figura 20.Algoritmo Conducta Obstétrica.
A. Pulsioximetría de 30% o superior
En los casos en que la saturación de O2 es normal asumimos que el feto está bien, no debemos hacer otra cosa sino que seguir con el CTG y vigilar el registro de oximetría por si surge alguna alteración.
B. Pulsioximetría entre 20-30%
Admitimos que los valores de saturación de O2 son inferiores a los óptimos. Son casos éstos susceptibles de tocolisis y observación de la evolución de los valores. Pueden volver a la zona normal, en cuyo caso seguiremos una conducta expectante, o descender a valores inferiores a 20%, en ese caso pasamos al apartado siguiente que comentaremos. Si los valores tras la tocolisis permanecen en la banda 20-30%, la conducta más prudente es acabar la gestación.
C. Pulsioximetría entre 10-20%
En este grupo la saturación de O2 está gravemente disminuida. Son los casos susceptibles de practicar un estudio del EAB fetal y terminar la gestación si se detecta una acidosis fetal. En las clínicas en que no se realice de forma rutinaria este estudio es mejor considerar que el feto está hipóxico y terminar la gestación.
D. Pulsioximetría por debajo del 10%
Son valores altamente anormales de saturación de O2 y la medida a tomar es terminar la gestación administrando tocolíticos mientras se prepara y se pasa a la enferma para practicar una cesárea.
Con la combinación de estos métodos diagnósticos y tal y como exponemos en el esquema anterior, el obstetra dispone de métodos para detectar la hipoxia, lo que mejorará la conducción del parto y no cabe la menor duda, redundará en una mejoría de los resultados perinatales.
Nos encontramos con una nueva técnica bien contrastada tanto experimentalmente como en feto humano, con un fundamento fisiopatológico distinto a los utilizados habitualmente en Medicina Perinatal. Su finalidad es medir la saturación de O2 de la hemoglobina fetal que como hemos visto tiene un gran interés clínico.
Existe una buena correlación tanto en cefálicas como en podálicas con el EAB del expulsivo y de los vasos de cordón umbilical. Las limitaciones achacadas al principio de pérdida de señal a lo largo del curso del parto, vemos que van minimizándose a medida que adquirimos más experiencia en su uso.
Con todo, pensamos que no debe entrar en competición con las ya existentes, CTG, y estudio del EAB, sino que con su uso combinado nos acercaremos más a la realidad fetal.
Como cualquier otro procedimiento, tiene sus falsos positivos y sus falsos negativos, pero, como hemos comentado, con el límite establecido en 30% de saturación conseguimos una buena sensibilidad y especificidad.
Con el uso de diferentes métodos conseguiremos disminuir nuestros errores aunque como pasa siempre en Medicina, desgraciadamente no conseguiremos que lleguen a desaparecer del todo. Será preciso más publicaciones y una revisión sistemática de ellas para que la técnica tenga una aceptación y una evidencia, pero pensamos que nos encontramos en el comienzo de un camino que llevará a ello.
BIBLIOGRAFIA
1. Freeman JE. Prenatal and Perinatal Factors Associated with Brain Disorders. U.S. Dept: of Health and Human Services publications No (NH). National Institutes of Health 1985;85:1144-52.
2. Fabre E, Pérez Hiraldo MªP, González de Agüero R, de Agustín J. Limitaciones de los Estudios del Equilibrio ácido-base Fetal Intraparto. XXIII Congreso Nacional de la S.E.G.O. Sitges (Barcelona).5-10 junio, 1995.
3. Williams C, Mallard C, Tauw C, Gluckmand P. Fisiopatología de la Asfixia Perinatal. Clin Perinat 1993;2:327-45.
4. Hohime A, Chao C, Bissonette J. The effect of combined hypoxemia and cephalic hypotension on fetal cerebral blood and metabolism. J Cereb Blood Flow Metab 1991;11:99-105.
5. Mallard E, Gunn A, Williams S y cols. Umbilical cord oclusion causes cerebral damage in the fetal sheep. Am J Obstet Gynecol 1992;167:1423-30.
6. Fee S, Malee K, Deddish R. Severe acidosis and subsequent neurologic status. Am J Obstet Gynecol 1990;162:802-7.
7. Comite on Obstetrics Maternal and Fetal Medicine: Fetal and Neonatal Neurologic Injury. ACOG. Technical Bolletin 163. Washington DC. January, 1992.
8. Carter BS, Haverkamp AD, Merestein GB. The determination of acute perinatal asphyxia. Clin Perinatol 1993;20:2-9.
9. Nelson K, Stancey E. Asfixia al nacer y cerebro neonatal, ¿qué se sabe y cuánto se sabe? Clin Perinat 1993;2:347-63.
10. Brian S, Haverkamp A, Merestein C. Definición de asfixia perinatal aguda. Clin Perinat 1993;2:311-26.
11. Mínguez J, Monleón J, Domínguez R, Perales A. XV Congreso Nacional de Medicina Perinatal. Salamanca. Septiembre, 1995.
12. Kubli F. Influence of labor on fetal acid-base balance. Clin Obstet Gynecol 1968;11:168-73.
13. Blechner JN. Fisiología ácido-básica materno-fetal. Clin Obstet Gynecol 1993;1:3-11.
14. Mannheimer PD, Fein ME, Casciani JR. Physio-optical considerations in the design of fetal pulse-oximetry sensors. Eur J Obstet Gynecol Reprod Biol 1997;72(Supp.):S9-S19.
15. Elchalal U, Weiseman A, Abramov Y, Abramov D, Weometeind D. Intrapartum fetal pulse oximetry: present and future. Int J Obstet Gynecol 1995;50:131-37.
16. Severinghaus JW, Honda Y. History of blood gas analysis. VII. Pulse oximetry. J Clin Monit 1987;3:135-8.
17. Buschmann J, Rail G, Knitza R. Fetal oxygen saturation measurement by transmision pulse oximetry. Lancet 1992;339:615.
18. Monleón Sancho J, Desantes D, Perales A, Domínguez R, Mínguez J, Monleón J. Pulsioximetría fetal. Actas IV Congreso de la S.O.G.C.V. Peñíscola (Castellón), 1996.
19. Johnson N, Johnson V. Continous foetal monitoring with a pulse oximeter. A case of cord compression. Am J Obstet Gynecol 1989;161:1295-6.
20. Hanson MA, Nijhuis JG. Pulse-oximetry physiological considerations. Eur J Obstet Gynecol Reprod Biol 1997;72(Supp.):S3-S8.
21. Dassel ACM, Graaff R, Aardema M, Zijlstr WG, Aarnoudse JG. Effect of location of the sensor on reflectance pulse oximetry. Br J Obstet Gynaecol 1997;104:910-6.
22. Johnson N, Johnson V, Beamister B, McNamara H. The effect of caput succedaneum on oxygen saturation measurements. Br J Obstet Gynaecol 1990;97:493-8.
23. Johnson N, Johnson V, Beamister B, McNamara H. The effect of meconium on neonatal and fetal reflectance pulse-oximetry. J Perinat Med 1990;18:351-5.
24. Carbone B, Cudeville C, Sivan H, Cabrol D, Papiernik E. Fetal oxygen saturation measured by pulse oximetry during labor with clear or meconium-stained amniotic fluid. Eur J Obstet Gynecol Reprod Biol 1997;72(Supp.):S51-S5.
25. Zijlstra WG, Buurama A, Meeuwsen WP. Absortion spectra of human fetal and adult oxyhemoglobin, de-oxyhemoglobin, carboxyhemoglobin, and methemoglobin. Clin Chem 199;37: 1633-88.
26. Pologe J, Raley D. Effects of fetal hemoglobin on pulse oxymetry. J Perinatol 1987;7:324-6.
27. Mendeleon Y, Kent J. Variations in optical absorption spectra of adult and fetal hemoglobins and its effect on pulse oximetry. IEEE TRANSTIONS ON Biomedical Engineering 1989;36:844-8.
28. Richardson B, Carmichael L, Homan J, Patrick J. Electrocortical activity, electroocular activity, and breathing movements in fetal sheep with prolonged and graded hypoxemia. Am J Obstet Gynecol 1992;167:553-8.
29. Richardson B, Carmichael L, Homan J y cols. Cerebral oxydative metabolism in fetal sheep with prolonged, graded hypoxemia. Proceeding of the 36th Meeting of the Society for Gynecologic Investigation. March 15-18. 1989. San Diego CA. p.106.
30. Nijland R, Jongsman HW, Nijhuis J, Van der Berg P, Oeseburg B. Arterial oxygen saturation in relation to metabolic acidosis in fetal lambs. Am J Obstet Gynecol 1995;172:810-9.
31. Kühnert M, Seelbach-Göbel B, Butterwegge M. Presented at Fetal Oximetry Symposium. 3rd World Congress of Perinatal Medicine. October 21 1996. San Francisco. CA.
32. Gardosi J, Schram C, Symondg E. Adaptation of pulse oximetry for fetal monitoring during labour. Lancet 1991;337:1265-8.
33. McNamara H, Chung DC, Lilford R, Johnson N. Do fetal pulse oximetry readings at delivery correlate with cord blood oxygenation and acidemia? Br J Obstet Gynaecol 1992;99:735-8.
34. Dildy GA, Clark SL, Loucks CA. Preliminary experience with intrapartum fetal pulse oximetry in humans. Obstet Gynecol 1993;81:630-5.
35. Johnson N, Barker M, Kelly M y cols. The effect of monitoring the foetus with a pulse oximeter on puerperal morbidity. J Obstet Gynecol 1994;14:11-3.
36. Butterwegge M, Lampe S. Clinical results of pulse oximetry sub parta for measuring fetal arterial oxygen saturation. Geburtshilfe Freuenheilkd 1995;55:634-41.
37. Monleón Sancho J, Desantes D, Domínguez R, Perales A, Mínguez J, Monleón J. Pulsioximetría fetal. Actual Obstet Gynecol 1997;9:198-204.
38. Saling E. Fetal pulse oximetry during labour: issues and recomendations for clinical use. J Perinat Med 1996;24:467-78.