PROGRESOS DE OBSTETRICIA Y GINECOLOGÍA
Volumen 41 Número 10 Diciembre 1998
Ginecología
Relaciones entre la insulina y los andrógenos en mujeres con hiperandrogenismo ovárico
Relation between insulin and androgens in women with ovarian hyperandrogenism
J. A. López Fernández
P. Matallín Evangelio
J. Sánchez Payá 1
F. Diéguez de Benito
M. Mauri Dot 2
Servicio de Obstetricia y Ginecología
1 Servicio de Medicina Preventiva
2 Laboratorio de hormonas
Hospital General Universitario de Alicante
Maestro Alonso, 109
03010 Alicante
Correspondencia:
José Antonio López Fernández
Concejal Lorenzo Llaneras, 5, 7.º D
03005 Alicante
López Fernández JA, Matallín Evangelio P, Sánchez Payá J, Diéguez de Benito F, Mauri Dot M. Relaciones entre la insulina y los andrógenos en mujeres con hiperandrogenismo ovárico. Prog Obstet Ginecol 1998;41:589-596.
Aceptado para publicación 18/9/98
RESUMEN
Objetivo: Estudiar la existencia de resistencia insulínica (RI) en pacientes con hiperandrogenismo ovárico (HAO), y la repercusión del hiperinsulinismo agudo sobre los niveles de los andrógenos y la globulina transportadora de esteroides sexuales (SHBG).
Material y métodos: Veinticinco mujeres con HAO (hirsutismo, oligomenorrea y elevación de testosterona (T) y/o androstendiona (A): Nueve obesas (IMC > 25) y 16 no obesas. Catorce mujeres sanas. Se realizó una prueba de tolerancia oral con 100 g de glucosa (PTOG) para determinar glucosa (G), insulina (I), T, A, deshidroepiandrostendiona sulfato (DHEA-S) y SHBG a los 0, 60, 120 y 180 minutos. Adicionalmente, en los controles se realizó un test placebo para realizar las mismas determinaciones.
Resultados: Las HAO no obesas presentaron áreas bajo curva (ABC) de insulina mayores que los controles (7.141 vs 5.538 mU/ml/min); en las pacientes HAO, la obesidad incrementó el valor del ABC I (8.538 vs 7.141 mU/ml/min). Los niveles séricos de A y T descendieron durante la PTOG (p < 0,001); DHEA y SHBG no modificaron sus concentraciones durante la curva. El placebo determinó igualmente descensos en los niveles de T y A (p < 0,001).
Conclusiones: Las mujeres HAO presentan resistencia insulínica respecto a los controles. La glucosa en fase aguda no modifica la expresión normal de los andrógenos y por tanto la PTOG no sería útil para demostrar la influencia de la insulina en la génesis del HAO.
PALABRAS CLAVE
Insulina; Andrógenos; Resistencia insulínica; Hiperandrogenismo ovárico.
ABSTRACT
Objectives: To study the presence of insulin resistance (IR) in patients with ovarian hyperandrogenism (OHA), and the effects of acute hyperinsulinism on the levels of androgens and the sex hormone-binding globuline (SHBG).
Material and methods: Twenty four women with HAO (hirsutism, oligomenorrhoea and raised levels of testosterone (T) and/or androstendione (A): nine obese (BMI > 25) and fifteen not obese. fourteen healthy women. An oral tolerance test was carried out with 100 g of glucose (OGTT) to determine the glucose (G), insulin (I), T, A, dehydroepiandrosterone sulfate (DHEA-S) and SHBG immediately and after 60, 120 and 180 minutes. A placebo test was also given to the control group to determine the same measurements.
Results: No obese OHA showed greater areas under the curve (AUC) of insulin than the control group (7,141 vs 5,538 mU/ml/min); obesity increased the value of the AUC I in OHA patients (8,538 vs 7,141 mU/ml/min). The serum levels of A and T decreased during the OGTT (p < 0.001); the concentrations of DHEA-S and SHBG did not change along the curve. The placebo test also showed decreases in the levels of T and A (p < 0.001).
Conclusions: Women with HAO show insulin resistance compared with the control group. In the acute phase, the normal production of androgens is not modified by glucose and the PTOG does not demonstrate the effect of insulin on the development of OHA.
KEY WORDS
Insulin; Androgens; Insulin resistance; Ovarian hiperandrogenism.
INTRODUCCIÓN
Se cree que en estados de resistencia a la acción de la insulina, el exceso de esta hormona podría actuar como factor de crecimiento y estimular el desarrollo del ovario y la esteroidogénesis (1,2). Numerosos estudios in vitro(3,4,5) han demostrado la capacidad de la insulina (I) de estimular la secreción de andrógenos (A) en células ováricas en cultivo. Sin embargo, los estudios in vivo muestran resultados contradictorios, pues la presencia de resistencia insulínica en pacientes con hiperandrogenismo no es constante (6), la correlación de niveles séricos de insulina y andrógenos no es universal (7,8), y los distintos métodos de consecución de hiperinsulinismo no han exhibido una capacidad generalizada de demostrar que el aumento de insulina se acompaña de un aumento de los andrógenos circulantes (9,10). Por otra parte, el papel de la globulina transportadora de esteroides (SHBG) también es contradictorio.
Nos planteamos realizar el siguiente trabajo con los objetivos de estudiar la existencia de resistencia insulínica (RI) en pacientes con hiperandrogenismo ovárico funcional (HAO), y analizar la repercusión del hiperinsulinismo agudo sobre los niveles de A y SHBG en estas mujeres.
MATERIAL Y MÉTODOS
Diseño: Se trata de un estudio observacional que por sus características se incluye en los estudios del tipo caso-control.
Sujetos de estudio: Se estudió un grupo de 25 pacientes en edad fértil diagnosticadas de HAO, atendidas en la Unidad de Ginecología Funcional del Hospital General Universitario de Alicante, destino al que llegan procedentes de las distintas consultas de ginecología general de todo el área de referencia (Área 18 de la Comunidad Valenciana). Se definió HAO por la presencia de hirsutismo (puntuación mayor de ocho según el esquema de Ferriman y Gallway (11)) y oligomenorrea (disminución de la frecuencia de la menstruación) junto con niveles séricos elevados de testosterona (T > 0,8 ng/ml) y/o androstendiona (A > 4 ng/ml). En función del índice de masa corporal (IMC), se dividieron en obesas, con IMC > 25 kg/m2 (n = 9), y no obesas, con IMC < 25 (n = 16). Todas estaban libres de cualquier otra enfermedad concomitante y en ningún caso hubo evidencia clínica ni analítica de otra causa distinta de HA. El grupo control lo formaron 14 mujeres voluntarias trabajadoras del hospital, sanas y con ciclos menstruales regulares.
Pruebas realizadas: En pacientes y controles, se realizó una prueba de tolerancia oral con 100 g de glucosa (PTOG) y se determinaron las concentraciones séricas basales de glucosa (G), I, T, A, deshidroepiandrostendiona sulfato (DHEA-S), SHBG, hormona luteoestimulante (LH) y hormona foliculoestimulante (FSH), así como las concentraciones de G, I, T, A, DHEA-S y SHBG a los 60, 120 y 180 minutos. En las pacientes del grupo control, se realizó adicionalmente un test de sobrecarga con placebo. Las pruebas se realizaron en la fase folicular precoz (dos-siete días tras una menstruación espontánea o inducida) y comenzaron a las 8,30 de la mañana. La glucosa plasmática se determinó por el método de la glucosa oxidasa (Hitachi). La insulinemia se determinó mediante IRMA (Medgenix). El coeficiente de variación (CV) intraensayo fue del 6,4%. Los niveles séricos de T, A y DHEA-S se cuantificaron mediante RIA directo utilizando los siguientes equipos comerciales: T, Radioassay Systems Laboratories (Inc. California); A, Clinical Assays (Incstar, Stillwater, MN); DHEA-S, Diagnostic Products Corporation (LA California). Los CV intraensayo fueron del 4,2% para T, 6,5% para A y 5,5% para DHEA-S. Las concentraciones de SHBG, FSH Y LH se midieron mediante IRMA (Orion). Los CV intraensayo fueron del 4,5% para SHBG, 6% para FSH y 5% para LH.
Métodos estadísticos: Dado que las variables no seguían una distribución paramétrica, se han descrito usando la mediana como medida de centralización, y los percentiles 25 y 75 como medidas de dispersión. Las áreas bajo curva (ABC) se calcularon mediante el método trapezoidal (12).
Para estudiar la asociación entre los niveles séricos de las distintas hormonas se utilizó el coeficiente de correlación de Spearman. Para la comparación de las concentraciones séricas entre grupos en cada uno de los momentos en el tiempo, se utilizó el test de la U-Mann Whitney. Para la comparación de los niveles de cada una de las hormonas a lo largo del tiempo se utilizó el test de Friedman.
RESULTADOS
La edad de las pacientes fue de 20 años (22-28). Como se aprecia en la tabla 1, las pacientes HAO mostraron mayores niveles de T, A y DHEA-S que el grupo control. La concentración de insulina (I) fue igualmente mayor en el grupo de pacientes con hiperandrogenismo ovárico funcional (HAO) que en el grupo control. La obesidad determinó un incremento de estos niveles. Por contra, las pacientes HAO presentaron niveles de SHBG inferiores que en el grupo control. Las más obesas tuvieron menor concentración de SHBG.
| Tabla 1 Edad, índice de masa corporal (IMC) y niveles séricos basales de insulina, LH, FSH, andrógenos y SHBG en los grupos de estudio y control. Se expresan usando la mediana como medida de centralización y los percentiles 25 y 75 como medida de dispersión. El valor de p expresa la significación estadística según el test U-Mann Whitney (ns: no significativo) | ||||||||||
| H.A.O. | ||||||||||
| No obesas (n = 15) | Obesas (n = 9) | Control (n = 14) | ||||||||
| Mediana | P25 | P75 | Mediana | P25 | P75 | Mediana | P25 | P75 | ||
| Edad (años) | 20 | 19 | 23 | 29 | 25 | 30 | 24 | 23 | 28 | |
| IMC (kg/m2) | 21,6* | 20,3 | 23,2 | 28++ | 27,4 | 29,1 | 20,8 | 20 | 21,2 | |
| LH (mU/ml) | 7,7* | 5 | 10 | 13,2++ | 10,2 | 14,6 | 5,9 | 5 | 7,8 | |
| FSH (mU/ml) | 4,6 | 3,7 | 5,5 | 6,1+ | 4,5 | 6,5 | 3,7 | 3,3 | 4 | |
| I (µU/ml) | 8,9* ++ | 7,5 | 10,9 | 15,9++ | 11,5 | 18,8 | 5,8 | 5,17 | 8,35 | |
| Glu (mg/dl) | 83 | 76 | 90 | 90 | 73,5 | 97,5 | 82 | 71 | 85 | |
| SHBG (nmol/l) | 33,2+ | 20,5 | 58 | 26,7++ | 14,5 | 64,5 | 68,4 | 51,6 | 89,12 | |
| T (ng/ml) | 0,85* +++ | 0,65 | 0,9 | 1,2+++ | 0,75 | 1,37 | 0,24 | 0,2 | 0,4 | |
| A (ng/ml) | 4,3+++ | 3,4 | 5,3 | 4,4+++ | 3,5 | 5,5 | 2,6 | 2 | 3,55 | |
| DHEA-S (µg/ml) | 3,8+ | 2,5 | 4,8 | 3,65+ | 1,85 | 4,3 | 1,95 | 1,41 | 2,57 | |
| * p < 0,05 vs HAO obesas | ||||||||||
| + p < 0,05 vs control; ++ p < 0,01 vs control; +++ p < 0,001 vs control | ||||||||||
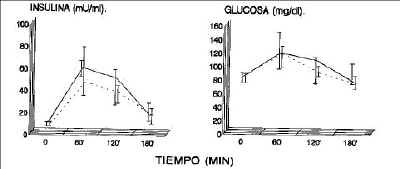
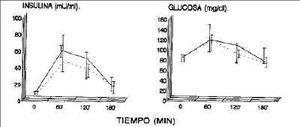
Las pacientes HAO no obesas presentaron ABC de I mayor que en el control (7.141 versus 5.538 mU/ml/min.); la obesidad incrementó el valor del ABC en el grupo estudio (8.538 en HAO obesas versus 7.141 mU/ml/min. en HAO no obesas). La figura 1 muestra la distribución de las concentraciones de I durante la PTOG en los distintos grupos, y se puede apreciar como se mantienen las diferencias punto por punto de la curva. No hubo diferencias estadísticamente significativas en cuanto al ABC de glucosa entre los distintos grupos.
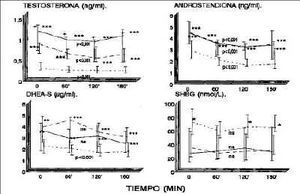
Figura 1.Niveles séricos de insulina y glucosa durante la prueba de tolerancia oral de glucosa en los grupos de pacientes HAO vs Control pareados para el índice de masa corporal. Curva de insulina: HAO: ABC 7.041 mU/ml/min (p < 0,0,5 vs control). Control: ABC 5.538 mU/ml/min. Curva de glucosa: HAO: ABC 17.580 mg/dl/min. Control: ABC 16.800 mg/dl/min. HAO. Grupo control.
Se estudió la correlación de los niveles séricos basales de I, A y SHBG. Se pudo demostrar una correlación negativa estadísticamente significativa entre I-SHBG (r = 0,39, p < 0,05) y entre ABCI-SHBG (r = 0,47, p < 0,05). En las pacientes HAO obesas, hubo correlación I-A (r = 0,71, p < 0,05) y ABCI-A (r = 0,49, p < 0,05), y mejoró el coeficiente de la relación I-SHBG (r = 0,47, p < 0,05) y de la relación ABCI-SHBG (r = 0,66, p < 0,05).
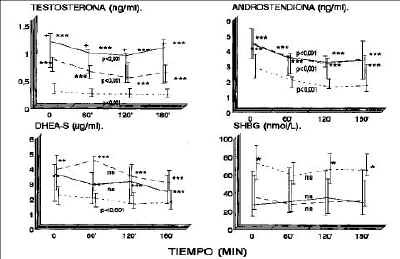
En la figura 2 se muestra el comportamiento de los andrógenos y SHBG durante la PTOG. Se puede apreciar que los niveles séricos de androstendiona (A) y testosterona (T) descienden durante la prueba. Estos descensos son estadísticamente significativos con p < 0,001. Los niveles de DHEA-S y SHBG no mostraron modificaciones estadísticamente significativas.
Figura 2.Concentraciones de andrógenos y SHBG durante la prueba de tolerancia oral de glucosa. El valor de p, expresa la significación estadística según el test de Friedman de las variaciones de los niveles a lo largo de la curva (ns, No significativo). El test de la U-Mann Whitney se usa para comparar las concentraciones séricas en cada momento del tiempo (+ p < 0,05 vs HAO no obesa; * p < 0,05; ** p < 0,01; *** p < 0,001 vs control). HAO obesas. HAO no obesas.
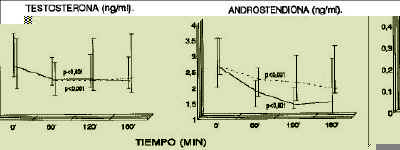
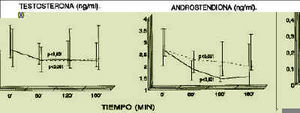
Para determinar si estos descensos obedecen al efecto de la I, o son independientes y responden a un ritmo diurno de secreción, se estudió el comportamiento de A y T durante un test con placebo en las mujeres sanas y se comparó con lo obtenido durante la PTOG. En la figura 3 se aprecia como el test placebo también se acompaña de descensos estadísticamente significativos de T y A, no hallándose diferencias en los porcentajes de cambio con respecto a lo ocurrido durante la PTOG.
Figura 3.Niveles séricos de testosterona y androstendiona durante las pruebas de tolerancia oral con glucosa y con placebo. No hubo diferencias en cada punto de la curva. Grupo HAO. Placebo.
DISCUSION
Participación suprarrenal en el HAO
En las pacientes con HAO, es característico el aumento de los niveles de DHEA-S sin alcanzar en ningún caso cifras que obligaran a descartar un origen primario suprarrenal del hiperandrogenismo. Se han comunicado hasta un 50% de aumentos de DHEA-S en mujeres diagnosticadas de síndrome de ovarios poliquísticos (SOPQ) (13), y una alta prevalencia de ovarios poliquísticos ecográficos en pacientes diagnosticadas de hiperplasia suprarrenal congénita (14). Se cree que la naturaleza de este androgenismo suprarrenal añadido al PCOS puede obedecer a déficits leves de 3-ß-OH-esteroidedeshidrogenasa (15) o a una disregulación simultánea en la suprarrenal y en el ovario de la 17-hidroxilasa y la 17-20-liasa, lo que refuerza el carácter funcional del hiperandrogenismo de nuestras pacientes y sugiere la anormalidad de un factor común, que podría ser la I, que junto con la LH estimularía la producción de A en la teca y en la suprarrenal (2).
Resistencia insulínica en el HAO
Hemos demostrado la presencia de hiperinsulinemia basal y estimulada en el grupo HAO con respecto al control, lo que refleja una resistencia insulínica (RI) relativa. Hallazgos similares han sido aportados por otros autores (6,7,16,17). También se ha evidenciado que la obesidad incrementa la RI 6, sin embargo, no depende sólo de la obesidad, pues cuando casos y controles se igualan según el IMC (Fig. 1), las pacientes HAO siguen teniendo mayor I basal y estimulada que las controles.
Se han establecido clasificaciones de las pacientes HAO según la resistencia insulínica (RI): HA-IR y HA-noIR (18). Nosotros pensamos que debido a los márgenes tan amplios que se expresan en el término RI, es más práctico admitir que la RI se relaciona en general con el SOPQ, y que por tanto, en todas las pacientes es interesante realizar esfuerzos diagnósticos para delimitar el grado de resistencia y orientar las medidas higiénico-dietéticas convenientes para prevenir el desarrollo de estados diabéticos, ya que se ha demostrado un incremento de su prevalencia en estas mujeres (19,20).
Variaciones de los andrógenos. Test en fase aguda
En el presente estudio, el aumento de I endógena tras una PTOG, se acompañó de descensos significativos de T y A con lo que no pudimos demostrar el efecto agudo de la I en la génesis del HAO. Existen algunos estudios que han usado igualmente la PTOG que muestrar resultados similares (8,10,16,21). Se ha argumentado que sólo consiguiendo cifras realmente altas de I, se podría demostrar un aumento de T y A; y así, Smith (17), comunica en 1987 aumentos de T y A durante la PTOG, en cinco pacientes hiperandrogénicas con respuestas de I mayores de 185 mU/ml a los 60 minutos. Lamentablemente, estos resultados no han sido reproducidos por otros autores. Además, este argumento se usa en aquellos trabajos en los que se utilizan métodos de asa abierta como el clamp hiperinsulinémico euglucémico; con estos tests, se consiguen cifras muy altas de I durante tiempos prologados (12-24 h). En algunos casos se ha demostrado que los niveles de T se elevan durante la prueba acompañando a la hiperinsulinemia (9,22); sin embargo, en otras ocasiones no se han observado variaciones de este andrógeno (23,24).
Estos hechos orientan a pensar que existe un subgrupo de pacientes con hiperandrogenismo ovárico funcional (HAO) en las que la I participaría en la génesis del hiperandrogenismo, pero los criterios de identificación no están determinados. Igualmente se pone de manifiesto que la PTOG no es un método útil para demostrar el papel causal de la I en el HAO, pues probablemente los cambios que esta hormona provoca en la esteroidogénesis ovárica exijan un período mayor de tiempo para producirse. La I podría actuar fundamentalmente disminuyendo la síntesis hepática de SHBG27, y de hecho, en nuestro estudio, se demuestra una correlación negativa entre los niveles basales de I y SHBG; Si además tenemos en cuenta que no hay variaciones agudas en la SHBG durante la PTOG, se podría deducir que los cambios que provoca la I en la génesis del HAO son crónicos, y por tanto, es razonable que los test agudos (PTOG, CLAMP) no aporten resultados concluyentes.
Ritmo diurno de secreción de andrógenos
El descenso de los niveles de T y A durante la PTOG no se puede atribuir al efecto de la insulina (I), pues hemos comprobado que también se produce tras la administración de un placebo. Es probable que exista un ritmo diurno de expresión de andrógenos o simplemente que el stress de la prueba provoque este descenso en las concentraciones de andrógenos, pues Hubbert (21) comprobó este ritmo descendente tras placebo cuando la prueba se inició a las 17 h. Nuestros resultados aportan que en fase aguda, la I no modifica el ritmo normal de expresión de los andrógenos y de la SHBG.
En resumen, las pacientes con hiperandrogenismo ovárico del presente grupo de estudio presentan resistencia insulínica con hiperinsulinemia compensadora, que podría contribuir en el androgenismo provocando el descenso de la globulina transportadora de esteroides. La prueba de tolerancia oral de glucosa no modifica la expresión normal de andrógenos, y por tanto, no sería un test útil para demostrar el papel de la insulina en la génesis del hiperandrogenismo ovárico.
BIBLIOGRAFÍA
1 Geffner ME, Golde DW. Selective insulin action on skin, ovary, and heart in insulin-resistant states. Diabetes Care 1988;11:500-50.
2 Barnes RB. Hyperandrogenism, polycystic ovary syndrome, and hirsutism. Current Opinion in Endocrinology and Diabetes 1994:200-5.
3 Barbieri RL, Makris A, Ryan KJ. Insulin stimulates androgen accumulation in incubations of human ovarian stroma and theca. Obstet Gynecol 1984;64:73S-80S.
4 Cara JF, Rossenfield RL. Insulin-like growth factor I and insulin potentiate luteinizing hormone-induced androgen synthesis by rat ovarian thecal interstitial cells. Endocrinology 1988;123:733-9.
5 Nahum R, Thong KJ, Hillier SG. Metabolic regulation of androgen production by human thecal cells in vitro. Hum Reprod 1995;10:75-81.
6 Dunaif A, Segal KR, Futterweit W, Dobrjansky A. Profound peripheral insulin resistance, independent of obesity, in polycystic ovary syndrome. Diabetes 1989;38:1165-74.
7 Chang RJ, Nkamura RM, Judd HL, Kaplan SA. Insulin resistance in nonobese patients with polycystic ovarian disease. J Clin Endocrinol Metab 1983;57:356-65.
8 Tropeano G, Lucisano A, Liberale I, Barini A, Vuolo IP, Martino G, Menini E, Dellacqua S. Insulin, C-péptide, androgens, and ß-endorphin response to oral glucose in patients with polycystic ovary syndrome. J Clin Endocrinol Metab 1994;78:305-9.
9 Dunaif A, Graf M, Laumas V. Insulin infusion increases androgen and estrogen production in polycystic ovary syndrome, but not in normal women. (Abstr. 878). Presentado en el 69 encuentro anual de la Sociedad de Endocrinología; 10-12 de junio 1987; Indianapolis, EE.UU.
10 Anttila L, Koskinen P, Jaatinen TA, Erkkola R, Irjala K, Ruutiainen K. Insulin hypersecretion together with high luteinizing hormone concentration augments androgen secretion in oral glucosa tolerance test in women with polycystic ovarian disease. Hum Reprod 1993;8:1179-83.
11 Ferriman D, Gallway JD. Clinical assessement of body hair growth in women. J Clin Endocrinol Metab 1961;21:1440-9.
12 Lanzone A, Fulghesu AM, Guido M, Fortini A, Caruso A, Mancuso S. Differential androgen response to adrenocorticotropic hormone stimulation in polycystic ovarian syndrome: relationship with insulin secretion. Fertil Steril 1992;58:296-301.
13 Hoffman DI, Klove K, Lobo RA. The prevalence and significance of elevated dehydroepiandrosterone sulfate levels in anovulatory women. Fertil Steril 1984;42:76-83.
14 Hague WM, Adams J, Rodda C, Brook CGD, Bruin R, Grant DB, Jacobs HS. The prevalence of polycystic ovaries in patients with congenital adrenal hyperplasia and their close relatives. Clin Endocrinol (Oxf) 1990;33:501-10.
15 Pang S, Lerner A, Stoner E, Levine LS, Oberfield SE, Engel I, New MI. Late-onset steroid 3ß-hydroxysteroid dehydrogenase deficiency. A cause of hirsutism in pubertal and postpubertal women. J Clin Endocrinol Metab 1985;60:428-36.
16 Smith S, Ravnikar VA, Barbieri RL. Androgen and insulin response to an oral glucose challenge in hyperandrogenic women. Fertil Steril 1987;48:72-7.
17 Buyalos RP, Pekonen F, Halme JK, Judd HL, Rutanen EM. The relationship between circulating androgens, obesity, and hyperinsulinemia on serum insulin-like growth factor binding protein-1 in the polycystic ovarian syndrome. Am J Obstet Gynecol 1995;172:932-9.
18 Barbieri RL. Hyperandrogenic disorders. Clin Obstet Gynecol 1990;33:640-54.
19 Dahlgren E, Johansson S, Lindstedt G. Women with Polycystic Ovary Syndrome wedge resected in 1956 to 1965: A long-term follow-up focusing on natural history and circulating hormones. Fertil Steril 1992;57:505-13.
20 Geisthovel F, Olbrich M, Frorath B, Thiemann M, Weitzell R. Obesity and hypertestosteronaemia are independently and sinergistically associated with elevated insulin concentrations and dyslipidaemia in pre-menopausal women. Hum Reprod 1994;9:610-6.
21 Hubbert GD, Schriock ED, Givens JR, Buster JE. Suppression of circulating androstenedione and dehydroepiandrosterone sulfate during oral glucose tolerance test in normal females. J Clin Endocrinol Metab 1991;73:781-4.
22 Stuart CA, Prince MJ, Peters EJ, Meyer WJ. Hiperinsulinemia and hyperandrogenism in vivo androgen response to insulin infusion. Obstet Gynecol 1987;69:921-8.
23 Nestler JE, Clore JN, Strauss III JF, Blackard WG. The effects of hyperinsulinemia on serun testosterone, progesterone, dehydroepiandrosterone sulfate, and cortisol levels in normal women and in a woman with hyperandrogenism, insulin resistance and acanthosis nigricans. J Clin Endocrinol Metab 1987;64: 180-4.
24 Farah MJ, Givens JR, Kitabchi AE. Bimodal correlation between the circulating insulin level and the production rate of dehydroepiandrosterone: Positive correlation in controls and negative correlation in the polycystic ovary syndrome with acanthosis nigricans. J Clin Endocrinol Metab 1990;70:1075-81.
25 Plymate SR, Matej LA, Jones RE, Friedl KE. Inhibition of sex hormone-binding globulin production in the human hepatoma (Hep G2) cell line by insulin and prolactin. J Clin Endocrinol Metab 1988;67:460-4.