Ginecología
¿Influye la edad en el pronóstico de las pacientes afectas de cáncer del cuello uterino tratadas mediante cirugía radical?
Does age influence the prognosis of patients with uterine cervix cancer treated by radical surgery?
M. Martín-Loeches
E. Asins
J. Llixiona
E. Cazorla
J. R. Bernabeu
T. Viñas
Sección de Ginecología Oncológica
Servicio de Ginecología
Hospital Universitario «La Fe» (Valencia)
Correspondencia:
Mariano Martín-Loeches de la Lastra
Abú-Zeyán, 8, 1.º-2.ª
03700 Denia (Alicante)
Fecha de recepción: 5/1/99
Aceptado para publicación: 9/9/99
RESUMEN
Objetivo: Estudiamos la influencia de la edad en el pronóstico y la evolución de las pacientes afectas de cáncer del cuello uterino en estadíos precoces.
Material y métodos: Estudio histórico retrospectivo de las 114 pacientes afectas de cáncer del cuello uterino tratadas mediante cirugía radical, en el período comprendido entre el año de inaguración de la Maternidad «La Fe» de Valencia, 1971 y 1989.
Resultados: El carcinoma de cérvix uterino tiene semejante pronóstico en los diferentes grupos de edad, no existiendo por lo tanto una correlación estadísticamente significativa entre los grupos de edad y el intervalo libre de enfermedad o el intervalo de supervivencia. Las pacientes jóvenes tienen un valor de hemoglobina menor en comparación con las pacientes mayores, hecho que denota un peor pronóstico.
Al realizar el cálculo de la regresión de Cox incluyendo la edad como variable discreta, el tipo de tratamiento preoperatorio empleado y la hemoglobina, vemos que la edad y el tratamiento preoperatorio pierden su significación a favor de la hemoglobina, que se muestra protectora y muy significativa.
Conclusiones: La edad no influye en el pronóstico y la evolución de las pacientes afectas de carcinoma cervical tratadas mediante cirugía radical.
PALABRAS CLAVE
Edad; Cáncer de cérvix uterino; Histerectomía radical y pronóstico.
ABSTRACT
Objetive: We are studying the influence of age in the prognosis and evolution of the patients affected by cancer of the uterine cervix in early stages.
Material and methods: Retrospective historic study of the 114 patients affected by cancer of the uterine cervix who have been treated by radical surgery in the period between the opening of «La Fe» Maternity Unit of Valencia, 1971 and 1989.
Results: The carcinoma of the uterine cervix has similar prognosis in the differents age groups, wich confirms the existence of a statistically no significant correlation between age groups and intervals free from illness or the interval of survival. Young patients have a lower haemoglobin value when compared with older patients, fact which denote a worse prognosis.
When the calculation of Cox''s regression is made, including age as a discrete variable, the type of preoperatory treatment employed and the haemoglobin, it can be seen that age and preoperatory treatment lose significance in comparison with the haemoglobin, which seems to be protective and extremely significant.
Conclusions: Age bears no influence on the prognosis and evolution of patients affected by cervical carcinoma who have been treated by radical surgery.
KEY WORDS
Age; Uterine cervix cancer; Radical hysterectomy and prognosis.
INTRODUCCION
Un gran número de publicaciones recientes sugieren que la incidencia del carcinoma cervical en mujeres jóvenes está aumentando(1), y que estos tumores cada vez son más agresivos(1-6); demostrando que existen diferentes edades en las cuales empeora el pronóstico, en pacientes menores de 30 años(5), 35 años(5) o 45 años. Y como factor pronóstico favorable, la edad mayor de 60 años(3).
Elliot et al.(1) y otros autores(7-9), encuentran un relativo aumento de la incidencia y un mayor grado de malignidad en los grupos de mujeres jóvenes; en cada estadío clínico las mujeres jóvenes tienen mayor riesgo de invasión ganglionar y de recidivas precoces.
Burghart et al.(10) y otros autores(11), demuestran que los tumores peor diferenciados y las formas clínicas más agresivas son más frecuentes en las pacientes jóvenes, con un marcado y significativo efecto en la supervivencia a los cinco años.
Sin embargo, dos publicaciones europeas han mostrado una menor frecuencia de presentación de la enfermedad en mujeres jóvenes(12), así como otros estudios americanos(13). Winkelstein y Sevin(14) afirman que la mortalidad por carcinoma de cérvix en mujeres jóvenes ha disminuido progresivamente durante los últimos 15 años.
De acuerdo con múltiples publicaciones, el carcinoma de cérvix uterino tiene semejante pronóstico tanto en pacientes jóvenes como en aquellas de edad avanzada(15-20). Monaghan et al.(21) y Cohn et al.(22) no encontraron diferencias significativas entre mujeres jóvenes y de edad avanzada en relación al aumento del porcentaje de metástasis linfáticas y adenocarcinomas.
El estudio europeo de cáncer ginecológico de Gatta et al.(23) y el último registro de tumores, realizado en Finlandia en 1989(24), han mostrado una disminución de la incidencia y la mortalidad del carcinoma de cérvix en el total de la población, pero un pequeño incremento de la mortalidad en los grupos de las mujeres más jóvenes y más viejas.
El objetivo del presente trabajo es estudiar la influencia en el pronóstico y la evolución que ejerce la edad de las pacientes afectas de cáncer del cuello uterino en estadios precoces, y acotar grupos de edad de mayor riesgo que podrían beneficiciarse de tratamientos complementarios a la cirugía.
MATERIAL Y MÉTODOS
Se ha realizado un estudio histórico retrospectivo de todas las pacientes que fueron diagnosticadas de un carcinoma de cérvix, en un estadio que permitió su tratamiento quirúrgico curativo mediante cirugía radical en nuestro Servicio de Ginecología Oncológica y cuya evolución se pudo seguir en el tiempo durante al menos cinco años después de la práctica de la cirugía radical, en el período comprendido entre el año de inaguración de la Maternidad «La Fe» de Valencia, 1971 y 1989.
Estudiamos las características generales de las pacientes según su edad, antecedentes familiares, personales, obstétricos y ginecológicos, motivo de consulta, exploración física y exploraciones complementarias; tratamiento quirúrgico y tratamientos pre y postoperatorios; anatomía patológica y evolución.
Las condiciones generales del estudio fueron: las pacientes acudieron a la consulta, en donde se realizaron todas las exploraciones, tanto físicas, como complementarias, necesarias para conocer el estado general y ginecológico de la paciente y alcanzar un diagnóstico de certeza de carcinoma cervical. Una vez clasificada a la paciente en estadios según la FIGO, se procedió a realizar el tratamiento oportuno del caso, mediante tratamiento preoperatorio, cirugía radical mediante intervención de Wertheim-Meigs (histerectomía total radical con linfadenectomía pélvica) y tratamiento postoperatorio, si diera lugar.
Las modalidades de tratamiento empleadas variaron a lo largo del estudio y a lo largo de los años, debido a que los protocolos terapéuticos, al ser una revisión histórica, cambiaron con el tiempo y comprenden las siguientes modalidades:
-- Radioterapia preoperatoria. La radioterapia preoperatoria consiste en la administración de 2.000 cGy a toda la pelvis y una inserción intracavitaria de 5.000 a 6.000 cGy, seguida de dos a seis semanas después de cirugía radical, generalmente cuando existen factores pronósticos clínicos que indican una evolución desfavorable de la paciente.
-- Radioterapia postoperatoria. El tratamiento consiste en la administración de 5.000 cGy a toda la pelvis mediante radioterapia externa, generalmente cuando existen ganglios linfáticos positivos, invasión de los espacios capilares, invasión profunda del estroma, tumor indiferenciado o anaplásico y carcinoma adenoescamoso. Las enfermas con afectación de bordes quirúrgicos suelen ser tratadas mediante radioterapia externa y braquiterapia, consistiendo en una o dos aplicaciones endocavitarias administrando una dosis de 6.500 cGy en la superficie de los aplicadores. Este tratamiento se efectúa entre dos a seis semanas después de la cirugía radical.
-- Quimioterapia neoadyuvante. Se administran tres ciclos de quimioterapia según el siguiente esquema terapéutico (V.B.P.): Vincristina (VCR), 1 mg/m2 intravenoso, el 1.er día; Cis-platino (CDDP), 50 mg/m2 intravenosos, el 1.er día y Bleomicina (BLM), 25 mg/m2 intramusculares, los días 1.º y 3.º. Estas dosis se repiten cada 10 días, siempre que la analítica lo permita y valorando su acción al final de los ciclos.
Una vez realizados los tratamientos indicados en cada caso, las pacientes se remiten a la consulta externa de Ginecología Oncológica, para continuar con el seguimiento de las mismas, donde se programan revisiones semestrales durante los primeros cinco años de seguimiento y después anuales hasta completar los primeros diez años de seguimiento.
En total se estudiaron 114 historias, a partir de las cuales se elaboró una base de datos mediante procesamiento informático utilizando un programa de análisis de datos, el «SPSS» (Statistical Package for Social Sciences) versión 6.1 para Windows (n.º de licencia 707852), en un ordenador IBM Personal Compatible con procesador 486 a 33 Hz.
La edad media de las pacientes fue de 49,1 ± 10,6 años (con un rango que osciló entre 27 y 76 años). Entre los 40 y 55 años se encontraban más de la mitad de los casos de nuestro material. Respecto a los grupos de edad, las pacientes menores de 40 años fueron 24 (21%), las que se encontraban incluidas en el intervalo entre 41 y 60 años fueron 73 (64%) y las pacientes mayores de 60 años fueron 17 (15%).
La media de edad de la menarquia se situó en 12,7 ± 1,5 años y de la menopausia en 47,6 ± 4,3 años, en las 51 pacientes (44,7%) que eran menopáusicas.
La distribución respecto al estadío clínico fue de ocho pacientes clasificadas en el estadio Ia (7%), 61 pacientes en el estadío Ib (53,5%), nueve pacientes en el IIa (7,9%) y 36 pacientes en el IIb (31,6%). Y respecto al estadio quirúrgico fue de seis pacientes (6,1%) clasificadas en el estadio Ia, 65 pacientes (65,7%) en el estadío Ib, 14 pacientes (14,1%) en el estadio IIa y 14 pacientes (14,1%) en el estadío IIb. No se clasificaron las previamente tratadas con quimioterapia y/o radioterapia, ya que al reducir el tamaño tumoral puede variar el estadío quirúrgico.
Se aplicó tratamiento preoperatorio en 15 pacientes (13,2%), de las cuales, a cinco pacientes (4,4%) se aplicó radioterapia preoperatoria y las 10 pacientes restantes (8,8%) recibieron quimioterapia neoadyuvante. En 62 pacientes (54,4%) se aplicó tratamiento postoperatorio, siendo en todas ellas la modalidad de radioterapia postoperatoria.
La anatomía patológica de las piezas operatorias reveló 86 casos (75,4%) de carcinomas epidermoides, 19 casos (16,7%) de adenocarcinomas y nueve casos (7,9%) de carcinomas mixtos.
En cuanto al grado de diferenciación encontramos 55 casos (48,2%) de carcinomas bien diferenciados, 26 casos (22,8%) de carcinomas moderadamente diferenciados y 33 casos (28,9%) de carcinomas mal diferenciados.
La invasión de los espacios capilares fue positiva en 31 casos (27,2%), la infiltración del endocérvix en 56 casos (49,1%), la infiltración del endometrio en 14 casos (12,3%), la infiltración del miometrio en 14 casos (12,3%) y la invasión de vagina en 18 casos (15,8%). La invasión de parametrios fue positiva en 16 casos (14%) y la infiltración de los márgenes quirúrgicos en la pieza operatoria fue positiva en dos casos (1,8%). La afectación ganglionar fue de 19 pacientes (16,6%) y la ovárica de tres pacientes (2,7%).
Respecto al tamaño tumoral, la dimensión media del tumor medida en la pieza quirúrgica fue de 2,2 ± 1,3 centímetros y la profundidad de invasión del tumor en el estroma cervical dio como resultado una media de 1,2 ± 0,7 centímetros.
El estado al finalizar el estudio de las pacientes objeto de nuestro trabajo era de 80 pacientes (70,2%) que vivían sanas libres de tumor, tres pacientes (2,6%) que vivían con tumor y 31 pacientes (27,2%) que fallecieron. La supervivencia global a los dos años fue del 87,7%, a los 5 años del 72,8% y a los 10 años del 51,4%.
El método estadístico utilizado consta en primer lugar de un análisis univariante en donde se obtienen los valores de la media aritmética y la desviación típica de los valores cuantitativos y los porcentajes relativos respecto de las variables cualitativas. Por último, un análisis multivariante aplicando una serie de ecuaciones de regresión múltiple tanto lineal como regresión de Cox, siendo este último modelo fijo (no stepwise) y calculando las curvas de supervivencia por medio de la prueba de Kaplan- Meier y la prueba log-rank para comparar las curvas de supervivencia.
RESULTADOS
No existen diferencias en los grupos de edad respecto del estadio clínico y quirúrgico, tipo histológico, grado de diferenciación, los diferentes tipos de diseminación tanto local como a distancia, la dimensión del tumor en la pieza operatoria o la profundidad de invasión del estroma tumoral.
Sin embargo, hemos encontrado valores de hemoglobina menores, estadísticamente significativos, en las pacientes menores de 40 años en comparación con las pacientes incluidas en el intervalo de 40 a 60 años, pero no en comparación con las pacientes mayores de 60 años.
La quimioterapia neoadyuvante se administra con mayor frecuencia significativa a las pacientes menores de 40 años, en comparación con los demás grupos (tabla 1).
Tabla 1 Características de las pacientes en relación a los diferentes grupos de edad en el momento del diagnóstico (NS = no significativo) | |||||
| Edad | ¾ 40 años | 41-60 años | > 60 años | p | |
| Estadío clínico | Ia | 2 (8%) | 6 (8%) | 0 | 0,2 |
| Ib | 15 (63%) | 39 (54%) | 17 (42%) | ||
| IIa | 3 (12%) | 3 (4%) | 3 (17%) | ||
| IIb | 4 (17%) | 25 (34%) | 7 (41%) | ||
| Estadío quirúrgico | Ia | 2 (12%) | 4 (6%) | 0 | 0,53 |
| Ib | 10 (56%) | 46 (70%) | 9 (61%) | ||
| IIa | 3 (16%) | 7 (10%) | 4 (26%) | ||
| IIb | 3 (16%) | 9 (14%) | 2 (13%) | ||
| Tipo histológico | Ca. epidermoide | 18 (75%) | 57 (78%) | 11 (65%) | 0,16 |
| Adenoca | 3 (12,5%) | 10 (14%) | 6 (35%) | ||
| Ca. mixtos | 3 (12,5%) | 6 (8%) | 0 | ||
| Grado de | G1 | 11 (46%) | 32 (44%) | 12 (71%) | 0,26 |
| Diferenciación | G2 | 7 (29%) | 18 (25%) | 1 (6%) | |
| G3 | 6 (25%) | 23 (31%) | 4 (23%) | ||
| Invasión CLS | 8 (33%) | 22 (30%) | 1 (5%) | 0,24 | |
| Infiltración endocérvix | 8 (33%) | 38 (52%) | 10 (58%) | 0,06 | |
| Infiltración endometrio | 2 (8%) | 9 (12%) | 3 (17%) | 0,08 | |
| Infiltración miometrio | 1 (4%) | 9 (12%) | 4 (23%) | 0,06 | |
| Invasión vagina | 4 (16%) | 9 (12%) | 5 (29%) | 0,06 | |
| Invasión parametrios | 4 (16%) | 9 (12%) | 3 (17%) | 0,4 | |
| Metástasis ganglionares | 6 (25%) | 14 (19%) | 0 | 0,25 | |
| Tamaño tumoral | 2,3 ± 1,4 | 2,14 ± 1,2 | 2,5 ± 1,1 | 0,32 | |
| Área | 6,3 ± 8,9 | 4,7 ± 5,7 | 5,1 ± 5 | 0,95 | |
| Volumen | 15,2 ± 32,6 | 7,6 ± 13,7 | 8,3 ± 13 | 0,53 | |
| Cociente tumor-cérvix | 0,4 ± 0,2 | 0,4 ± 0,2 | 0,4± 0,2 | 0,31 | |
| Profundidad invasión | 1,5 ± 0,9 | 1,1 ± 0,6 | 1,2 ± 0,7 | 0,07 | |
| Tto. preoperatorio | Ninguno | 18 (75%) | 66 (91%) | 15 (88%) | 0,03 |
| Radioterapia | 0 | 4 (5%) | 1 (6%) | ||
| Quimioterapia | 6 (25%) | 3 (4%) | 1 (6%) | ||
| Tto postoperatorio | Ninguno | 13 (54%) | 33 (45%) | 6 (35%) | 0,49 |
| Radioterapia | 11 (46%) | 40 (65%) | 11 (65%) | ||
| Hemoglobina | 12,5 ± 1,4 | 13,4 ± 1,6 | 13,1 ± 1,4 | 0,04 | |
Realizamos un análisis estadístico multivariante mediante el cálculo de la regresión de Cox, que incluyera la edad como variable discreta, el tipo de tratamiento preoperatorio empleado y la hemoglobina. Así vimos que, respecto al intervalo libre de enfermedad, la edad y el tratamiento preoperatorio pierden su significación a favor de la hemoglobina, que se muestra protectora y muy significativa. En relación al intervalo de supervivencia ocurre algo similar, aunque la hemoglobina se muestra menos significativa y el grupo de pacientes con edad menor de 40 años pierde su significación por unas centésimas (tabla 2).
Tabla 2 Ecuaciones de regresión de Cox de las variables grupos de edad, tratamiento preoperatorio y hemoglobina, respecto del intervalo libre de enfermedad y del intervalo de supervivencia (IC = intervalo de confianza; NS = no significativo) | ||||
| Intervalo libre de enfermedad | Riesgo relativo | IC 95 % | p | |
| Grupos de edad | ¾ 40 años | 1 | 1 | |
| 40-60 años | 0,85 | (0,5-1,4) | 0,51 | |
| > 60 años | 0,87 | (0,4-1,8) | 0,69 | |
| Tto preoperatorio | ninguno | 1 | 1 | |
| Radioterapia | 6,5 | (0,4-8,2) | 0,95 | |
| Quimioterapia | 3,2 | (0,3-4,9) | 0,96 | |
| Hemoglobina | 0,74 | (0,6-0,9) | 0,003 | |
| Intervalo de supervivencia | Riesgo relativo | IC 95 % | p | |
| Grupos de edad | ¾ 40 años | 1 | 1 | |
| 40-60 años | 1,03 | (0,6-1,9) | 0,92 | |
| > 60 años | 0,5 | (0,2-1,4) | 0,2 | |
| Tto preoperatorio | ninguno | 1 | 1 | |
| Radioterapia | 1 | (0,2-4) | 0,99 | |
| Quimioterapia | 1 | (0,4-2,7) | 0,99 | |
| Hemoglobina | 0,8 | (0,6-0,9) | 0,04 | |
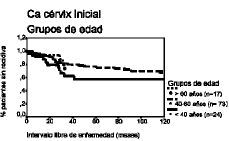
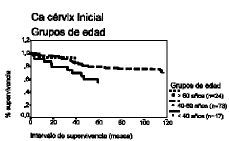
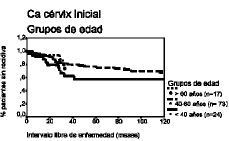
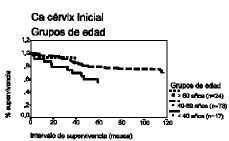
El análisis de la supervivencia según el método de Kaplan-Meier demuestra que el intervalo libre de enfermedad a los cinco años para las pacientes de cada grupo de edad es de 58%, 77% y 76% y a los 10 años es de 28%, 52% y 67%, respectivamente, lo que demuestra que las pacientes menores de 40 años tienen un porcentaje de pacientes libres de recidiva menor en los diferentes intervalos, en comparación con el resto de pacientes.
Respecto del intervalo de supervivencia ocurre una circunstancia semejante, con porcentajes del 50%, 77% y 88% a los cinco años para cada grupo de edad y del 38%, 55% y 71% a los diez años, observando que las pacientes menores de 40 años tienen un porcentaje de supervivencia menor para cada intervalo de tiempo, en comparación con las demás pacientes (tabla 3 y Figs. 1 y 2).
Tabla 3 Análisis de la supervivencia a los cinco y diez años según el método de Kaplan-Meier y cálculo del riesgo relativo según la ecuación de regresión de Cox, para la variable grupos de edad en relación al intervalo libre de enfermedad y al intervalo de supervivencia (RR = riesgo relativo; IC = intervalo de confianza; NS = no significativo) | |||||||
| Intervalo libre de enfermedad | 5 años | RR (IC 95 %) | p | 10 años | RR (IC 95 %) | p | |
| N.º | Nº (%) | Nº (%) | |||||
| ¾ 40 años | 24 | 14 (58,3) | 1 | 4 (28,5) | 1 | ||
| 41-60 años | 73 | 56 (76,7) | 1,4 (0,8-2,3) | 0,35 | 23 (52,3) | 0,8 (0,5-1,3) | 0,2 |
| > 60 años | 17 | 13 (76,5) | 0,9 (0,4-1,7) | 0,96 | 8 (66,7) | 0,7 (0,4-1,5) | 0,69 |
| Total | 114 | 83 (72,8) | 35 (50) | ||||
| Intervalo de supervivencia | 5 años | RP (IC 95 %) | p | 10 años | RP (IC 95 %) | p | |
| N.º | Nº (%) | Nº (%) | |||||
| ¾ 40 años | 24 | 12 (50) | 1 | 8 (38) | 1 | ||
| 41-60 años | 73 | 56 (76,7) | 1,6 (0,8-2,9) | 0,18 | 23 (54,8) | 0,9 (0,5-1,7) | 0,14 |
| > 60 años | 17 | 15 (88,2) | 0,5 (0,2-1,4) | 0,73 | 5 (71,4) | 0,5 (0,2-1,3) | 0,22 |
| Total | 114 | 83 (72,8) | 36 (51,4) | ||||
Figura 1. Curva de supervivencia según el método de Kaplan-Meier para el intervalo libre de enfermedad correspondiente a los grupos de edad. Prueba «log rank» (4,47; df = 2; p = NS).
Figura 2. Curva de supervivencia según el método de Kaplan-Meier para el intervalo de supervivencia correspondiente a los grupos de edad. Prueba «log rank» (6,67; df = 2; p < 0,05).
DISCUSION
El carcinoma de cérvix uterino tiene un pronóstico semejante en los diferentes grupos de edad de nuestro material, no existiendo, por lo tanto, una correlación estadísticamente significativa entre los grupos de edad y el intervalo libre de enfermedad o el intervalo de supervivencia. Así, coincidiendo con nuestros resultados, encontramos numerosas publicaciones que afirman que la edad no se puede considerar como factor pronóstico, ya que no influye en la disminución del intervalo libre de enfermedad o del intervalo de supervivencia(17-21). Poka et al.(25) no observan diferencias significativas en los porcentajes de supervivencia de pacientes menores de 35 años y menores de 45 años, en comparación con otras de mayor edad. Monaghan et al.(21) y Cohn et al.(22), al igual que nosotros, no encontraron diferencias significativas entre mujeres jóvenes y otras de edad avanzada en relación al aumento del porcentaje de metástasis linfáticas y de la variedad histológica adenocarcinoma, en pacientes afectas de carcinoma cervical. Patanaphan et al.(20) y otros autores(15,16), coincidiendo con nuestros resultados, apuntan a que la supervivencia a los cinco años es semejante en los diferentes grupos de edad.
En la misma línea de acontecimientos, dos publicaciones europeas han mostrado una menor frecuencia de presentación de la enfermedad en mujeres jóvenes(12), así como otros estudios americanos(13). Y Winkelstein y Sevin(14), afirman que la mortalidad por carcinoma cervical en mujeres jóvenes ha disminuido progresivamente durante los últimos 15 años.
Sin embargo, Rodríguez et al.(26), Sevin et al.(27) y otros autores(28,29) afirman que la edad menor de 40 años es un factor independiente de mal pronóstico en las pacientes afectas de carcinoma cervical.
Para algunos autores, como Stanhope et al.(5), las pacientes menores de 30 años tienen peor pronóstico, en comparación con mujeres mayores de esta edad. Otros autores determinan la edad de 35 años como el límite por debajo de la misma, en donde se sitúan las mujeres de peor pronóstico(5) y para otros es la edad de 45 años(5,30). Y como factor pronóstico favorable, Kodama y cols. apuntan la edad mayor de 60 años(3).
Un gran número de publicaciones recientes sugieren que la incidencia del carcinoma cervical en mujeres jóvenes está aumentando(1), y que estos tumores cada vez son más agresivos(1-6), demostrando que existen diferentes edades en las cuales empeora el pronóstico.
Nosotros encontramos que las pacientes jóvenes tienen un valor de hemoglobina menor que las pacientes mayores, hecho que denotan un peor pronóstico. Elliot et al.(1) y otros autores(7,8,31), encuentran un relativo aumento de la incidencia de carcinoma cervical y un mayor grado de malignidad en las pacientes jóvenes. Burghart et al.(10) y otros autores(11,32,33), demuestran que los tumores peor diferenciados y las formas clínicas más agresivas son más frecuentes en estas pacientes, lo que influye en la consecución de un peor pronóstico(3), no encontrando diferencias en otros factores pronósticos (metástasis linfáticas, invasión vascular o parametrial y tamaño tumoral). Elliot y Burghart(10) concluyen que la edad tiene un marcado y significativo efecto en la supervivencia a los cinco años, demostrando que la supervivencia disminuye en las mujeres menores de 35 años, en comparación con las mayores de esa edad.
Otros autores(7,8,31) observan que la invasión vascular ocurre frecuentemente en pacientes jóvenes y este evento se asocia a un aumento de las metástasis linfáticas.
Fenton et al.(2) encuentran que la supervivencia en pacientes jóvenes es significativamente más baja que en pacientes mayores y su pronóstico es especialmente malo en casos de invasión linfática.
Kaplan(34) informa acerca de resultados desfavorables en los tratamientos de mujeres jóvenes y encuentran que en estas mujeres existe un progresivo aumento del porcentaje de formas diseminadas de la enfermedad.
A la vista de las conclusiones tan dispares halladas en la literatura mundial, Pfeiffer et al.(11) estudian cuánto tiene de dependencia con la edad el carcinoma cervical y cuánto se debe al cambio de éste en la última década, basándose en que el porcentaje de carcinomas de cérvix disminuye y al mismo tiempo, el porcentaje de pacientes jóvenes aumenta, llegando a la conclusión de que la supervivencia es menor en las pacientes jóvenes, aun cuando se comparan estadios semejantes.
En la misma línea de investigación, Webb et al.(35), comparan mujeres menores de 35 años en dos períodos diferentes de tiempo, llegando a la conclusión de que los dos grupos no muestran diferencias en cuanto a la incidencia, estadio o mortalidad, pero la proporción de adenocarcinomas aumenta al doble en el grupo de mujeres del período más reciente.
El estudio europeo de cáncer ginecológico de Gatta et al.(23) y el último registro de tumores, realizado en Finlandia en 1989(24), han mostrado una disminución de la incidencia y la mortalidad del carcinoma de cérvix en el total de la población, debido a las campañas de diagnóstico precoz, pero un pequeño incremento de la mortalidad en los grupos de las mujeres más jóvenes y más viejas.
CONCLUSIONES
La edad no influye en el pronóstico y la evolución de las pacientes afectas de carcinoma cervical, tratadas mediante cirugía radical.
BIBLIOGRAFIA
01 Elliott PM, Tattersall MHN, Copplesson M. Changing Character of cervical cancer in young women. Br Med J 1989;298:288-90.
02 Fenton J, Chevret S, Asselain B, et al. Invasive cancer of the uterine cervix in young women: retrospective study of 236 cases. Bull Cancer Paris 1990;77:109-16.
03 Kodama S, Kanazawa K, Honma S, Tanaka K. Age as a prognostic factor in patients with squamous cell carcinoma of the uterine cervix. Cancer 1991;68:2481-5.
04 Prempree T, Patanaphan V, Sewchand W, et al. The influence of patients'' age and tumor grade on the prognosis of carcinoma of the cervix. Cancer 1983;51:1764-71.
05 Stanhope CR, Smith JP, Wharton JT, et al. Carcinoma of the cervix. The effect of age on survival. Gynecol Oncol 1980;10: 188-93.
06 Stehman FB, Bundy BN, DiSaia PH, et al. Carcinoma of the cervix terated with irradiation therapy. I. A multi-variate analysis of prognostic variables in the Gynecologic Oncology Group. Cancer 1991;67:2776-85.
07 Boyce JG, Fruchter RG, Nicastri AD, et al. Vascular invasion in stage I carcinoma of the cervix. Cancer 1984;53:1175-80.
08 Creasman WT, Fetter BF, Clarke-Paerson DL, et al. Managemen of stage Ia carcinoma of the cervix. Am J Obstet Gynecol 1985;153:164-72.
09 Nagell JR, Hudson S, Gay EC, et al. Carcinoembryonic antigen in carcinoma of the uterine cervix: Antigen distribution in primary and metastatic tumors. Cancer 1982;49;379-83.
10 Burghardt E, Haas J, Girardi F. The significance of the parametrium in the operative treatment of the cervical cancer. Bailliere''s Clin Obstet Gynaecol 1988;2:879-88.
11 Pfeiffer D, Schubert-Fritschle G, Meier W, et al. Age-related differences and changes in clinical aspects and follow-up of cervix cancer since 1973. Geburtshilfe Frauenheilkd 1992 Feb; 52:81-7.
12 Meanwell CA, Kelly KA, Wilson S, et al. Young age as a prognostic factor in cervical cancer: Analysis of population based on data from 10,022 cases. Br Med J 1988;296:386-91.
13 Chu J, White E. Decreasing incidence of invasive cervical cancer in young women. Am J Obstet Gynecol 1987;157:1105-7.
14 Winkelstein W, Sevin S. Cervical cancer in young women. Lancet 1989;11:1385.
15 Martino M, Houvenaeghel G, Hardwigsen J, et al. Pelvic recurrence of cancers of the uterine cervix. A study of a series of 49 cases. Ann Chir 1997;51:36-45.
16 Mundt AJ, Connell PP, Campbell T, et al. Race and clinical outcome in patients with carcinoma of the uterine cervix treated with radiation therapy. Gynecol Oncol 1998;71: 151-8.
17 Obermair A, Wanner C, Bilgi S, et al. The influence of vascular space involvement on the prognosis of patients with stage IB cervical carcinoma: correlation of results from hematoxylin and eosin staining with results from immunostaining for factor VIII-related antigen. Cancer 1998;82:689-96.
18 Yeh SA, Wan Leung S, Wang CJ, Chen HC. Postoperative radiotherapy in early stage carcinoma of the uterine cervix: treatment results and prognostic factors. Gynecol Oncol 1999; 72:10-5.
19 Baltzer J, Koepcke W, Lohe KJ, et al. Age and 5-year survival rates in patients with operated carcinoma of the cervix. Gynecol Oncol 1982;14:220-4.
20 Patanaphan V, Poussin--Rosillo H, Villa Santa U, Salazar OM. Cancer of uterine cervix stage IB. Treatment results and prognostic factors. Cancer 1986;57:866-70.
21 Monaghan JM, Ireland D, Mor-Yosef S, et al. Role of centralization of surgery in stage Ib carcinoma of the cervix: a review of 498 cases. Gynecol Oncol 1990;37:206-9.
22 Cohn DE, Peters WA 3rd, Muntz HG, et al. Adenocarcinoma of the uterine cervix metastatic to lymph nodes. Am J Obstet Gynecol 1998;178:1131-7.
23 Gatta G, Lasota MB, Verdecchia A. Survival of European women with gynaecological tumours, during the period 1978-1989. Eurocare Working Group. Eur J Cancer 1998;34: 2218-25.
24 Hakulinen T, Kenward M, Luostasrinen T. Cancer in Finland in 1954-2008. Helsinki: Finnish Cancer Registry, Finnish Foundation for Cancer Research, 1989:48-50.
25 Poka R, Juhasz B, Lampe L. Cerical cancer in young women: a poorer prognosis? Int J Gynecol Obstet 1994;46:33-7.
26 Rodríguez GC, Clarke-Pearson DL, Soper JT, et al. The negative prognostic implications of thrombocitosis in women with stage Ib cervical cancer. Obstet Gynecol 1994;83:445-8.
27 Sevin BU, Lu Y, Bloch DA et al. Surgically defined prognostic parameters in patients with early cervical carcinoma. A multivariate survival tree analysis. Cancer 1996;78:1438-46.
28 Delgado G, Bundy B, Zaino R, et al. Prospective surgical-pathological study of disease-free interval in patients with stage IB squamous cell carcinoma of the cervix: A Gynecologic Oncology Group study. Gynecol Oncol 1990;38:352-7.
29 Soisson AP, Soper JT, Clarke-Pearson DL, et al. Adjuvant radiotherapy following radical hysterectomy for patients with stage IB and IIA cervical cancer. Gynecol Oncol 1990;37:390-5.
30 Delaloye JF, Pampallona S, Coucke PA, De Grandi P. Younger age as a a bad prognostic factor in patients with carcinoma of the cervix. Eur J Obstet Gynecol Reprod Biol 1996;64:201-5.
31 Nahhas W, Sharkey F, Whitney C, et al. The prognostic significance of vascular channel involvement and deep stromal penetration in early cervical carcinoma. Am J Clin Oncol 1983; 6:259-64.
32 Ishikawa H, Nakanishi T, Inoue T, Kuzuya K. Prognostic factors of adenocarcinoma of the uterine cervix. Gynecol Oncol 1999;73:42-6.
33 Burghardt E, Haas J, Girardi F. The significance of the parametrium in the operative treatment of the cervical cancer. Bailliere''s Clin Obstet Gynaecol 1988;2:879-88.
34 Kaplan M. Investigation of age as a prognostic factor in early stage invasive cancer of the cervix: implications for nursing. Cancer Nurs 1989;12:177-82.
35 Webb MJ, Symmonds RE. Wertheim hysterectomy: a reappraisal. Obstet Gynecol 1979;54:140-5.