Ginecología
El significado pronóstico de las metástasis ganglionares en las pacientes afectas de cáncer del cuello uterino en estadios precoces
Prognostic significance of lymph-node metastases in patients with early-stage cancer of the uterine cervix
M. Martín-Loeches
R. Ortí1
E. Asins
J. Llixiona
E. Cazorla
J. R. Bernabeu
Sección de Ginecología Oncológica
Servicio de Ginecología
Hospital Universitario «La Fe». Valencia
1 Servicio de Medicina Preventiva
Hospital Clínico Universitario. Valencia
Correspondencia:
Dr. Mariano Martín-Loeches de la Lastra
c/ Abú-Zeyán, 8 - 1.º - 2.ª
03700 Denia (Alicante)
Fecha de recepción: 25/3/99
Aceptado para publicación: 9/9/99
RESUMEN
Objetivo: Estudiamos la influencia de las metástasis ganglionares en la supervivencia de las pacientes afectas de cáncer del cuello uterino en estadios precoces.
Material y métodos: Estudio histórico retrospectivo de las 114 pacientes afectas de cáncer del cuello uterino tratadas mediante cirugía radical, en el período comprendido entre el año de inaguración de la Maternidad «La Fe» de Valencia, 1971 y 1989.
Resultados: Las pacientes con metástasis ganglionares tienen un menor intervalo libre de enfermedad y un menor intervalo de supervivencia, empeorando el pronóstico a partir de la existencia de metástasis en dos ganglios.
Practicamos un análisis de regresión de Cox que incluyera todas las variables que describen las distintas variedades de diseminación. Así obtuvimos que la invasión de los espacios capilares, la infiltración del endocérvix, la invasión de vagina y la invasión de parametrios poseen significado pronóstico para predecir el intervalo libre de enfermedad, perdiendo significación estadística la invasión de endometrio, la invasión de miometrio y las metástasis ganglionares, y respecto al intervalo de supervivencia, las variables infiltración del endocérvix, invasión de endometrio, invasión de miometrio e invasión de parametrios pierden su significado pronóstico, ganando en validez la invasión de los espacios capilares, la invasión de vagina y las metástasis ganglionares.
Conclusiones: Las metástasis ganglionares influyen en gran medida en la supervivencia de las pacientes afectas de cáncer del cuello uterino en estadios precoces, empeorando el pronóstico a partir de la existencia de metástasis en dos ganglios.
PALABRAS CLAVE
Metástasis ganglionares; Cáncer de cérvix uterino y pronóstico.
SUMMARY
Objetive: We study the influence of lymph node metastases on the survival of patients affected by cancer of the uterine cervix in early stages.
Material and methods: Retrospective historic study of the 114 patients affected by cancer of the uterine cervix who have been treated by radical surgery in the period between the opening of «La Fe» Maternity Unit of Valencia, 1971 and 1989.
Results: Patients with lymph node metastases have a smaller free disease interval and a smaller survival interval. When two lymph node metastases is found, the prognosis worsens.
We carried out a Cox''s regression that included all variables described in the different dissemination varieties. We thus observed that the invasion of capillary spaces, the endocervix infiltration, the vagina invasion and the parametrial invasion can help to predict the free disease interval. However, the endometrium invasion, the myometrium invasion and the lymph node metastases lose statistical meaning. With regard to the survival interval, some variables like endocervix infiltration, endometrium invasion, myometrium invasion and parametrial invasion lose their prognosis meaning, the invasion of capillary spaces, the vagina invasion and the lymph node metastases do not lose it.
Conclusions: Lymph node metastases have a big influence in the survival of patients affected by cervical carcinoma in early stages, but the prognosis worsens when two lymph node metastases is found.
KEY WORDS
Lymph node metastases; Uterine cervix cancer and prognosis.
INTRODUCCION
Las posibilidades de supervivencia de las pacientes afectas de carcinoma cervical decrecen en gran manera cuando hay invasión de ganglios linfáticos(1). Parsons y Friedell en 1963(2) son probablemente los primeros en describir la asociación de tal evento con el tamaño tumoral, posteriormente corroborada por otros autores(3-5). Asimismo, la presencia de metástasis linfáticas aumenta el riesgo de recidiva(6-9) y de metástasis a distancia según Pickel et al.(10).
Ferraris et al.(11) encuentran relación entre la localización de las metástasis linfáticas y la supervivencia, aunque no la tiene para otros autores(12).
La influencia de la invasión linfática unilateral o bilateral es conflictiva. Algunos autores(5) han reportado grandes diferencias en la supervivencia entre pacientes con invasión linfática unilateral y aquellas que padecían invasión bilateral, así como otros coinciden en no encontrar diferencias(13,14).
En cualquier caso, Kamura et al.(15) demuestran que existen diferencias en la supervivencia en relación a la invasión de uno o más grupos de ganglios linfáticos, coincidiendo con numerosos autores(6-8,16) y en relación con el número de ganglios linfáticos afectados por el cáncer, asimismo afirmación efectuada por otros muchos autores(17,18).
Numerosas publicaciones han comparado el significado de las metástasis ganglionares paraaórticas con la supervivencia(19-20). En un análisis multivariante del Gynecologic Oncology Group, las pacientes con metástasis ganglionares paraaórticas eran más susceptibles de desarrollar metástasis extrapélvicas, al igual que en la publicación de Kim et al.(20).
El tamaño de la metástasis ganglionar se relaciona con la supervivencia(21,22). El pronóstico se ensombrece mucho cuando la metástasis excede en 20mm de diámetro(21).
Tsakraklides et al.(23) y Van Nagell et al.(24) encuentran resultados similares al estudiar la morfo-histología de las metástasis linfáticas pélvicas. El porcentaje de supervivencia disminuye en pacientes con patrón nodal predominantemente linfocitario y aumenta en aquellas con patrón nodal con gran deplección de linfocitos.
Graz et al.(25) encuentran una correlación entre la infección por HPV-16 (human papilloma virus) del tumor primario y la invasión ganglionar.
El objetivo del presente trabajo es estudiar la influencia en el pronóstico y la evolución de las metástasis ganglionares en las pacientes afectas de cáncer del cuello uterino en estadios precoces.
MATERIAL Y MÉTODOS
Se ha realizado un estudio histórico retrospectivo de todas las pacientes que fueron diagnosticadas de un carcinoma de cérvix, en un estadio que permitió su tratamiento quirúrgico curativo mediante cirugía radical en nuestro Servicio de Ginecología Oncológica y cuya evolución se pudo seguir en el tiempo durante al menos cinco años después de la práctica de la cirugía radical, en el período comprendido entre el año de inaguración de la Maternidad «La Fe» de Valencia, 1971 y 1989.
Estudiamos las características generales de las pacientes según su edad; antecedentes familiares, personales, obstétricos y ginecológicos; motivo de consulta; exploración física y exploraciones complementarias; tratamiento quirúrgico y tratamientos pre y postoperatorios; anatomía patológica y evolución.
Las condiciones generales del estudio fueron: las pacientes acudieron a la consulta, en donde se realizaron todas las exploraciones, tanto físicas, como complementarias, necesarias para conocer el estado general y ginecológico de la paciente y alcanzar un diagnóstico de certeza de carcinoma cervical. Una vez clasificada a la paciente en estadios según la FIGO, se procedió a realizar el tratamiento oportuno del caso, mediante tratamiento preoperatorio, cirugía radical mediante intervención de Wertheim-Meigs (histerectomía total radical con linfadenectomía pélvica) y tratamiento postoperatorio, si diera lugar.
Las modalidades de tratamiento empleadas variaron a lo largo del estudio y a lo largo de los años, debido a que los protocolos terapéuticos, al ser una revisión histórica, cambiaron con el tiempo y comprenden las siguientes modalidades:
-- Radioterapia preoperatoria. La radioterapia preoperatoria consiste en la administración de 2.000 cGy a toda la pelvis y una inserción intracavitaria de 5.000 a 6.000 cGy, seguida de dos a seis semanas después de cirugía radical, generalmente cuando existen factores pronósticos clínicos que indican una evolución desfavorable de la paciente.
-- Radioterapia postoperatoria. El tratamiento consiste en la administración de 5.000 cGy a toda la pelvis mediante radioterapia externa, generalmente cuando existen ganglios linfáticos positivos, invasión de los espacios capilares, invasión profunda del estroma, tumor indiferenciado o anaplásico y carcinoma adenoescamoso. Las enfermas con afectación de bordes quirúrgicos suelen ser tratadas mediante radioterapia externa y braquiterapia, consistiendo en una o dos aplicaciones endocavitarias administrando una dosis de 6.500cGy en la superficie de los aplicadores. Este tratamiento se efectúa entre dos a seis semanas después de la cirugía radical.
-- Quimioterapia neoadyuvante. Se administran tres ciclos de quimioterapia según el siguiente esquema terapéutico (VBP): Vincristina (VCR), 1 mg/m2 intravenoso, el 1.er día; Cis-platino (CDDP), 50 mg/m2 intravenosos, el 1.er día y Bleomicina (BLM), 25 mg/m2 intramusculares, los días 1.º y 3.º. Estas dosis se repiten cada diez días, siempre que la analítica lo permita y valorando su acción al final de los ciclos.
Una vez realizados los tratamientos indicados en cada caso, las pacientes se remiten a la consulta externa de Ginecología Oncológica, para continuar con el seguimiento de las mismas, donde se programan revisiones semestrales durante los primeros cinco años de seguimiento y después anuales hasta completar los primeros diez años de seguimiento.
En total se estudiaron 114 historias, a partir de las cuales se elaboró una base de datos mediante procesamiento informático utilizando un programa de análisis de datos, el «SPSS» (Statistical Package for Social Sciences) versión 6.1 para Windows (número de licencia 707852), en un ordenador IBM Personal Compatible con procesador 486 a 33 Hz.
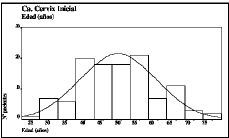
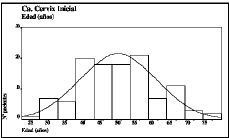
La edad media de las pacientes fue de 49,1 ± 10,6 años (con un rango que osciló entre 27 y 76 años). Entre los 40 y 55 años se encontraban más de la mitad de los casos de nuestro material (Fig. 1). Respecto a los grupos de edad, las pacientes menores de 40 años fueron 24 (21 por 100), las que se encontraban incluidas en el intervalo entre 41 y 60 años fueron 73 (64 por 100) y las pacientes mayores de 60 años fueron 17 (15 por 100).
Figura 1. Distribución por edades de las pacientes objeto del estudio (n = 114). Se incluye la curva normal correspondiente.Media aritmética = 49,12; desviación estándar = 10,57; varianza = 111,7; mediana = 48,5; moda = 54; valor máximo = 76; valor mínimo = 27; rango = 49.
La media de edad de la menarquia se situó en 12,7 ± 1,5 años y de la menopausia en 47,6 ± 4,3 años, en las 51 pacientes (44,7 por 100) que eran menopáusicas.
La distribución respecto al estadio clínico fue de ocho pacientes clasificadas en el estadio Ia (7 por 100), 61 pacientes en el estadio Ib (53,5 por 100), nueve pacientes en el IIa (7,9 por 100) y 36 pacientes en el IIb (31,6 por 100). Y respecto al estadio quirúrgico fue de seis pacientes (6,1 por 100) clasificadas en el estadio Ia, 65 pacientes (65,7 por 100) en el estadio Ib, 14 pacientes (14,1 por 100) en el estadio IIa y 14 pacientes (14,1 por 100) en el estadio IIb. No se clasificaron las previamente tratadas con quimioterapia y/o radioterapia, ya que al reducir el tamaño tumoral puede variar el estadio quirúrgico.
Se aplicó tratamiento preoperatorio en 15 pacientes (13,2 por 100), de las cuales, a cinco pacientes (4,4 por 100) se aplicó radioterapia preoperatoria y las diez pacientes restantes (8,8 por 100) recibieron quimioterapia neoadyuvante. En 62 pacientes (54,4 por 100) se aplicó tratamiento postoperatorio, siendo en todas ellas la modalidad de radioterapia postoperatoria.
La anatomía patológica de las piezas operatorias reveló 86 casos (75,4 por 100) de carcinomas epidermoides, 19 casos (16,7 por 100) de adenocarcinomas y nueve casos (7,9 por 100) de carcinomas mixtos.
En cuanto al grado de diferenciación encontramos 55 casos (48,2 por 100) de carcinomas bien diferenciados, 26 casos (22,8 por 100) de carcinomas moderadamente diferenciados y 33 casos (28,9 por 100) de carcinomas mal diferenciados.
La invasión de los espacios capilares fue positiva en 31 casos (27,2 por 100), la infiltración del endocérvix en 56 casos (49,1 por 100), la infiltración del endometrio en 14 casos (12,3 por 100), la infiltración del miometrio en 14 casos (12,3 por 100) y la invasión de vagina en 18 casos (15,8 por 100). La invasión de parametrios fue positiva en 16 casos (14 por 100) y la infiltración de los márgenes quirúrgicos en la pieza operatoria fue positiva en dos casos (1,8 por 100). La afectación ganglionar fue de 21 pacientes (18,4 por 100) y la ovárica de tres pacientes (2,7 por 100).
Contabilizando el total de ganglios extirpados en la intervención quirúrgica, si éstos eran del lado derecho o izquierdo y los que eran positivos a metástasis, obtuvimos los resultados mostrados en la tabla 1.
| Tabla 1 Tabla de frecuencias de las variables ganglios extirpados y ganglios positivos y sus respectivos estadísticos | ||||
| Ganglios extirpados | Número de pacientes (%) | Media ± DS | Máximo | |
| Obturadores | Total | 100 (87,71) | 5,75 ± 4,27 | 25 |
| Derechos | 83 (72,8) | 3,4 ± 2.9 | 21 | |
| Izquierdos | 84 (73,68) | 3 ± 2 | 10 | |
| Iliacos externos | Total | 100 (87,71) | 8,2 ± 4,53 | 28 |
| Derechos | 99 (86,84) | 4,39 ± 3,05 | 19 | |
| Izquierdos | 97 (85,08) | 4,25 ± 2,53 | 12 | |
| Iliacos comunes | Total | 68 (59,64) | 5,4 ± 3,28 | 15 |
| Derechos | 63 (55,26) | 3 ± 2,21 | 9 | |
| Izquierdos | 46 (40,35) | 3,3 ± 2,17 | 12 | |
| Aórticos | Total | 2 (1,75) | 1,5 ± 0,71 | 2 |
| Derechos | 2 (1,75) | 1,5 ± 0,71 | 2 | |
| Izquierdos | 0 | |||
Ganglios positivos | Número de pacientes (%) | Media ± DS | Máximo | |
| Obturadores | Total | 9 (7,89) | 1,78 ± 1,3 | 4 |
| Derechos | 8 (7,01) | 1,5 ± 1,1 | 4 | |
| Izquierdos | 2 (1,75) | 2 | 2 | |
| Iliacos externos | Total | 15 (13,15) | 2,67 ± 2,29 | 8 |
| Derechos | 10 (8,77) | 2 ± 1,25 | 4 | |
| Izquierdos | 10 (8,77) | 2,1 ± 1,45 | 5 | |
| Iliacos comunes | Total | 7 (6,14) | 2 ± 2,65 | 8 |
| Derechos | 3 (2,63) | 2 ± 1.73 | 4 | |
| Izquierdos | 4 (3,5) | 1,75 ± 1,5 | 4 | |
| Aórticos | Total | 1 (0,9) | 2 | 2 |
| Derechos | 1 (0,9) | 2 | 2 | |
| Izquierdos | 0 | |||
Respecto al tamaño tumoral, la dimensión media del tumor medida en la pieza quirúrgica fue de 2,2±1,3 centímetros y la profundidad de invasión del tumor en el estroma cervical dio como resultado una media de 1,2 ± 0,7 centímetros.
El estado al finalizar el estudio de las pacientes objeto de nuestro trabajo era de 80 pacientes (70,2 por 100) que vivían sanas libres de tumor, tres pacientes (2,6 por 100) que vivían con tumor y 31 pacientes (27,2 por 100) que fallecieron. La supervivencia global a los dos años fue del 87,7 por 100; a los cinco años, del 72,8 por 100, y a los 10 años, del 51,4 por 100.
El método estadístico utilizado consta en primer lugar de un análisis univariante en donde se obtienen los valores de la media aritmética y la desviación típica de los valores cuantitativos y los porcentajes relativos respecto de las variables cualitativas. Un análisis bivariante consistente en un análisis de correlaciones, pruebas de diferencias (pruebas t de Student y la F Ratio (ANOVA) y la prueba de *2 y un análisis de regresión simple. Por último, un análisis multivariante aplicando una serie de ecuaciones de regresión múltiple tanto lineal como regresión de Cox y calculando las curvas de supervivencia por medio de la prueba de Kaplan-Meier.
RESULTADOS
Realizamos un análisis bivariante de los diferentes tipos de diseminación en relación al intervalo libre de enfermedad y al intervalo de supervivencia, en donde obtuvimos los siguientes resultados:
-- Encontramos una relación estadísticamente significativa entre la existencia de invasión de los espacios capilares y el menor intervalo libre de enfermedad e intervalo de supervivencia.
-- Asimismo, encontramos una relación significativa entre la infiltración del endocérvix y la disminución de ambos intervalos.
-- Relación también estadísticamente significativa entre la infiltración del endometrio y ambos intervalos.
-- La infiltración del miometrio muestra una relación estadísticamente significativa respecto al intervalo de supervivencia, aunque no respecto al intervalo libre de enfermedad.
-- La invasión de vagina también muestra una relación estadísticamente significativa respecto a ambos intervalos.
-- La invasión de parametrios se comporta de manera semejante a la invasión de vagina en relación a ambos intervalos.
-- Las metástasis ganglionares presentan una relación muy significativa respecto al intervalo libre de enfermedad y al intervalo de supervivencia (tablas 2 y 3).
Tabla 2 Comparaciones de medias o pruebas de diferencias (t de Student) de las variables correspondientes al apartado diseminación respecto al intervalo libre de enfermedad | |||||
Intervalo libre de enfermedad | Media ± DS | t | df | p | |
| Invasión de los CLS | Sí | 62,1 ± 59,7 | 2 | 44,61 | < 0,05 |
| No | 85,8 ± 47 | ||||
| Variedad | Linfática | 35,6 ± 23 | 2,01 | 2;28 | NS |
| Sanguínea | 86,3 ± 70 | ||||
| Ambas | 60 ± 62,2 | ||||
| Infiltración del | Sí | 67,9 ± 47 | 2,37 | 112 | < 0,05 |
| endocérvix | No | 90,4 ± 53,8 | |||
| Invasión del | Sí | 52,8 ± 44 | 2,09 | 112 | < 0,05 |
| endometrio | No | 83,1 ± 51,7 | |||
| Infiltración del | Sí | 55,71 ± 45,3 | 1,85 | 112 | NS |
| miometrio | No | 82,7 ± 51,76 | |||
| Invasión de vagina | Sí | 40,9 ± 37,2 | 3,63 | 112 | < 0,001 |
| No | 86,6 ± 50,8 | ||||
| Invasión de | Sí | 43 ± 45,8 | 3,16 | 112 | < 0,005 |
| parametrios | No | 85,3 ± 50,2 | |||
| Variedad | Uno | 38,4 ± 41,4 | 0,5 | 14 | NS |
| Ambos | 50,6 ± 56 | ||||
| Metástasis ováricas | Sí | 44,2 ± 37,1 | 1,4 | 112 | NS |
| No | 80,3 ± 51,7 | ||||
| Metástasis | Sí | 43,8 ± 42,6 | 3,8 | 112 | < 0,001 |
| ganglionares | No | 87,9 ± 50,9 | |||
| Valor en meses; NS = no significativo. | |||||
Tabla 3 Comparaciones de medias o pruebas de diferencias (t de Student) de las variables correspondientes al apartado diseminación respecto al intervalo de supervivencia | |||||
Intervalo de supervivencia | Media ± DS | t | df | p | |
| Invasión de los CLS | Sí | 68,9 ± 56,5 | 2,11 | 112 | < 0,05 |
| No | 91 ± 47,3 | ||||
| Variedad | Linfática | 45,2 ± 22,5 | 1,9 | 2;28 | NS |
| Sanguínea | 91,5 ± 65,3 | ||||
| Ambas | 62,6 ± 60,6 | ||||
| Infiltración del | Sí | 75,5 ± 46,4 | 2 | 112 | < 0,05 |
| endocérvix | no | 94,2 ± 53,3 | |||
| Invasión del | si | 55 ± 43,3 | 2,42 | 112 | < 0,05 |
| endometrio | No | 89,2 ± 50,4 | |||
| Infiltración del | Sí | 53 ± 40,6 | 2,59 | 112 | < 0,05 |
| miometrio | No | 89,5 ± 50,5 | |||
| Invasión de vagina | Sí | 50,3 ± 40 | 3,31 | 112 | < 0,005 |
| No | 91,5 ± 50 | ||||
| Invasión de | Sí | 53,1 ± 47 | 2,8 | 112 | < 0,05 |
| parametrios | No | 90,2 ± 49,5 | |||
| Variedad | Uno | 53,9 ± 44,8 | 0,08 | 14 | NS |
| Ambos | 51,8 ± 54,9 | ||||
| Metástasis ováricas | Sí | 85,6 ± 50,6 | 0,6 | 112 | NS |
| No | 62,4 ± 60,6 | ||||
| Metástasis | Sí | 45,4 ± 42,1 | 4,4 | 112 | < 0,001 |
| ganglionares | No | 94,5 ± 48,1 | |||
| Valor en meses; NS = no significativo. | |||||
Al realizar el análisis de regresión simple para obtener el porcentaje de variabilidad que explican las metástasis ganglionares y el valor medio en meses de intervalo libre de enfermedad e intervalo de supervivencia que disminuyen en las pacientes que padecen la mencionada diseminación, observamos que la existencia de metástasis ganglionares explica el 11 por 100 y el 16 por 100 de la variabilidad en los mencionados intervalos y los hace disminuir en 45 y 53 meses, respectivamente (tabla 4).
Tabla 4 Ecuación de regresión simple de la variable metástasis ganglionares respecto al intervalo libre de enfermedad y al intervalo de supervivencia | ||||
| Diseminación | Intervalo libre libre de enfermedad | Intervalo de supervivencia | ||
| Metástasis | r | 0,33 | r | 0,4 |
| ganglionares | F | 14 | F | 21,6 |
| p | < 0,001 | p | < 0,001 | |
| B | 45,1 ± 12 | B | 53,3 ± 11,8 | |
| Valor de B en meses; NS = no significativo. | ||||
Hemos realizado los análisis de supervivencia según el método de Kaplan-Meier para las pacientes con metástasis ganglionares y observamos que tienen una menor supervivencia en comparación con las pacientes sin tales metástasis, que se cifran en 24 por 100 y 10 por 100 a los cinco y diez años, para las que poseen metástasis y en 73 por 100 y 51 por 100, respectivamente, para las pacientes que no las poseen (tabla 5).
Tabla 5 Análisis de la supervivencia a los cinco y diez años según el método de Kaplan-Meier y cálculo de la razón de peligro según la ecuación de regresión de Cox, para la variable metástasis ganglionares | ||||||||
| N.º | 5 años N.º (%) | RP (IC 95 %) | p | 10 años N.º (%) | RP (IC 95 %) | p | ||
| Met. ganglionares | No | 93 | 78 (83,9) | 1 | 34 (68) | 1 | ||
| Sí | 21 | 5 (23,8) | 1,6 (1,1-2,4) | < 0,05 | 2 (10) | 2,9 (2-4,2) | < 0,001 | |
| RP = razón de peligro; IC = intervalo de confianza; NS = no significativo. | ||||||||
Las pacientes con metástasis ganglionares tienen un menor intervalo libre de enfermedad y un menor intervalo de supervivencia, tal y como hemos comentado anteriormente, empeorando el pronóstico a partir de la existencia de metástasis en dos ganglios (tabla 6). La supervivencia a los cinco años pasa del 29 por 100 al 14 por 100 en las pacientes con metástasis en más de dos ganglios y supervivencia nula en las pacientes con metástasis en más de tres ganglios. La supervivencia a los diez años pasa del 29 por 100 a ser nula en las pacientes con metástasis en más de dos ganglios (tabla 7).
Tabla 6 Comparaciones de medias o pruebas de diferencias (análisis de varianza-ANOVA) del intervalo libre de enfermedad y del intervalo de supervivencia de las pacientes en función del número de metástasis ganglionares | ||||||
Intervalo libre de enfermedad | N.º | Media ± DS | Razón | df | p | |
| Número de metástasis | 0 | 93 | 88 ± 49,7 | 4,76 | 3;110 | < 0,005 |
| ganglionares | 1 y 2 | 7 | 50,7 ± 42 | |||
| 3 | 10 | 35,5 ± 37 | ||||
| >= 4 | 4 | 50,3 ± 75,4 | ||||
| Tamaño metástasis | 0,23 | 21 | NS | |||
| Localización metástasis | Unilateral | 15 | 54,9 ± 47,4 | 3,34 | 1;20 | NS |
| Bilateral | 6 | 18,6 ± 12,5 | ||||
| Intervalo de supervivencia | N.º | Media ± DS | Razón | df | p | |
| Número de metástasis | 0 | 93 | 95 ± 48 | 7,25 | 3;110 | < 0,001 |
| ganglionares | 1 y 2 | 7 | 53,8 ± 41,4 | |||
| 3 | 10 | 32,3 ± 23,1 | ||||
| >= 4 | 4 | 51 ± 75,1 | ||||
| Tamaño metástasis | 0,27 | 21 | NS | |||
| Localización metástasis | Unilateral | 15 | 52,1 ± 48,7 | 1,12 | 1;20 | NS |
| Bilateral | 6 | 30,1 ± 19,6 | ||||
| Valor en meses; NS = no significativo. | ||||||
Tabla 7 Análisis de la supervivencia a los cinco y diez años según el método de Kaplan-Meier y cálculo de la razón de peligro según la ecuación de regresión de Cox, para la pacientes con metástasis ganglionares en función del número de metástasis | ||||||||
| N.º | 5 años N.º (%) | RP (IC 95 %) | p | 10 años N.º (%) | RP (IC 95 %) | p | ||
| Más de 2 ganglios positivos | ||||||||
| < 2 ganglios | 7 | 2 (28,6) | 0,6 (0,4-0,8) | < 0,01 | 2 (28,6) | 0,3 (0,2-0,5) | < 0,001 | |
| >= 2 ganglios | 14 | 2 (14,3) | 1 | 0 | 1 | |||
| Más de 3 ganglios positivos | ||||||||
| < 3 ganglios | 15 | 5 (33,3) | 0,5 (0,3-0,8) | < 0,005 | 2 (14,3) | 0,3 (0,2-0,5) | < 0,001 | |
| >= 3 ganglios | 6 | 0 | 0 | 1 | ||||
| Total | 21 | 5 (23,8) | 1 | 2 (10) | ||||
| RP = razón de peligro; IC = intervalo de confianza; NS = no significativo. | ||||||||
Por último, practicamos un análisis de regresión de Cox que incluyera todas las variables que describen las distintas variedades de diseminación, para poder conocer cuáles de ellas predicen con más fuerza el intervalo libre de enfermedad y el intervalo de supervivencia de las pacientes de nuestro material y cuáles de estas variables pierden su significado pronóstico al relacionarlas entre sí. Así obtuvimos los siguientes resultados:
-- La invasión de los espacios capilares, la infiltración del endocérvix, la invasión de vagina y la invasión de parametrios poseen significado pronóstico para predecir el intervalo libre de enfermedad, perdiendo significación estadística la invasión de endometrio, la invasión de miometrio y las metástasis ganglionares.
-- Respecto al intervalo de supervivencia, las variables infiltración del endocérvix, invasión de endometrio, invasión de miometrio e invasión de parametrios pierden su significado pronóstico, ganando en validez la invasión de los espacios capilares, la invasión de vagina y las metástasis ganglionares (tabla 8).
Tabla 8 Ecuaciones de regresión de Cox de las variables incluidas en el apartado diseminación respecto del intervalo libre de enfermedad y del intervalo de supervivencia | ||||
Intervalo libre de enfermedad | Razón de peligro | IC 95 % | p | |
| Invasión CLS | No | 1 | ||
| Sí | 1,9 | (1,3-2,8) | < 0,001 | |
| Infiltración endocérvix | No | 1 | ||
| Sí | 1,6 | (1,1-2,4) | < 0,05 | |
| Invasión endometrio | No | 1 | ||
| Sí | 1,2 | (0,7-2,1) | NS | |
| Infiltración miometrio | No | 1 | ||
| Sí | 0,9 | (0,5-1,8) | NS | |
| Invasión vagina | No | 1 | ||
| Sí | 2 | (1,4-3) | < 0,001 | |
| Invasión parametrios | No | 1 | ||
| Sí | 1,5 | (1-2,4) | < 0,05 | |
| Metástasis ganglionares | No | 1 | ||
| Sí | 1,3 | (0,8-2) | NS | |
| Intervalo de supervivencia | Razón de peligro | IC 95 % | p | |
| Invasión CLS | No | 1 | ||
| Sí | 1,7 | (1,1-2,5) | < 0,005 | |
| Infiltración endocérvix | No | 1 | ||
| Sí | 1,5 | (0,9-2,3) | NS | |
| Invasión endometrio | No | 1 | ||
| Sí | 1,1 | (0,6-1,9) | NS | |
| Infiltración miometrio | No | 1 | ||
| Sí | 0,9 | (0,4-1,6) | NS | |
| Invasión vagina | No | 1 | ||
| Sí | 2,3 | (1,4-3,6) | < 0,001 | |
| Invasión parametrios | No | 1 | ||
| Sí | 1 | (0,6-1,7) | NS | |
| Metástasis ganglionares | No | 1 | ||
| Sí | 2,5 | (1,4-4,4) | < 0,005 | |
| IC = intervalo de confianza; NS = no significativo. | ||||
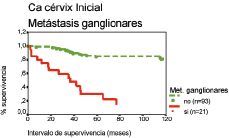
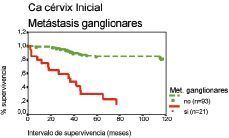
La figura 2 muestra los análisis de supervivencia según el método de Kaplan-Meier para las pacientes con metástasis ganglionares respecto del intervalo de supervivencia.
Figura 2. Curva de supervivencia según el método de Kaplan-Meier respecto del intervalo de supervivencia correspondiente a las metástasis ganglionares. Prueba «log rank» (52,9; df = 1; p < 0,001).
DISCUSION
Las posibilidades de supervivencia decrecen en gran manera cuando hay invasión de ganglios linfáticos en las pacientes de nuestro estudio, coincidiendo con Finan et al.(26) y numerosos autores(2,4,5,27-32). Otras muchas publicaciones apuntan a que la peor supervivencia en los estadios precoces es debida a la presencia de metástasis linfáticas(6,7,9,32). Asimismo, la presencia de metástasis linfáticas aumenta el riesgo de recidiva y disminuye el porcentaje de supervivencia según Roman et al.(33), Okada et al.(34) y otros autores(6,9,32,35).
Las metástasis ganglionares están relacionadas de manera significativa con el intervalo libre de enfermedad y con el intervalo de supervivencia en nuestro material. Las pacientes que padecen invasión de los ganglios linfáticos tienen una mayor frecuencia de invasión de los espacios capilares, invasión de endometrio, invasión de miometrio e invasión de parametrios.
Las metástasis ganglionares aumentan con el estadio clínico del tumor en nuestro material de manera no significativa y en numerosas publicaciones(30,36-39), y con el aumento de la profundidad de invasión del estroma, coincidiendo con Roman et al.(33) y otros autores(36). La presencia de estas metástasis ganglionares hace que aumente el porcentaje de invasión de los espacios capilares(33).
Al estudiar la localización de las metástasis linfáticas o la invasión de uno o más grupos de ganglios linfáticos, observamos que no tienen relación con la supervivencia en nuestro material, coincidiendo con las afirmaciones de Kjorstad et al.(40) y Burghart et al.(41). Sin embargo, Renolleau(42), Ferraris et al.(11) y Kamura et al.(30) están en descacuerdo con ellos.
Beyer y Murphy(29) y Burghart et al.(12) realizan un exhaustivo análisis de la localización de las metástasis ganglionares, en las pacientes afectas de carcinoma cervical.
La influencia de la invasión linfática unilateral o bilateral es conflictiva. Algunos autores como Renolleau(42) y otros(5), han reportado grandes diferencias en la supervivencia entre pacientes con invasión linfática unilateral y aquellas que padecían invasión bilateral. En nuestro material y en otros estudios(13,14) no se encuentran diferencias.
En cualquier caso, existen diferencias en la supervivencia en relación con el número de grupos ganglionares positivos y el número de ganglios linfáticos positivos, coincidiendo con Frigerio et al.(43), Kamura et al.(15) y numerosos autores(11,17), empeorando el pronóstico a partir de la existencia de metástasis en dos ganglios y coincidiendo este resultado con Berman et al.(16), Stock et al.(44) y Renolleau(42). Aunque Lai et al.(45) muestran un empeoramiento del pronóstico en las pacientes con tres o más ganglios positivos y Kjorstad et al.(40) en las pacientes con cuatro o más ganglios positivos.
Nosotros ciframos la supervivencia a los cinco y diez años en un 24 por 100 y 10 por 100, respectivamente, para las pacientes con metástasis ganglionares y el tiempo medio de supervivencia en cuatro años. En pacientes con metástasis en más de dos ganglios la supervivencia se sitúa en un 14 por 100 a los cinco años y llega a ser nula a los diez años y en pacientes con metástasis en más de tres ganglios a los cinco años.
El tamaño de la metástasis ganglionares se relaciona con la supervivencia en algunas publicaciones(41), aunque no en nuestra serie, determinando que el pronóstico se ensombrece grandemente cuando la metástasis excede en diámetro los 20 mm(41).
Una completa linfadenectomía se asocia a una mayor supervivencia, tal y como lo demuestran los estudios de Cosin et al.(28), Kjorstad(40), Kolbenstvedt(46), Thomas(47) y otros autores(48), por lo que se debe de realizar una cirugía completa, que incluya linfadenectomía, encontrando con este método un mayor porcentaje de metástasis linfáticas, en comparación con períodos anteriores y con otros métodos para los mismos investigadores(3,42). Como observan Burghart et al.(41), la extirpación de ganglios linfáticos positivos cura a pacientes con carcinoma cervical.
Aparte de los efectos terapéuticos de la linfadenectomía completa, el procedimiento ayuda a determinadas pacientes a elegir la terapia adyuvante oportuna en cada caso, que se administra frecuentemente a pacientes con ganglios linfáticos positivos. Así, al comparar las publicaciones que muestran la frecuencia de metástasis linfáticas según el estadio clínico, observamos una menor frecuencia de presentación en las pacientes irradiadas.
En las publicaciones de Cosin et al.(28) y Monaghan et al.(37) se muestra el efecto terapéutico de la linfadenectomía sistemática y técnicamente correcta.
El mejor pronóstico fue para las pacientes en las que, después de una linfadenectomía completa, no se demostró ninguna metástasis linfática, y esto es así, incluso para los estadios precoces de la enfermedad(9,24,38). En aquellas pacientes en las cuales se objetivaron metástasis en ganglios linfáticos, disminuyó su intervalo libre de enfermedad en poco menos de cuatro años y su supervivencia en cuatro años y medio.
CONCLUSIONES
Las metástasis ganglionares influyen en gran medida en la supervivencia de las pacientes afectas de cáncer del cuello uterino en estadios precoces, empeorando el pronóstico a partir de la existencia de metástasis en dos ganglios.
BIBLIOGRAFIA
01 Delgado G, Bundy B, Zaino R, et al. Prospective surgical-pathological study of disease-free interval in patients with stage IB squamous cell carcinoma of the cervix: A Gynecologic Oncology Group study. Gynecol Oncol 1990;38:352-7.
02 Parsons L, Friedell G. The evaluation of pelvic lymphadenectomy in the treatment of cervical cancer. Prog Gynecol 1963; 4:445-56.
03 Creasman WT, Zaino RJ, Major FJ, et al. Early invasive carcinoma of the cervix (3 to 5 mm invasion): risk factors and prognosis. A Gynecologic Oncology Group study. Am J Obstet Gynecol 1998;178:62-5.
04 Álvarez RD, Soong SJ, Kinney WK, et al. Identification of prognostic factors and risk groups in patients found to have nodal metastasis at the time of radical hysterectomy for early stage squamous carcinoma of the cervix. Gynecol Oncol 1989; 35:13.
05 Shingleton HM, Orr JW. Cancer of the cervix: diagnosis and treatment. Edinburgh: Churchill Livingstone; 1987.
06 Burke TW, Hoskins WJ, Heller PJ, et al. Clinical patterns of recurrence after radical hysterectomy in stage IB cervical cancer. Obstet Gynecol 1987;69:382-5.
07 Figge DC, Tamimi. Patterns of recurrence of carcinoma following radical hysterectomy. Am J Obstet Gynecol 1981;140: 213-20.
08 Gauthier P, Gore I, Shingleton H, et al. Identification of histopathologic risk groups in stage IB squamous cell carcinoma of the cervix. Obstet Gynecol 1985;66:569-74.
09 Larson DM, Copeland LJ, Stringer CA, et al. Recurrent cervical carcinoma after radical hysterectomy. Gynecol Oncol 1988;30: 381-7.
10 Pickel H, Haas J, Lahousen M. Prognostic factors in cervical cancer. Eur J Obstet Gynecol Reprod Biol 1997;71:209-13.
11 Ferraris G, Lanza A, D''Addato F, et al. Techniques of pelvic and paraaortic lymphadenectomy in the surgical treatment of the cervix carcinoma. Eur J Gynecol Oncol 1988;1:83-6.
12 Burghardt E, Pickel H. Local spread and lymph node involvement in cervical cancer. Obstet Gynecol 1978;52:138-45.
13 Martimbeau PW, Kjorstad KE, Iversen T. Stage Ib carcinoma of the cervix, the Norwegian Radium Hospital: results of treatment and major complications, 2: results when pelvic nodes are involved. Obstet Gynecol 1982;60:215-8.
14 Wertheim E. Zur Frage der Radikaloperation beim Uteruskrebs. Arch Gynakol 1900;61:627-68.
15 Kamura T, Shigematsu T, Kaku T, Shimamoto T, et al. Histopathological factors influencing pelvic lymph node metastases in two or more sites in patients with cervical carcinoma undergoing radical hysterectomy. Acta Obstet Gynecol Scand 1999;78:452-7.
16 Berman ML, Bergen S, Salazar H. Influence of histological features and treatment on the prognosis of patients with cervical cancer metastasic to pelvic lymph nodes. Gynecol Oncol 1990;39:127-31.
17 Fuller AF Jr, Elliott N, Kosloff C, Lewis JL. Lymph node metastases from carcinoma of the cervix, stages IB and IIA: Implications for prognosis and treatment. Gynecol Oncol 1982; 13:165-74.
18 Inoue T, Morita K. The prognostic significance of number of positive nodes in cervical carcinoma stage IB, IIA, and IIB. Cancer 1990;65:1923-7.
19 Morice P, Castaigne D, Pautier P, Rey A, et al. Interest of pelvic and paraaortic lymphadenectomy in patients with stage IB and II cervical carcinoma. Gynecol Oncol 1999;73:106-10.
20 Kim PY, Monk BJ, Chabra S, et al. Cervical cancer with paraaortic metastases: significance of residual paraaortic disease after surgical staging. Gynecol Oncol 1998;69:243-7.
21 Burghardt E, Pickel H, Haas J. Prognostische Faktoren und operative Behandlung des Zervixkarzinoms. In: Burghardt E, ed. Spezielle Gynacologie und Geburtshilfe mit Andrologie und Neonatologie. Vienna: Springer; 1985. p. 72-88.
22 Inoue T, Okumura M. Prognostic significance of parametrial extension in patients with cervical carcinoma Stages Ib, IIa, and IIb: a study of 628 cases treated by radical hysterectomy and lymphadenectomy with or without postoperative irradiation. Cancer 1984;54:1714-9.
23 Van Nagell JR, Donaldson ES, Gay EC, et al. Carcinoembryonic antigen in carcinoma of the uterine cervix: I. The prognostic value of serial plasma determinations. Cancer 1978;42: 2428-34.
24 Van Nagell JR, Roddick JW, Lowin DM. The staging of the cervical cancer: inevitable discrepancies between clinical staging and pathologic findings. Am J Obstet Gynecol 1971;110:973-8.
25 Fuchs PG, Girardi F, Pfister H. Human papillomavirus 16-DNA in cervical cancers and in lymph nodes of cervical cancer patients: a diagnostic marker for early metastases?. Int J Cancer 1989;43:41-4.
26 Finan MA, Decesare S, Fiorica JV, et al. Radical histerectomy for stage Ib1 versus Ib2. Carcinoma of the cervix: should the new FIGO staging system define therapy? Gynecol Oncol 1996;62:139-47.
27 Ishikawa H, Nakanishi T, Inoue T, Kuzuya K. Prognostic factors of adenocarcinoma of the uterine cervix. Gynecol Oncol 1999;73:42-6.
28 Cosin JA, Fowler JM, Chen MD, et al. Pretreatment surgical staging of patients with cervical carcinoma: the case for lymph node debulking. Cancer 1998;82:2241-8.
29 Beyer FD Jr, Murphy A. Patterns of spread of invasive cancer of the human cervix. Cancer 1965;18:34-40.
30 Kamura T, Tsukamoto N, Tsuruchi N, et al. Multivariate analysis of the histopathologic factors of cervical cancer in patients undergoing radical hysterectomy. Cancer 1992;69:181-6.
31 Liu W, Meigs JV. Radical hysterectomy and pelvic lymphadenectomy. Am J Obstet Gynecol 1955;69:1-32.
32 Bolla M, Grand E, Salvat J, et al. Inflammatory carcinoma of the uterine cervix. Review of 9 cases. J Gynecol Obstet Biol Reprod Paris 1990;19:187-91.
33 Roman LD, Felix JC, Muderspach LI, et al. Influence of quantity of lymph-vascular space invasion on the risk of nodal metastases in women with early-stage squamous cancer of the cervix. Gynecol Oncol 1998;68:220-5.
34 Okada M, Kigawa J, Minagawa Y, et al. Indicaton and efficacy of radiation therapy following radical surgery in patients with stage Ib to IIb cervical cancer. Gynecol Oncol 1998;70:61-4.
35 Yuan C, Wang P, Lai C, Tsu E, et al. Recurrence and survival analyses of 1,115 cervical cancer patients treated with radical hysterectomy. Gynecol Obstet Invest 1999;47:127-32.
36 Sakuragi N, Satoh C, Takeda N, Hareyama H, et al. Incidence and distribution pattern of pelvic and paraaortic lymph node metastasis in patients with Stages IB, IIA, and IIB cervical carcinoma treated with radical hysterectomy. Cancer 1999;85: 1547-54.
37 Monaghan JM, Ireland D, Mor-Yosef S, et al. Role of centralization of surgery in stage Ib carcinoma of the cervix: a review of 498 cases. Gynecol Oncol 1990;37:206-9.
38 Meigs JV. Radical hysterectomy with bilateral dissection of the pelvic nodes: The method of Joe V. Meigs. In: Meigs JV, ed. Surgical Treatment of Cancer of the Cervix. New York: Grune and Stratton; 1951. p. 149.
39 Falk V, Lundgren N, Quarfordt L, Arström K. Primary surgical treatment of carcinoma stage I of the uterine cervix. Acta Obstet Gynecol Scand 1982;61:481-6.
40 Kjorstad KF, Bond B. Stage Ib adenocarcinoma of the cervix: metastatic potential and patterns of dissemination. Am J Obstet Gynecol 1984;150:297-9.
41 Burghardt E, Baltzer J, Tulusan H, Haas J. Results of surgical treatment of 1,028 cervical cancers studied with volumetry. Cancer 1992;10:648-55.
42 Renolleau C, Laroussine MP, Mosseri V, et al. Pelvic lymph node invasion in cancer of the uterine cervix. Bull Cancer Paris 1995;82:377-83.
43 Frigerio L, Mariani A, Gandini L, Origoni M, et al. Prognostic factors in patients with with locally advanced cervical cancer treated with radical hysterectomy and adjuvant radiotherapy. Int Surg 1998;83:265-70.
44 Stock RG, Chen AS, Flickinger JC, et al. Node positive cervical cancer: impact of pelvic irradiation and patterns of failure. Int J Radiat Oncol Biol Phys 1995;31:31-6.
45 Lai CH, Chang HC, Hsueh S, Tang SG. Prognostic factors and impacts of adjuvant therapy in early-stage cervical carcinoma with pelvic node metastases. Gynecol Oncol 1993;51:390-6.
46 Kolbenstvedt A. Pelvic lymph node dissection under peroperative lymphographic control. Gynecol Oncol 1974;2:39.
47 Thomas GM. Pretreatment surgical staging of patients with cervical carcinoma: the case for lymph node debulking. Cancer 1999;85:254-5.
48 Hart K, Han I, Deppe G, Malviya V, et al. Postoperative radiation for cervical cancer with pathologic risk factors. Int J Radiat Oncol Biol Phys 1997;37:833-8.