La frecuencia de gestaciones gemelares monocigóticas se estima entre 0,4-0,45% de las gestaciones espontáneas. Sin embargo, tras la utilización de técnicas de reproducción asistida (TRA) numerosos estudios han demostrado un aumento del riesgo de gestaciones monocigóticas.
A propósito de 2 casos presentados recientemente en nuestro servicio, planteamos una revisión de los posibles factores que se pueden asociar entre las TRA y la gestación múltiple monocigótica.
Monozygotic twin pregnancies account for about 0.4%-0.45% of nonstimulated in vivo conceptions. However, numerous studies have demonstrated that the risk of these pregnancies is increased after the use of assisted reproductive technologies.
We report two cases of monozygotic twin pregnancies that occurred recently in our hospital and review the possible factors that may be involved in the association between assisted reproductive technologies and monozygotic twin pregnancies.
Las gestaciones monocigóticas (GMC) son consideradas de alto riesgo debido al incremento de patología obstétrica que conllevan, tales como abortos, anomalías estructurales congénitas (gemelos acardios, siameses, acortamiento de las extremidades), crecimiento intrauterino retardado, discordancia gemelar, síndrome de transfusión feto-fetal, partos prematuros y morbilidad neurológica1.
En la GMC, el patrón coriónico y amniótico depende del momento en el que se dividen las blastómeras en 2 contingentes celulares homocigotos independientes. Si la división se produce antes del día 3, da lugar a un embarazo bicorial-biamniótico lo que supone un 25% de los gemelos monocigóticos. Si la división acontece después del día 3 y antes del 8.° día de fertilización (entre D4-D8), determina un embarazo monocorial-biamniótico; la división entre D8-D13 determina gemelos monocoriales-monoamnióticos, y a partir de D-13, gemelos unidos o siameses2.
La frecuencia de gestaciones gemelares monocigóticas se estima entre el 0,4 y el 0,45% de las gestaciones espontáneas, y la frecuencia de embarazos triples monocigóticos, en el 0,004%3,4.
Sin embargo, tras la utilización de técnicas de reproducción asistida (TRA), numerosos estudios han demostrado un aumento del riesgo de GMC, concretamente aquellas que conllevan manipulación de gametos, en especial ovocitos, por medio de microinyección espermática (ICSI), eclosión asistida y/o perforación de la zona pelúcida (ZP) para biopsia de blastómeras.
Se estima un incremento entre 2-12 veces mayor de monocigosis en gestaciones con TRA frente a las espontáneas (0,9%).
Describimos 2 casos de GMC asociadas a TRA diagnosticadas en el Hospital de Fuenlabrada.
Casos clínicosCaso clínico 1Mujer de 41años que acude a nuestro servicio para control de embarazo aportando un informe de centro privado de gestación triple, bicorial-triamniótica.
Los antecedentes personales no presentan hallazgos de interés, siendo el grupo sanguíneo O negativo. En los antecedentes ginecoobstétricos de la paciente se encuentran un embarazo y parto normal en 2006, una segunda gestación conseguida con ICSI-TE realizada en un centro privado en noviembre del 2008 con semen de donante por factor masculino severo. Esta gestación finaliza con una interrupción legal del embarazo (ILE) tras el diagnóstico fetal de trisomía18. La paciente presenta una tercera gestación obtenida también mediante ICSI-TE en 2009 con semen de donante y posterior realización de diagnóstico preimplantacional embrionario normal que acabó con ILE tras diagnóstico fetal de agenesia de cuerpo calloso y anomalía de Ebstein.
La gestación actual fue conseguida con microinyección con gametos masculino y femenino de donantes, dados los antecedentes previos, y se transfirieron 2 embriones con el diagnóstico posterior de gestación triple.
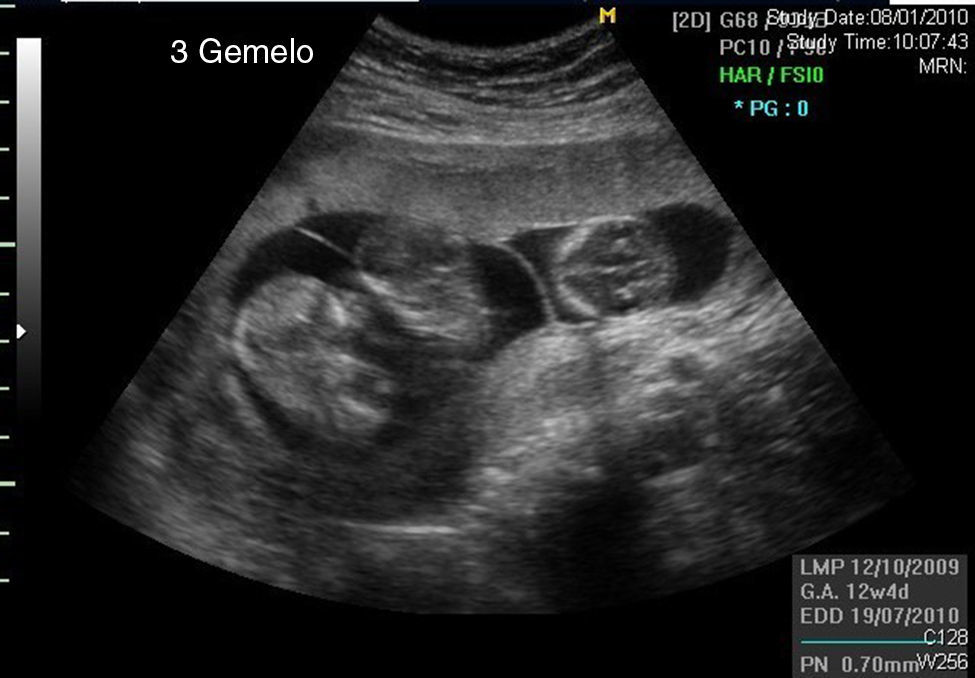
Las ecografías confirman el diagnóstico de gestación triple bicorial-triamniótica con gemelos monocigóticos. En la ecografía más precoz se describen 2 sacos gestacionales, uno con un solo embrión con latido cardiaco y el otro saco con 2 polos embrionarios, ambos con latido cardiaco (fig. 1).
En el control evolutivo, ninguno de los fetos presentaba alteraciones morfológicas y los crecimientos fueron acordes a la edad gestacional hasta la semana 25, presentando un control analítico sin hallazgos patológicos significativos salvo test de O'Sullivan positivo con curva de glucemia normal. A partir de semana 25 se traslada al hospital terciario de referencia para seguimiento.
La paciente ingresó en dicho centro en la semana 31+2 por rotura prematura de membranas, realizándose una cesárea con el resultado de los 3 recién nacidos (RN) vivos. Los pesos de los RN fueron el primero de 1.510g, con test de Apgar de 9/10 y reanimación (REA) 3, el peso del segundo fue de 1.410g, Apgar 9/9 y REA 3, y el tercero tuvo un peso de 1.800g, Apgar 5/8 y REA 4.
Durante el ingreso en neonatología, el curso clínico de los recién nacidos se complicó con sepsis neonatal tardía en los 3 casos por Streptococcus agalactiae, y en uno de ellos, con meningitis añadida. La evolución posterior fue satisfactoria y fueron dados de alta hospitalaria a los 41días del ingreso.
La evolución de los niños ha sido totalmente normal, teniendo en la actualidad 4años de vida, con un correcto desarrollo de crecimiento y psicomotor.
Caso clínico 2Mujer de 37años remitida a nuestro hospital desde un centro privado de reproducción asistida para seguimiento de embarazo.
En los antecedentes personales presenta una herniorrafia inguinal derecha y cirugía del hombro izquierdo, no refiere alergias conocidas ni hábitos tóxicos, siendo su grupo sanguíneo O positivo. En sus antecedentes ginecoobstétricos se describen 2 abortos espontáneos tras gestaciones conseguidas con microinyección espermática y semen de donante por factor masculino severo.
La gestación actual fue realizada también mediante ICSI-TE con donación de ovocitos y semen y con transferencia de 2 embriones.
La paciente aporta informe ecográfico en la semana 7+4 donde se describe una gestación cuádruple con presencia de 3 vesículas, una con vesícula hidrópica y botón embrionario sin latido, otra vesícula bien configurada y embrión con latido, ambas separadas por membrana amniótica, y un tercer saco gestacional que presenta 2 polos embrionarios con latido cardiaco, sin que se visualice amnios de separación.
La analítica de control fue normal, salvo la orina, en la que aparece presencia de Streptococcus agalactiae.
En el control ecográfico realizado en nuestro servicio en la semana 8-9.a se diagnostica una gestación cuádruple, bicorial tetraamniótica, con uno de los gemelos acardio.
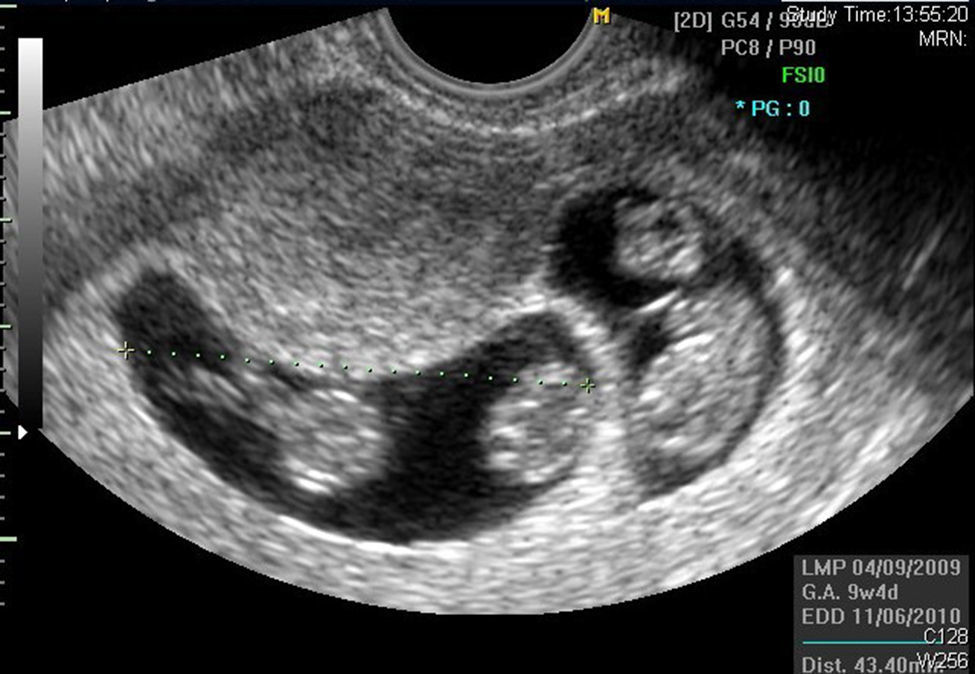
La ecografía describe 2 sacos gestacionales. El primer saco gestacional monocorial- biamniótico alberga un embrión con latido con CRL de 20mm y otro embrión sin latido de 9mm. El segundo saco gestacional, monocorial-biamniótico, presenta 2 embriones vivos con CRL 18 y 21mm (fig. 2).
En la semana 12 se describe en el lado izquierdo una gestación monocorial-biamniótica con un feto vivo, con medida fetal acorde y translucencia nucal (TN) normal y por encima otra bolsa con un feto acardio que presenta solo desarrollo de miembros inferiores y tronco inferior. La gestación monocorial-biamniótica del lado derecho presenta ambos fetos vivos (fetos3 y 4) con medidas acordes a la edad gestacional y TN normales.
Discutido el caso en el Comité Perinatal y tras informar a la mujer y a su pareja de los riesgos del embarazo, se remite a la Unidad de Medicina y Cirugía Fetal de referencia para plantear tratamiento.
En semana 17 se realiza la reducción del gemelo perfusor de la secuencia TRAP mediante cardiocentesis e instilación de ClK intracardiaco, y en el mismo acto se recoge líquido amniótico para cariotipo fetal.
A los 4 días de la intervención la paciente acude a urgencias de nuestro hospital por sospecha de rotura prematura de membranas y temperatura de 37,7°C. Se observan los fetos 3 y 4 vivos y móviles con sus bolsas normales. En la secuencia TRAP, situada en el polo inferior, se describe oligoamnios en ambas bolsas con presencia de coágulos y ausencia de latido fetal en el gemelo-bomba, siendo la analítica del ingreso sugestiva de corioamnionitis.
Se produce la expulsión espontánea del feto muerto y en quirófano, con anestesia intradural, se extrae el feto acardio del cérvix y restos de bolsa amniótica incompletos.
Al tacto no se palpa tejido placentario sino la bolsa de los fetos vivos, por lo que se liga y se deja in situ el cordón del feto muerto, instaurando cobertura antibiótica intravenosa y profilaxis antitrombótica, y tras 2 semanas de ingreso se da el alta hospitalaria.
En la semana 20+6 se objetiva rotura de membranas de una de las bolsas, ingresando de nuevo para control clínico, analítico, reposo, y se da el alta a los 5 días.
A las 23 semanas acude a urgencias por dolor abdominal intenso con expulsión espontánea de un feto. El segundo feto se expulsa a las 48h previo tratamiento con misoprostol y finalmente legrado evacuador en quirófano, requiriendo la paciente transfusión de 3 concentrados de hematíes.
El resultado de la autopsia fetal informa de un feto acéfalo-acardio de 75g de peso y otro feto de 88g de peso con anomalías morfológicas, describiéndose presencia de labio leporino y defecto de cierre toracoabdominal. La autopsia de los otros 2 fetos de 23 semanas no evidencia malformaciones y describe un desarrollo ponderal acorde con la edad gestacional.
Posteriormente, la pareja inicia estudio de aborto recurrente en centro privado con el diagnóstico de mutación de la MTHFR y elevación de los linfocitos natural killer. Comienza tratamiento con inmunoglobulinas i.v. y se transfieren 2 embriones congelados del ciclo previo con el resultado de gestación única evolutiva que llega a término y feto nacido vivo por cesárea en la semana 38.
DiscusiónEn la actualidad, uno de los más importantes objetivos de la reproducción asistida es la prevención de los embarazos múltiples, en especial en aquellas técnicas que conllevan manipulación de gametos como la microinyección espermática, la eclosión asistida y/o la perforación de la ZP para biopsiar blastómeras.
Los 2 casos presentados reflejan la gran problemática que la gestación múltiple entraña, como son la prematuridad, los abortos tardíos, la rotura prematura de bolsa con infección materna, el empleo de anestesia materna para diversos tratamientos quirúrgicos o la transfusión materna. A estas complicaciones descritas se añade la intensa ansiedad que se genera en las pacientes afectas y en sus parejas.
La importancia de la patología derivada de las gestaciones múltiples, y en particular de las monocoriales, hace que se investigue acerca de los posibles factores que se relacionan con las mismas en el campo de la reproducción asistida.
En los 2 casos descritos llama la atención que son gestaciones múltiples con evolución homocigota procedentes de la transferencia de 2 embriones obtenidos a partir de gametos masculinos y femeninos de donante, probablemente con alto potencial implantatorio por la elevada calidad esperada en los embriones.
Se conoce poco acerca de las causas del incremento de los gemelos monocigóticos asociados a las TRA. Sin embargo, la edad materna, la estimulación ovárica, la manipulación de la ZP, como la que realiza en la inyección intracitoplasmática y en la eclosión asistida, y factores asociados con el cultivo in vitro de embriones se han propuesto como posibles factores3,5-7.
Edad materna avanzadaLa GMC se ha relacionado con la edad materna avanzada, posiblemente asociada a la elevación de la FSH como a los cambios que se producen en la ZP. Sin embargo, se ha observado un incremento de GMC en mujeres de edad avanzada con óvulos donados, lo cual no apoyaría la relación entre edad materna y cambios en la calidad de la ZP. Los estudios hablan a favor de que la incidencia de GMC espontánea estaría más en relación con factores genéticos que con factores ambientales o debidos a la edad de la mujer5.
Estimulación ováricaSe ha observado un incremento de GMC en ciclos después de estimulación ovárica (1,2%), entre 3 hasta casi 12 veces mayor frente a las gestaciones espontáneas, pudiendo influir la estimulación con citrato de clomifeno, pero sobre todo el uso de gonadotropinas con fines de inducción de la ovulación o de estimulación ovárica. Las hormonas empleadas en la estimulación ovárica podrían producir un endurecimiento de la ZP o un retraso en la implantación y esto conllevar un incremento de las GMC sin que intervenga incluso el cultivo o la micromanipulación de gametos o embriones8.
Manipulación de la zona pelúcidaLa manipulación de la ZP como causa de GMC es objeto de debate, como se muestra en publicaciones tipo serie de casos que indican asociación, frente a otros que no la han demostrado5.
El incremento de las GMC se ha asociado con la rotura artificial de la ZP tanto en perforaciones leves como en la técnica de microinyección espermática intracitoplasmática o en disrupciones más extensas como las que se realizan en la eclosión asistida (assisted Hatching) o en la biopsia de blastómeras para el diagnóstico gestacional preimplantacional (DGP)9-11.
Como consecuencia de la manipulación de la ZP se puede producir herniación de las blastómeras a través del agujero creado durante la expansión del blastocisto. Otros autores postulan que el ICSI por sí mismo podría causar la división de la masa celular interna a través de uniones GAP artificiales, pero estas observaciones no se han visto corroboradas por otros estudios12.
La eclosión asistida también se ha descrito como posible factor asociado al aumento de GMC. Sin embargo, hay trabajos publicados que aunque reflejan la asociación no encuentran diferencia estadísticamente significativa respecto a cuándo no realizan eclosión asistida, atribuyendo el incremento de GMC a otros posibles factores, como son el cultivo prolongado del blastocisto, el empleo de láser para realizar el agujero en la ZP que produciría más calentamiento y también un agujero más duro que el que produce el ácido Tyrodes y el diámetro del agujero creado en la ZP13. La perforación amplia de la ZP podría tener un efecto difícil de deslindar del producido por los medios de cultivo específicos para la biopsia por su carencia de calcio y magnesio.
El DGP es otra técnica descrita con posible relación con la GMC al necesitar realizar la rotura de la ZP para la biopsia blastomérica14. Sin embargo, hay publicaciones que no encuentran esta asociación15.
Experimentalmente se ha descrito que la técnica de separación de blastómeras podría provocar embarazos gemelares monocoriales16.
Transferencia en estadio de blastocistoLa incidencia de GMC después de transferencia de blastocisto (D-5) está estimada en el 4,3-5%. Existe controversia entre los estudios que no encuentran relación entre la transferencia en estadio de blastocisto y el aumento en la probabilidad de GMC17 y los que sí lo asocian12,18,19.
Condiciones del cultivo embrionarioAún está en debate si las condiciones del cultivo o la duración de este son causa de GMC, ya que también se han descrito después de transferencias de embriones sin cultivo prolongado. Frente a trabajos que propugnan que el cultivo prolongado de embriones per se asocia un incremento del riesgo de GMC18,20, otros publican que cuando el cultivo prolongado se acompaña de rotura de la ZP, el rango de GMC es mayor que con cada procedimiento solo12.
Con la maduración in vitro de ovocitos (IVM) también se ha publicado GMC21. La IVM conlleva un largo periodo de cultivo in vitro porque añade un día más de cultivo de los ovocitos inmaduros, lo que podría explicar el riesgo de GMC.
Experimentalmente en animales se ha observado que la temperatura de incubación o la reducción en la tensión de oxígeno incrementan la incidencia de GMC en peces. En conejos, hay trabajos que demuestran que la hipoxia en los cultivos embrionarios puede retrasar la fertilización, y esto se asocia con GMC22.
Las posibles influencias de un cultivo embrionario prolongado al estadio de blastocisto sobre la incidencia de GMC es insuficientemente conocido. Se ha sugerido que bajas concentraciones de calcio en el medio de cultivo debilitan las uniones intercelulares de la masa celular interna y predisponen al embrión a dividirse. El uso de medio libre de calcio-magnesio cuando se realiza biopsia de blastómeras favorece la salida de la masa celular interna23. Sin embargo, hay que matizar que su aplicación es imprescindible para extraer blastómeras íntegras sin lesionar el embrión.
Hay otros trabajos que proponen que el nivel elevado de glucosa en el medio de cultivo produciría más radicales libres que inducirían a la apoptosis y disrupción de la masa celular interna24.
Otros grupos publican que el riesgo de GMC con transferencia en estadio de blastocisto ha disminuido en los últimos años, igualando al riesgo tras transferencia del embrión en D3, probablemente atribuido a la mejora en los sistemas de cultivo y la mayor experiencia de los embriólogos25.
Como conclusión, y debido a la trascendencia de las gestaciones múltiples monocigóticas, es muy importante identificar los factores que puedan contribuir a su incremento con el uso de TRA e instaurar medidas de prevención.
Con la literatura actual publicada se puede desprender que la incidencia de GMC es muy rara a pesar del uso de ICSI y del cultivo de blastómeras. La rotura de la ZP para biopsia de blastómeras y el uso de medios de cultivo sin calcio durante el procedimiento pueden añadir un riesgo potencial para la división embrionaria y la gestación múltiple monocigótica. La mejora en los sistemas de cultivo y la experiencia de los equipos de biólogos son muy importantes para la disminución de las mismas.
Sin embargo, estos factores son en su mayor parte inherentes al tratamiento de fecundación extracorpórea y escasamente modificables.
En la actualidad, la única medida capaz de disminuir de forma drástica la incidencia de gestaciones múltiples es la transferencia electiva de un único embrión en casos seleccionados.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.