INTRODUCCIÓN
Los efectos que podemos encontrar en mujeres tratadas con tamoxifeno son diversos y reflejo de la complejidad de su mecanismo de acción, debido a su efecto simultáneo agonista y antagonista en distintos tejidos, lo que muy probablemente dependa del ambiente de estradiol en el momento de su tratamiento y, por lo tanto, de la situación de premenopausia o posmenopausia de la paciente. En general, podemos decir que el tamoxifeno se comporta en la mama como un fármaco antagonista, agonista parcial en el útero y agonista en el hueso y el metabolismo del colesterol.
Se utilizó por primera vez en el Reino Unido como anticonceptivo en 19601. En 1966, debido al estudio de los distintos isómeros de la molécula, se descubrió su efecto inductor de la ovulación y así se lo utilizó durante algunos años2. En 1977, la Food and Drug Administration lo aprobó como tratamiento del cáncer metastásico de mama en la posmenopausia, y 15 años más tarde quedó demostrado su beneficio en mujeres premenopáusicas porque incrementa el intervalo libre de enfermedad y la incidencia de cáncer contralateral en mujeres con cáncer de mama receptor de estrógenos3.
El bloqueo del receptor estrogénico por el tamoxifeno ocasiona un crecimiento tumoral lento por bloqueo del ciclo celular en la fase G0/G14, se bloquea el crecimiento de fibroblastos, se inhibe la neoangiogénesis y el factor de crecimiento y las enzimas proteolíticas que favorecen la invasión y la metástasis.
El funcionamiento de este receptor es complejo, tiene capacidad de unirse a estrógenos, tamoxifeno, clomifeno, raloxifeno y toremifeno.
El efecto celular específico del tamoxifeno en el tejido genital es divergente y complejo, lo que nos impide definirlo como agonista o antagonista.
PACIENTES Y MÉTODO
Se ha realizado un estudio observacional prospectivo entre los años 2000 y 2003. De todas las pacientes con diagnóstico de cáncer de mama, se seleccionó a las 92 que recibieron tratamiento con tamoxifeno por un cáncer de mama con receptores de estrógenos.
Se siguió a este grupo de 92 pacientes durante años para ver qué incidencia de quistes o formaciones ováricas había y qué características presentaba la población con estas formaciones.
Por otro lado, del grupo de 92 pacientes se seleccionó exclusivamente el grupo de posmenopáusicas de más de 1 año cuando se diagnosticó el cáncer de mama, que se correspondía con 76 pacientes, para estudiar el efecto del tamoxifeno en el epitelio vaginal; para comparar los resultados, se las enfrentó a un grupo de 52 pacientes que también habían tenido un cáncer de mama y eran posmenopáusicas de más de 1 año, pero no estaban tomando tamoxifeno.
El análisis estadístico de los resultados comparativos de las variables cualitativas se llevó a cabo mediante la prueba de la χ2 y la fuerza de asociación se expresó en riesgos relativos (RR) con intervalo de confianza (IC) del 95%. Se estableció la significación estadística en el 5% bilateral (p < 0,05).
RESULTADOS
Acción del tamoxifeno en el epitelio vaginal
Del grupo de 92 pacientes que tomaban tamoxifeno 20 mg/día por un cáncer de mama con receptores de estrógenos, seleccionamos a las que llevaran más de 1 año en menopausia (76 pacientes) y para estudiar el efecto del tamoxifeno en el epitelio vaginal, las comparamos con 52 mujeres en menopausia con cáncer de mama pero que no tomaban tamoxifeno. Se trataba de 2 grupos homogéneos en cuanto a edad, estado menopáusico y antecedentes del cáncer de mama. La edad media del grupo de mujeres que tomaban tamoxifeno fue de 58,2 ± 5,5 años (intervalo, 41-87 años). En este grupo, el frotis atrófico esperado sólo se encontró en el 13% de las pacientes, mientras que el 87% conservaba un frotis de células intermedias y superficiales, es decir, un frotis expresivo de actividad estrogénica. En el grupo control de 52 mujeres que no tomaban tamoxifeno, la edad media fue 60,3 ± 6,2 años (intervalo, 39-78 años), con una incidencia de frotis atróficos del 79,1% y de frotis estrogénicos del 20,9% (RR = 3,76; IC del 95%, 1,85-7,67; p < 0,001).
Acción del tamoxifeno en los ovarios
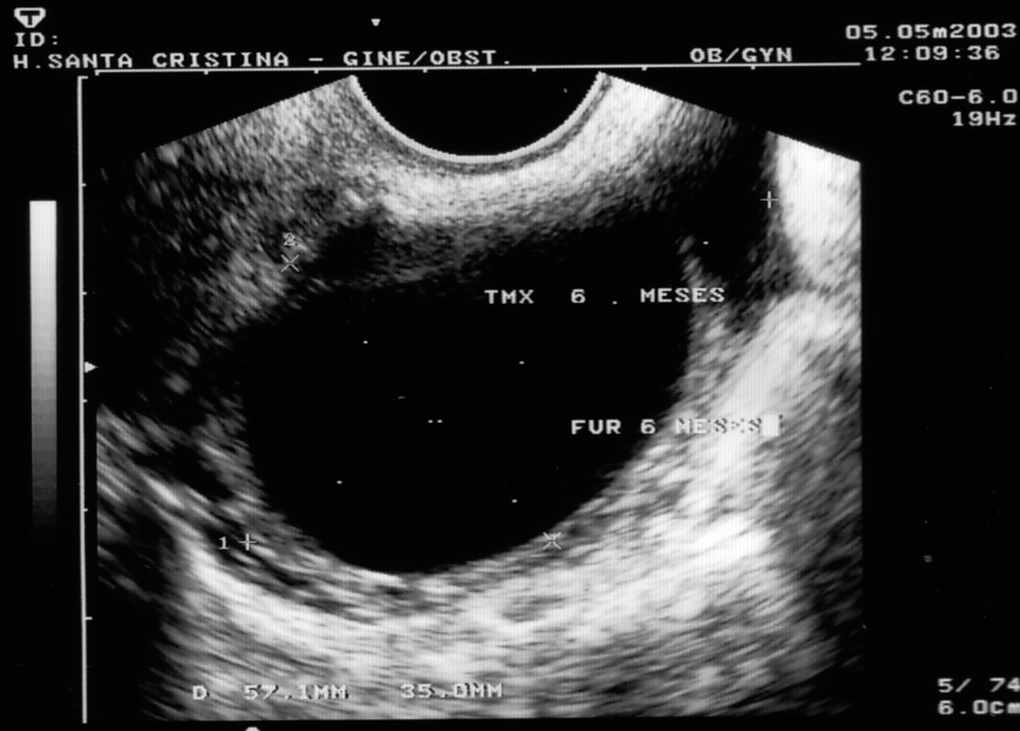
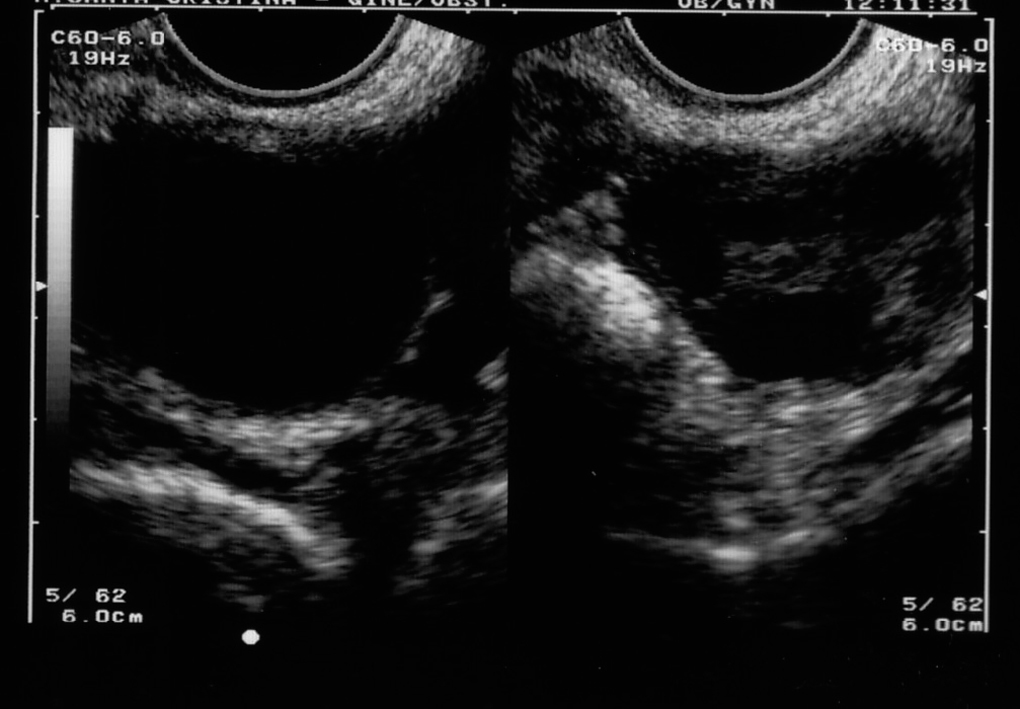
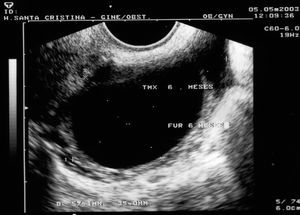
Seguimos, mediante ecografía vaginal, a las 92 pacientes de nuestro estudio desde el primer mes de inicio del tratamiento con tamoxifeno, para ver los cambios que este tratamiento originaba en su aparato genital. La edad media de esta población fue de 57,8 ± 6,7 años (intervalo, 38-87 años). En su seguimiento detectamos formaciones de ovario ecoicas en 12 (13%) pacientes, incluso a los pocos meses de iniciar el tratamiento (3 meses) y todas las pacientes que presentaron formaciones de este tipo lo hicieron en el primer año de tratamiento.
Analizamos las características de esas mujeres que presentaron las formaciones ováricas, y encontramos:
Edad media, 44,5 ± 4,6 años (intervalo, 38-53 años).
Sólo 1 paciente se encontraba en menopausia, las demás conservaban ciclos normales. La paciente menopáusica lo era desde hacia menos de 1 año.
No encontramos ninguna formación en mujeres con más de 1 año de amenorrea.
El 50% de las formaciones ya habían desaparecido en el momento de obtener las conclusiones de este estudio y probablemente el resto lo haga con el tiempo.
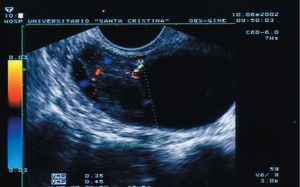
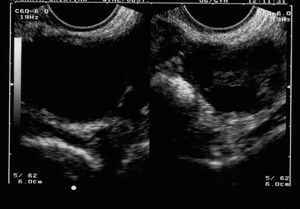
Sólo se intervino a 1 paciente, porque presentaba un Doppler patológico, aunque la imagen ecográfica no nos hizo pensar que se tratara de un cáncer de ovario (fig. 1). La anatomía patológica informó de «carcinoma lúteo hemorrágico y quiste folicular».
Figura 1. Formación ecoica que se intervino, porque presentaba un Doppler patológico.
En las figuras 2 y 3 se aprecian otras formaciones de ese tipo.
Figura 2. Formación ecoica a los 6 meses de tomar tamoxifeno.
Figura 3. Formación ovárica tras tomar tamoxifeno.
DISCUSIÓN
Desde el punto de vista fisiopatológico, ¿cómo se explican los distintos efectos del tamoxifeno? Una de las explicaciones se debe al descubrimiento, en 1966, de la isoforma beta del receptor del tamoxifeno5. Que haya 2 isoformas distintas para el receptor explicaría sus distintos efectos agonistas y antagonistas en distintos tejidos.
Pero esto no explicaría los distintos efectos en el mismo tejido; por ejemplo, no explicaría que indujera receptores de progesterona en el tejido mamario (efecto agonista) mientras que inhibe el crecimiento tumoral del cáncer de mama (efecto antagonista). Para dar explicación a este fenómeno se argumenta la teoría tripartita de Katzenellenbogen6, de donde se puede concluir que la acción esteroidea en una célula depende de un sistema tripartito que comprende «ligando/receptor/efector», de forma que el efecto agonista o antagonista del ligando (tamoxifeno) queda determinado por el complejo «receptor-efector», que en el núcleo celular da lugar a una u otra respuesta transcripcional e inicia la activación o la represión de determinados genes diana.
Tamoxifeno en el epitelio vaginal
Al igual que se describe en la literatura, se demuestra un efecto estrogénico en el epitelio vaginal de mujeres tratadas con tamoxifeno durante largos períodos, evaluado por el índice de maduración, es decir, midiendo la proporción de células superficiales, intermedias y parabasales7.
Esto es así en las pacientes posmenopáusicas, ya que en las pacientes premenopáusicas, con vaginas sometidas a un ambiente estrogénico, se encuentra el efecto contrario, y disminuye el índice de maduración como efecto antiestrogénico, con sequedad vaginal y dispareunia8 que, por otro lado, es el efecto que cabría esperar de un fármaco antiestrogénico como es el tamoxifeno.
Encontramos así el primer efecto paradójico del tamoxifeno que, dependiendo del ambiente hormonal en que se encuentre, es decir, dependiendo del estado menopáusico de la paciente, actuará con un efecto estrogénico o con un efecto antiestrogénico. Esta paradoja de acción no sólo se ve en el epitelio vaginal.
Tamoxifeno en los ovarios
Consideramos que tiene importancia conocer los efectos del tamoxifeno en los ovarios por 3 razones:
Estas formaciones podrían hacer pensar en una metástasis ovárica de un cáncer de mama.
El desarrollo de un tumor primario del ovario (correlación genética).
Como cualquier formación quística de ovario, se podría torsionar9.
El efecto del tamoxifeno en los ovarios fue descrito por Klopper y May en 19712. El tamoxifeno induciría la esteroidogénesis por efecto directo (dependiente del factor de crecimiento insulínico I)11 y, así como el clomifeno, bloquearía a nivel de la hipófisis el feedback negativo, aumentando la folitropina y la lutropina; pero la gran mayoría de los autores no encuentran tal aumento de estas hormonas12. El tamoxifeno actuaría estimulando las células de la granulosa de igual manera que en el endometrio, con lo que contribuye al aumento de estrógenos11, aumento éste que sólo ha quedado demostrado en pacientes premenopáusicas. Esta acción en las células de la granulosa contribuiría al desarrollo de esas formaciones o quistes funcionales en el ovario.
Mouritis et al13 encontraron en su estudio un 18% de mujeres que presentaban estas formaciones de ovario y, como nosotros, las encontraron en las mujeres más jóvenes, con menos tiempo de amenorrea y con mayores concentraciones de estrógenos14 de forma estadísticamente significativa.
Las mujeres que han recibido dosis altas de quimioterapia no van a desarrollar estas formaciones ováricas, es decir, los quistes aparecen en mujeres con una función ovárica residual. Así como Powles et al15, nosotros no encontramos ningún quiste en mujeres con más de 1 año de amenorrea.
Son quistes siempre de aspecto ecográfico benigno y desaparecen con el tiempo, aunque una alteración en el Doppler ecográfico no obligó a realizar estudio histológico de una de esas formaciones.
Algunos autores16 encuentran en el útero hiperplasias o pólipos endometriales asociados a los hallazgos ováricos, y aunque concluyen que no existe correlación entre ellos, dejan la puerta abierta a un efecto agonista mediado por el factor de crecimiento insulínico I en el ovario y el endometrio simultáneamente.
Otros autores17 encuentran resultados muy parecidos, quistes en el 25% de las mujeres, también jóvenes, aunque alguno en la posmenopausia, que igualmente se resuelven espontáneamente, e intervinienen sólo a 1 paciente, porque presentaba un CA 125 elevado, que resultó ser un cistoadenoma seroso.
La asociación de un hiperestrogenismo a estas formaciones ha hecho que se hayan ensayado tratamientos para su resolución, como los análogos de la gonadoliberina, que han hecho que desaparezcan a los 2 meses de iniciarse el tratamiento y que los estrógenos vuelvan a niveles fisiológicos en un 64% de las pacientes tratadas; el resto de las pacientes precisaron un segundo ciclo para la completa normalización estrogénica y la desaparición de las formaciones18.
CONCLUSIONES
Hay diversos efectos del tamoxifeno en el aparato genital, íntimamente relacionados con el ambiente estrogénico a que está sometida la paciente que recibe el tratamiento, y se encuentran frotis cervicovaginales no atróficos en mujeres que llevan muchos años en menopausia y toman tamoxifeno, y frotis atróficos en mujeres de edad y estado menopáusico similares pero que no toman tamoxifeno. Este hecho es frecuente y no ha de ser causa de preocupación.
Se puede encontrar formaciones ováricas en mujeres que toman tamoxifeno como tratamiento coadyuvante por cáncer de mama, generalmente formaciones ecoicas poco sospechosas de cáncer de ovario, y en mujeres jóvenes que conservan los ciclos a pesar del tamoxifeno o de reciente menopausia, que no han recibido quimioterapia o ésta ha sido poco agresiva. Son formaciones transitorias, desaparecen espontáneamente y se asocian a una situación de hiperestronismo.
Correspondencia:
Dr. J.I. Bermejo Aycart.
Servicio de Obstetricia y Ginecología. Hospital General de Segovia.
Carretera de Ávila, s/n. 40002 Segovia. España.
Correo electrónico: jbermejo@hgse.sacyl.es
Fecha de recepción: 22/9/04
Aceptado para su publicación: 3/11/05