INTRODUCCIÓN
La relación masa anexial/gestación oscila entre 1:81 y 1:2.5001. En la serie de Hoffman2, el tumor dermoide es el segundo tipo histológico más frecuente (21,5%) dentro de las masas anexiales extirpadas durante el embarazo, sólo precedido por el cistoadenoma. Estos tumores dermoides son bilaterales en el 8-15% de las ocasiones3. Es más infrecuente, afortunadamente, encontrarse con un tumor maligno ovárico durante el embarazo (de 1:10.000 a 1:25.000 partos)4.
El diagnóstico se basa fundamentalmente en la ecografía, y se puede emplear puntualmente la resonancia magnética (RM).
Algunos protocolos indican cirugía programada a partir de la semana 16 del embarazo en caso de masas ováricas sólidas > 5 cm y de masas quísticas > 8 cm1.
Se expone un caso clínico y sobre él se revisan los puntos más sobresalientes de la bibliografía.
CASO CLÍNICO
Mujer de 32 años, con una cesárea hace 9 años por primípara podálica y un aborto de primer trimestre. Fumadora de 10 cigarrillos al día. Sin otros antecedentes medicoquirúrgicos de interés. En la ecografía de su primera consulta de obstetricia se objetiva un embrión intraútero con latido positivo y un CRL correspondiente a 7 semanas y 2 días de gestación. Durante el mismo estudio ecográfico se observan 2 grandes masas anexiales.
En el anejo derecho, con sonda vaginal, se visualiza una imagen de ecotextura sólida poseedora de múltiples líneas y puntos hiperecoicos con sombra acústica en su interior. El tamaño ronda los 8 cm de diámetro mayor. Esta masa está enclavada en la pelvis, ocupa el Douglas y desplaza el útero grávido hacia la izquierda.
En el anejo izquierdo se aprecia, con sonda abdominal, una masa quística de unos 10 cm de diámetro. La tumoración izquierda está a la altura aproximada del riñón ipsilateral y posee un polo sólido hiperecogénico en la pared que se orienta hacia la luz del quiste, que produce sombra acústica. El mapa color fue negativo para ambas tumoraciones. No se llegó a visualizar parénquima ovárico normal.
La paciente está asintomática. Se procede a solicitar las analíticas rutinarias del embarazo además de unos marcadores tumorales, cuyos resultados fueron: CEA de 2 (normal), CA-19.9 de 54,6 (discretamente elevado, valor normal entre 0 y 37), CA-125 de 18,3 (normal). Los resultados de las analíticas de protocolo de embarazo están dentro de límites normales.
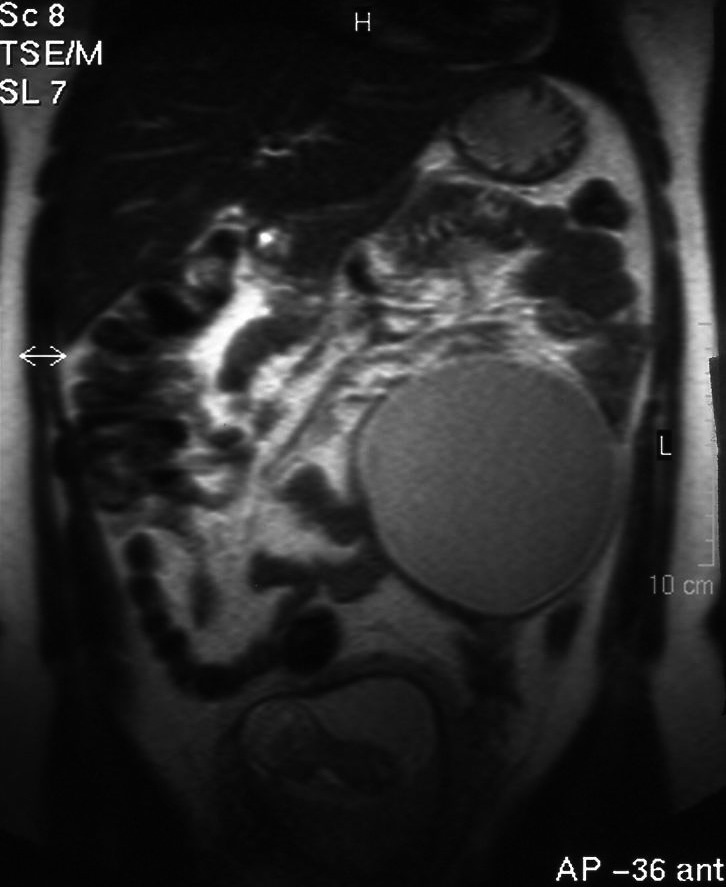
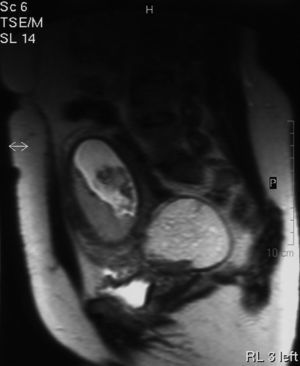
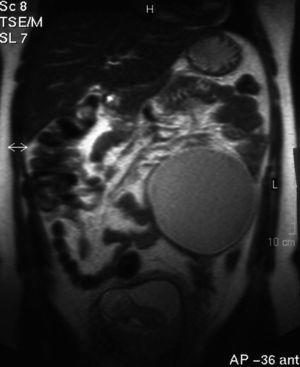
En el intento de profundizar en la caracterización de las masas se solicita una RM que se lleva a cabo en la semana 13 y 4 días de gestación. El informe de RM habla de masa hiperintensa en secuencias potenciadas en T1. La lesión está localizada en el margen posterior e inferior derecho de la pelvis, y presenta bordes indefinidos con buen plano de clivaje con respecto a estructuras circundantes y unos diámetros de 80 x 50 mm. Las secuencias de supresión grasa muestran una importante pérdida de señal en el interior de la lesión. Se observa asimismo otra masa localizada en la cavidad abdominal media izquierda de bordes bien definidos y con unos diámetros transversos de aproximadamente 10 cm. La masa presenta señal intermedia con un polo inferior hiperintenso en secuencias potenciadas en T1 que pierde señal con la secuencia STIR. En conclusión, se trata de quiste dermoide bilateral en paciente gestante.
En el control ecográfico de la consulta no se demuestra en el feto translucencia nucal patológica y se visualiza el hueso nasal en el primer trimestre. El resultado del cribado bioquímico de AFP (alfafetoproteína) y βhCG del segundo trimestre están dentro de parámetros normales.
Llegados a este punto, se notificó a la paciente la posibilidad de intervenir los tumores ováricos a partir de la semana 16 de su embarazo. Informada de las posibles complicaciones de la intervención programada así como de los inconvenientes que podría tener no operar las masas en el segundo trimestre, la pareja decidió seguir una conducta conservadora. Se pactó que ante cualquier dolor abdominal de cierta entidad acudiría con premura a urgencias de tocoginecología.
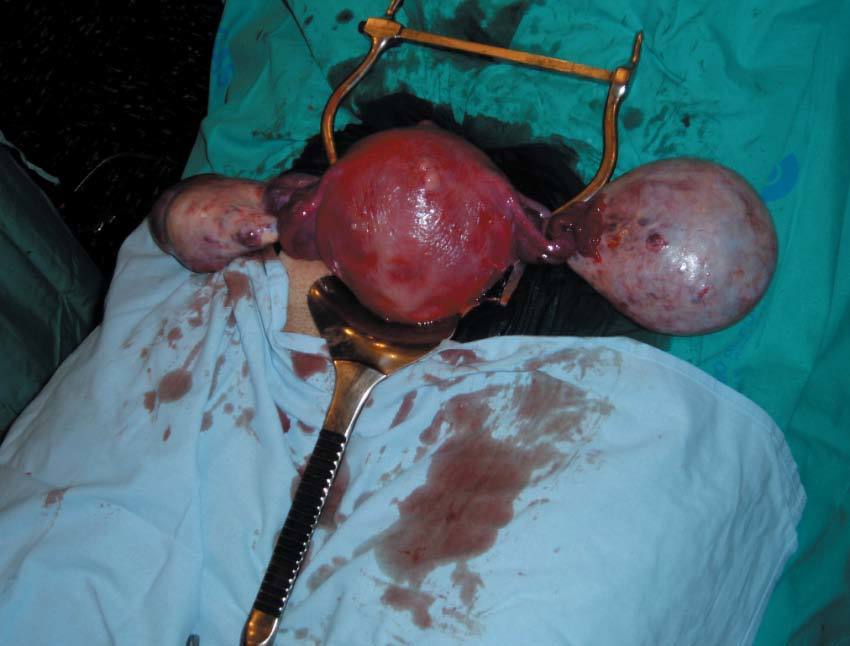
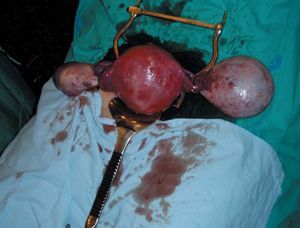
El embarazo continuó su curso normal. Los sucesivos controles ecográficos no mostraron variación significativa del tamaño de las masas y el mapa color seguía siendo negativo. Sin embargo, se evidencia el ascenso de la masa anexial derecha que es expulsada de la pelvis por el útero gestante, que finalmente se situó a nivel abdominal, a la altura de la tumoración contralateral (fig. 1).
Figura 1.Útero y anejos tras cesárea.
Se decide finalizar la gestación mediante intervención cesárea en la semana 38 de embarazo. Se optó por una incisión de laparotomía media infraumbilical para obtener el mejor campo quirúrgico posible con vistas a la manipulación de las masas y a la exploración pelvicoabdominal tras la extracción fetal. Nació un varón de 3.300 g y Apgar 9/10. Durante la cesárea se realiza anexectomía izquierda de tumoración quística de unos 10-11 cm de diámetro, sin adherencias y fácilmente movilizable. El tumor anexial derecho mide unos 8 cm, es de aspecto sólido, está libre, sin adherencias y posee una cápsula fina, que deja ver a su través material piloso. Aquí se logra realizar quistectomía (al despegar la cápsula drena fuera del campo abundante material sebáceo y pelo). Se logró conservar tejido ovárico aparentemente sano para la paciente en anejo derecho.
El anatomopatólogo informó de teratoma maduro quístico de ovario derecho y teratoma maduro quístico de ovario izquierdo, lo que descartó malignidad.
La evolución postoperatoria fue óptima, y la paciente continuó con controles rutinarios en las consultas externas de ginecología (figs. 2 y 3).
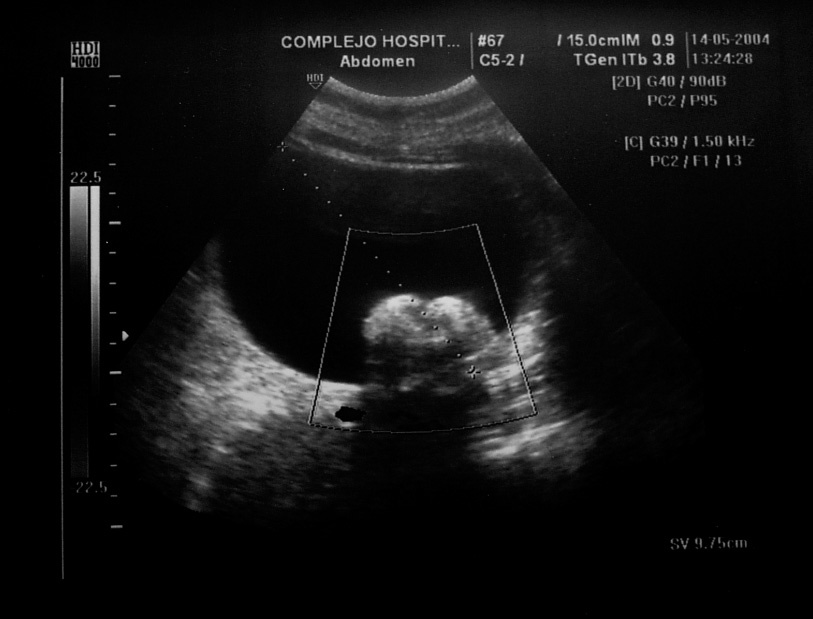
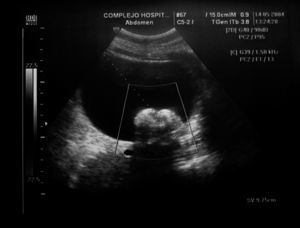
Figura 2.Masa anexial izquierda por ecografía. Protuberancia de Rokitansky.
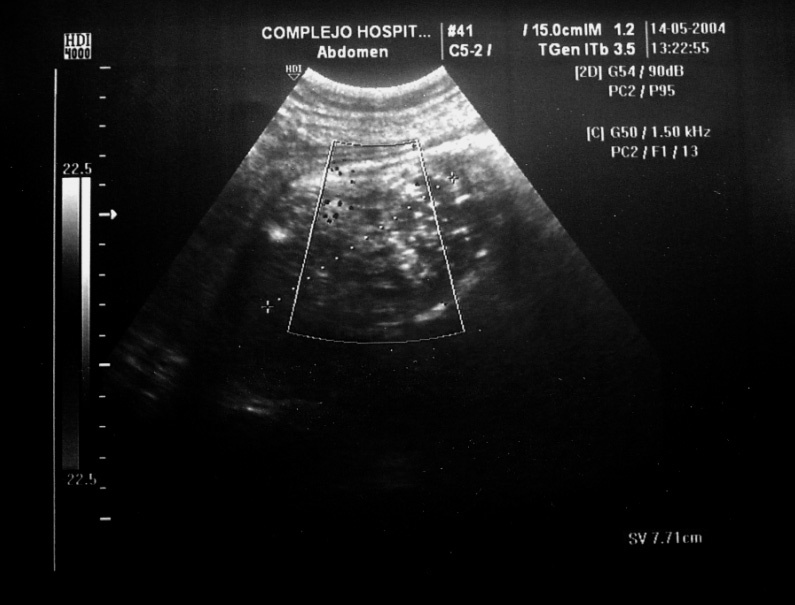
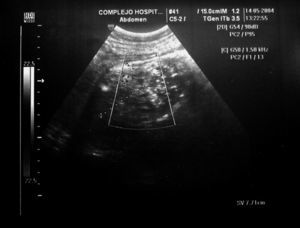
Figura 3.Masa anexial derecha por ecografía.
DISCUSIÓN
Según la bibliografía3, en el diagnóstico ecográfico de masas dermoides, el valor predictivo positivo fue de un 80% para la ecodensidad que produce sombras, un 75% para ecos brillantes regionales, un 50% para líneas y puntos hiperecoicos y un 20% para los niveles líquido-líquido. Se puede asumir que el valor predictivo positivo de 2 o más rasgos ecográficos de teratoma ronda el 100%. Con el sistema de puntaje morfológico para los quistes dermoides, Kurjak et al5 lograron una sensibilidad y una especificidad del 93,1 y del 99,4%, respectivamente, en un estudio de 887 masas anexiales. En cuanto al estudio Doppler color, el 72% de los teratomas quísticos eran en su mayoría avasculares, lo cual, combinado con el sistema de puntaje, produjo una sensibilidad y una especificidad del 99,02 y del 99,75%, respectivamente5. Continuando con el diagnóstico ecográfico hay que aclarar que durante el embarazo, y particularmente más allá del primer trimestre, puede ser difícil diagnosticar por ecografía masas anexiales. No es infrecuente que el útero grávido las arrastre fuera de la pelvis y las "camufle", lo que hace que sea complicado diferenciar la ecotextura uterina de la del tumor. Así, los problemas más significativos serían los del diagnóstico inicial y el diagnóstico diferencial. Para solventarlos se debe usar con pericia nuestro ecógrafo.
Es conocida la existencia de entre un 10 y un 25%1 de posibilidad de pérdida fetal por aborto o desencadenamiento de parto prematuro como consecuencia de la cirugía programada durante el embarazo, riesgo que se ve aumentado si hubiese que realizar una laparotomía urgente por quiste complicado (torsionado, infartado, roto...). La torsión puede verse con una frecuencia del 10 al 15%1 de los tumores ováricos, sobre todo entre las semanas 8 y 164. También se conoce que el resultado de una rotura del dermoide puede ser un shock o una hemorragia, especialmente durante el embarazo y el parto. La rotura del tumor hacia la cavidad peritoneal puede ir seguida de una peritonitis química con intensa reacción granulomatosa y formación de graves adherencias. La infección del dermoide es una complicación más infrecuente (1%)4.
Caspi et al6 exponen en el Am J Obstet Gynecol los resultados de su estudio en el manejo conservador durante el embarazo y el parto de varios casos de teratomas quísticos de ovario. Todos ellos diagnosticados por ecografía y < 6 cm con excelentes resultados. No encuentran complicaciones graves ni grandes crecimientos de las masas. Moore y Smith7 en el J Reprod Med comunican 14 casos de masas anexiales abordadas por laparoscopia en el segundo trimestre de la gestación, que incluyen 3 teratomas maduros. Observan buenos resultados en el sentido de evitar el aborto o el parto pretérmino tras la cirugía. Comunican un caso de peritonitis tras laparoscopia en una de las masas. Sin embargo, hay que pensar que el abordaje de estas masas por laparoscopia puede ser muy complicado y debe estar en manos de un ginecólogo endoscopista experimentado. Basta pensar en la imposibilidad de usar movilizadores uterinos y en el tamaño del útero grávido que podría lesionarse con facilidad. Por otro lado, Ballard8, al revisar 55.278 embarazos a término encontró 15 casos de masas ováricas bilaterales (como en nuestro caso) y 100 masas anexiales en total. Entre todas ellas sólo 2 correspondían a tumores malignos. DiSaia y Creasman4 proponen que cuando se lleve a cabo la exploración quirúrgica, no se manipule el útero ("manos lejos del útero") para reducir las contracciones uterinas en el postoperatorio. Estos autores señalan que en las gestantes con masas anexiales que puedan ser sospechosas de malignidad, el potencial peligro para la madre supera con mucho el peligro imaginado para el niño y que la mayor parte de las responsabilidades encontradas con los tumores ováricos son de omisión más que de comisión. La dificultad se plantearía cuando tanto el médico como la paciente se resistieran a la exploración abdominal durante el embarazo por temor a producir la muerte fetal. Según su experiencia, el momento óptimo de la intervención sería sobre las 18 semanas, salvo que se sospeche malignidad, en cuyo caso la cirugía podría adelantarse (figs. 4 y 5).
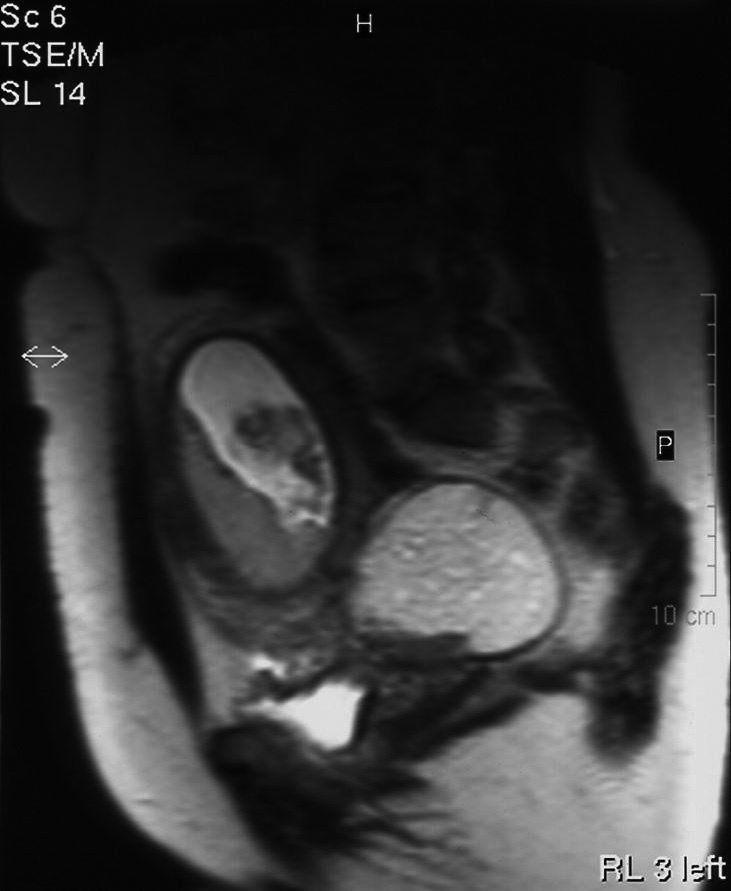
Figura 4.Masa anexial derecha por resonancia magnética.
Figura 5.Masa anexial izquierda por resonancia magnética.
A modo de recordatorio, podría decirse que ante el hallazgo de una masa anexial en el primer trimestre de embarazo, deberá continuarse con los controles ecográficos en las semanas siguientes, pues la mayoría resultarán ser imágenes funcionales o quistes del cuerpo lúteo que tienden a desaparecer espontáneamente. De encontrarse con un anejo complicado, abdomen agudo, etc., obviamente se operará de urgencia a la paciente, independientemente de la edad gestacional en que se encuentre. Cuando se trate de tumoraciones grandes, > 6 cm, que no desparecen o tienen un aspecto complejo y sospechoso, pueden intervenirse de manera programada. Se dice que el mejor momento para ello es entre las semanas 16 y 18, aunque debería adelantarse la exploración quirúrgica si la imagen es compatible con malignidad. En principio, el abordaje podría ser laparoscópico, pero esta técnica estaría reservada para ginecólogos endoscopistas experimentados. No está demostrado que los útero inhibidores sean de utilidad de manera profiláctica para prevenir la pérdida de la gestación tras la cirugía1. Puede ocurrir que se descubra una gran masa anexial, no diagnosticada previamente, al realizar una cesárea por otro motivo. Los marcadores tumorales (CA-125) suelen elevarse durante el embarazo normal1, sin embargo en algunos casos pueden resultar de utilidad. Pensemos que para el embarazo del estudio se obtuvo un CA-125 y un CEA rigurosamente normales, solamente el CA-19.9 se elevó ligeramente. Esta elevación debe interpretarse en el contexto del caso clínico conocido, y en nuestra opinión es razonable no tomar ninguna determinación clínica basada en este dato aislado. Cuando haya dudas, se podrá solicitar el auxilio de la RM para perfilar mejor la actitud terapéutica. En nuestro caso, la paciente rehusó la cirugía programada, a pesar de las 2 grandes tumoraciones que poseía, con un resultado final favorable. En este sentido se empieza a hablar de la necesidad de individualizar los casos pudiéndose optar por conductas conservadoras que dependerán del tamaño de la masa, grado de sospecha de malignidad y deseos de la paciente. Así, se podría optar por intervenir una masa que no diese problemas en todo el embarazo con el consiguiente riesgo de pérdida de gestación tras una cirugía inútil o se podría decidir no operar una masa a riesgo de que se complique en cualquier momento, o peor aún, en el caso de malignidad, aunque ésta sea poco frecuente.
CONCLUSIÓN
El manejo de tumoraciones ováricas durante la gestación puede suponer un reto para el obstetra. No se nos debe escapar la necesidad de individualizar la conducta a aplicar en cada caso, y usar juiciosamente las posibilidades diagnósticas de que se disponga y tener en cuenta la opinión de la paciente debidamente informada.