Comprobar la eficacia del test combinado de aneuploidías del primer trimestre en gestaciones espontáneas y compararlas con embarazos conseguidos con técnicas de reproducción asistida (TRA).
Material y métodosEstudio retrospectivo de los 1.675 cribados del primer trimestre realizados en nuestro centro, incluyendo la proteína plasmática A asociada al embarazo (PAPP-A) y la fracción libre de la subunidad β de la gonadotropina coriónica humana (β-hCG libre), edad materna y la translucencia nucal (TN). De ellos, 1.299 fueron en gestaciones espontáneas (77,5%) y 376 en gestaciones tras TRA (22,5%). El punto de corte para recomendar una prueba invasiva fue de 1/270.
ResultadosEl test combinado se aplicó en 74 gemelares, con dos falsos negativos. Entre las gestaciones únicas, se obtuvieron 70 cribados positivos, correspondiendo 49 de ellos (3,79%) a los espontáneos y 21 casos (6,84%) a las TRA. Se encontraron 11 cromosomopatías, 9 en espontáneos y 2 en TRA. La sensibilidad de la prueba fue de un 89% en espontáneos y de un 100% en TRA. La especificidad fue del 96 y el 93,77%, respectivamente.
ConclusionesEl cribado del primer trimestre presenta una sensibilidad y especificidad elevadas en gestaciones únicas, espontáneas y tras TRA. La tasa de cribados positivos es superior en el caso de TRA.
To determine the effectiveness of the combined test for aneuploidies in the first trimester of spontaneous pregnancies in comparison with pregnancies following assisted reproductive technology (ART).
Materials and methodsWe performed a retrospective study of 1675 triple tests performed in the first trimester in our center, including pregnancy-associated plasma-A (PAPP-A) and the free fraction of the β subunit of human chorionic gonadotropin (free β-hCG), maternal age and nuchal scan. Of these, 1299 (77.5%) were spontaneous pregnancies and 376 (22.5%) were pregnancies following ART. The cut-off point for recommending an invasive test was 1/270.
ResultsThe combined test was carried out in 74 twin pregnancies, with two false-positive results. Among single pregnancies, 70 positive triple tests were obtained, 3.79% of spontaneous pregnancies and 6.84% of ART pregnancies. Eleven chromosomal abnormalities were found, nine in spontaneous pregnancies and two in ART pregnancies. The sensitivity of the test was 89% in spontaneous pregnancies and 100% in ART pregnancies. The specificity was 96% and 93.77%, respectively.
ConclusionsThe first trimester triple test has high sensitivity and specificity in single pregnancies, whether spontaneous or following ART. The rate of positive triple tests is higher in pregnancies following ART.
En la actual asistencia obstétrica, es prioritario el diagnóstico prenatal de las anomalías cromosómicas, pues éstas acarrean causas importantes de muerte perinatal y discapacidad infantil permanente. En general, la inquietud sobre los resultados de la concepción son mayores cuando se trata de edades avanzadas o en el marco de la reproducción asistida.
Ya se ha abandonado definitivamente la estrategia de indicar pruebas invasivas dependiendo tan sólo de la edad materna1,2. La aparición de nuevos marcadores ecográficos y bioquímicos, con la integración de ambos, ha mejorado de forma sustancial la forma de seleccionar a las gestantes de riesgo.
El marcador ecográfico más efectivo en la trisomía 21 es el aumento del espesor de la llamada translucencia nucal (TN), entre las 11 y 14 semanas3,4. Debido a que esta medida se modifica con el tiempo de gestación, se encuentran mejores resultados expresando éstos en múltiplos de la mediana para el día en que se realiza la medición. Sólo esta medida brinda una aceptable tasa de detección, pero con un porcentaje alto de falsos positivos.
Respecto a los llamados marcadores bioquímicos, los de más reciente aparición son la proteína plasmática A asociada al embarazo (PAPP-A) y la fracción libre de la subunidad β de la gonadotropina coriónica humana (β-hCG libre). En la trisomía 21, la concentración sérica materna de β-hCG libre es más elevada que en los fetos euploides, mientras que el nivel de PAPP-A es más bajo. Al igual que en la translucencia, estas pruebas bioquímicas presentan variaciones de una población a otra y con la edad gestacional. Por ello sus resultados también se interpretan en términos de múltiplos de la mediana.
Entre estos marcadores bioquímicos y la TN fetal no hay una asociación significativa, tanto en los embarazos con cromosomas normales como en la trisomía 21, por tanto, ambos marcadores se pueden combinar y lograr una detección más eficaz. Surge de esta manera el llamado test combinado de aneuploidías del primer trimestre, con su correspondiente demostración de seguridad y eficacia5–7.
Mención aparte merecen los embarazos conseguidos tras la aplicación de las distintas técnicas de reproducción asistida, sobre todo si se trata de gestaciones gemelares. Se sabe del continuo y progresivo auge de la reproducción asistida en sus diversos procedimientos, con el consiguiente aumento del porcentaje de nacimiento de niños con cualquiera de las técnicas de fecundación in vitro y sus variantes. Sin embargo, continúa la controversia respecto a si estas técnicas conllevan un incremento de las malformaciones congénitas, de anomalías cromosómicas e incluso dudas respecto al futuro neurodesarrollo y conducta8. Respecto a la aplicación del cribado del primer trimestre en este tipo de embarazos, los resultados publicados han sido muy dispares.
Una consecuencia conocida de las técnicas de reproducción asistida es el incremento en la incidencia de la gestación múltiple. En estos casos, también debemos aplicar programas de cribado de aneuploidías9–11, pero se presentan algunas connotaciones. Por un lado, los marcadores ecográficos tienen el mismo valor sea cual sea el número de fetos en una gestación bicorial, no así si se trata de una monocorial, ante la posibilidad del inicio de una transfusión feto-fetal12. Al aplicar los marcadores bioquímicos, no parecen existir diferencias significativas entre las gestaciones múltiples espontáneas y las que resultan de tratamientos de reproducción13. En general, se ha comprobado la disminución de los falsos positivos tras la medición de la TN.
Respecto a los marcadores bioquímicos en los fetos tras la reproducción asistida, la variabilidad sí puede ser mayor, pues se ha comprobado por una mayoría de autores13–20 que la PAPP-A puede alterarse en estos casos, con cifras claramente inferiores respecto a los embarazos espontáneos y, por tanto, es necesario la corrección de resultados por parte del laboratorio correspondiente, o en todo caso informar que la fiabilidad del test no es tan alta como en los fetos nacidos tras gestación espontánea. En cuanto al marcador ecográfico, no se demuestran cambios en las cifras de TN en este tipo de embarazos13,14,21–25.
Material y métodosSe trata de un estudio observacional, retrospectivo, de los cribados combinados del primer trimestre recogidos en nuestro centro de Alicante, desde la puesta en marcha del programa en marzo de 2004 hasta septiembre de 2009. Según el protocolo adoptado por nuestro grupo en la fecha del inicio del estudio, ya en la primera visita del embarazo se explican detalladamente el significado y utilidad del test combinado a todas las pacientes, independientemente de su edad. Igualmente, se especifican las limitaciones conocidas de la prueba, en concreto en los gemelares y en los embarazos tras reproducción asistida, especialmente en los conseguidos en el programa de ovodonación.
En esta primera visita, se data con seguridad la edad gestacional de los embarazos espontáneos. En todos los casos, firman el correspondiente consentimiento de la prueba o la denegación en su caso.
La extracción de suero materno para la determinación de los dos marcadores bioquímicos, la PAPP-A y la fracción libre de la subunidad β-hCG se realizó entre la semana 9 y la 12. Para la determinación de estos dos marcadores mencionados anteriormente se utilizó la técnica de quimioluminiscencia empleando para ello como analizador el Inmulite 2000 de Siemens.
La medición de la TN se realizó alrededor de la semana 12, aceptando tan sólo los fetos con longitud craneocaudal entre 45 y 85mm, y siguiendo los criterios de la Fetal Medicine Foundation. Se emplearon los equipos ecográficos Voluson Expert y Voluson Pro (GE Medical Systems), por ecografistas experimentados, tanto por vía vaginal como abdominal.
El cálculo de riesgo se determinó mediante el programa PRISCA Software 4.0 (Typolog Software, Siemens). Especial consideración en dos casos: en los gemelares, se utilizó un programa informático adecuado a estos casos y en las gestantes tras ovodonación, se incluyó, en el apartado de la edad tan sólo la de la donante. El nivel de corte aceptado para indicar la prueba invasiva y la determinación del cariotipo fetal fue un riesgo estimado ≥ 1/270. En esos casos, se ofreció biopsia corial transcervical en la semana 12 o amniocentesis en la semana 15 a 16. Estos procedimientos fueron realizados en la unidad de diagnóstico prenatal de nuestro centro.
En todos los casos se hizo un seguimiento del embarazo correspondiente, incluida la ecografía morfológica entre la semana 18 a la 22. Se recogieron datos de todos los recién nacidos a partir de la historia clínica y se completaron los datos mediante llamada telefónica a las pacientes con seguimiento obstétrico y parto en otros centros.
El análisis estadístico de los datos se realizó mediante el programa Statistics Package for Social Sciences (SPSS), versión 12.0. Las variables cuantitativas se comparan empleando la prueba de la Student. Se consideraron estadísticamente significativas las diferencias que mostraron valores de p<0,05.
ResultadosDurante el período de estudio, se realizaron un total de 1.675 cribados de primer trimestre. De ellos, 1.299 (77,5%) fueron en gestaciones espontáneas y 376 (22,5%) con técnicas de reproducción asistida: 111 (29,5%) tras fecundación in vitro (FIV), 158 (42%) tras FIV con microinyección intracitoplasmática de espermatozoides (FIV-ICSI), 59 (15,7%) tras ovodonación y 48 (12,8%) tras inseminación artificial.
Del total, 74 fueron gemelares, 69 (93,2%) de ellos tras tratamientos y 5 (6,8%) espontáneos. En este grupo de gemelares, se encontraron dos cribados falsos negativos en gestación tras TRA (en ambos casos, uno de los fetos con síndrome de Down y el otro sano).
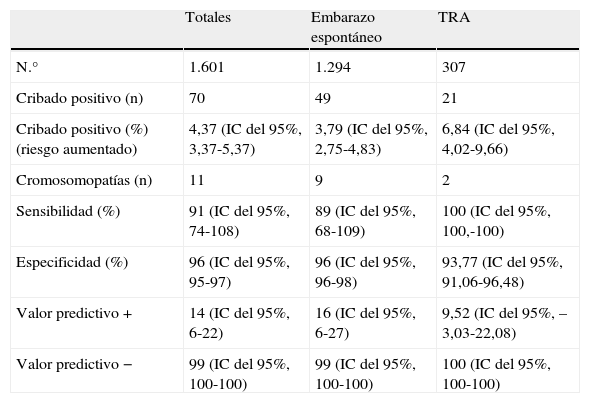
En cuanto a las gestaciones únicas (tabla 1) y considerando como punto de corte para indicar prueba invasiva un riesgo igual o superior a 1/270, el total de cribados positivos obtenidos fue de 70 (4,37%), distribuyéndose según el tipo de gestación entre 49 espontáneas y 21 tras tratamiento (la tasa de cribados positivos, por tanto es superior en el grupo de TRA, en un 6,84% frente a un 3,79% en los espontáneos). El 82,85% (58/70) de las pacientes con cribado positivo realizaron estudio de cariotipo fetal, 49 amniocentesis y 9 biopsias coriales. En el 17,14% (12/70), y tras ser informadas con su correspondiente documento de denegación, rechazaron su realización. Se encontraron un total de 11 alteraciones cromosómicas: 10 en el grupo de cribados positivos y un síndrome de Down, falso negativo y gestación espontánea. De los diagnosticados prenatalmente, 8 fueron trisomía 21, otro caso trisomía 18 y otro caso síndrome de Turner. La tasa de detección global de cromosomopatías fue del 91%, (89% en las espontáneas y 100% en TRA), con un valor predictivo positivo del 14% y un valor predictivo negativo de 99%. En la misma tabla se especifican las correspondientes tasas, diferenciando gestaciones espontáneas y las conseguidas con tratamientos de reproducción asistida.
Resultados del cribado del primer trimestre en gestaciones únicas, diferenciando los embarazos espontáneos y los conseguidos tras TRA
| Totales | Embarazo espontáneo | TRA | |
| N.° | 1.601 | 1.294 | 307 |
| Cribado positivo (n) | 70 | 49 | 21 |
| Cribado positivo (%) (riesgo aumentado) | 4,37 (IC del 95%, 3,37-5,37) | 3,79 (IC del 95%, 2,75-4,83) | 6,84 (IC del 95%, 4,02-9,66) |
| Cromosomopatías (n) | 11 | 9 | 2 |
| Sensibilidad (%) | 91 (IC del 95%, 74-108) | 89 (IC del 95%, 68-109) | 100 (IC del 95%, 100,-100) |
| Especificidad (%) | 96 (IC del 95%, 95-97) | 96 (IC del 95%, 96-98) | 93,77 (IC del 95%, 91,06-96,48) |
| Valor predictivo + | 14 (IC del 95%, 6-22) | 16 (IC del 95%, 6-27) | 9,52 (IC del 95%, –3,03-22,08) |
| Valor predictivo − | 99 (IC del 95%, 100-100) | 99 (IC del 95%, 100-100) | 100 (IC del 95%, 100-100) |
IC: intervalo de confianza; TRA: tratamiento de reproducción asistida.
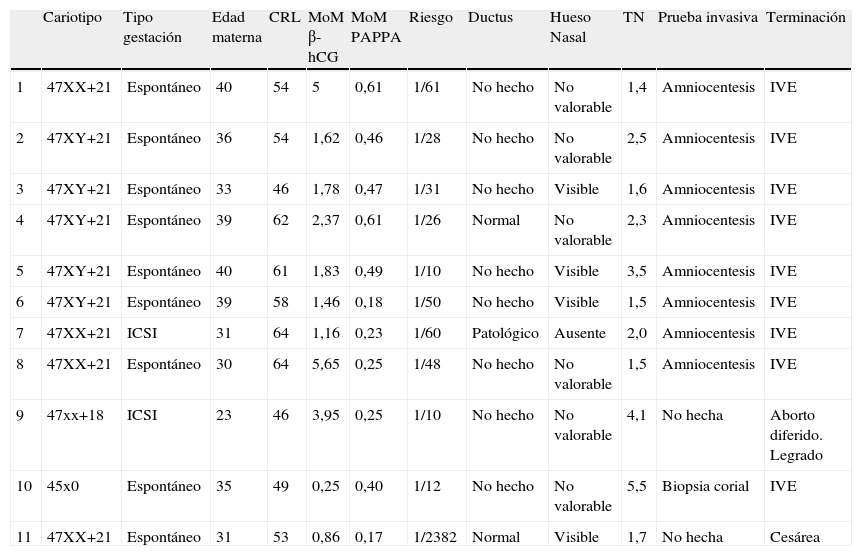
En la tabla 2 se detallan diversos datos clínicos con marcadores bioquímicos y ecográficos de los 11 casos encontrados de aneuploidías.
Descripción de los casos con cromosomopatías encontrados. El caso n.° 11 es el falso negativo
| Cariotipo | Tipo gestación | Edad materna | CRL | MoM β-hCG | MoM PAPPA | Riesgo | Ductus | Hueso Nasal | TN | Prueba invasiva | Terminación | |
| 1 | 47XX+21 | Espontáneo | 40 | 54 | 5 | 0,61 | 1/61 | No hecho | No valorable | 1,4 | Amniocentesis | IVE |
| 2 | 47XY+21 | Espontáneo | 36 | 54 | 1,62 | 0,46 | 1/28 | No hecho | No valorable | 2,5 | Amniocentesis | IVE |
| 3 | 47XY+21 | Espontáneo | 33 | 46 | 1,78 | 0,47 | 1/31 | No hecho | Visible | 1,6 | Amniocentesis | IVE |
| 4 | 47XY+21 | Espontáneo | 39 | 62 | 2,37 | 0,61 | 1/26 | Normal | No valorable | 2,3 | Amniocentesis | IVE |
| 5 | 47XY+21 | Espontáneo | 40 | 61 | 1,83 | 0,49 | 1/10 | No hecho | Visible | 3,5 | Amniocentesis | IVE |
| 6 | 47XY+21 | Espontáneo | 39 | 58 | 1,46 | 0,18 | 1/50 | No hecho | Visible | 1,5 | Amniocentesis | IVE |
| 7 | 47XX+21 | ICSI | 31 | 64 | 1,16 | 0,23 | 1/60 | Patológico | Ausente | 2,0 | Amniocentesis | IVE |
| 8 | 47XX+21 | Espontáneo | 30 | 64 | 5,65 | 0,25 | 1/48 | No hecho | No valorable | 1,5 | Amniocentesis | IVE |
| 9 | 47xx+18 | ICSI | 23 | 46 | 3,95 | 0,25 | 1/10 | No hecho | No valorable | 4,1 | No hecha | Aborto diferido. Legrado |
| 10 | 45x0 | Espontáneo | 35 | 49 | 0,25 | 0,40 | 1/12 | No hecho | No valorable | 5,5 | Biopsia corial | IVE |
| 11 | 47XX+21 | Espontáneo | 31 | 53 | 0,86 | 0,17 | 1/2382 | Normal | Visible | 1,7 | No hecha | Cesárea |
CRL: longitud craneocaudal fetal; ICSI: microinyección intracitoplasmática de espermatozoides.
En la tabla 3 se comparan las medias de los marcadores bioquímicos y ecográficos en los cribados de riesgo alto y entre el grupo de gestaciones espontáneas y tras tratamiento.
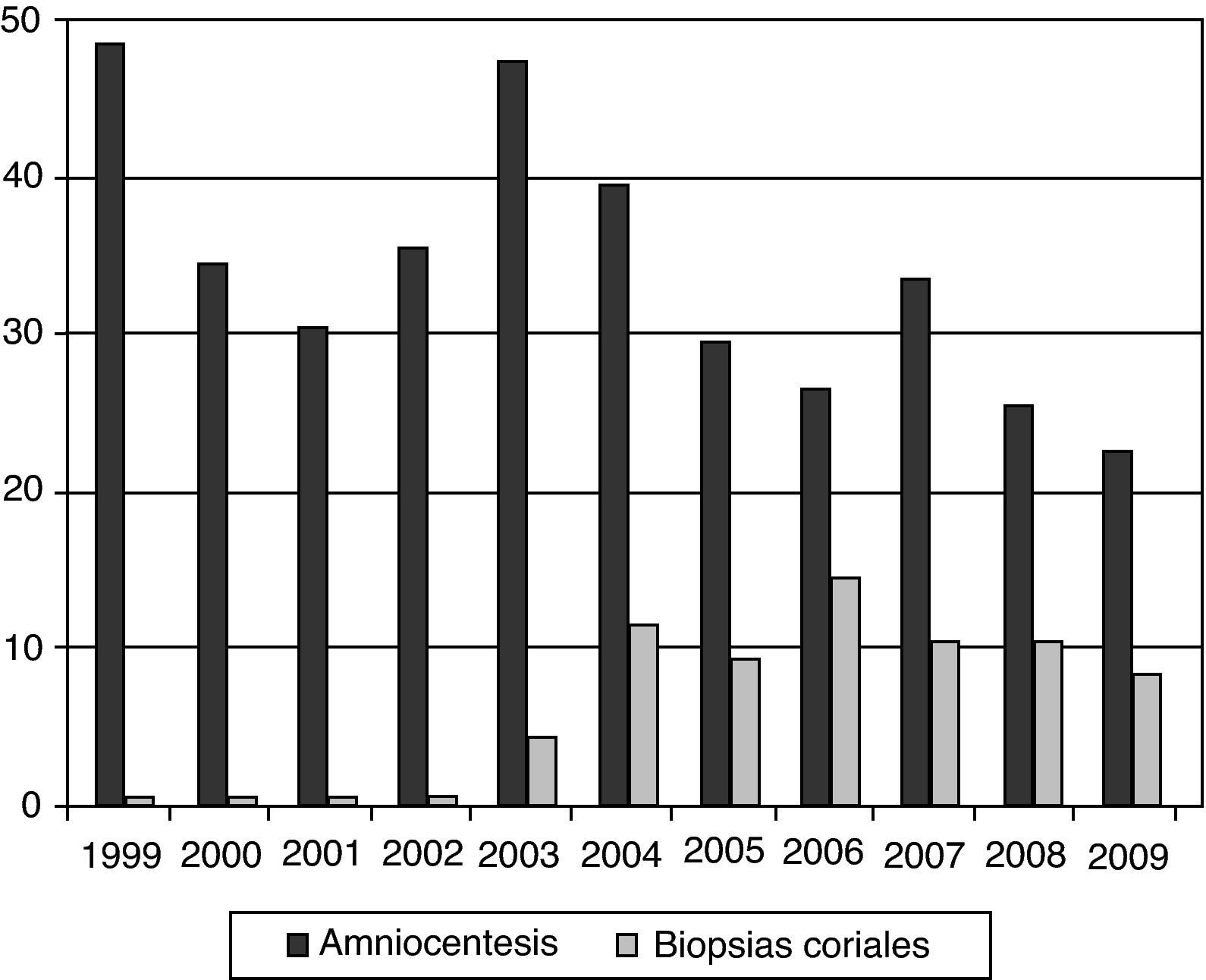
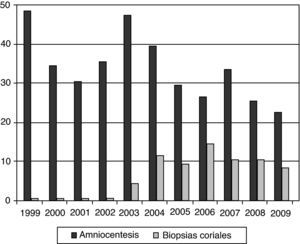
En la figura 1 se muestra la evolución experimentada en el número y tipo de pruebas invasivas en nuestro centro en los años previos y posteriores a la implantación del cribado en el primer trimestre. Tras abandonar en el año 2004 el test de aneuploidías del segundo trimestre junto al factor edad materna para la indicación de amniocentesis, se aprecia un progresivo descenso global de pruebas realizadas a pesar de un mayor número de controles obstétricos, y en todo caso, un aumento de biopsias coriales en detrimento de las amniocentesis.
DiscusiónLa detección de aneuploidías en una determinada población, ha sufrido una gran transformación en los últimos 30 años. En un principio, el único factor de riesgo que se debía tener en cuenta era la edad materna avanzada. Posteriormente, se instauró el test del segundo trimestre, que incluía la alfafetoproteína junto a la β-HCG, con unos resultados mediocres26–29. En la última década, se generaliza por fin el test combinado del primer trimestre30–34.
La posible asociación entre defectos congénitos de toda índole, malformativos y cromosómicos, y las TRA continúa siendo un tema de amplia controversia en la literatura, a pesar del progresivo aumento de niños nacidos con estos procedimientos en los últimos 25 años. Coexisten trabajos que niegan la evidencia de un aumento y otros sí comprueban la presencia de diversos defectos. Subyace la cuestión en todos ellos de una falta de uniformidad de datos, muestras pequeñas y carencia de grupos control adecuados.
Queda fuera de toda duda la alta eficacia y seguridad que ofrece este cribado, tanto en la extensa literatura reciente como en nuestros propios casos y especialmente en el grupo de gestantes tras tratamientos de reproducción asistida, con una muy aceptable tasa de detección. Como era de esperar, se asume un ligero aumento de falsos positivos respecto a los embarazos espontáneos, debido como así están de acuerdo la mayoría de autores, a la disminución en las cifra de la PAPP-A que se asocia a los embarazos tras TRA. A esta conclusión, también llega el reciente artículo de Amor et al35, con la casuística más amplia publicada hasta la fecha. Nuestro estudio demuestra un aumento similar del número de falsos positivos en el grupo de TRA, siendo del 6,84% frente al 3,79% de las espontáneas (en el artículo antes mencionado, representa un 10,1 frente a un 4,0%). Igualmente obtenemos unas cifras inferiores de PAPP-A (aunque sin significación estadística, como así ocurre en otros trabajos22,24,25,36). Aumenta, por tanto, ligeramente los procedimientos invasivos en el grupo de gestantes tras TRA, pero en todo caso, siempre en un número inferior si tan sólo se tomara la edad materna avanzada, situación ésta que se da con frecuencia en este grupo. Se disminuye, por tanto, el número global de pruebas invasivas, de vital importancia en estos embarazos en los que el mínimo riesgo añadido posible supone una especial preocupación a estas parejas.
Los cálculos de riesgo se realizan mediante sistemas informáticos, empleando los marcadores bioquímicos y ecográficos distribuidos entre poblaciones diferentes, según trabajos realizados y publicados anteriormente. Es deseable, y por ello uno de los propósitos de este artículo, la validación de la prueba con la población propia, y específicamente distinguiendo entre gestaciones espontáneas y con tratamiento.
Realizar el cribado más precozmente ofrece otras ventajas añadidas. Se fomenta la realización de ecografías más precoces, con la posibilidad de ampliar a otros marcadores indirectos de cromosomopatías distintos de la translucencia, como hacemos en nuestro centro. Igualmente, facilita la detección de anomalías morfológicas ya en fase embrionaria. La obtención temprana de resultados positivos hace factible la opción de ofrecimiento de la biopsia corial como primera opción de prueba invasiva37. En el presente estudio se constata que todas las pacientes diagnosticadas de cromosomopatía optaron por la interrupción voluntaria de su embarazo.
Si la frecuencia general referida de síndrome de Down es de un caso entre 600-700 gestaciones, resulta un hecho llamativo la alta frecuencia encontrada en nuestros resultados: 11 casos en 1.601 gestaciones simples, repartidos por igual entre gestaciones espontáneas y tras TRA y con la particularidad de haber superado el primer trimestre.
Es de destacar, como así demostramos, la posibilidad de diagnóstico de otras aneuploidías distintas del síndrome de Down y que curiosamente es un hecho no muy constatado en la literatura. Nos ha servido en nuestro caso para la detección de un síndrome de Edwards (caso 9: sin prueba invasiva, pues acabó en aborto diferido, con confirmación del cariotipo en los restos del legrado) y otro síndrome de Turner.
La aplicación del test del primer trimestre en gestaciones gemelares nos ha resultado más controvertido. Aunque en la literatura de los últimos años se constata una amplia utilización en este tipo de embarazos9,11, también se ha comprobado que la aplicación del test no mejora la sensibilidad del cribado ecográfico, aunque sí podría disminuir el número de falsos positivos12. En nuestro centro, comenzamos su aplicación tres años más tarde, tras conseguir el correspondiente programa informático específico. Después de los primeros 74 casos, y con la aparición de dos falsos negativos en este grupo, ponemos en tela de juicio la utilidad del cribado en las gestaciones gemelares. Decidimos apoyarnos con más determinación en los marcadores ecográficos, translucencia, hueso nasal, ductus venoso y regurgitación mitral, y, en todo caso, seguir aplicando el cribado si así lo deciden los futuros padres, tras ser informados previamente de una mayor tasa de falsos negativos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.