Comparar las concentraciones de quimiocina RANTES en gestantes con preeclampsia y embarazadas normotensas sanas.
MétodoSe seleccionó un total de 100 pacientes. Se incluyeron 50 gestantes con preeclampsia como los casos (grupo A) y un grupo control seleccionado por tener una edad y un índice de masa corporal similares al grupo de estudio que consistió en 50 embarazadas normotensas sanas (grupo B). Las muestras de sangre se recogieron en todas las pacientes antes del parto e inmediatamente después del diagnóstico en el grupo B para determinar las concentraciones de RANTES.
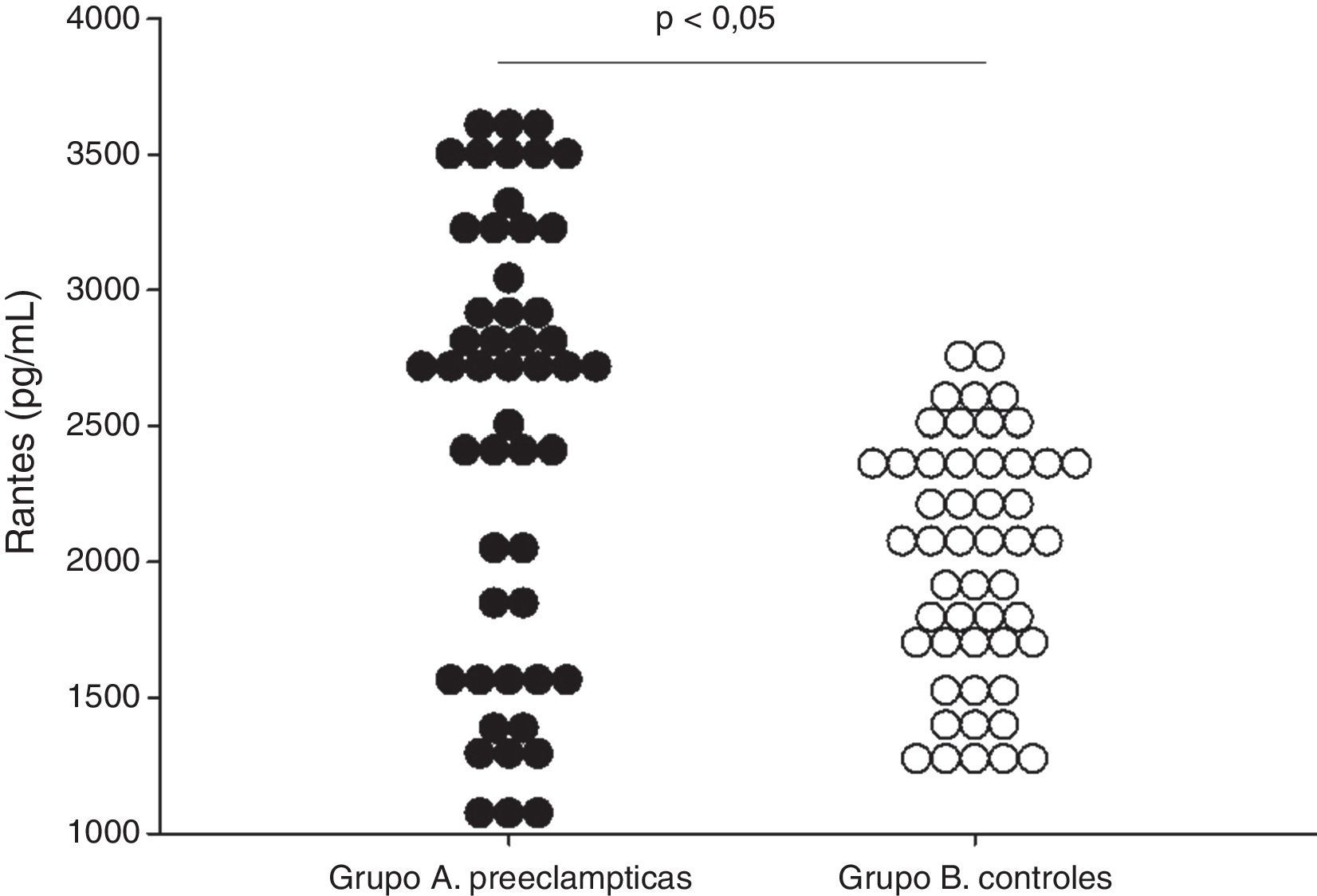
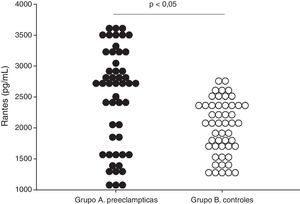
ResultadosNo se encontraron diferencias significativas con relación a la edad materna, edad gestacional e índice de masa corporal en el momento de la toma de la muestra (p=ns). Se encontraron diferencias estadísticamente significativas en las concentraciones de RANTES entre las pacientes en el grupo de estudio (grupo A; 2484,6±113,7pg/ml) y las pacientes del grupo control (grupo B; 2002,8±62,6pg/ml; p<0,05). Se observó una correlación moderada, positiva y significativa con los valores de presión arterial sistólica (r=0,283; p<0,05) y con los valores de presión arterial diastólica (r=0,322; p<0,05).
ConclusionesLas gestantes con preeclampsia presentaron concentraciones significativamente más altas de la quimiocina RANTES al compararlas con embarazadas normotensas sanas.
To compare concentrations of chemokine RANTES in pre-eclampsia patients and healthy normotensive pregnant women.
MethodA total of 100 patients were selected. We included 50 pre-eclamptic patients as cases (group A) and a control group of 50 healthy normotensive women with the same age and body mass index as the study group (group B). Blood samples were collected in all patients before labor and immediately after diagnosis in group B to determine RANTES concentrations.
ResultsThere were no significant differences in maternal age, gestational age, or body mass index when the samples were taken (P=ns). RANTES concentrations showed statistically significant differences between cases (group A; 2484.6±113.7pg/mL) and controls (group B; 2002.8±62.6pg/mL; P<.05). There was a moderate, positive and significant correlation with systolic blood pressure values (r=.283; P<.05) and with diastolic blood pressure values (r=.322; P<.05).
ConclusionsChemokine RANTES concentrations were significantly higher in pre-eclampsic patients than in healthy normotensive pregnant women.
La preeclampsia, una complicación específica del embarazo que ocurre durante la segunda mitad, está caracterizada por la presencia de hipertensión y proteinuria1. A pesar de los grandes esfuerzos para establecer los mecanismos y moléculas que inducen la preeclampsia, no se ha identificado ningún factor específico2. La isquemia placentaria y el daño endotelial han sido considerados eventos claves en la fisiopatología del síndrome; sin embargo, los mediadores que llevan a estos daños aún no han sido completamente estudiados3.
La naturaleza y la cantidad de las sustancias inmunorreguladoras presentes en el suero materno pueden ser parcialmente responsables de la regulación in vivo de las condiciones asociadas a la preeclampsia. El proceso de determinar las alteraciones de las citoquinas en el suero de las gestantes con preeclampsia permitiría mejorar el entendimiento de la etiología y patogénesis de la preeclampsia1,4.
El inicio de la cascada de inflamación está caracterizado por la expresión coordinada de quimiocinas y citosinas proinflamatorias. Las quimiocinas, con sus potentes propiedades de activación y atracción de leucocitos, desempeñan un papel crítico en este proceso5. La quimiocina regulated on activation, normal T cell expressed and secreted (RANTES), una quimiocina quimiotáctica también conocida como CCL5, un miembro de la clase C-C de las quimiocinas (subgrupo β), tiene acciones proinflamatorias incluyendo quimioatracción de monocitos, células T, células natural killer, eosinófilos y basófilos, activación de las células T de memoria, monocitos y eosinófilos, adhesión y transmigración de las células T a través del endotelio, liberación de histamina por los basófilos y adhesión de los monocitos a las proteínas de la matriz6. En humanos la RANTES se produce en una gran variedad de células, incluyendo células T, macrófagos, células endoteliales y tejido gestacional7. Se ha propuesto un papel clave para la RANTES en el embarazo e inicio del parto8, pero los reportes sobre los cambios en las concentraciones séricas en gestantes con preeclampsia son escasos9.
El objetivo de la investigación fue comparar las concentraciones de la quimiocina RANTES en pacientes con preeclampsia y embarazadas normotensas sanas.
MétodoSe seleccionó a un total de 100 pacientes: se incluyó a 50 gestantes con preeclampsia en el grupo de los casos (grupo A) y un grupo control seleccionado por tener edad e índice de masa corporal similares al grupo de estudio, que consistió en 50 embarazadas normotensas sanas (grupo B) en el periodo de octubre de 2011 a diciembre 2013. Todas las pacientes eran primigestas. La investigación fue aprobada por el comité de ética e investigación del hospital y se obtuvo consentimiento por escrito de todas las pacientes.
La preeclampsia se definió como la presión arterial sistólica de 140mmHg o más, o presión arterial diastólica de 90mmHg o más, confirmadas por 6h o más de diferencia, mientras que la proteinuria se definió como 300mg o más de proteína en una muestra de 24h, o uno o 2 cruces de proteinuria en un examen cualitativo después de las 20 semanas de gestación10.
Se excluyó a las embarazadas con polihidramnios, hemorragia del tercer trimestre (desprendimiento prematuro de placenta, placenta previa), sospecha de restricción del crecimiento intrauterino del feto (circunferencia cefálica, circunferencia abdominal y longitud del fémur menor del percentil 10 de referencia con confirmación posnatal de peso menor al percentil 10 de referencia), síndrome de HELLP, alteraciones de la frecuencia cardiaca fetal, gestaciones múltiples, presencia de infección intrauterina o materna activa, enfermedad hipertensiva crónica (antes de las 20 semanas de embarazo), tratamiento con antihipertensivos, enfermedad cardiaca, hepática, renal o sistémica crónica, diabetes mellitus pre o gestacional y hábito tabáquico. También se excluyó a las pacientes que se negaron a participar en la investigación.
Las muestras de sangre se recolectaron en todas las pacientes antes del parto y en los grupos en estudio inmediatamente después del diagnóstico y antes de cualquier intervención. Se centrifugaron inmediatamente después de que se produjo la coagulación y el sobrenadante del suero fue almacenado a –80°C hasta el momento de la determinación. Se utilizó una prueba de inmunoanálisis ligado a enzima para la medición cuantitativa de RANTES (Quantikine1 Human RANTES Immunoassay, R&D Systems, Minneapolis, EE. UU.). Todas las mediciones fueron hechas por duplicado y el promedio fue el resultado final. La concentración mínima detectable fue<8 pg/ml. Los coeficientes de variación intra e interensayo de 3 y 7%, respectivamente.
Los valores obtenidos se presentaron como promedio±desviación estándar. La prueba de la «t» de Student para muestras no relacionadas se utilizó para el análisis de los grupos y para comparar las variables continuas. Los coeficientes de correlación entre la RANTES y la presión arterial sistólica y diastólica se evaluaron usando la prueba de Pearson. La precisión de la RANTES para el diagnóstico de preeclampsia se presenta en función de la sensibilidad, la especificidad, el valor predictivo positivo, el valor predictivo negativo y la precisión. Se utilizó el análisis operador-receptor para determinar el mejor valor de corte. Se consideró p<0,05 como estadísticamente significativo.
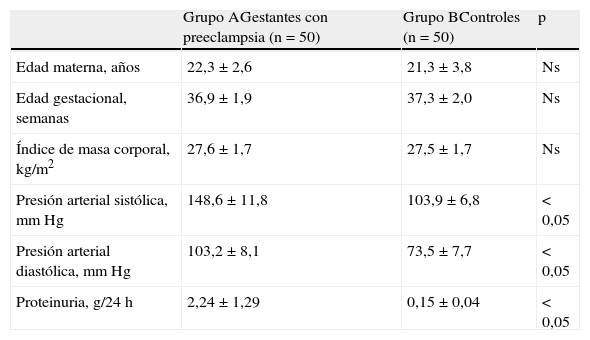
ResultadosLas características generales de los 2 grupos de pacientes se muestran en la tabla 1. No se encontraron diferencias significativas con relación a la edad materna, la edad gestacional y el índice de masa corporal en el momento de la toma de la muestra (p=ns). Se observaron diferencias estadísticamente significativas entre los grupos en los valores promedio de presión arterial sistólica y diastólica (p<0,05).
Características generales
| Grupo AGestantes con preeclampsia (n=50) | Grupo BControles (n=50) | p | |
| Edad materna, años | 22,3±2,6 | 21,3±3,8 | Ns |
| Edad gestacional, semanas | 36,9±1,9 | 37,3±2,0 | Ns |
| Índice de masa corporal, kg/m2 | 27,6±1,7 | 27,5±1,7 | Ns |
| Presión arterial sistólica, mmHg | 148,6±11,8 | 103,9±6,8 | <0,05 |
| Presión arterial diastólica, mmHg | 103,2±8,1 | 73,5±7,7 | <0,05 |
| Proteinuria, g/24h | 2,24±1,29 | 0,15±0,04 | <0,05 |
Se encontraron diferencias estadísticamente significativas entre las pacientes del grupo A (2484,6±113,7 pg/ml) y las pacientes del grupo B (2002,8±62,6 pg/ml; figura 1; p<0,05). Al realizar la correlación entre las concentraciones de RANTES y los valores de presión arterial se observó una correlación leve, positiva y significativa con los valores de presión arterial sistólica (r=0,283; p<0,05) y con los valores de presión arterial diastólica (r=0,322; p<0,05).
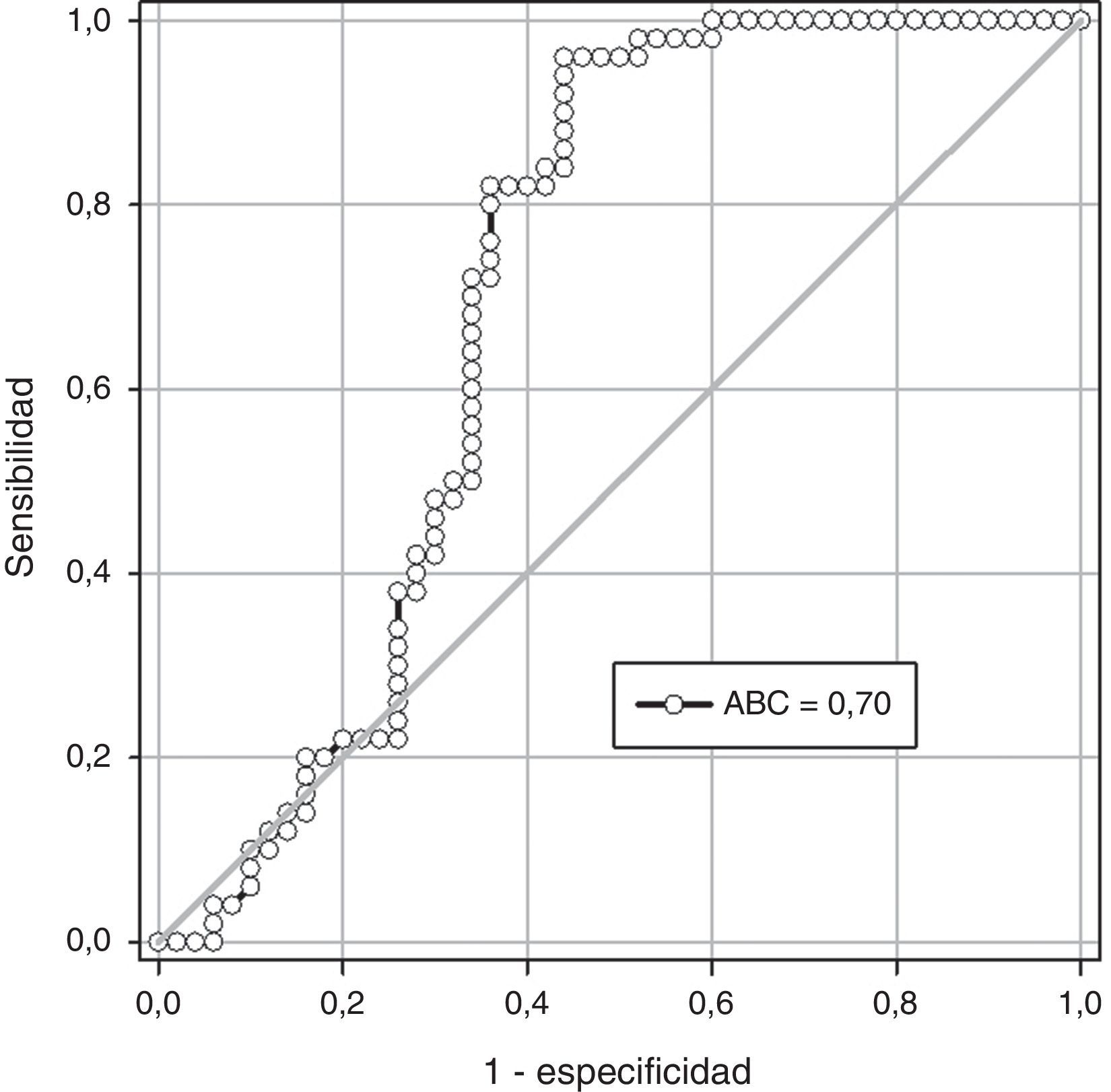
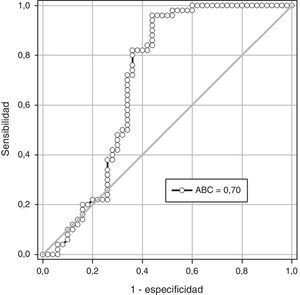
En la figura 2 se muestra la curva operador-receptor para la precisión de la RANTES para el diagnóstico de preeclampsia. Un valor de corte de 2.200pg/ml presentó un valor por debajo de la curva de 0,70 y tiene una sensibilidad del 63,8% (intervalo de confianza [IC] del 95%: 48,5-77,3), una especificidad del 62,2% (IC del 95%: 47,9-75,2), un valor predictivo positivo del 60,0% (IC del 95%: 45,2-73,6) y un valor predictivo negativo del 60,0% (IC del 95%: 51,2-78,7) con una exactitud diagnóstica del 69,1%.
DiscusiónEn el presente estudio las pacientes con preeclampsia presentaron concentraciones significativamente más altas de la quimiocina RANTES en comparación con embarazadas normotensas sanas. También se demostró que las concentraciones de RANTES se correlacionan de forma significativa con la presión arterial sistólica y diastólica. Los hallazgos de esta investigación suministran evidencia que apoya la hipótesis de una respuesta inflamatoria excesiva y podría implicar a la RANTES, que puede ejercer un papel en la preeclampsia.
Se ha sugerido que la adhesión de los componentes de la matriz extracelular es un evento importante en la diferenciación y activación de los monocitos11. Se ha reportado que la RANTES aumenta de forma selectiva la adhesión de los monocitos a la matriz de proteínas12. Los macrófagos pueden desempeñar un papel crucial en la respuesta inmune al procesar los antígenos extraños y presentarlos en combinación con los antígenos humanos de histocompatibilidad a las células T para su identificación. Los macrófagos también contribuyen a la respuesta inflamatoria al liberar citosinas proinflamatorias, factor de necrosis tumoral α e interleucina 1β. Sin embargo, el RANTES no es el único quimioatrayente de monocitos y macrófagos (por ejemplo MIP-1α). Además, la RANTES y la MIP-1α comparten el mismo receptor, lo que sugiere una forma de acción similar13.
Otra evidencia sugiere que la RANTES puede ser una citosina proinflamatoria, ya que esta es un mediador importante en la selección de macrófagos en un modelo animal in vivo14. Estudios in vitro de varias líneas celulares, incluyendo trofoblasto del primer trimestre, indican que esta quimiocina es producida en respuesta a la estimulación por lipopolisacáridos y por el factor de necrosis tumoral α15. También se ha demostrado que los corticosteroides pueden inhibir la expresión del ácido ribonucleico mensajero y de la proteína RANTES en las células T humanas16.
El hallazgo de altas concentraciones séricas de RANTES en las gestantes con preeclampsia comparado con las embarazadas normales puede ser una consecuencia de la supresión de la inmunidad celular en estas pacientes. A diferencia de lo encontrado en la presente investigación Jonsson et al.9 fueron incapaces de lograr encontrar diferencias estadísticamente significativas en las concentraciones séricas de RANTES en las gestantes con preeclampsia en comparación con las embarazadas normales. Estas altas concentraciones podrían indicar que la deficiencia de la quimiocina circulante puede tener un papel activo en la producción de un estado inflamatorio crónico, el cual en el embarazo humano es representado como la maduración del sitio de placentación, con cambios ateroscleróticos en su vasculatura17. En investigaciones previas se ha demostrado que la formación del ateroma constituye uno de los desórdenes producidos por la quimiocina18.
Mientras que las variaciones de las concentraciones de RANTES pueden tener un efecto protector al reclutar leucocitos en procesos infecciosos del líquido amniótico, la activación inapropiada en la preeclampsia puede tener efectos negativos sobre la madre y el feto. Los neutrófilos muestran disminución de la apoptosis durante la preeclampsia llevando a la activación persistente de estas células19. Más aún, mientras varios estímulos pueden iniciar la migración de los leucocitos hacia el endotelio, las quimiocinas tienen importancia particular en la progresión de los leucocitos hacia una adhesión firme20. Las variaciones de las concentraciones en la preeclampsia pueden llevar a potenciar la interacción entre las células endoteliales y los leucocitos, posiblemente contribuyendo a la patogénesis de este desorden.
El aumento de la activación plaquetaria durante la preeclampsia puede promover la coagulación y la tromobosis, pero también puede estimular la respuesta inflamatoria en estas pacientes. Además, las plaquetas pueden inducir la activación de varios subtipos de leucocitos a través de mecanismos solubles21 y dependientes del contacto22, llevando a un aumento de la liberación de mediadores inflamatorios. Se ha demostrado que las plaquetas facilitan la interacción leucocito/célula endotelial bajo condiciones de estrés23, y tales mecanismos pueden afectar la circulación uteroplacentaria durante la preeclampsia. Diferentes estudios también han demostrado que las plaquetas tienen receptores funcionales para las quimiocinas que pueden responder a los ligandos llevando a una mayor activación plaquetaria24. Existen varios reportes de aumento de la activación de los leucocitos durante la preeclampsia25, y las interacciones entre estas células y las plaquetas activadas pueden llevar a un círculo vicioso que lleva a mayor inflamación y activación endotelial inadecuada. La correlación observada en la presente investigación entre las concentraciones de RANTES y los valores de presión arterial sistólica y diastólica podría apoyar este hecho.
Se concluye que las gestantes con preeclampsia presentaron concentraciones significativamente más altas de la quimiocina RANTES al compararlas con embarazadas normotensas sanas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos.Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.