INTRODUCCIÓN
El carcinoma papilar seroso peritoneal primario (CPSPP) fue descrito por primera vez por Swerdlow en 19591, y es en 1977 cuando Kannerstein et al2 establecen los criterios para diferenciarlo del mesotelioma maligno; desde entonces se le han atribuido múltiples nombres como tumor peritoneal papilar3, carcinoma papilar seroso de la superficie ovárica4-6, carcinoma papilar seroso extraovárico7,8 y carcinoma papilar seroso del peritoneo9-11. Actualmente, se considera una entidad independiente y derivada del mesotelio extraovárico con potencial mülleriano12, y el tipo histológico predominante es el seroso aunque se han descrito otros13,14.
Se caracteriza por una afectación masiva del peritoneo con nula o mínima afectación de la superficie ovárica y puede desarrollarse en mujeres con ooforectomía bilateral previa, bien por patología benigna15, bien como medida profiláctica por susceptibilidad hereditaria para cáncer de ovario16. Su incidencia real es desconocida aunque los datos publicados por otros autores presentan una relación de 1 a 10 entre este tumor y el carcinoma ovárico8,17; un estudio publicado por Rothacker y Mobius18 basado en autopsias ha demostrado que el CPSPP aparece en el 8% de las mujeres cuyo diagnóstico final había sido carcinoma seroso de ovario. Sus manifestaciones clínicas son similares a las del carcinoma ovárico avanzado8,19,20, y los síntomas más frecuentes son dolor y distensión abdominal, ascitis y manifestaciones digestivas. Su tratamiento sigue los criterios establecidos para el carcinoma ovárico avanzado y su pronóstico es malo.
En este estudio presentamos 12 pacientes con carcinoma papilar seroso peritoneal primario diagnosticadas y tratadas en el Servicio de Ginecología del Hospital Universitario Miguel Servet en un período de 5 años, entre el 30 de junio de 1999 y el 30 de junio de 2004.
MATERIAL Y MÉTODOS
Estudio retrospectivo basado en 12 pacientes con CPSPP diagnosticadas y tratadas en nuestro servicio entre el 30 de junio de 1999 y el 30 de junio de 2004. Se realizó tomografía computarizada (TC) en todas las pacientes y determinación de marcadores tumorales séricos, CA 125 y CA 199, en 10. Para establecer el diagnóstico se siguieron los criterios utilizados por el Gynecology Oncology Group19:
A. Ovarios de tamaño normal o con un diámetro < 5 cm.
B. Afectación extraovárica llamativamente mayor que la ovárica.
C. Microscópicamente el componente ovárico puede ser:
No existe.
Está confinado al epitelio de la superficie ovárica.
Afectación del epitelio de la superficie ovárica junto a invasión de la estroma, y ésta es < 5 x 5 mm.
Invasión de la estroma < 5 x 5 mm con o sin afectación del epitelio de la superficie.
En 8 pacientes el tratamiento inicial fue cirugía de citorreducción primaria, en 3 se administró en primer lugar quimioterapia neoadyuvante (3 ciclos) con carboplatino y paclitaxel, y después se realizó cirugía de intervalo, y se completó con 3 ciclos más de quimioterapia con los mismos agentes; en 1 sólo se pudo realizar laparoscopia diagnóstica y biopsias múltiples por su mal estado general; a las 8 pacientes que inicialmente recibieron tratamiento quirúrgico se les administró quimioterapia adyuvante con carboplatino y paclitaxel durante 6 ciclos. En 1 paciente se realizó nueva cirugía con fines paliativos por derrame pleural masivo, en 8 se utilizó quimioterapia de segunda línea y ninguna recibió tratamiento radioterápico. Las 12 pacientes fueron estadificadas retrospectivamente siguiendo los criterios establecidos por la FIGO para el cáncer ovárico21.
Se analizaron las siguientes variables: edad al diagnóstico; situación menstrual; forma de presentación clínica; tipo histológico; hallazgos en la TC; valor sérico preoperatorio de los marcadores CA 125 y CA 199; tipo de tratamiento; estadio de la enfermedad; incidencias en el seguimiento, y supervivencia. El seguimiento ha oscilado entre 4 y 46 meses con una media de 29.
RESULTADOS
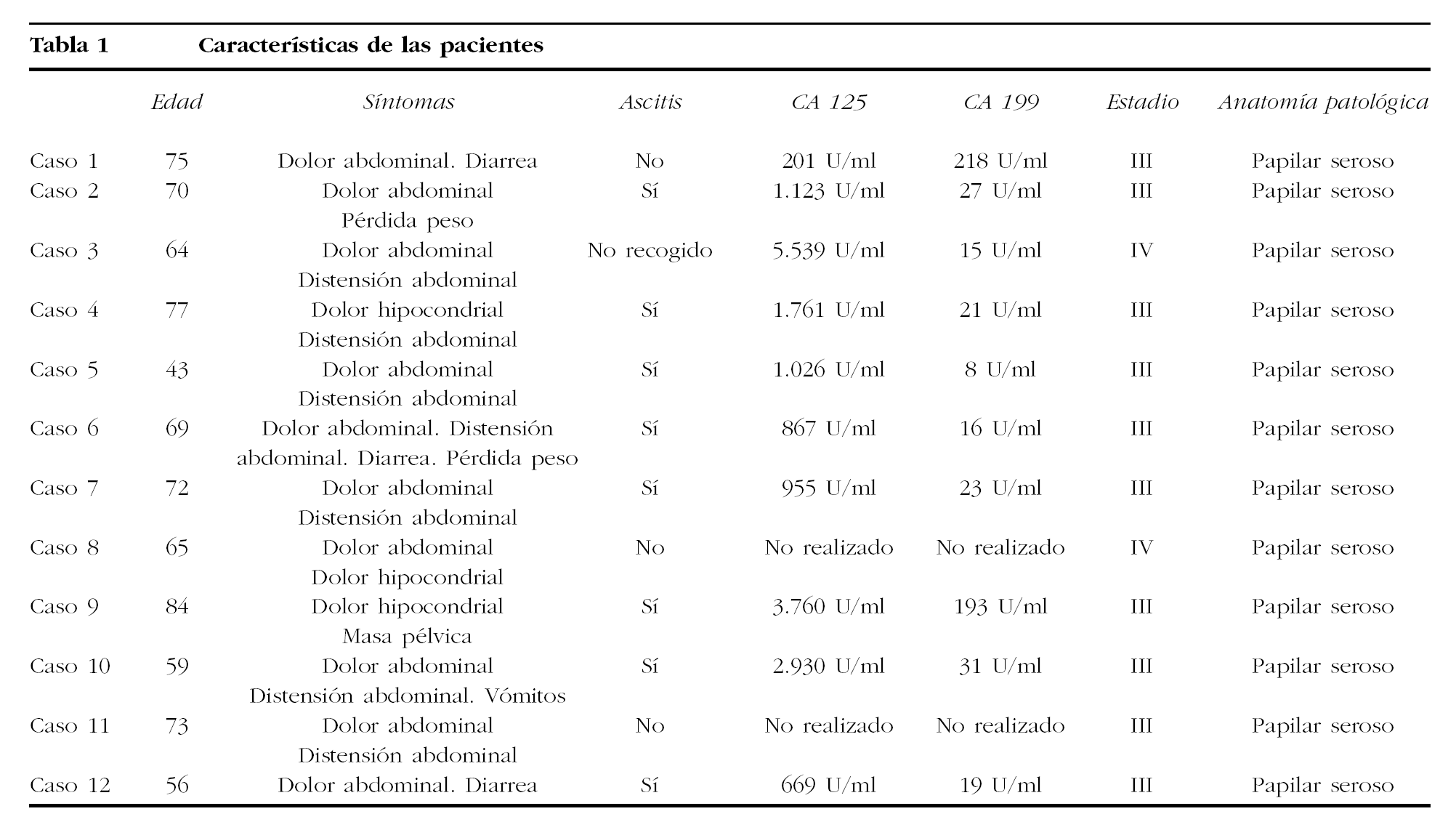
Las características de las pacientes se encuentran detalladas en la tabla 1; la media de edad en el momento del diagnóstico fue de 67 años (rango, 43-87), 11 (91,6%) eran posmenopáusicas y 1 (8,4%), premenopáusica. Todas tenían síntomas en el momento del diagnóstico, los más frecuentes fueron: dolor abdominal en 11 (91,6%); distensión abdominal en 7 (58,3%), y síntomas digestivos en 4 (33,2%); con respecto a la ascitis, fue > 1 l en 8 (69,2%), estaba ausente en 3 (25,2%) y no está recogido en 1.
Se realizó TC en todas las pacientes y solamente en 1 (8,3%) se comprobó la presencia de una masa pélvica de 10 cm de diámetro en pelvis menor, sin poder especificar su dependencia; los hallazgos más frecuentes fueron: afectación peritoneal difusa en 9 (75%) pacientes, ascitis en 8 (66,6%) y masas en omento en 2 (16,6%). En ningún caso se apreció afectación ovárica.
En 10 pacientes se realizó la determinación sérica preoperatoria del CA 125 y fue patológica en todas, con un rango que osciló entre 201 y 5.539 U/ml; no ocurrió lo mismo con el CA 199, que se determinó en el mismo número de pacientes y sólo fue anómalo en 3 (25,2%); su rango osciló entre 8 y 218 U/ml. Se realizó triple toma vaginal en 8 pacientes y todas se informaron como normales.
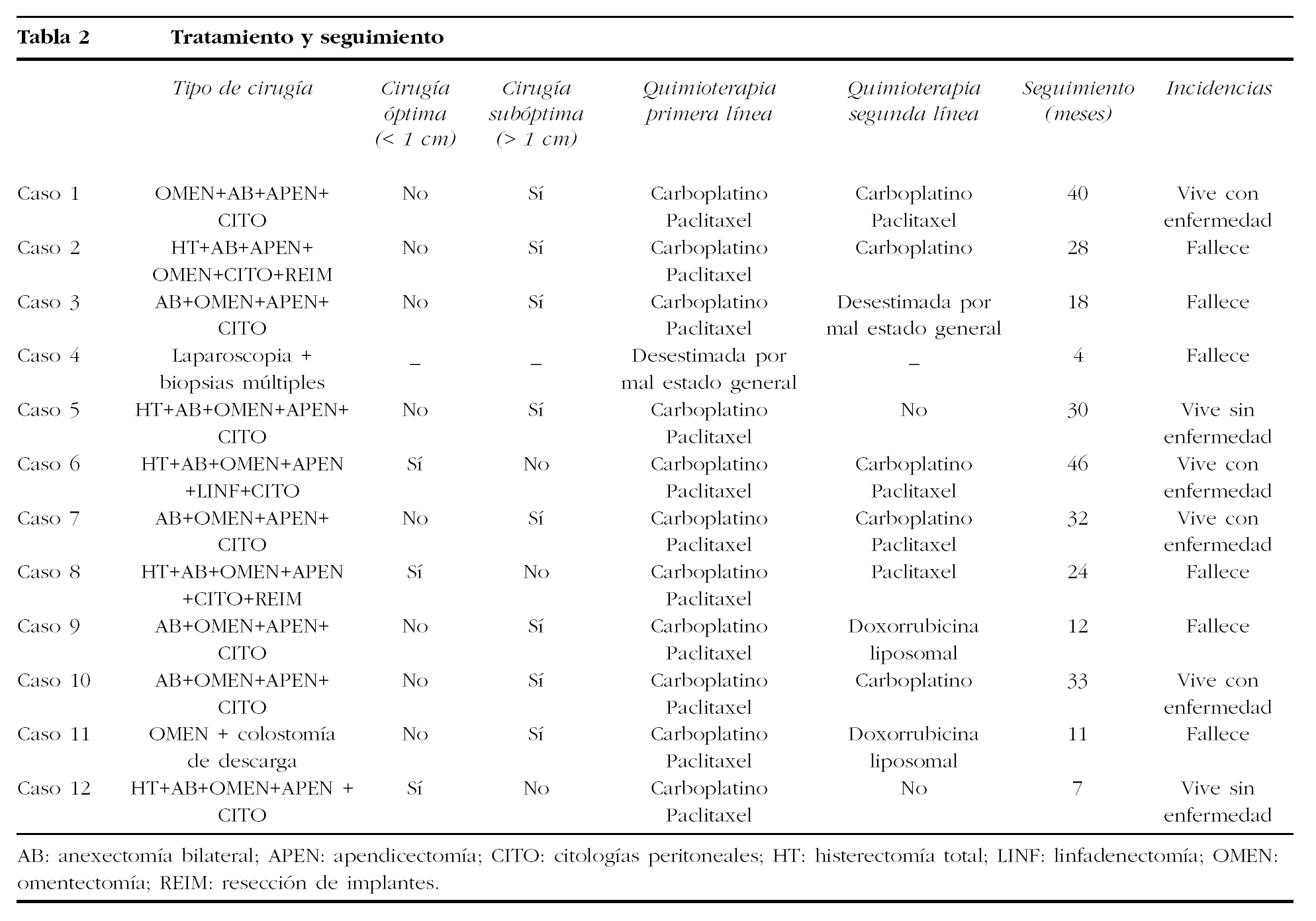
Los datos correspondientes al tratamiento se encuentran recogidos en la tabla 2. En 8 pacientes se realizó cirugía de citorreducción primaria como primer acto terapéutico, y en 3 el tratamiento quirúrgico fue posterior a quimioterapia neoadyuvante con carboplatino y paclitaxel, mientras que en 1 sólo fue posible llevar a cabo laparoscopia diagnóstica con biopsias múltiples. La cirugía citorreductora fue óptima, con volumen de enfermedad residual < 1 cm en 3 pacientes y subóptima, volumen de enfermedad residual > 1 cm, en las 8 restantes. En todos los casos el tipo histológico fue carcinoma papilar seroso que en 1 paciente se asoció a teratoma maduro de ovario. Respecto al estadio, 10 pacientes se clasificaron como estadio III y 2 como estadio IV.
A las 8 pacientes que recibieron tratamiento quirúrgico como primer acto terapéutico se les administró quimioterapia adyuvante con carboplatino y paclitaxel durante 6 ciclos. Tres pacientes ya habían recibido 3 ciclos de quimioterapia neoadyuvante, también con carboplatino y paclitaxel, y se les administraron 3 ciclos más después de la cirugía de intervalo, y en 1 se desestimó este tratamiento por su mal estado general. Se administró quimioterapia de segunda línea en 8 pacientes y en 1 se desestimó por sus malas condiciones físicas; en 3 se utilizó una asociación de carboplatino-paclitaxel; en 2, carboplatino como agente único; en 1, paclitaxel como agente único, y en las 2 restantes, doxorrubicina liposomal. Solamente en 1 paciente, por derrame pleural masivo, se realizó nuevo tratamiento quirúrgico mediante toracoscopia, drenaje de líquido pleural, biopsias pleurales y pleurodesis química, y el estudio histológico confirmó la naturaleza metastásica del tumor.
En el seguimiento de las pacientes se realizaron exploración física, TC y determinación de CA 125; se recurrió a la tomografía por emisión de positrones (PET) en los casos con elevación del CA 125 en los que la TC no se mostraba concluyente. El seguimiento ha oscilado entre 4 y 46 meses (tabla 2), con una media de 29, y durante éste se produjeron 6 casos de progresión de la enfermedad a los 3, 9, 10, 14, 21 y 24 meses del diagnóstico y 4 recurrencias a los 26, 28, 32 y 38 meses. Las 6 pacientes que presentaron progresión de la enfermedad han fallecido a los 4, 11, 12, 18, 24 y 28 meses de seguimiento, mientras que las 4 con recurrencia están vivas con presencia de enfermedad a los 32, 33, 40 y 46 meses de seguimiento. Al finalizar este estudio prospectivo --30 de junio de 2004--, 6 pacientes han fallecido por la enfermedad a los 4, 11, 12, 18, 24 y 28 meses del diagnóstico inicial, 4 están vivas con presencia de enfermedad a los 32, 33, 40 y 46 meses de seguimiento y 2 están vivas sin presencia de enfermedad a los 7 y 30 meses de seguimiento.
DISCUSIÓN
La característica fundamental del CPSPP es la afectación peritoneal difusa con nula o mínima afectación ovárica, y el tumor es histológicamente similar al carcinoma seroso de ovario. Es habitual la ausencia de síntomas específicos y, como se indica en las series publicadas8,9,13, los más frecuentes incluyen dolor abdominal, distensión abdominal, ascitis y manifestaciones digestivas, que estuvieron presentes en nuestro estudio en el 91,6, el 58,3, el 69,2 y el 33,2% de los casos, respectivamente. Se podría decir que su presentación es similar a la del carcinoma ovárico avanzado pero con una diferencia reseñable: la ausencia de masas ováricas6; de hecho, en nuestra serie el tamaño de los ovarios fue normal en todas las pacientes.
Se debe sospechar su diagnóstico ante cualquier paciente con ascitis y ausencia de masas pélvicas, y la TC y la determinación sérica del CA 125 son elementos fundamentales a la hora de completar el estudio. Al revisar la bibliografía se encontraron 4 series22-25 que incluyen 49 pacientes con CPSPP, y los autores consideran las pacientes que en la TC presentan enfermedad peritoneal difusa, ascitis, afectación del omento y ovarios normales o con discreto aumento de tamaño, son altamente sospechosas de presentar la enfermedad. En nuestra serie, 9 (75%) pacientes presentaron afectación peritoneal difusa; 8 (75%), ascitis, y ninguna tenía imágenes de afectación ovárica. Debe realizarse diagnóstico diferencial con el carcinoma ovárico avanzado y las neoplasias malignas de trompa y del tracto gastrointestinal, especialmente de colon y estómago. El mesotelioma peritoneal también presenta imágenes radiológicas similares26,27, pero generalmente afecta a varones jóvenes y con antecedente de exposición al asbesto2,28,29.
La determinación sérica del CA 125 se ha mostrado útil en el diagnóstico6,20,30; Altras et al30 consideran que los valores de este marcador se correlacionan con el estadio y la respuesta al tratamiento, mientras que en el estudio de Killackey y Davis20 los valores de CA 125 que presentan las pacientes con CPSPP son similares a los que presentan las pacientes con cáncer de ovario cuando se correlacionan con la edad, el estadio y el grado tumoral. En nuestro estudio, el valor preoperatorio de este marcador tumoral fue patológico en el 100% de las pacientes en las que se determinó; los estudios de Furukawa et al23, Chopra et al24 y Zissin et al25 presentan resultados similares. No ocurre lo mismo con la determinación del CA 199 cuya sensibilidad es notablemente inferior en este proceso.
Su tratamiento sigue las pautas establecidas en el carcinoma ovárico avanzado, aunque varias series presentan un éxito de la cirugía de citorreducción primaria inferior al que se obtiene en el cáncer epitelial ovárico9,19,20,30; la afectación peritoneal difusa, especialmente del abdomen superior, probablemente es la causa de estos resultados. Se han presentado porcentajes de citorreducción óptima, volumen de enfermedad residual < 1 cm, que oscilan entre el 33 y el 69%8,9,17,19,20,30, y en nuestro caso fue del 25%. Respecto a la quimioterapia, una mayoría de autores9,11,17,19 indican que las pacientes con CPSPP tienen una respuesta similar a la que presentan las pacientes con carcinoma ovárico y los regímenes que tienen como base platino constituyen la primera línea de tratamiento8,9,11,17,19,20,30,31. Cuando las condiciones de la paciente o las características de la enfermedad lo indican, puede ser útil la quimioterapia neoadyuvante seguida de cirugía de intervalo, como de hecho ocurrió en 3 pacientes de nuestro estudio. La citorreducción quirúrgica máxima asociada a quimioterapia adyuvante con carboplatino y paclitaxel constituye la piedra angular de su tratamiento.
Dado que en un porcentaje significativo de los casos es frecuente la recurrencia o progresión de la enfermedad, como ha ocurrido en 10 pacientes de nuestra serie, la utilización de quimioterapia de segunda línea es un hecho a tener en cuenta, aunque en casos de recidiva única y en abdomen puede ser útil la cirugía de citorreducción secundaria. Cuando la recurrencia o progresión tiene lugar dentro de los 6 meses que siguen al tratamiento inicial, la paciente se considera resistente al platino y se deben utilizar nuevos agentes quimioterapéuticos, de elección doxorrubicina liposomal y ciclofosfamida, como ocurrió en 2 pacientes de nuestra serie, aunque recientemente se han descrito supervivencias prolongadas con enfermedad estable con la utilización de topotecan semanal32. Por el contrario, si la recurrencia o progresión de la enfermedad se produce pasados 6 meses desde el tratamiento inicial, la quimioterapia debe seguir teniendo como base un régimen que contenga platino.
La supervivencia media de la enfermedad es baja, y en nuestra serie es de 29 meses, similar a la presentada por otros autores8,11,19,20,33 y superior a la que indican otras series3,5,30,34-36; el factor pronóstico fundamental es el volumen de enfermedad residual.
Como conclusión se podría decir que ante una paciente, generalmente posmenopáusica, que presenta dolor y distensión abdominal asociados a una elevación del CA 125 sérico y que en el estudio radiológico (TC) aparece afectación peritoneal difusa, ascitis y ovarios normales, se debe establecer una alta sospecha diagnóstica de CPSPP y poner en marcha el tratamiento más adecuado.