Evaluación de nuestros resultados y análisis de diferentes variables como determinantes de éxito en la inseminación intrauterina homóloga
Sujetos y métodoAnálisis retrospectivo de 500 ciclos de inseminación intrauterina realizados a 183 parejas. Se ha realizado una sola inseminación por ciclo de estimulación ovárica controlada a pacientes con endometriosis, anovulación, subfertilidad masculina o esterilidad idiopática. Las variables estudiadas incluyen edad de la mujer, tiempo de esterilidad, etiología, protocolo de estimulación, número de ciclo, número de folículos preovulatorios, recuento de espermatozoides móviles poscapacitación y grosor endometrial.
ResultadosLa tasa acumulada de embarazo por pareja fue del 24%, la tasa media por ciclo del 9%, con un 11% de embarazos múltiples. Se han obtenido mejores resultados en mujeres menores de 37 años (p=0,048) y en ciclos con más de un folículo preovulatorio. No ha habido diferencias en la tasa de embarazo según el número de ciclo, el protocolo de estimulación o el recuento de espermatozoides móviles inseminados.
ConclusiónLa edad mayor de 38 años empeora el pronóstico de la inseminación intrauterina; los ciclos con más de un folículo preovulatorio son de mejor pronóstico. Con recuento de espermatozoides móviles inseminados superior a 1,5 millones los resultados son similares.
To evaluate the results and analyse different factors influencing pregnancy rate using homologous intrauterine insemination.
Subjects and methodsRetrospective analysis of 500 homologous intrauterine insemination cycles in 183 infertile couples. Only one insemination per stimulated ovarian cycle was performed in patients with: mild endometriosis, ovulatory factor, male subfertility or unexplained infertility. We studied female age, duration of infertility, stimulation protocol, number of cycle, number of preovulatory follicles, motile sperm count and endometrial thickness related to pregnancy rate.
ResultsPregnancy rate per couple was 24% and per intrauterine insemination 9%, 11% was multiple pregnancies. Best outcome has been got in women younger than 37 years (P=.048) and in cycles with more than one preovulatory follicle. Other studied factors did not have influence in homologous intrauterine insemination outcome.
ConclusionsFemale age is a prognostic factor for homologous intrauterine insemination with poor outcome in women older than 38 years. Cycles with more than one preovolatory follicle have better outcome. No differences in pregnancy rate have been achieved with motile sperm count over 1.5 millions/0.3ml.
La inseminación intrauterina homóloga (IIUH) consiste en el depósito intrauterino de espermatozoides móviles de la pareja capacitados en el momento de la ovulación.
Con frecuencia, es la primera opción terapéutica que se ofrece a parejas con diferentes causas de infertilidad, como factor cervical, anovulación, endometriosis leve o moderada, subfertilidad masculina o esterilidad idiopática1.
Se trata de una técnica con una efectividad aceptable, menos cara y compleja que otras técnicas de reproducción asistida como la fertilización in vitro (FIV).
La efectividad de la IIUH, expresada en tasa de embarazo por inseminación, presenta importantes variaciones en diferentes publicaciones y oscila del 7 al 20%2,3. Esta diversidad en los resultados se atribuye diferentes factores de influencia en el resultado del ciclo de tratamiento4,5. Se han descrito factores pronósticos dependientes de la pareja, como la duración de la esterilidad; femeninos, como la edad y el diagnóstico; masculinos, como la concentración, la motilidad y la morfología espermáticas, y dependientes de la respuesta en el ciclo de tratamiento, como el número de folículos preovulatorios y el grosor endometrial4,6. En la literatura científica no hay consenso sobre qué factores tienen mayor significación ni sobre los umbrales de respuesta de mejor pronóstico.
En este artículo se presentan los resultados obtenidos en la sección de esterilidad de nuestro centro y se analizan diferentes factores de influencia en la tasa de embarazo. La identificación de los factores predictivos de éxito en nuestra población debe contribuir a una adecuada selección de las parejas candidatas a IIUH, a mejorar el tratamiento de estas parejas y de esta forma obtener la mejor tasa de embarazo posible.
SUJETOS Y MÉTODOPacientesEstudio retrospectivo de una muestra de 183 parejas infértiles tratadas de forma consecutiva a las que se les ha realizado un total de 500 ciclos de IIUH.
Para el estudio de las parejas hemos realizado un protocolo básico de estudio de esterilidad en el que se incluye:
- –
Ecografía transvaginal.
- –
Determinación hormonal en primera fase del ciclo: hormona foliculoestimulante (FSH), hormona luteinizante (LH), prolactina (PRL) y estradiol.
- –
Prueba poscoital y de filancia en fase preovulatoria.
- –
Histerosalpingografía o laparoscopia para la evaluación de la permeabilidad tubárica.
- –
Seminograma siguiendo los criterios de normalidad de la Organización Mundial de la Salud.
Los requisitos para el tratamiento con inseminación fueron:
- –
Esterilidad primaria o secundaria.
- –
Ausencia de contraindicación médica para el tratamiento o el embarazo.
- –
Serología negativa para enfermedades infecciosas en ambos miembros de la pareja (sífilis, hepatitis B o C, virus de la inmunodeficiencia humana).
- –
Mujer menor de 40 años. Aunque el criterio del servicio es no realizar tratamiento a mujeres mayores de 40 años, se han incluido 3 casos de mujeres mayores de esta edad con esterilidad de corta evolución y reserva ovárica adecuada.
- –
Reserva ovárica conservada (FSH < 10mU/ml en fase folicular temprana).
- –
Permeabilidad tubárica conservada en al menos una trompa.
- –
Recuento de espermatozoides móviles poscapacitación (REM) superior a 1 millón/0,3ml, aunque en el protocolo no se considera indicada la IIUH si el REM es inferior a 1 millón/0,3ml se han incluido algunos casos en los que se ha realizado IIUH de prueba y el REM fue inferior a 1 millón.
El tratamiento se ha indicado en parejas con alguno de los siguientes factores etiológicos: endometriosis leve o moderada, factor ovulatorio y cervical, subfertilidad masculina o esterilidad idiopática.
El rango de edad de las pacientes incluidas en el estudio fue de 25 a 43 años, con una media de 33,7 años y una mediana de 34 años. La duración de la esterilidad fue como mínimo 6 meses y como máximo de 15 años, con una media de 2,9 años y una mediana de 2 años.
En el 82,5% de los casos fue esterilidad primaria y secundaria en el 17,5%.
El 78% de las pacientes no tenía antecedente de afección ginecológica; del 22% con afección ginecológica, la más frecuente fue la endometriosis, con afectación en el 9% de las pacientes, seguida del síndrome de ovario poliquístico y miomas, con el 2% de afectación cada una.
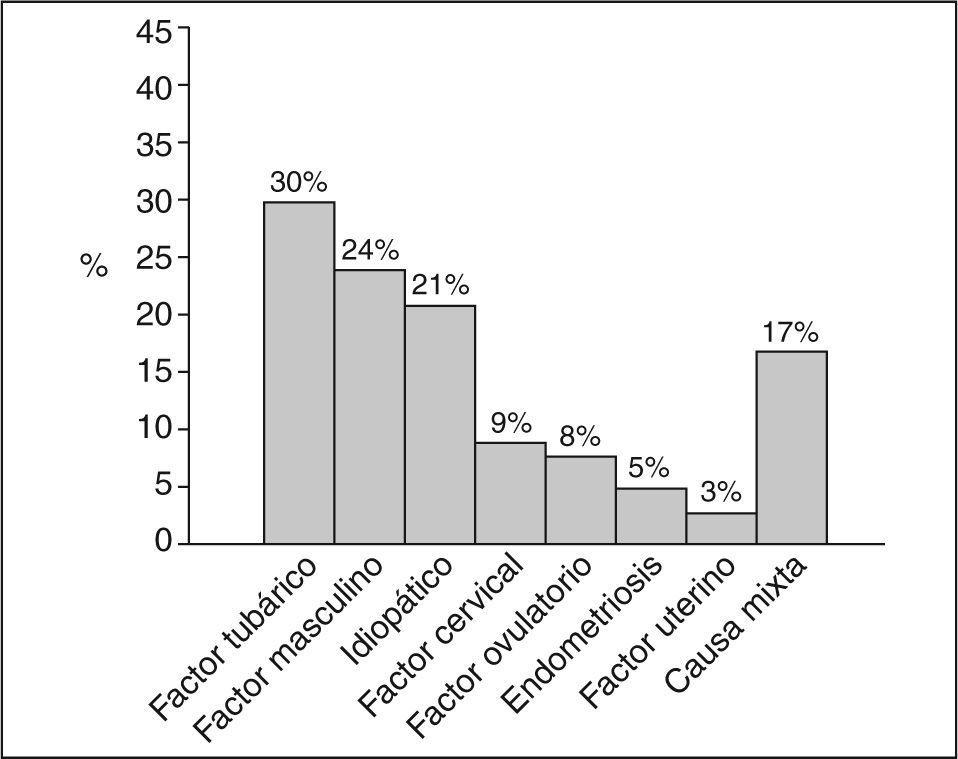
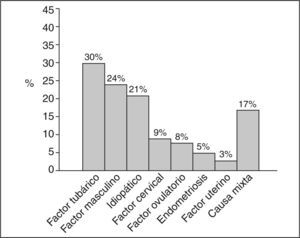
Los porcentajes de cada diagnóstico como causa principal de esterilidad quedan reflejados en la figura 1, las causas que con mayor frecuencia se han detectado son el factor tubárico parcial, el factor masculino y la esterilidad idiopática. En el 38% de las parejas había más de un factor etiológico y en el 17% la causa ha sido mixta con presencia de algún factor femenino y masculino.
Se ha realizado de 1 a 6 ciclos de tratamiento con una media de 2,3 inseminaciones por pareja, en el 83% de los casos se ha realizado de 1 a 3 IIUH, en el 94% de 1 a 4, y sólo en el 6% 5 o más inseminaciones.
Protocolo de estimulación ovárica y monitorizaciónPara la estimulación del desarrollo folicular múltiple se ha utilizado gonadotropina urinaria (HMG) u hormona foliculoestimulante recombinante (FSHr) a partir tercer día del ciclo. La dosis de inicio habitual ha sido de 75–150 U diarias durante 4–5 días, descendiendo o manteniendo dosis según la respuesta observada. El primer control ecográfico se hizo al 7.°-8.° día del ciclo y, posteriormente, cada 48h hasta alcanzar al menos 1 folículo maduro de 17mm de diámetro. En caso de síndrome de ovario poliquístico o antecedente de ciclo cancelado por respuesta excesiva, se ha disminuido la dosis de comienzo a 37,5 o 50 U/24h.
Tras 24h sin estimulación con gonadotropina se han administrado 250μg de gonadotropina coriónica humana (HCG) recombinante para la inducción de la ovulación.
Los ciclos con más de 4 folículos mayores de 14mm fueron cancelados por riesgo de hiperestimulación ovárica y de embarazo múltiple.
Los casos en los que no se ha realizado inseminación por falta de respuesta o riesgo de hiperestimulación no se han incluido en el estudio.
Preparación del semen y diagnóstico embarazoPara capacitación del semen se ha empleado la técnica de swim-up:
- –
Una vez licuado el semen, se centrifuga la muestra durante 10min a 2.000rpm.
- –
Eliminación de líquido sobrenadante mediante decantación.
- –
Al pellet se le añade 1ml de medio de cultivo Ham F-10.
- –
Incubación en estufa a 37°C, durante 1h aproximadamente.
Con una cánula flexible de inseminación intrauterina (Gynetics R) se deposita en la cavidad uterina de 0,3-0,5ml de la muestra capacitada. Se realiza una sola inseminación a las 24h de la administración de HCG y apoyo de la fase lútea con 400mg/24h de progesterona natural.
En caso de retraso menstrual se realizó una ecografía transvaginal para el diagnóstico de embarazo.
Análisis estadísticoEl análisis se realizó con el paquete estadístico SPSS para Windows 10.0. Para las variables cualitativas el resumen de datos se hizo mediante tablas de distribución de frecuencias absolutas y porcentajes. En el caso de las variables cuantitativas, se calcularon medidas de resumen: media, mediana, desviación estándar y rango. La prueba de la χ2 se utilizó para valorar la asociación entre variables cualitativas.
Las variables que mostraron diferencias estadísticamente significativas en el análisis unifactorial, se analizaron mediante el modelo logístico multivariante. Este método de regresión es una técnica que investiga la relación entre la probabilidad de embarazo y una serie de variables pronósticas. El modelo relaciona el riesgo relativo (odds ratio [OR]) de buen pronóstico con los factores de riesgo seleccionados.
RESULTADOSSe han obtenido 44 embarazos en las 183 parejas, lo que representa una tasa acumulada de embarazo por pareja del 24%, con un intervalo de confianza (IC) del 95% de 18–31. De los embarazos conseguidos, 5 fueron múltiples, 4 gemelares y 1 triple, lo que representa, respectivamente, el 11, el 9 y el 2% del total de embarazos.
La tasa de embarazo por ciclo global fue del 9% (IC del 95%, 6,5-11,6).
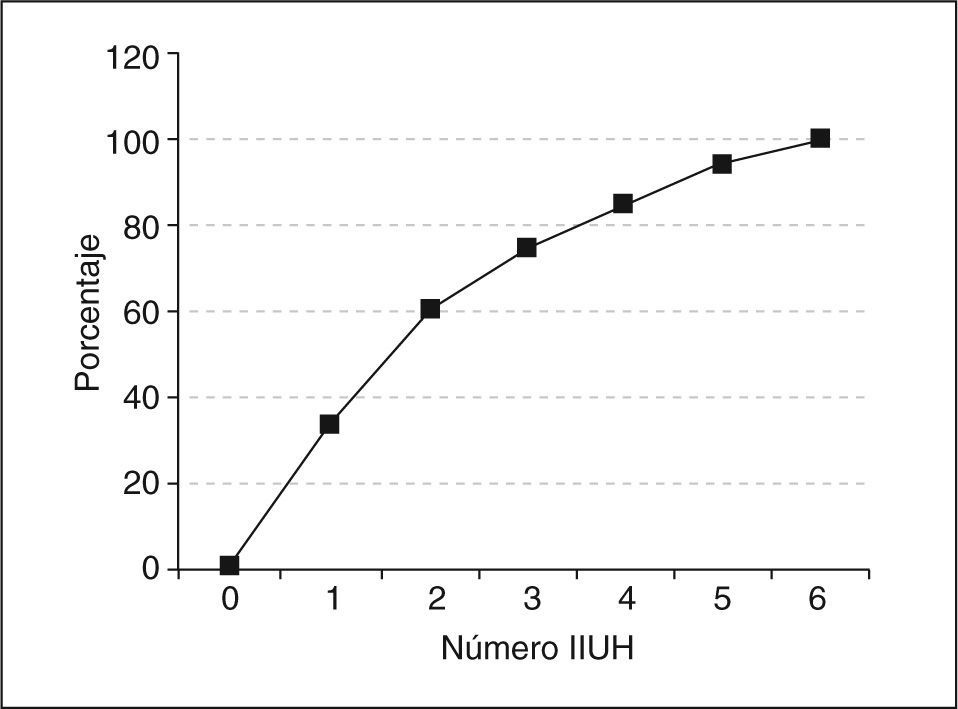
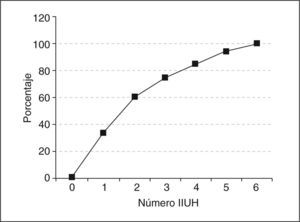
En la figura 2 se expresa el porcentaje de embarazos conseguidos según el número de ciclo de tratamiento. El 34% (n = 15) de los embarazos se han conseguido en la primera inseminación, el 27% (n = 12) en la segunda, el 14% (n = 6) en la tercera y el 11% (n = 5) en la cuarta, lo que representa un porcentaje acumulado de embarazo en las tres primeras IIUH del 75% y en las cuatro primeras del 86%.
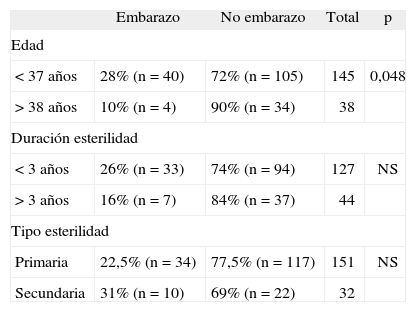
En la tabla 1 quedan reflejados los resultados respecto a la edad de la mujer, el tiempo de esterilidad y el tipo de esterilidad. De estos factores, sólo la edad de la mujer ha presentado significación sobre probabilidad de embarazo. La tasa de embarazo fue significativamente mayor en el grupo de pacientes menores de 37 años respecto al de mayores de 38 años (p = 0,048).
Tasa de embarazo según factores de la pareja
| Embarazo | No embarazo | Total | p | |
| Edad | ||||
| < 37 años | 28% (n = 40) | 72% (n = 105) | 145 | 0,048 |
| > 38 años | 10% (n = 4) | 90% (n = 34) | 38 | |
| Duración esterilidad | ||||
| < 3 años | 26% (n = 33) | 74% (n = 94) | 127 | NS |
| > 3 años | 16% (n = 7) | 84% (n = 37) | 44 | |
| Tipo esterilidad | ||||
| Primaria | 22,5% (n = 34) | 77,5% (n = 117) | 151 | NS |
| Secundaria | 31% (n = 10) | 69% (n = 22) | 32 | |
NS: no significativo.
Respecto a la duración de la esterilidad, aunque la tasa de embarazo en parejas con menos de 3 años de esterilidad es mayor, la diferencia entre ambos grupos no fue significativa. Tampoco se han observado diferencias según el tipo de esterilidad.
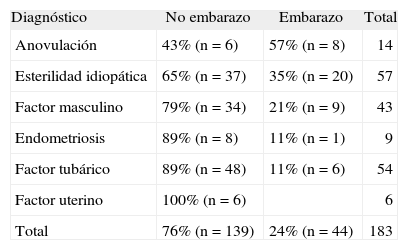
Según el diagnóstico principal de la pareja (tabla 2), los mejores resultados se han obtenido en el factor ovulatorio, los peores en la endometriosis y el factor tubárico, y los resultados intermedios en el factor masculino y la esterilidad idiopática.
Tasa de embarazo según etiología
| Diagnóstico | No embarazo | Embarazo | Total |
| Anovulación | 43% (n = 6) | 57% (n = 8) | 14 |
| Esterilidad idiopática | 65% (n = 37) | 35% (n = 20) | 57 |
| Factor masculino | 79% (n = 34) | 21% (n = 9) | 43 |
| Endometriosis | 89% (n = 8) | 11% (n = 1) | 9 |
| Factor tubárico | 89% (n = 48) | 11% (n = 6) | 54 |
| Factor uterino | 100% (n = 6) | 6 | |
| Total | 76% (n = 139) | 24% (n = 44) | 183 |
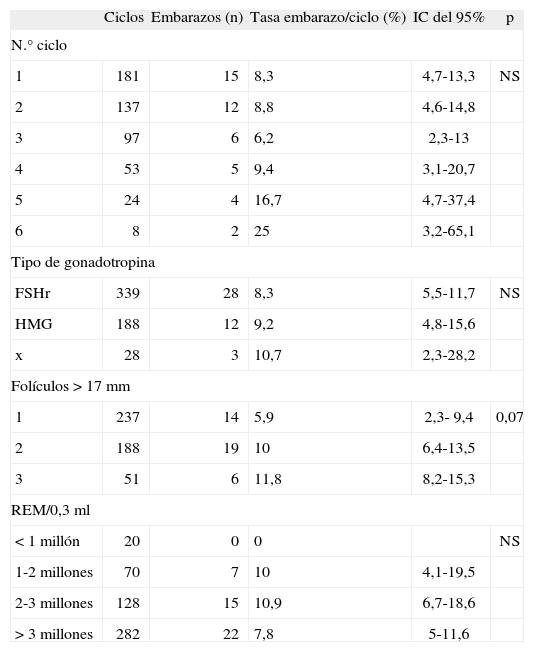
Como queda expresado en la tabla 3, no ha habido diferencias significativas en la tasa de embarazo, según el número de ciclo de tratamiento. En los 3 primeros ciclos el IC fue muy similar, por lo que la comparación es muy precisa; a partir del cuarto ciclo el IC es amplio y la precisión es baja; a partir de la quinta inseminación, el IC es muy amplio y las proporciones tienen valores muy imprecisos.
Tasa de embarazo según factores del ciclo
| Ciclos | Embarazos (n) | Tasa embarazo/ciclo (%) | IC del 95% | p | |
| N.° ciclo | |||||
| 1 | 181 | 15 | 8,3 | 4,7-13,3 | NS |
| 2 | 137 | 12 | 8,8 | 4,6-14,8 | |
| 3 | 97 | 6 | 6,2 | 2,3-13 | |
| 4 | 53 | 5 | 9,4 | 3,1-20,7 | |
| 5 | 24 | 4 | 16,7 | 4,7-37,4 | |
| 6 | 8 | 2 | 25 | 3,2-65,1 | |
| Tipo de gonadotropina | |||||
| FSHr | 339 | 28 | 8,3 | 5,5-11,7 | NS |
| HMG | 188 | 12 | 9,2 | 4,8-15,6 | |
| x | 28 | 3 | 10,7 | 2,3-28,2 | |
| Folículos > 17mm | |||||
| 1 | 237 | 14 | 5,9 | 2,3- 9,4 | 0,07 |
| 2 | 188 | 19 | 10 | 6,4-13,5 | |
| 3 | 51 | 6 | 11,8 | 8,2-15,3 | |
| REM/0,3ml | |||||
| < 1 millón | 20 | 0 | 0 | NS | |
| 1-2 millones | 70 | 7 | 10 | 4,1-19,5 | |
| 2-3 millones | 128 | 15 | 10,9 | 6,7-18,6 | |
| > 3 millones | 282 | 22 | 7,8 | 5-11,6 | |
IC: intervalo de confianza; FSHr: hormona foliculostimulante recombinante; HMG: gonadotropina urinaria; NS: no significativo; REM: espermatozoides móviles poscapacitación.
La tasa de embarazo por IIUH fue similar en los diferentes protocolos utilizados para el desarrollo folicular múltiple.
Aunque la diferencia no ha llegado a ser significativa, se observa una tendencia a mayor tasa de embarazo con 2 o 3 folículos preovulatorios mayores de 17mm respecto a las IIUH con un solo folículo (p = 0,07).
A partir de REM mayores de 1,5 millones, no se han observado diferencias significativas en la tasa de embarazo. En los ciclos con REM menores de 1 millón no se ha obtenido ningún embarazo.
Respecto al grosor endometrial medio, el día de la inseminación no se han encontrado diferencias entre el grupo con embarazo y sin embarazo (8,6 frente a 8,7mm).
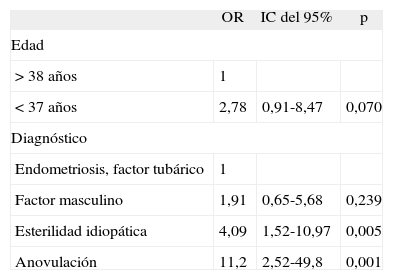
Según el análisis multivariante de regresión logística los factores con influencia estadísticamente significativa en la probabilidad de embarazo fueron la edad y el diagnóstico, ambos factores independientes al ajustar por la duración de la esterilidad (tabla 4).
Probabilidad de embarazo, regresión logística
| OR | IC del 95% | p | |
| Edad | |||
| > 38 años | 1 | ||
| < 37 años | 2,78 | 0,91-8,47 | 0,070 |
| Diagnóstico | |||
| Endometriosis, factor tubárico | 1 | ||
| Factor masculino | 1,91 | 0,65-5,68 | 0,239 |
| Esterilidad idiopática | 4,09 | 1,52-10,97 | 0,005 |
| Anovulación | 11,2 | 2,52-49,8 | 0,001 |
IC: intervalo de confianza; OR: odds ratio.
La tasa media de embarazo por ciclo obtenida fue del 9%, porcentaje que se encuentra en el rango de las publicaciones revisadas, en las que esta tasa oscila en el 9-12%. Ibérico et al7 presentan una tasa del 9,2% en 1.010 ciclos de IIU. Dickey et al8, en 3.381 ciclos también obtienen una tasa del 9,2%. Papageorgiou et al9 obtienen una tasa del 10% en 3.219 ciclos. El registro francés de IIU del año 2000 presenta una tasa del 10,9% en 44.271 IIU10; Stone et al4, del 10,5 en 9.963 ciclos. Otros autores refieren tasas algo superiores, como Khalil et al5, del 11,9% en 2.473 ciclos, Nuojua-Huttenen et al11, del 12,6% en 811 ciclos, y los registros de la Sociedad Española de Fertilidad de 2002 y 2003, con una tasa global de embarazo del 12,8% en 13.303 ciclos y del 14,7% en 15.319 ciclos, respectivamente12,13. Las diferencias en la tasa de embarazo en los distintos grupos dependen de los criterios de selección de las pacientes, del protocolo de estimulación empleado y del número de inseminaciones que se realiza por pareja. La naturaleza retrospectiva de los trabajos implica que no haya un diseño experimental previo, por lo que el análisis de los factores se realiza en una segunda fase en una muestra heterogénea y con resultados, a veces, difícilmente comparables entre los diferentes estudios.
Nuestra tasa de embarazo acumulada por pareja fue del 24%, cifra similar a la publicada por otros autores, que oscila del 20 al 27,2%5,8.
La tasa de embarazo múltiple es uno de los parámetros más importantes a la hora de evaluar una técnica de reproducción asistida y los resultados de una unidad de fertilidad debido a la mayor morbilidad materna y fetal que conllevan y a su mayor coste económico. La tendencia actual en tratamientos de reproducción asistida es disminuir al máximo el porcentaje de embarazos múltiples y erradicar los embarazos múltiples de alto grado. Este objetivo en fertilización in vitro (FIV) se logra limitando el número de embriones que se transfiere; en inseminación con ciclo estimulado es más difícil de conseguir. Nuestra tasa de embarazo múltiple fue del 11%, con 4 embarazos gemelares y 1 triple, lo que representa el 9 y el 2% de las gestaciones, respectivamente. Este porcentaje es similar al publicado en otras series, que va del 8,39 al 19,7%5.
La incidencia de embarazo múltiple en IIUH se ha relacionado con la edad de la mujer, el valor de estradiol y el número de folículos preovulatorios el día de la HCG14–17. El número de embarazos múltiples de alto grado se relaciona con el número de folículos preovulatorios, y el riesgo aumenta significativamente a partir de 4–5 folículos maduros. Tanto Stone et al4 como Khalil et al5 en sus revisiones concluyen que en ciclos con 2–4 folículos se obtiene la mejor tasa de embarazo (10-14%) en relación un número de triples (2–3,7%) y de embarazo múltiple global aceptable (16%) y aconsejan la cancelación de los ciclos con 4 o más folículos maduros. Estamos de acuerdo con esta recomendación y en nuestro protocolo se cancela el ciclo si hay más de 3 folículos maduros.
De los factores pronósticos dependientes de la pareja estudiados sólo la edad de la mujer ha tenido una significación estadística; la probabilidad de embarazo es mayor en mujeres menores de 37 años.
La edad es probablemente el marcador más fiable del potencial fértil de la mujer; existe una relación inversamente proporcional entre la edad y la fertilidad femenina18. Se considera la edad como un indicador indirecto de la calidad ovocitaria y diferentes estudios han mostrado su importancia en las técnicas de reproducción asistida3–5,11,19. Se ha documentado una menor fecundidad con la edad en las mujeres sometidas a IIUH4,19,20, mientras unos autores detectan que los resultados empeoran significativamente a partir de los 40 años2,3,9,11,21, en otros estudios, al igual que en este trabajo, se halla una disminución de la probabilidad de embarazo a edades más tempranas, que van desde los 3022 a los 374,15 o 39 años20.
Aunque en nuestra serie el tiempo de esterilidad no ha alcanzado significación como factor pronóstico, sí hemos observado una mayor tasa de embarazo acumulada en parejas con menos de 3 años de esterilidad. En diferentes series el tiempo de esterilidad fue un factor determinante en el resultado de IIUH, con peores resultados en parejas con más de 3–6 años de esterilidad2,3,7,11, por lo que estos autores desaconsejan la IIUH en parejas con esterilidad de larga evolución. El tiempo medio de esterilidad en nuestra serie fue de 2 años; el 74% de las parejas consultó antes de 3 años de esterilidad, el 26% después de 3 años y sólo el 10% después de 6 años. Este reducido número de parejas con esterilidad de larga evolución puede explicar que el tiempo de evolución de la esterilidad no haya alcanzado significación estadística.
Respecto a la causa principal de esterilidad, los mejores resultados se han obtenido en el factor ovulatorio y los peores en el tubárico y la endometriosis. Estos resultados están de acuerdo con otras publicaciones que también hallan peor pronóstico en las parejas con causa tubárica o con endometriosis8,9,11,15,23. Noujua-Huttenen et al11, en una revisión de 811 ciclos de IIU, encuentran una tasa de embarazo significativamente menor en endometriosis respecto a esterilidad idiopática (el 6,5 frente al 15,3%) y concluyen que en la endometriosis, aunque no se evidencie afectación tubárica, los bajos resultados de la IIU aconsejan considerar la FIV como tratamiento de primera línea.
Se han realizado 1–6 inseminaciones por pareja; el 86% de los embarazos se han obtenido en las 4 primeras inseminaciones. Otros trabajos también muestran una tasa de embarazo acumulado similar en las 3–4 primeras IIU4,9,11,21. La tasa media de embarazo fue similar en los 3 primeros ciclos; a partir del cuarto ciclo de tratamiento los resultados son poco precisos por el escaso número de la muestra y no nos permite sacar conclusiones. En la literatura científica revisada se refiere una disminución significativa de la eficacia de la IIU a partir del 3.°-4.° ciclo de tratamiento3,8,11,20,24.
Dickey et al8, en una revisión de 8.051 ciclos, observan una tasa de embarazo similar en las 4 primeras inseminaciones (tasa media del 9,7%) y un descenso significativo a partir de la quinta inseminación (tasa del 2,8%) y concluyen que se deben realizar al menos 4 inseminaciones antes de pasar a FIV y que hacer más inseminaciones no es coste efectivo. Basándonos en nuestros resultados y en las publicaciones, creemos que se deben realizar 4 ciclos de IIU antes de indicar tratamientos más complejos y de mayor agresividad como la FIV.
La estimulación ovárica controlada, sobre todo con gonadotropinas, aumenta de forma significativa la eficacia de la IIU respecto a la IIU en ciclo natural6,25. El desarrollo multifolicular puede dar lugar a un número mayor de oocitos fertilizables, a una mejor calidad del endometrio y de la fase lútea y, por todo ello, a unas tasas de fertilización e implantación mejores.
En nuestra serie hemos hallado mejores resultados en los ciclos con 2–3 folículos preovulatorios maduros respecto a los ciclos monofoliculares (tasa de embarazo del 10,4 frente al 5,9%); en otros trabajos también se observan mejores resultados con más de un folículo maduro2–5,7,11,26. La tasa de embarazo aumenta con el número de folículos preovulatorios3,5 pero, como se ha señalado anteriormente, este aumento en la eficacia conlleva un aumento de riesgo de embarazo múltiple. En ciertos estudios se ha referido un aumento significativo de la tasa de embarazo con 2 folículos preovulatorios respecto a uno, pero no hay un incremento significativo con 3 o más folículos, por lo que se recomienda cancelar los ciclos con más de 3 folículos preovulatorios para minimizar el riesgo de embarazo múltiple sin disminuir de forma significativa la tasa de embarazo26–28.
Se acepta que en IIU la estimulación con gonadotropinas ofrece mejores resultados que la estimulación con clomifeno5,19,29. En cuanto al tipo de gonadotropina utilizada, no se ha demostrado la superioridad de la gonadotropina recombinante o de la urinaria en la tasa de embarazo por IIUH30,31. De acuerdo con lo referido, la tasa de embarazo obtenida fue similar en los ciclos estimulados con FSH recombinante o con HMG.
Respecto al factor masculino, con un REM superior a 1,5 millones no hemos encontrado diferencias significativas en la tasa de embarazo. Se han descrito distintos parámetros seminales con capacidad predictiva en el resultado de la IIU; de ellos los más estudiados son: el recuento de espermatozoides móviles inseminados, recuento total de espermatozoides móviles en el eyaculado, el porcentaje de espermatozoides móviles poscapacitación y el porcentaje de espermatozoides con morfología normal.
El umbral del REM del inseminado que marca el límite a partir del cual se conseguiría una tasa de embarazo aceptable por IIU varía de unas publicaciones a otras y oscila de 1 a 5 millones4,5,20,32. En cuanto al umbral del número total de espermatozoides móviles en el eyaculado que daría resultados aceptables en IIU va de 5 a 10 millones19,33. Estas diferencias en los umbrales dependen de los criterios de inclusión y de la metodología en la evaluación de los parámetros seminales. Duran et al6, en una revi75 sión sistemática, sugieren que no puede establecerse un umbral universal y que cada centro debe establecer el suyo basándose en su población, su laboratorio y sus resultados.
En cuanto a la morfología, un metaanálisis realizado en 2001 concluyó que la morfología es un factor predictivo de éxito en IIU, con un impacto negativo en la tasa de embarazo en muestras con < 4% morfología normal según criterios estrictos34.
Respecto a motilidad poscapacitación, el umbral a partir del cual aumentarían las posibilidades de embarazo oscila del 20 al 40%4,35.
En nuestros resultados ningún embarazo se ha obtenido en pacientes con REM < 1 millón, por lo que consideramos que estos casos deben ir directamente a tratamiento de fertilización in vitro. En nuestro estudio no hemos encontrado diferencias en la tasa de embarazo con REM a partir de 1,5 millones, resultado similar al publicado por Noujua-Huttenen et al11. Para otros autores no habría diferencia en la tasa de embarazo a partir de un REM de 4–5 millones4,5. Se ha publicado también un aumento progresivo de la tasa de embarazo al aumentar el REM, con una tasa que se duplica con REM > 30 millones/ml respecto a REM 5–30 millones/ml7.
El grosor endometrial se ha propuesto como un factor de buen pronóstico. Tomlinson et al3 refieren mejores resultados con un grosor superior a 8,2mm el día de la inseminación. En nuestra serie no ha habido diferencias en la media de grosor endometrial entre el grupo de embarazo y no embarazo; en otras series, como la de Khalil et al5, tampoco se encuentran diferencias.
Esta revisión nos ha permitido comprobar que los resultados obtenidos en nuestro centro son comparables con los referidos en la literatura científica. De los factores estudiados, los de mayor impacto favorable en la probabilidad de embarazo fueron la edad de la mujer menor de 37 años y el diagnóstico de anovulación respecto al factor tubárico y endometriosis. La obtención de mejores resultados en ciclos con más de un folículo preovulatorio puede indicar que el desarrollo multifolicular mejoraría el pronóstico en pacientes con factores desfavorables o fracaso de ciclos previos de IIUH. A partir de un REM de 1,5 millones/0,3ml los resultados obtenidos son similares.