La hipertensión pulmonar persistente del recién nacido es el resultado de un fracaso o de una mala adaptación circulatoria al momento de nacimiento; y representa una falla respiratoria aguda con un aumento sostenido de la resistencia vascular pulmonar, generando cortos circuitos extrapulmonares de derecha a izquierda, a través del conducto arterioso y foramen oval, con hipoxemia severa y acidosis secundaria. La clave del tratamiento reside en lograr una rápida mejoría de la oxigenación y dilatación de la arteria pulmonar para revertir los cortos circuitos con el uso de vasodilatadores pulmonares, de los cuales el óxido nítrico es el único agente aprobado por la FDA para su uso en neonatos con hipertensión pulmonar persistente del recién nacido, y debe ser considerado como el tratamiento de primera línea. Esta revisión se centrará en qué es el óxido nítrico y su papel como tratamiento de la hipertensión pulmonar persistente del recién nacido.
Persistent pulmonary hypertension of the newborn is the result of an abnormal adaptation to the perinatal circulatory transition. Persistent pulmonary hypertension of the newborn is a syndrome noted for its sustained elevation of the pulmonary vascular resistance, decreased lung perfusion, and continued right to left shunting of blood through the foramen ovale and ductus arteriosus. Respiratory failure in the neonate is frequently complicated by persistent pulmonary hypertension of the newborn. Nitric oxide has been shown to be efficient in its treatment, and inhaled nitric oxide is the only agent approved by the FDA for use in neonates with persistent pulmonary hypertension of the newborn, and, should always be the first-line treatment. In this article a review is presented of the evidence for the use of inhaled nitric oxide in the persistent pulmonary hypertension of the newborn.
El óxido nítrico (ON) es un gas simple que actúa como un mediador químico endógeno cuyo efecto predominante es la vasodilatación pulmonar. Desde su descubrimiento hace 30 años, a la fecha cada vez son más los procesos fisiológicos y patológicos en los que desempeña un papel importante.
En 1980, Furchgott y Zawadzki descubren que el endotelio estimulado por algunas sustancias como acetilcolina y bradiquinina, producía una sustancia que relajaba el músculo liso, y se denominó factor relajante derivado del endotelio1. Palmer, Ferrige y Moncada en 1987 identificaron al factor relajante derivado del endotelio como ON2. Las investigaciones sobre el ON en fisiología humana se iniciaron con su participación en la regulación de la presión sanguínea, mismas investigaciones que le valieron el premio Nobel de Medicina y Fisiología 1998 a los científicos Robert Furchgott, Ferid Murad y Louis Ignarro3,4.
Dentro de las diversas funciones que se le atribuyen se encuentra su participación en el mantenimiento del tono vascular, la función de neurotransmisores tanto en sistema nervioso central como periférico, y en la regulación del sistema inmune. Además, interactúa con el sistema mitocondrial para regular la respiración celular y para aumentar la generación de oxígeno, lo que desencadena mecanismos de supervivencia celular o la muerte5–8. Esta revisión se centrará en qué es el ON y su papel como tratamiento de la hipertensión pulmonar persistente del recién nacido (HPPRN).
Hipertensión pulmonar persistente del recién nacidoLa HPPRN es un síndrome de fracaso en la adaptación circulatoria al nacer caracterizado por un incremento en la resistencia vascular pulmonar (RVP) y presencia de cortos circuitos de derecha a izquierda a través del foramen oval y/o conducto arterioso; contrario a lo que sucede en la hipertensión pulmonar del adulto, en el recién nacido la HPPRN no está definida como una presión específica de la circulación pulmonar5–9. La incidencia es 1-2 casos por cada 1,000 nacidos vivos, y en recién nacidos con trisomía 21 se incrementa hasta 12 por cada 1,000 nacidos vivos10. La mortalidad varía del 10-50%5,6. Se presenta principalmente en recién nacidos a término y prematuros tardíos, pero también puede ser reconocido en algunos recién nacidos prematuros crónicos con dificultad respiratoria o displasia broncopulmonar6,10.
La circulación en el feto se caracteriza por una alta RVP y una baja resistencia vascular sistémica, siendo la placenta la encargada de realizar el intercambio gaseoso. Son varios los factores que contribuyen a mantener la RVP elevada en el útero, entre ellos, los mecánicos (compresión de las arteriolas pulmonares por los alvéolos distendidos por líquido amniótico), presión arterial de oxígeno baja y elevados niveles de mediadores de vasoconstricción como son la endotelina-1 (ET-1) y tromboxano5–8.
La ET-1 es un potente vasoconstrictor, sintetizado por las células del endotelio vascular, que actúa a través de los receptores ETA y ETB. Los receptores ETA desempeñan un papel importante en la vasoconstricción y los ETB en la vasodilatación. El bloque selectivo mediado por calcio de los receptores ETA causa vasodilatación pulmonar en el feto; y la estimulación de los receptores ETB por acción del ON vasodilatación5–9.
Al momento del nacimiento existen una serie de eventos que permiten hacer la transición a la vida extrauterina. Con el pinzamiento del cordón umbilical y las primeras respiraciones existe un aumento de la tensión arterial de oxígeno que lleva a una rápida disminución de la presión en arteria pulmonar y a un incremento de hasta 8 veces el flujo sanguíneo a nivel pulmonar, generando aumento en la presión de la aurícula derecha lo que condiciona el cierre funcional del foramen oval; conforme las RVP disminuyen por debajo del nivel de las resistencias vasculares sistémicas existe un flujo reverso a través del conducto que junto con el aumento del contenido de oxígeno arterial llevan a la vasoconstricción y cierre funcional del conducto arterioso en las primeras horas posterior al nacimiento5–7. De esta forma se establece la separación de la circulación pulmonar y sistémica de circuitos paralelos a circuitos en serie. En la etapa final de esta transición pulmonar del recién nacido, el descenso de la RVP se acompaña además de remodelación estructural del lecho pulmonar, con cambios de las arterias pulmonares a capilares; el endotelio vascular libera varios agentes vasoactivos que tienen un rol importante en la transición al nacimiento, como lo es la producción incrementada del ON5,8–10.
La HPPRN es una entidad clínica del recién nacido caracterizada por hipoxemia acentuada y cianosis generalizada debido a que existe una elevación sostenida de la RVP y una resistencia vascular sistémica normal o baja. Como consecuencia existe un aumento en la presión en la aurícula derecha, se eleva la presión de llenado diastólico del ventrículo derecho y el retorno venoso pulmonar disminuye; esto conduce a una derivación extrapulmonar de derecha a izquierda, de sangre no oxigenada a través de la persistencia de canales fetales-conducto arterioso persistente y foramen oval permeable con alteración importante en la ventilación/perfusión con hipoxemia severa y acidosis secundaria. La RVP persistentemente elevada aumenta la poscarga ventricular derecha y la demanda de oxígeno, con alteración en el aporte de oxígeno a nivel de los ventrículos lo que puede provocar un compromiso severo del funcionamiento del miocardio con dilatación del corazón derecho, insuficiencia tricuspídea y falla cardiaca derecha; de perpetuarse el daño, existe necrosis de los músculos papilares e insuficiencia ventricular izquierda. El aumento de la poscarga ventricular derecha causa desplazamiento del tabique hacia el ventrículo izquierdo, alteración ventricular izquierda, reducción del volumen minuto cardiaco y afectación severa del gasto cardiaco5–8.
La HPPRN se divide en primaria (20%), o secundaria (80%) asociada a diversas enfermedades pulmonares neonatales, como el síndrome de aspiración de meconio, hernia diafragmática congénita y síndrome de dificultad respiratoria5–7,10.
El diagnóstico debe de sospecharse en todo recién nacido a término o casi a término que presente datos de dificultad respiratoria e hipoxemia. El abordaje inicial debe ser con radiografía de tórax y gasometría arterial. La presencia de hipoxemia severa que no se correlaciona con hallazgos radiográficos de enfermedad del parénquima pulmonar obliga a descartar HPPRN primaria o cardiopatía congénita cianógena, mientras que hallazgos radiográficos compatibles con síndrome de dificultad respiratoria, aspiración de meconio etc. pueden orientar hacia una HPPRN secundaria5. Las diferencias en las mediciones preductales (en miembro torácico derecho) y posductales (en miembros inferiores) de PaO2 y saturación de oxígeno pueden ayudar a diferenciar HPPRN de una cardiopatía congénita; una diferencia de PaO2≥20mmHg o≥5-10% en la saturación de oxígeno indica diagnóstico de HPPRN. Las prueba de hiperoxia e hiperventilación ya no se realiza debido a sus efectos adversos5,6.
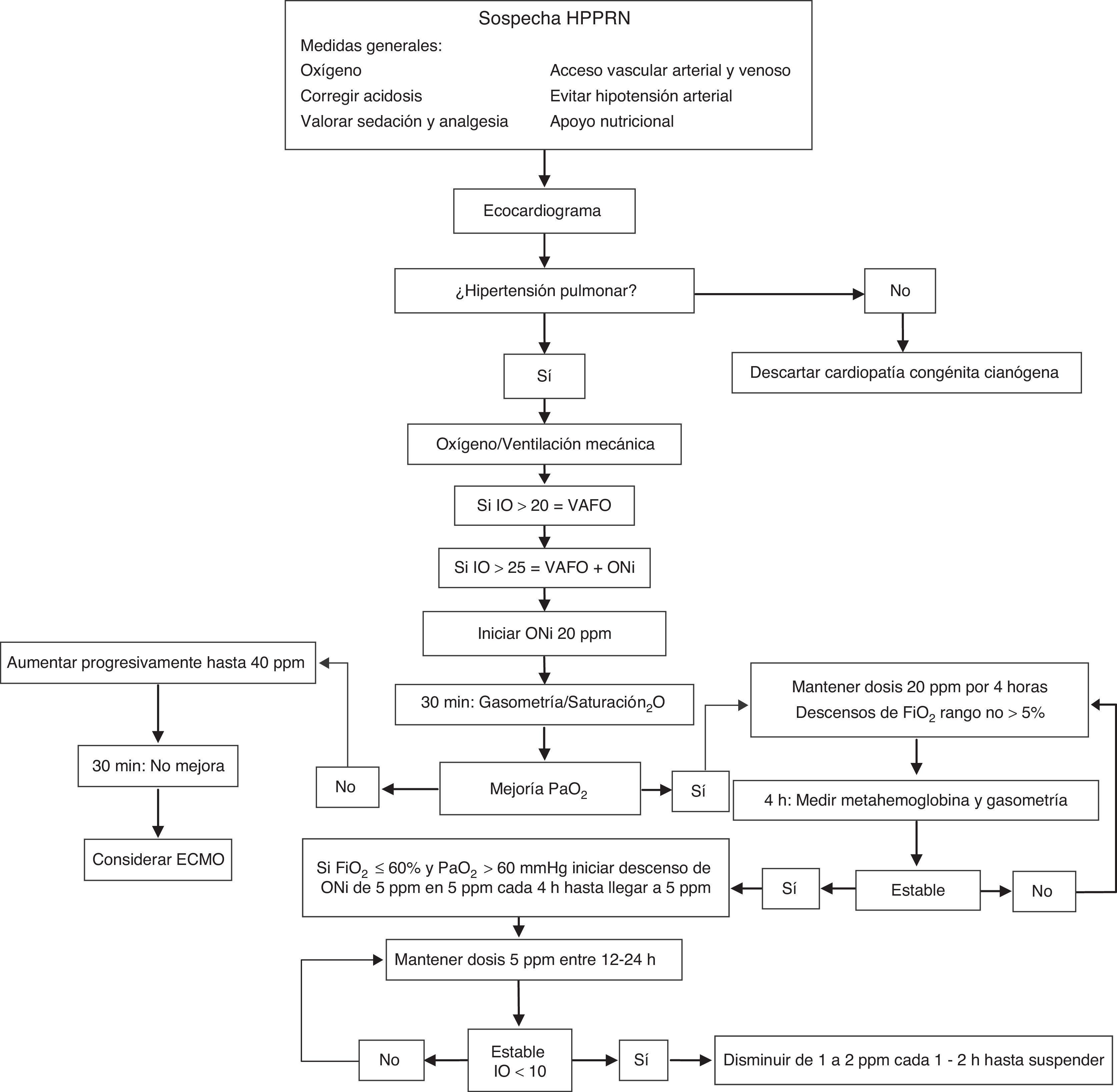
Se debe de realizar ecocardiograma doppler en todo paciente con sospecha de HPPRN para corroborar el diagnóstico, descartar cardiopatía congénita cianógena y para monitorización o seguimiento de la eficacia de las intervenciones terapéuticas. Los hallazgos cardiográficos son: aumento de la presión del ventrículo derecho evaluado por regurgitación tricuspídea, desviación del septum interventricular hacia la izquierda (imagen conocida como «D shape») y presencia de corto circuito de derecha a izquierda a través del foramen oval y/o conducto arterioso (aunque su ausencia no la descarta) y alteración de la función ventricular derecha5–8,10.
El tratamiento de la HPPRN depende de la severidad del cuadro ya que puede presentarse desde una hipoxemia leve con mínimos datos de dificultad respiratoria hasta una hipoxemia severa con inestabilidad cardiopulmonar que requiera de cuidados intensivos. El manejo general debe incluir adecuado aporte nutricional, normotermia, sedación y analgesia. La terapéutica ventilatoria debe de ir encaminada a mantener una adecuada oxigenación por lo que se pueden utilizar estrategias ventilatorias convencionales, ventilación de alta frecuencia oscilatoria o ECMO dependiendo del grado de compromiso y el uso de vasodilatadores pulmonares5,9–11.
Terapia específica con óxido nítrico inhalado para hipertensión pulmonar persistente del recién nacidoConceptoEl ON es una pequeña molécula gaseosa sintetizada principalmente por las células endoteliales; es el factor endógeno relajante del endotelio más importante que produce dilatación del músculo liso vascular en respuesta a la estimulación celular endotelial12. Es sintetizado a partir del aminoácido L-arginina, por la enzima óxido-nítrico sintetasa. Estímulos mecánicos como el flujo pulsátil y la tensión de rozamiento que este provoca en la célula endotelial, unido a niveles de ion calcio en el líquido extracelular, constituyen los patrones reguladores de la síntesis y liberación del ON en el endotelio. En las células endoteliales y en las neuronas, la enzima oxido-nítrico sintetasa está presente de forma constitutiva y puede ser activada por el incremento en la concentración citoplasmática del calcio en presencia de modulina. El calcio activa la enzima oxido-nítrico sintetasa que transforma la L-arginina en L-citrulina y ON; este último se difunde al músculo liso vascular y activa a la guanilatociclasa soluble y aumenta los niveles de GMP cíclico que produce un potente efecto vasodilatador sobre la musculatura lisa, favoreciendo la perfusión tisular en el lugar donde se libera12,13. Puesto que el ON tiene una vida corta media de 4-6seg es necesario un aporte continuo por parte de las células como respuesta a las fuerza de estiramiento del flujo sanguíneo sobre la pared arterial6,12,13.
La importancia del ON endotelial no se limita únicamente a su papel vasodilatador. El ON previene la agregación y adherencia plaquetaria, así como también la agregación neutrofílica en el endotelio normal, también en la permeabilidad endotelial y en la supresión de la proliferación del músculo liso adyacente7,13.
Un papel importante del ON es su acción como neuromodulador en el sistema nervioso central, interviene tanto en la memoria y aprendizaje, ciclo vigilia/sueño, como en la prevención de enfermedades como Alkzheimer y Parkinson13.
Indicaciones terapéuticasLa administración sistémica del ON no es posible debido a su rápida inactivación por la hemoglobina. El ON es 1,000-3,000 veces más afín con la hemoglobina que el O2. Sin embargo, ya se ha logrado elaborar un ON sintético (ONi), en forma de gas que se administra por vía inhalatoria, el ONi se difunde del alvéolo a la circulación pulmonar produciendo vasodilatación a dicho nivel, mejorando así la relación ventilación-perfusión, y al combinarse con la hemoglobina forma la metahemoglobina, que impide la vasodilatación sistémica, esto lo diferencia del resto de los vasodilatadores4,8,11. Su inicio de acción rápida es de 1-5min. Se metaboliza en 3 formas: 1) mediante la formación de dióxido de nitrógeno al reaccionar con el O2 de la sangre, 2) con la hemoglobina para formar la metahemoglobinemia, donde el hierro ha sido oxidado desde el estado ferroso al férrico, el cual no puede transportar O2 y por tanto, no contribuye a la capacidad de la sangre para transportar este gas, y 3) al combinarse con deoxihemoglobina y formar nitrosohemoglobina. Se excreta por vía renal siendo sus metabolitos nitratos y nitritos14.
El ON está indicado en varias enfermedades del adulto como falla cardiaca derecha, enfermedad pulmonar crónica y fibrosis pulmonar entre otras. En el recién nacido a término o casi a término (>34 semanas de gestación), su uso fue aprobado por la FDA en 2000 para pacientes con HPPRN ya sea primaria, o secundaria a enfermedades pulmonares (SDR del recién nacido, SAM, hernia diafragmática congénita, neumonía) o relacionada con cardiopatías congénitas tanto en periodo preoperatorio como postoperatorio4,5,9,11.
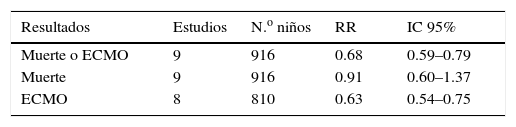
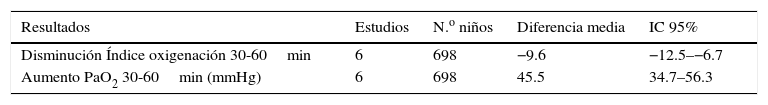
Múltiples estudios han revelado que el uso de ONi ha disminuido la necesidad de ECMO cuando se usa en los primeros 30-60min, con mejoría de los índices de oxigenación y en la incidencia de displasia broncopulmonar4,12–18 (ver tablas 1 y 2). Sin embargo no se encontraron cambios en mortalidad, y los peores resultados se hallaron en pacientes con hernia diafragmática4,12,16,17.
Resultado del uso de ONi en recién nacidos a término con falla respiratoria hipóxemica
| Resultados | Estudios | N.o niños | RR | IC 95% |
|---|---|---|---|---|
| Muerte o ECMO | 9 | 916 | 0.68 | 0.59–0.79 |
| Muerte | 9 | 916 | 0.91 | 0.60–1.37 |
| ECMO | 8 | 810 | 0.63 | 0.54–0.75 |
Modificada de Cochrane Database Syst Rev19.
Otros resultados del uso de ONi en recién nacidos a término con falla respiratoria hipoxémica
| Resultados | Estudios | N.o niños | Diferencia media | IC 95% |
|---|---|---|---|---|
| Disminución Índice oxigenación 30-60min | 6 | 698 | −9.6 | −12.5–−6.7 |
| Aumento PaO2 30-60min (mmHg) | 6 | 698 | 45.5 | 34.7–56.3 |
Modificada de Cochrane Database Syst Rev19.
Así también estudios realizados en prematuros indican que el uso de ONi puede mejorar el estado de oxigenación, pero no la tasa de supervivencia4,12–16. Mercier et al. en el 2010 encuentra que el uso precoz de bajas dosis de ONi en los recién nacidos prematuros no mejora la supervivencia sin displasia broncopulmonar o daño cerebral, por lo que no debe ser usado como estrategia preventiva18,19.
Criterios de inicio:
- •
Recién nacido≥34 semanas de edad gestacional con falla respiratoria hipoxémica grave en el que exista evidencia de hipertensión pulmonar diagnosticada por PaO2 posductal<60mmHg, con diferencia de PaO2 pre-posductal superior 15mmHg y/o gradiente de saturación O2 pre-posductal superior al 5%, y/o evidencia por ecocardiografía doppler15,18.
- •
Recién nacido≥34 semanas de edad gestacional con índice de oxigenación>25 en 2 controles sucesivos separados al menos 30min15. En los recién nacidos con enfermedades difusas del parénquima pulmonar (HPPRN secundaria) con índice de oxigenación>25 se requiere usar en conjunto con VAFO19. La VAFO permite que la entrega del ONi llegue mejor al capilar pulmonar al mantener un mejor reclutamiento alveolar. Existen estudios sobre el inicio precoz de ONi con índice de oxigenación entre 15-25, sin embargo, los resultados han sido contradictorios ya que en algunos mejoraba la oxigenación pero no la mortalidad o necesidad de ECMO, por lo que se debe tener más evidencia científica para emitir una recomendación15,20–22.
- •
No existe suficiente evidencia científica de su utilidad y seguridad en prematuros≤de 34 semanas de gestación, en los cuales solo se consideran dosis bajas de 5ppm de ONi y presencia de hipoxemia severa22–24.
Los primeros reportes de tratamiento con ON en recién nacidos de término utilizaron dosis variadas desde 5ppm hasta 80ppm. La evidencia clínica actual muestra que la dosis inicial de 20ppm es suficientemente eficaz y segura en la mayoría de los casos, mejora la oxigenación rápidamente, y rara vez se asocia a efectos secundarios, y por el contrario, la dosis de 80ppm aumenta el riesgo de metahemoglobinemia21–24.
Existes múltiples propuestas sobre cómo realizar el manejo y destete del ONi y es importante establecer una estrategia de manejo (fig. 1). Se comienza con 20ppm de ONi hasta lograr mejoría y posteriormente se irá haciendo una reducción gradual, ya que si se realiza un retiro brusco se puede generar una vasoconstricción de rebote, con una rápida disminución en la oxigenación. En general, existe una rápida respuesta al manejo con ONi en los primeros 60min. Se considera mala respuesta al ONi cuando a las 2h de administración del ONi la PaO2 posductal no asciende un 20% sobre los valores basales. En estos casos se debe de elevar la dosis al doble durante otras 2h, pero es muy poco probable que se obtenga una respuesta satisfactoria; ante la falta de respuesta se disminuye el ONi en forma paulatina (20, 10, 5, 3, 1ppm cada 10min hasta retirarlo). No existe motivo para retrasar más de 4h la retirara del ONi tras una respuesta negativa. Si la oxigenación no mejora a pesar de una ventilación adecuada y estabilidad hemodinámica con ONi, se debe considerar como opción terapéutica ECMO1,5,15,.
Duración del tratamientoEstudios multicéntricos reportan una duración de la terapia con ONi menor a 5días (media de 2 días), lo cual coincide con la mejoría clínica observada en los recién nacidos con HPP. Si el ONi es requerido por más de 5 días, es necesario descartar otras causas como una administración incorrecta por hipoinsuflación pulmonar que se corrige con un buen reclutamiento alveolar mejorando o modificando la técnica de ventilación mecánica. Otras posibles causas de falla serían neumopatía grave (hipoplasia pulmonar, hernia diafragmática), alteración hemodinámica grave, o alteración vascular pulmonar como en la displasia capilar alveolar, o alteraciones del metabolismo en la célula muscular lisa del vaso pulmonar, con disminución de la síntesis del GMP cíclico, en cuyo caso puede ser útil el uso de inhibidores de fosfodiesterasa.
Efectos adversos- -
Metahemoglobinemia: consiste en la unión del ON a la hemoglobina, impidiendo el transporte de oxígeno. Se recomienda monitorizar la metahemoglobina en todo paciente que precise tratamiento con ONi; se disminuirá cuando esta se encuentre entre 2.5-5% y se suspenderá cuando sea>5%. El recién nacido pretérmino tiene más riesgo de toxicidad por tener menores niveles de metahemoglobinemia reductasa.
- -
Aumento en la producción de dióxido de nitrógeno: se produce al reaccionar el ON con altas concentraciones de oxígeno en el circuito y en la vía aérea. Con niveles superiores a 3ppm puede producirse lesión pulmonar, edema y estrés oxidativo derivado de la producción de peroxinitrito, sin embargo, con las dosis recomendadas su aparición es infrecuente.
- -
Alteración de la función plaquetaria (inhibición de la agregación y adhesión) con prolongación de tiempos de coagulación, que incrementa el riesgo de hemorragia, sobre todo intracraneal2, sin embargo, estudios recientes muestran que bajas dosis (<5ppm) no parecen incrementar el riesgo.
Cardiopatías congénitas como síndrome de ventrículo hipoplásico izquierdo e interrupción de arco aórtico, además, de ahí la importancia del ecocardiograma antes del inicio de ONi1.
ConclusionesCada vez son más los estudios que demuestran la participación del ON en múltiples procesos biológicos en el organismo; por más de dos décadas ha mostrado su efectividad como vasodilatador pulmonar en el manejo de la HPPRN. Este artículo expone una actualización sobre sus características fundamentales y su importancia en las funciones cardiovasculares principalmente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.