La falla ovárica prematura (FOP) es el cese de la función ovárica acompañado por hipoestrogenismo y niveles de hormona foliculoestimulante (FSH) ≥40 UI/ml antes de los 40 años. Las alteraciones cromosómicas, principalmente las que involucran al cromosoma X, son la causa genética más común, con una prevalencia que llega a alcanzar el 15%. La existencia de mosaicismo del cromosoma X se asocia con la aparición de la enfermedad.
ObjetivoDeterminar la existencia de mosaicismo en diferentes tejidos de pacientes con falla ovárica prematura y compararlo con un grupo control.
Materiales y métodosDurante el período comprendido entre mayo y noviembre de 2014 se recolectaron muestras de mucosa oral, sangre periférica y orina de un total de 6 pacientes con diagnóstico de FOP y cariotipo normal y de 6 controles pareados por edad. Se realizó el análisis de 3,000 núcleos de cada paciente y su respectivo control, 1,000 por cada tejido analizado, y se obtuvo un total de 6,000 núcleos por cada pareja de caso y control para determinar la proporción de mosaicismo del cromosoma X mediante la técnica de hibridación fluorescente in situ (FISH).
ResultadosEn el grupo de casos, el análisis mediante FISH de los núcleos en interfase de los tres tejidos analizados mostró una línea celular con monosomía X en el 0.94% (0.3-2%) y una línea celular con trisomía X en el 0.52% (0-3.4%) del total de 18,000 células analizadas; la mayor proporción de células con cariotipo 45,X se observó en el urotelio. En el grupo control se encontró una señal correspondiente a monosomía X en el 0.32% (0-0.7%) y otra correspondiente a trisomía X en el 0.4% (0-3.4%).
DiscusiónSe encuentra una diferencia significativa (p <0.05) entre el porcentaje de mosaicismo correspondiente a monosomía del cromosoma X entre las pacientes y las controles; de igual manera existe diferencia significativa entre el porcentaje de mosaicismo encontrado en células uroteliales y el encontrado en células de sangre periférica y mucosa oral.
ConclusiónLa existencia de mosaicismo de bajo grado puede ser la causa de falla ovárica prematura. Este estudio indica que es necesario más de un tipo de tejido para identificar el mosaicismo de bajo grado. Por ello, el estudio de células del urotelio puede incluirse dentro del abordaje diagnóstico de las pacientes con esta enfermedad.
Premature ovarian failure (POF) is the cessation of ovarian function accompanied by oestrogen deficiency and follicle-stimulating hormone (FSH) levels ≥40 IU/ml before the age of 40. Chromosomal abnormalities, mainly involving the X chromosome, are the most common genetic cause, with a prevalence of up to 15%. The presence of X chromosome mosaicism is associated with the onset of the disease.
ObjectiveTo determine the presence of mosaicism in different tissue samples from patients with POF compared to a control group.
Materials and methodsSamples of oral mucosa, peripheral blood and urine were collected from 6 patients diagnosed with POF who presented a normal karyotype, as well as from 6 age-matched controls, between May and November 2014. We analysed 3,000 nuclei from each patient and their respective control (1,000 nuclei from each tissue), thus obtaining a total of 6,000 nuclei per pair of case and control subjects. These nuclei were used to determine the percentage of X chromosome mosaicism using the fluorescent in-situ hybridisation (FISH) technique.
ResultsIn the study group, FISH analysis of interphase nuclei from the 3 tissues analysed showed a cell line with monosomy X in 0.94% (0.3-2%) and a cell line with trisomy X in 0.52% (0-3.4%) of the total 18,000 cells analysed. Cells with 45,X were more frequent in the urothelium. In the control group, FISH analysis showed a cell line corresponding to monosomy X in 0.32% (0-0.7%) and to trisomy X in 0.4% (0%-3.4%) of cases.
DiscussionA statistically significant difference (p <0.05) between the percentages of mosaicism for X chromosome monosomy was found between patients and their matched controls. Likewise, there was a statistically significant difference between the percentage of mosaicism found in urothelial cells and in cells from peripheral blood and oral mucosa.
ConclusionThe presence of low-grade mosaicism can be a cause of POF. This study indicates that more than 1 tissue type is necessary to identify low-grade mosaicism. The study of urothelial cells should be included in the diagnostic approach of patients with POF.
La falla ovárica prematura (FOP) es el cese de la función ovárica y se caracteriza por la elevación de la hormona foliculoestimulante (FSH) en valores superiores a 40 UI/ml y la disminución de estrógenos (estradiol menor a 50 pg/ml) en dos tomas con 4 meses de intervalo en mujeres menores de 40 años. Alrededor del 10-28% de mujeres presentan amenorrea primaria y el 4-18%, amenorrea secundaria con síntomas derivados de la depleción estrogénica1. Esta patología afecta a 1 de cada 100 mujeres y la mayoría de las pacientes presenta infertilidad. Sin embargo, el 50% de los casos muestra función ovárica residual, por lo que se estima que, aproximadamente, entre el 5 y el 10% de ellas puede concebir espontáneamente2.
La falla ovárica prematura es una enfermedad heterogénea, la cual puede estar asociada con factores autoinmunes, endocrinológicos, infecciosos, metabólicos o genéticos. Estos factores pueden causar disfunción folicular ovárica, depleción de folículos primordiales de manera acelerada o inhabilidad para reclutar folículos primordiales2. La mayoría de los casos de FOP es esporádica. Sin embargo, entre el 4 y el 33% de los casos son familiares3. Estos casos han permitido la identificación de genes candidatos en diferentes poblaciones donde el abordaje genético es esencial para la determinación causal y el asesoramiento reproductivo.
Las alteraciones cromosómicas se consideran la causa genética más común de FOP, con una prevalencia del 15% por término medio4. Diversos estudios muestran alteraciones estructurales y numéricas en el cromosoma X, como la existencia de mosaico cromosómico1. Un mosaico se define como la existencia de 2 líneas celulares o más con diferente genotipo procedentes de un mismo cigoto en un mismo individuo. La frecuencia de mosaicismo del cromosoma X en mujeres con FOP esporádica se ha estimado entre el 3 y el 11%5–8, con una frecuencia de mosaicismo del 9.92% (0.64-19.2%) en el cariotipo 45,X y del 6% (0-12%) en el cariotipo 47,XXX. El mosaico detectado más frecuentemente es 45,X/46,XX, seguido en frecuencia por el mosaico 45,X/46,XX/47,XXX. La edad de inicio de la FOP en mujeres con más del 10% de células aneuploides es de 26 ± 5.65 años y en mujeres con menos del 10% de células aneuploides es de 35.92 ± 3.87 años1. Clásicamente, la monosomía del cromosoma X está asociada con el síndrome de Turner. Sin embargo, parece que el mosaicismo con una línea 46,XX atenúa el fenotipo y causa falla ovárica prematura a diferentes edades9.
El mosaico gonadal de bajo grado se define como el estado de mosaicismo de los cromosomas sexuales en que la línea celular aberrante se presenta en el 10% o menos de las células analizadas10. La detección de un bajo grado de mosaicismo de células 45,X en un estudio citogenético puede ser difícil de interpretar ya que se ha documentado que existe una pérdida de uno de los cromosomas X como una circunstancia normal asociada con el envejecimiento11. Esta asociación fue documentada en linfocitos desde los años sesenta del siglo pasado y se han realizado múltiples estudios para determinar su frecuencia y posibles asociaciones. Se ha demostrado que la pérdida del cromosoma X es 10 veces más común que la pérdida de cualquier autosoma sin predilección aparente por el cromosoma activo o inactivo. Se reporta que en mujeres de 25 años el porcentaje de mosaicismo esperado es inferior al 1% y éste incrementa proporcionalmente con la edad11.
A veces, el análisis citogenético convencional no detecta un bajo grado de mosaicismo; en cambio, la utilización de hibridación fluorescente in situ (FISH) en núcleos en interfase aumenta la detección de mosaico de bajo nivel al analizar un mayor número de células12,13. Lakhal y cols. utilizaron FISH en núcleos en interfase de linfocitos de 200 mujeres con FOP y cariotipo normal (46,XX), en los cuales encontraron una proporción de mosaico significativamente mayor en el 11.5% de las pacientes en comparación con el grupo control, con una proporción mayor en las mujeres con amenorrea secundaria6. Asimismo, Baronchelli y cols. estudiaron a 269 mujeres con FOP y cariotipo normal y encontraron que el grupo de pacientes presentaba una proporción de células 45,X del 7.5% frente al 2.7% en el grupo control y una proporción de células 47,XXX del 3.3% frente al 0.6% en el grupo control14.
Los estudios citogenéticos tanto convencionales (cariotipo) como moleculares (FISH) son la forma más fácil y costeable de estudiar la causa genética más común de falla ovárica prematura. Los estudios citogenéticos en sangre periférica de mujeres con falla ovárica prematura pueden detectar alteraciones cromosómicas. Sin embargo, se conoce que el mosaicismo es un suceso celular dependiente del tejido, por lo que el análisis de los cromosomas sexuales en tejidos con diferente origen embrionario podría determinar la existencia de mayor proporción de mosaicismo que explicara la falla ovárica prematura.
Las células del urotelio poseen un origen embrionario común con las gónadas en la cresta urogenital. La obtención de este tipo de células a través de la recolección de orina es un estudio no invasivo de un tejido diferente a la sangre periférica y más representativo del tipo de tejido en el cual se origina la falla ovárica prematura.
La determinación de mosaicismo en diferentes tejidos de pacientes con FOP puede ayudar a comprender la causa de la enfermedad.
ObjetivoSe desea determinar la existencia de mosaicismo en diferentes tejidos de pacientes con falla ovárica prematura en comparación con un grupo control.
Material y métodosSe realizó un estudio descriptivo de casos y controles durante el período de tiempo comprendido entre los meses de mayo y noviembre de 2014. Se incluyó a un total de 6 pacientes con diagnóstico de FOP y cariotipo normal 46,XX en 20 metafases de sangre periférica. Las pacientes tenían 40 años o menos y presentaban amenorrea secundaria en un lapso de tiempo mayor o igual a 6 meses con dos determinaciones de FSH mayor o igual a 40 UI/l. Todas las pacientes contaban con historia clínica ginecológica completa y diagnóstico de FOP idiopática. El grupo control estuvo compuesto por 6 mujeres pareadas por edad a los casos, con ciclos menstruales regulares. Se obtuvo consentimiento informado de todas las participantes y sus controles.
Se solicitaron tres muestras a cada paciente y al grupo control: a) mucosa oral; se obtuvieron células con cepillo para citología exfoliativa mediante raspado de ambos carrillos; b) sangre periférica; se obtuvieron células por venopunción en un tubo heparinizado, y c) orina; se obtuvieron células de dos frascos estériles de 100ml de la primera orina de la mañana. Todas las muestras fueron procesadas en el laboratorio de Citogenética del Instituto Nacional de Perinatología.
Se efectuó el análisis de 3,000 núcleos de cada paciente y su respectivo control. De cada tejido se analizaron 1,000 células y se obtuvo el total de 6,000 núcleos por cada pareja de caso y control. El estudio de FISH se realizó con sondas alfa satélite para los cromosomas X, Y y 18 (AneuVysion Multicolor DNA ProbeKit, Vysis, Abbott Molecular) y la lectura se dividió entre dos lectores y a cada uno le correspondieron 500 células de cada tejido. La sonda centromérica correspondiente al cromosoma 18 se utilizó como señal de referencia para valorar la eficiencia de la hibridación y las células con monosomía y trisomía para el cromosoma X se tomaron en consideración para determinar la tasa de mosaicismo. Se establecieron tres categorías para la lectura e interpretación de los cromosomas 18 y X: a) 2:1 (dos señales 18 y una señal X); b) 2:2, y c) 2:3.
Se llevó a cabo el análisis con estadística descriptiva con prueba de la χ2 mediante una hoja de cálculo de Microsoft Excel (Microsoft Corporation, Redmond, WA). El análisis de la información entre los grupos analizados se consideró como significativo con un valor de p <0.05. El número de células necesarias para determinar si se trata de un mosaicismo verdadero depende del punto de corte establecido en cada laboratorio, lo que refleja la sensibilidad y especificidad del kit de FISH utilizado. En este caso en particular, todas las células encontradas sin importar su número se toman en cuenta para la determinación del mosaicismo y se subclasifica en mosaicismo de bajo grado si el número es igual o inferior al 10% de la población celular total.
ResultadosEn total se realizó el análisis de 36,000 núcleos en interfase: 18,000 correspondientes a los casos y 18,000 a sus respectivos controles, de los cuales 6,000 núcleos corresponden a cada tejido: mucosa oral, sangre periférica y orina, respectivamente. Se realizó una comparación de los tres tejidos en conjunto y de forma individual para determinar la proporción de mosaicismo.
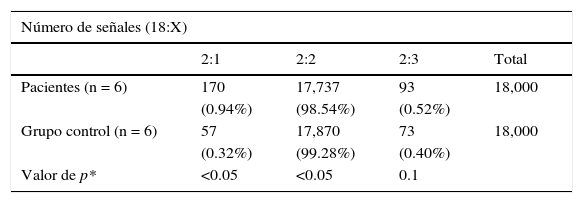
El análisis mediante FISH de los núcleos en interfase de los tres tejidos analizados de las pacientes mostró mayor número de alteración en los cromosomas sexuales que los del grupo control. Se detectó una línea celular con monosomía X en el 0.94% (0.3-2%) de los casos y una línea celular con trisomía X en el 0.52% (0-3.4%) de los casos de un total de 18,000 células analizadas. En el grupo control se encontró una señal correspondiente a monosomía del cromosoma X en el 0.32% (rango del 0-0.7%) y de trisomía X en el 0.4% (0-3.4%) del total de 18,000 células analizadas. Todos los casos presentaron dos señales correspondientes al cromosoma 18.
La prueba de la χ2 mostró una diferencia significativa en la distribución encontrada en los dos grupos (p<0.05) con monosomía del cromosoma X. Sin embargo, no se encontró diferencia significativa en la existencia de trisomía X (tabla 1).
Análisis por FISH de pacientes y controles de núcleos en interfase en los tres tejidos analizados
| Número de señales (18:X) | ||||
|---|---|---|---|---|
| 2:1 | 2:2 | 2:3 | Total | |
| Pacientes (n = 6) | 170 | 17,737 | 93 | 18,000 |
| (0.94%) | (98.54%) | (0.52%) | ||
| Grupo control (n = 6) | 57 | 17,870 | 73 | 18,000 |
| (0.32%) | (99.28%) | (0.40%) | ||
| Valor de p* | <0.05 | <0.05 | 0.1 | |
*Prueba de la χ2.
FISH: hibridación fluorescente in situ.
El análisis comparativo de los diferentes tejidos mostró lo siguiente:
- 1.
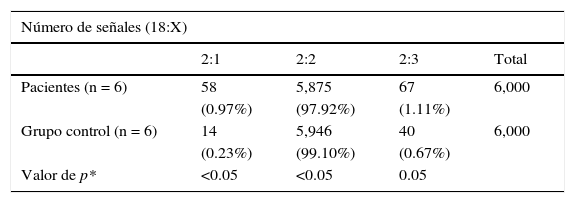
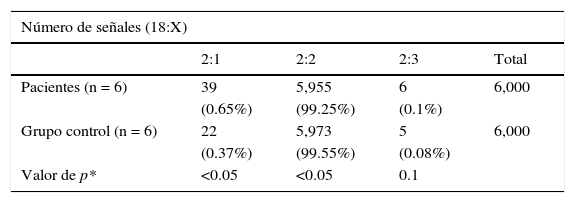
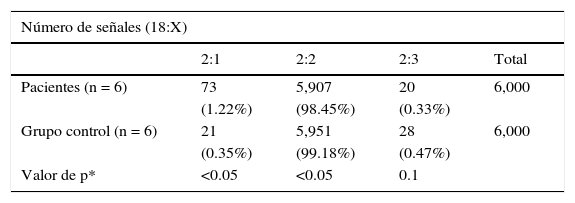
Casos. En células de la mucosa oral se encontró monosomía del cromosoma X en el 0.97% (0.4-2%) y trisomía X en el 1.11% (0-3.4%). En linfocitos de sangre periférica se encontró monosomía X en el 0.65% (0.3-0.9) y trisomía X en el 0.1% (0-0.2%). En células del urotelio se encontró monosomía X en el 1.22% (0.9-2%) y trisomía X en el 0.33% (0-1.3%).
- 2.
Controles. En células de la mucosa oral se encontró monosomía X en el 0.23% (0.1-0.5%) y trisomía X en el 0.67% (0-3.4%). En sangre periférica se encontró monosomía X en el 0.37% (0-0.7%) y trisomía X en el 0.08% (0-0.7%). En células del urotelio se encontró monosomía X en el 0.35% (0.1-0.6%) y trisomía X en el 0.47% (0-2.4%).
Se observó una diferencia significativa, con una p<0.05, de monosomía del cromosoma X en los tres tejidos analizados del grupo de casos en comparación con los tejidos del grupo control. No se encontró diferencia significativa en la distribución correspondiente a trisomía X (tablas 2–4).
Análisis por FISH de pacientes y controles de núcleos en interfase en mucosa oral (6,000 núcleos en interfase)
| Número de señales (18:X) | ||||
|---|---|---|---|---|
| 2:1 | 2:2 | 2:3 | Total | |
| Pacientes (n = 6) | 58 | 5,875 | 67 | 6,000 |
| (0.97%) | (97.92%) | (1.11%) | ||
| Grupo control (n = 6) | 14 | 5,946 | 40 | 6,000 |
| (0.23%) | (99.10%) | (0.67%) | ||
| Valor de p* | <0.05 | <0.05 | 0.05 | |
*Prueba de la χ2.
Análisis por FISH de núcleos de pacientes y controles en interfase en sangre periférica (6,000 núcleos en interfase)
| Número de señales (18:X) | ||||
|---|---|---|---|---|
| 2:1 | 2:2 | 2:3 | Total | |
| Pacientes (n = 6) | 39 | 5,955 | 6 | 6,000 |
| (0.65%) | (99.25%) | (0.1%) | ||
| Grupo control (n = 6) | 22 | 5,973 | 5 | 6,000 |
| (0.37%) | (99.55%) | (0.08%) | ||
| Valor de p* | <0.05 | <0.05 | 0.1 | |
*Prueba de la χ2.
Análisis por FISH de pacientes y controles de núcleos en interfase en urotelio (6,000 núcleos en interfase)
| Número de señales (18:X) | ||||
|---|---|---|---|---|
| 2:1 | 2:2 | 2:3 | Total | |
| Pacientes (n = 6) | 73 | 5,907 | 20 | 6,000 |
| (1.22%) | (98.45%) | (0.33%) | ||
| Grupo control (n = 6) | 21 | 5,951 | 28 | 6,000 |
| (0.35%) | (99.18%) | (0.47%) | ||
| Valor de p* | <0.05 | <0.05 | 0.1 | |
*Prueba de la χ2.
Al comparar los tejidos entre sí para determinar la existencia de células con monosomía X, se observó una diferencia significativa (p<0.05) entre las células del urotelio y los linfocitos de sangre periférica. No se observó diferencia significativa entre células de la mucosa oral y de la sangre periférica de las pacientes ni al comparar los tejidos del grupo control.
DiscusiónEn este estudio se encontró que tanto las pacientes como sus respectivos controles presentaron tres líneas celulares a expensas del cromosoma X, en las cuales la mayor proporción correspondió a un complemento normal 46,XX, seguido de una línea celular con monosomía del cromosoma X y finalmente una línea con trisomía 47,XXX. Diferentes estudios informan de la existencia de aneuploidía en mosaico de los cromosomas sexuales en mujeres, que puede ser el resultado de un mosaicismo genuino, un artefacto técnico o asociado con la edad11. De las tres causas, el artefacto técnico se puede descartar fácilmente por la existencia de otras aneuploidías. Sin embargo, diferenciar entre las otras dos causas puede representar un reto para la interpretación, en especial en pacientes sin características fenotípicas anormales. En estudios como éste, en el cual se intenta relacionar la existencia de mosaicismo de cromosomas sexuales con entidades patológicas, es necesario comparar los hallazgos con controles pareados por edad.
Al analizar el porcentaje de cada línea celular en los tres tejidos estudiados, se encuentra mosaicismo de bajo grado, tanto en monosomía como en trisomía en ambos grupos. Se observa una diferencia significativa entre casos y controles, lo que apoya los hallazgos publicados por otros autores6,14. Estos estudios refieren una mayor proporción de mosaico entre pacientes en comparación con los controles y ello puede deberse al menor número de pacientes incluidas en este estudio.
Una característica importante del mosaico de los cromosomas sexuales es que se trata de un fenómeno dependiente del tejido y la aneuploidía en el cromosoma X es común en linfocitos de sangre periférica. Sin embargo, rara vez se encuentra en la médula ósea11. Éste es el primer trabajo de pacientes con FOP en que se comparan tres tejidos diferentes de la misma paciente, de los cuales dos (mucosa oral y urotelio) son diferentes a linfocitos y uno de ellos (urotelio) tiene un origen embrionario diferente.
En este estudio, se ha intentado determinar si existe diferencia entre los tres tejidos del grupo de pacientes afectadas con el fin de establecer si el estudio de pacientes con FOP requiere un abordaje distinto. Los resultados que se han obtenido no han mostrado diferencia en células con trisomía X. Sin embargo, han mostrado diferencia en el porcentaje de células con monosomía X del 1.22, el 0.97 y el 0.65% en urotelio, mucosa oral y sangre periférica, respectivamente. Lo anterior apoya la hipótesis de que las pacientes con FOP pueden mostrar mayor porcentaje de mosaicismo en un tejido con relación espacial al tejido ovárico procedente del seno urogenital. Este hallazgo debe ser confirmado en un mayor número de pacientes.
La técnica de FISH es una técnica rápida, que permite la cuenta de un mayor número de células en comparación con las técnicas de citogenética convencional y es una herramienta útil para determinar la existencia de mosaicismo con mayor precisión y sin artefactos técnicos. A pesar de que la muestra de pacientes estudiada es pequeña, es importante destacar que la cantidad de núcleos en interfase que fueron analizados por paciente (1,000 células por tejido) es cinco veces la cantidad estudiada regularmente, lo que permite la detección de mosaicismo de bajo grado con mayor precisión. El número de núcleos en interfase analizados varía de acuerdo con el laboratorio y se basa en puntos de cortes determinados por la sensibilidad y especificidad de la sonda utilizada. Sin embargo, como guía general, el mosaicismo detectado en el 5% de las células puede ser detectado con la lectura de 282 núcleos en interfase con un IC del 99% cuando la sonda tiene sensibilidad del 99%15. El número de núcleos analizados dependerá del porcentaje de mosaicismo que se desee determinar y de la correlación que se pretenda realizar con una patología específica.
ConclusionesSe encontró una diferencia significativa entre el porcentaje de mosaicismo para monosomía del cromosoma X entre las pacientes y sus controles; de igual manera existe diferencia significativa entre el porcentaje de mosaicismo encontrado en células uroteliales y el encontrado en células de sangre periférica y mucosa oral. Los hallazgos sugieren que la detección de mosaico de bajo grado es mayor en las mujeres con FOP, principalmente en células que derivan de la cresta urogenital. Esta diferencia también apoya el hecho de que el mosaicismo es dependiente del tejido, por lo que estaría indicado estudiar más de un tejido para descartar la existencia o no de mosaicismo de bajo grado. Se necesita estudiar un número de pacientes mayor para confirmar los hallazgos mencionados y así proponer el estudio de células del urotelio dentro del abordaje diagnóstico de las pacientes con FOP.
Agradecemos sinceramente al Dr. Osvaldo M. Mutchinick B. y a su equipo, así como a las químicas fármaco-biólogas Renata Rivera Juárez y Virginia Santiago Cano del Instituto Nacional de Ciencias Médica y Nutrición Salvador Zubirán por su valiosa contribución en la realización de algunas de las técnicas de laboratorio utilizadas en este trabajo de investigación.