Comparar las concentraciones plasmáticas de lípidos y lipoproteínas en neonatos con restricción en el crecimiento intrauterino y alteraciones de la velocidad diastólica final de la arteria umbilical.
Material y métodosSe realizó una investigación en embarazadas con diagnóstico de restricción del crecimiento intrauterino atendidas en el Hospital Central Dr. Urquinaona de Maracaibo, Venezuela. Los casos se dividieron en: reversión de la onda de flujo diastólico final de la arteria umbilical (grupo A), ausencia de la onda de flujo diastólico final (grupo B) y onda de flujo diastólico final presente y positiva (grupoC). También se midieron las concentraciones plasmáticas de colesterol, triglicéridos, lipoproteínas de alta y baja densidad de los recién nacidos.
ResultadosLa velocidad diastólica final presentaba reversión en 33 casos, 71 casos con ausencia de la onda de flujo diastólico final y 146 casos con velocidad diastólica final presente en la arteria umbilical. Los recién nacidos del grupo A y B presentaron concentraciones significativamente más altas de colesterol y triglicéridos comparado con el grupo C (p<0.05). Las concentraciones de lipoproteínas de alta densidad fueron significativamente más bajas en los grupos A y B comparado con el grupo C (p<0.05). No se encontraron diferencias significativas en las concentraciones de lipoproteínas de baja densidad entre los 3 grupos (p=ns).
ConclusiónLos neonatos con restricción en el crecimiento intrauterino con reversión o ausencia de la onda de flujo diastólica final de la arteria umbilical muestran alteraciones significativas de las concentraciones de lípidos y lipoproteínas.
To compare plasma lipids and lipoproteins concentrations in newborns with intrauterine growth restriction and alterations of umbilical artery end-diastolic velocity.
Material and methodsA study was conducted on pregnant women with a diagnosis of intrauterine growth restriction who attended at Hospital Central Dr. Urquinaona, Maracaibo, Venezuela. The cases were divided into, reversed umbilical artery end-diastolic velocity (group A), absent umbilical artery end-diastolic velocity (group B), and umbilical artery end-diastolic velocity present and positive (groupC). Plasma concentrations of cholesterol, triglycerides, and low- and high-density lipoproteins were also measured in newborns.
ResultsReversed umbilical artery end-diastolic velocity was present in 33 cases, with 71 cases of absent umbilical artery end-diastolic velocity, and 146 cases with umbilical artery end-diastolic velocity present. The newborns in groups A and B had significantly higher plasma concentrations of cholesterol and triglycerides compared with group C (p<.05). High-density lipoproteins were significantly lower in group A and B compared with group C (p<.05). There were no significant differences found in low-density lipoproteins between the three groups (p>.05).
ConclusionNewborns with intrauterine growth restriction and absent or reversed umbilical artery end-diastolic velocity showed significant alterations in plasma lipids and lipoproteins concentrations.
La restricción del crecimiento intrauterino (RCIU) afecta al 3-8% de los embarazos y refleja una condición patológica en la cual el feto no alcanza su potencial genético de crecimiento. El diagnóstico se realiza por la desaceleración de la velocidad del crecimiento en las mediciones ecográficas seriadas de la biometría fetal. En la práctica clínica la RCIU se define como bajo peso fetal sumado a signos de compromiso del bienestar fetal, asimetría del crecimiento y disminución del volumen de líquido amniótico evaluados por ecografía1. Es una causa importante de morbimortalidad perinatal, además de contribuir de forma substancial en la indicación de parto pretérmino iatrogénico, para evitar la muerte fetal intrauterina1,2. Su patogénesis es aún desconocida. Sin embargo, la hipótesis actual postula que la invasión trofoblástica es insuficiente y la alteración de la remodelación de las arterias espirales en el lecho placentario puede llevar a lesiones ateroscleróticas placentarias.
El flujo sanguíneo de la arteria umbilical (AU) evaluado por ecografía Doppler en diferentes condiciones fetales, incluyendo la RCIU, es utilizado para ayudar a predecir la hipoxemia y la acidemia fetal3,4. El aumento de la resistencia del flujo sanguíneo en la AU podría indicar obliteración de pequeñas arterias en el sistema de vellosidades terciarias o desarrollo de anomalías del árbol vascular de las vellosidades terminales3,5. Estudios en ovejas indican que es necesario que por lo menos se produzca el 70% de la embolización placentaria para producir la ausencia o reversión de la velocidad final diastólica de la AU6.
Entre los lípidos, el colesterol es un componente esencial para el desarrollo fetal y placentario. Las necesidades de colesterol se relacionan de forma positiva en la tasa de crecimiento fetal. Una cantidad significativa de colesterol fetal se origina de la síntesis de novo en el hígado fetal. Sin embargo, en forma adicional, el colesterol materno es transferido en forma activa por la placenta hacia el feto y contribuye de forma sustancial a las concentraciones de colesterol fetal7. En la superficie placentaria materna varios receptores están involucrados en la captación del colesterol8. El colesterol es transportado a la superficie fetal con la posterior liberación por las células endoteliales en la circulación fetal formando lipoproteínas de alta densidad (HDL)9. La HDL tiene un papel importante en el mecanismo de protección contra la aterosclerosis. Además de su función en el eflujo revertido de colesterol, muestra propiedades antiinflamatorias y protege contra la oxidación a las lipoproteínas de baja densidad (LDL)10.
Existen escasos informes de las concentraciones de lípidos y lipoproteínas en recién nacidos con diagnóstico de RCIU. Debido a que la placenta puede transportar tanto colesterol como ácidos grasos hacia el feto, se ha propuesto que las alteraciones cualitativas de la velocimetría de la AU podrían afectar el perfil lipídico en los recién nacidos con RCIU. El análisis cualitativo de las ondas de flujo en la predicción de los cambios en el perfil lipídico es un campo inexplorado. El objetivo de la investigación fue comparar las concentraciones de lípidos y lipoproteínas en neonatos con restricción en el crecimiento intrauterino y alteraciones de la velocidad diastólica final de la arteria umbilical.
Materiales y métodosSe realizó una investigación de tipo transversal y comparativa con un diseño cuasi-experimental en pacientes embarazadas con diagnóstico de restricción del crecimiento intrauterino del feto que fueron atendidas en el Hospital Central Dr. Urquinaona de Maracaibo, Venezuela, entre enero de 2012 y mayo de 2016. El estudio fue aprobado por el comité de ética del hospital y se obtuvo el consentimiento por escrito de todas las participantes.
Se incluyeron aquellos fetos sin alteraciones fenotípicas o genotípicas, mediciones ecográficas de la circunferencia abdominal menor del quinto percentil para la edad gestacional por los valores de referencia, velocimetría doppler anormal de la AU (índice de pulsatilidad más de 2 desviaciones estándar por encima del promedio para la edad gestacional para los valores de referencia)7, disponibilidad de datos de seguimiento neonatal y sin otra indicación de interrupción del embarazo. Además, para preservar la relación temporal entre los resultados del Doppler y las concentraciones de lípidos-lipoproteínas, solo se incluyeron neonatos que fueron evaluados en las 24horas previas al parto.
Se excluyeron las pacientes con embarazos múltiples, uso de fármacos que alteren las concentraciones maternas de lípidos-lipoproteínas en las 4 semanas previas a la evaluación, antecedentes de enfermedad cardiaca, hematológicas, hepática, renal o sistémica crónica, diabetes mellitus pregestacional o gestacional, presencia de infección intrauterina o materna activa. También se excluyó aquellos casos en los que no se pudo obtener datos de las concentraciones de lípidos-lipoproteínas y a las pacientes que se negaron a participar en la investigación.
Todas las evaluaciones fueron realizadas con un ecógrafo Doppler color General Electric® Logiq Pro 3 en tiempo real y un transductor convexo de 3,5MHz con filtro de alto paso fijo a 100Hz para separar las vibraciones de las paredes del vaso de las ondas de la velocidad de flujo. Las mediciones se obtuvieron durante la apnea y el reposo fetal. Las imágenes del Doppler color se utilizaron para optimizar la colocación de la puerta del Doppler de onda pulsado, permitiendo ajustar la escala de velocidad e identificar el área y dirección de flujo sanguíneo máximo. El ángulo de insonación se mantuvo tan cerca de 0° como fuese posible y la muestra de volumen se ajustó a la cubierta completo del vaso. Esta forma de medición maximiza la detección de las velocidades diastólicas finales y la precisión de las mediciones Doppler8. Las mediciones se realizaron de las imágenes fijas después de por lo menos 5 ondas de velocidad de flujo uniformes consecutivas con alta relación señal/ruido de la sección media del cordón umbilical. El diagnóstico de ausencia o reversión de la velocidad diastólica final se basó en múltiples mediciones, tomando en cuenta la mejor onda de flujo obtenida. Las elevaciones del índice de pulsatilidad fueron corregidas por la edad gestacional por la conversión de las mediciones individuales en sus puntuaciones Z (Δ índice de pulsatilidad=desviación estándar para el promedio de la edad gestacional). La edad gestacional fue estimada por la fecha del último periodo menstrual o por estimación ecográfica antes de las 20 semanas de embarazo.
Para el análisis final los fetos se dividieron en 3 grupos: grupo A, con reversión de la onda de flujo diastólico final de la AU (casos); grupo B, con ausencia de la onda de flujo diastólico final de la AU (casos) y grupo C, con onda de flujo diastólico final presente y normal de la AU (controles) y se compararon las concentraciones plasmáticas de lípidos y lipoproteínas entre los grupos.
Se obtuvo una muestra de sangre (5ml) inmediatamente después del nacimiento para la determinación de las concentraciones plasmáticas de lípidos y lipoproteínas por el pediatra encargado de la atención. El plasma fue almacenado a –80°C y centrifugado a baja velocidad y las mediciones se realizaron de forma inmediata. Los valores de las concentraciones plasmáticas de colesterol total, triglicéridos (TG), HDL y LDL se realizaron por una modificación del protocolo estándar de investigación clínica de lípidos, usando reactivos enzimáticos para su cuantificación. Tanto el colesterol total como los TG se midieron usando métodos enzimáticos automáticos (COBAS® Integra Colesterol y COBAS® Integra tryglicerides) en un analizador Roche/Hitachi®. Las concentraciones de HDL se determinaron después de precipitación selectiva usando manganeso-heparina y posterior a la determinación enzimática de colesterol. Los valores de LDL se calcularon usando la fórmula de Friedwald (LDL=colesterol – HDL – [TG/5]).
Se utilizó la prueba «t» de Student o prueba U de Mann-Whitney se empleó para analizar las variables continuas de acuerdo a la distribución. Se utilizó la prueba exacta de Fischer o Chi cuadrado para las variables categóricas. La regresión lineal múltiple se utilizó para determinar la relación entre las alteraciones de la velocidad diastólica final de la AU, percentil de peso al nacer, edad gestacional al momento del parto y concentraciones de lípidos y lipoproteínas. Un valor de p<0.05 fue considerado como estadísticamente significativo.
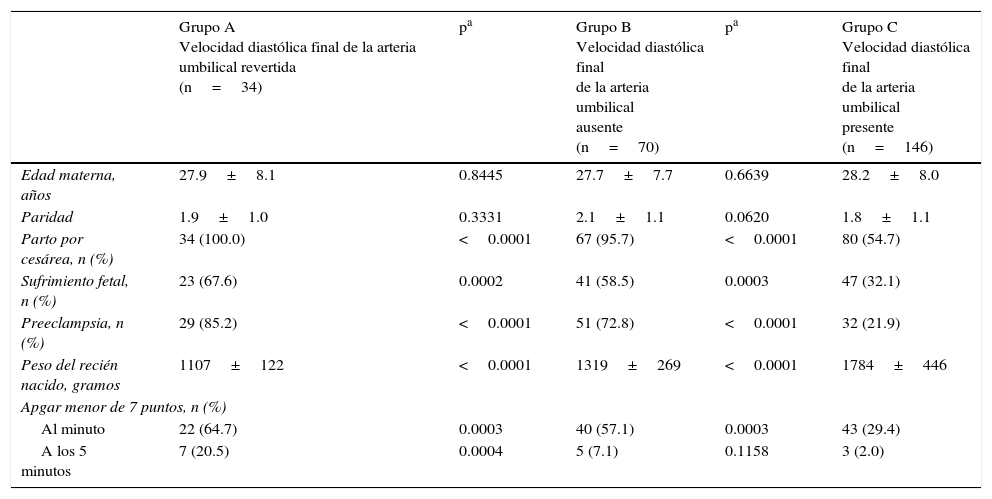
ResultadosSe incluyeron 33 casos en el grupo A, 71 casos en el grupo B y 146 casos en el grupo C. Las características generales de los grupos se muestran en la tabla 1. Los 2 grupos de estudio no mostraron diferencias con relación a la edad materna y a la paridad (p=ns). La edad gestacional en el momento del parto y el peso de los recién nacidos fue significativamente menor en el grupo de fetos con ausencia y con reversión del flujo diastólico final comparado con los fetos del grupo C (p<0.05). Los neonatos de los grupos que presentaban ausencia y reversión del flujo diastólico final de la AU presentaron una frecuencia significativamente superior de puntuaciones de Apgar al minuto menor de 7 puntos que los recién nacidos del grupo C (p<0.05).
Características generales
| Grupo A Velocidad diastólica final de la arteria umbilical revertida (n=34) | pa | Grupo B Velocidad diastólica final de la arteria umbilical ausente (n=70) | pa | Grupo C Velocidad diastólica final de la arteria umbilical presente (n=146) | |
|---|---|---|---|---|---|
| Edad materna, años | 27.9±8.1 | 0.8445 | 27.7±7.7 | 0.6639 | 28.2±8.0 |
| Paridad | 1.9±1.0 | 0.3331 | 2.1±1.1 | 0.0620 | 1.8±1.1 |
| Parto por cesárea, n (%) | 34 (100.0) | <0.0001 | 67 (95.7) | <0.0001 | 80 (54.7) |
| Sufrimiento fetal, n (%) | 23 (67.6) | 0.0002 | 41 (58.5) | 0.0003 | 47 (32.1) |
| Preeclampsia, n (%) | 29 (85.2) | <0.0001 | 51 (72.8) | <0.0001 | 32 (21.9) |
| Peso del recién nacido, gramos | 1107±122 | <0.0001 | 1319±269 | <0.0001 | 1784±446 |
| Apgar menor de 7 puntos, n (%) | |||||
| Al minuto | 22 (64.7) | 0.0003 | 40 (57.1) | 0.0003 | 43 (29.4) |
| A los 5 minutos | 7 (20.5) | 0.0004 | 5 (7.1) | 0.1158 | 3 (2.0) |
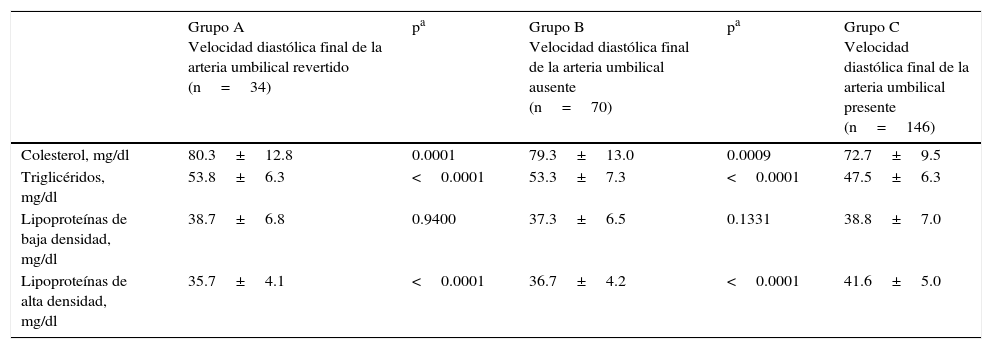
Las concentraciones promedio de lípidos y lipoproteínas en cada grupo se muestran en la tabla 2. Los recién nacidos del grupo A y B presentaron concentraciones significativamente más altas de colesterol (80.3±12.8mg/dl y 79.3±13.0mg/dl, respectivamente) comparado con los recién nacidos que presentaban velocidad diastólica final de la AU presente (72.7±9.5mg/dl; p<0.05). De igual forma, los recién nacidos de los grupos que tenían velocidad diastólica final de la arteria umbilical revertido y velocidad diastólica final de la AU ausente presentaban valores más elevados de TG (53.8±6.3mg/dl y 53.3±7.3mg/dl, respectivamente) comparado con los recién nacidos del grupo C (47.5±6.3mg/dl; p<0.05). Las concentraciones de HDL fueron significativamente más bajas en los grupos A (35.7±4.1mg/dl) y B (36.7±4.2mg/dl) comparado con los recién nacidos del grupo C (41.6±5.0mg/dl; p<0.05). No se encontraron diferencias estadísticamente significativas en las concentraciones de LDL entre los 3 grupos (p=ns).
Concentraciones de lípidos y lipoproteínas en los neonatos
| Grupo A Velocidad diastólica final de la arteria umbilical revertido (n=34) | pa | Grupo B Velocidad diastólica final de la arteria umbilical ausente (n=70) | pa | Grupo C Velocidad diastólica final de la arteria umbilical presente (n=146) | |
|---|---|---|---|---|---|
| Colesterol, mg/dl | 80.3±12.8 | 0.0001 | 79.3±13.0 | 0.0009 | 72.7±9.5 |
| Triglicéridos, mg/dl | 53.8±6.3 | <0.0001 | 53.3±7.3 | <0.0001 | 47.5±6.3 |
| Lipoproteínas de baja densidad, mg/dl | 38.7±6.8 | 0.9400 | 37.3±6.5 | 0.1331 | 38.8±7.0 |
| Lipoproteínas de alta densidad, mg/dl | 35.7±4.1 | <0.0001 | 36.7±4.2 | <0.0001 | 41.6±5.0 |
El análisis de regresión múltiple utilizando el peso al nacer, la edad gestacional y las alteraciones de la velocidad diastólica final de la AU como variables independientes y las concentraciones de lípidos y lipoproteínas como variables dependientes identificó que las alteraciones de la velocidad diastólica final de la AU tienen una fuerte asociación con los valores de colesterol (beta=0.956; p<0.05), TG (beta=1.001; p<0.05) y HDL (beta=1.743; p<0.05).
DiscusiónLos resultados de esta investigación demuestran que la velocimetría Doppler anormal de la AU en fetos con RCIU afecta negativamente las concentraciones plasmáticas de lípidos y lipoproteínas en los recién nacidos. Hasta la fecha no se conoce hallazgos similares en investigaciones previas.
Varios informes han sugerido que las lesiones ateroscleróticas pueden tener origen en condiciones intrauterinas adversas11–13. La RCIU es una condición de placentación inadecuada que lleva a alteraciones en el flujo sanguíneo de las arterias espirales dentro del lecho placentario14. Estos cambios producen isquemia/reperfusión e hipoxia, llevando a formación de especies reactivas de oxígeno por vías mitocondriales o separación proteolítica de la deshidrogenasa de xantina15. La ausencia o reversión de la velocidad diastólica final de la AU es la manifestación de alteraciones placentarias asociada a modificaciones de las vellosidades, del flujo sanguíneo y de las funciones de intercambio gaseoso. Como consecuencia, la biosíntesis y función de las proteínas placentarias está alterada, como se ha demostrado con el receptor de LDL y otras proteínas fijadoras de lipoproteínas16.
Los hallazgos de esta investigación demuestran un perfil pro-aterogénico, caracterizado por aumento de las concentraciones de colesterol y TG y disminución de las concentraciones de HDL, probablemente secundario a las alteraciones de la velocimetría Doppler de la AU. La importancia de estos hallazgos es que los TG actúan como un predictor independiente de enfermedad cardiaca coronaria, y asociados a otras alteraciones lipídicas explicaría el incremento en el riesgo de enfermedades cardiovasculares en la vida adulta en sujetos con antecedentes de RCIU17.
Dos estudios han reportado los valores de lípidos y lipoproteínas en fetos con diagnóstico de RCIU. Rodie et al.18 no encontraron diferencias significativas en las concentraciones de lipoproteínas y colesterol entre los casos y los controles, mientras que Peck et al.19 demostraron disminuciones significativas de las concentraciones de colesterol en recién nacidos con diagnóstico de RCIU comparado con los controles.
Debido a la naturaleza de los mecanismos fisiopatológicos subyacentes involucrados en estos hallazgos, las modificaciones más marcadas del perfil lipídico en los 2 grupos de RCIU con alteraciones de la velocimetría de la AU pueden explicarse por la exposición crónica a hipoxia y subnutrición. El daño hipóxico induce alteraciones en el metabolismo lipídico durante el periodo prenatal, llevando a hiperlipidemia e incrementando los ésteres de colesterol17. Modelos animales en condiciones de subnutrición demuestran incremento de los ácidos grasos libres y alteraciones en la depuración de las lipoproteínas ricas en TG20,21. La presencia de diferencias significativas entre los grupos de casos apoyaría la teoría de que esos fetos tienen mayor tendencia a presentar perfiles más aterogénicos.
La reversión o ausencia del flujo diastólico final de la AU indica una marcada disminución en el flujo sanguíneo de las vellosidades, por la liberación de factores humorales que puede alterar el tono vascular6,22,23. Esto se produce secundario a la oclusión vascular progresiva de las vellosidades y al aumento de la resistencia al flujo en la AU24. Además, la trombosis placentaria episódica tiene implicaciones específicas en la RCIU. La pérdida progresiva de la función placentaria, junto a cambios en la precarga cardiaca, presión arterial fetal, viscosidad sanguínea secundaria y un perfil lipídico mas aterogénico, incrementaría el riesgo de complicaciones perinatales25. Todos estos elementos se incluyen en un círculo de retroalimentación negativa que va de la lesión placentaria al RCIU, al daño vascular y al flujo sanguíneo anormal.
Las alteraciones de la velocimetría Doppler de la AU descritas en la RCIU pueden tener efectos marcados sobre la función placentaria, que podría fácilmente alterar el transporte de los lípidos. Los cambios en los valores del perfil lipídico pueden ser una respuesta fisiológica apropiada a un ambiente intrauterino adverso. Los mecanismos de transporte pueden estar aumentados para compensar los daños oxidativos y estructurales de la placenta26,27.
En este estudio se observó un aumento en la frecuencia de preeclampsia y cesáreas en los grupos de alteraciones en la velocimetría Doppler de la AU; esto puede explicarse por mecanismos etiopatogénicos comunes involucrado en la preeclampsia y el RCIU28. Sin embargo, la literatura demuestra que el diagnóstico adicional de preeclampsia no afecta al perfil lipídico observado en el RCIU29. Por otra parte, la mayor tasa de cesárea en los 2 grupos con RCIU y alteración de la velocimetría Doppler puede deberse a la necesidad de finalizar el embarazo a una edad gestacional lejana al término con condiciones desfavorables para el parto vaginal. Por lo tanto, estas alteraciones están inevitablemente asociadas con una alta tasa de cesárea. En forma alternativa, el perfil lipídico fetal puede estar alterado por desarrollo incompleto o inmadurez de las vías y procesos bioquímicos involucrados en el metabolismo. Esto se produce como un efecto de «protección» que redirige los nutrientes para el desarrollo de órganos clave en condiciones que alteran el crecimiento. Esto último es apoyado por los hallazgos en recién nacidos pequeños para su edad gestacional que tienen alteraciones en el uso de los TG circulantes con depleción adiposa periférica30.
Esta investigación tiene limitaciones. La prematuridad per se es una condición patológica. No se puede excluir que las concentraciones de lípidos en los 3 grupos pueden ser modificados por los factores que producen parto prematuro espontáneo. También es conocido que el perfil lipídico puede ser afectado por el estado nutricional, el cual es difícil de determinar en el feto. De igual forma, las diferentes medidas terapéuticas del RCIU pueden afectar el metabolismo materno y/o fetal. El estrés también afecta los parámetros lipídicos, y el compromiso fetal que produce es una indicación médica común para el parto. Si el estrés puede o no alterar las concentraciones de lípidos y lipoproteínas en fetos con RCIU aún debe ser establecido.
Aunque los datos de esta investigación no permiten la identificación de una causa subyacente precisa, demuestran que parte de las anomalías placentarias, que se manifiestan en ausencia o reversión de la velocidad diastólica final de la AU, está acompañada de un perfil lipídico aterogénico en el momento del nacimiento. Se necesitan más investigaciones sobre la relación entre el flujo sanguíneo uteroplacentario, concentraciones de lípidos-lipoproteínas y resultante perinatal para el mejorar el manejo de los casos de RCIU, planificando el mejor momento de la interrupción del embarazo y manejo de las complicaciones neonatales.
ConclusiónSobre la base de los hallazgos de la investigación se puede concluir que los neonatos con restricción en el crecimiento intrauterino y alteraciones de la velocidad diastólica final de la arteria umbilical muestran alteraciones significativas de las concentraciones plasmáticas de lípidos y lipoproteínas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.