El síndrome metabólico es un trastorno caracterizado por obesidad, hipertensión arterial, hipercolesterolemia, hiperlipidemia y alteraciones en el metabolismo de la glucosa, y constituye un factor de riesgo para el desarrollo de diabetes y enfermedades cardiovasculares. Las condiciones nutricionales, hormonales y metabólicas de la madre durante el embarazo y el posparto temprano pueden condicionar el desarrollo de enfermedades metabólicas en la vida adulta de los hijos. Este concepto, llamado “programación fetal”, sugiere la existencia de marcadores moleculares que permitirían estimar de forma temprana el riesgo de desarrollar síndrome metabólico e implementar medidas para prevenirlo. Este trabajo revisa el potencial de los microRNAs como biomarcadores para la detección temprana del síndrome metabólico dada su especificidad y estabilidad, su presencia en fluidos biológicos de obtención rutinaria en la clínica y su expresión temprana en diversas enfermedades.
Metabolic syndrome is a disorder characterised by obesity, hypertension, hypercholesterolemia, hyperlipidemia and alterations in glucose metabolism. It constitutes a risk factor for diabetes and cardiovascular disease development. Nutritional, hormonal and metabolic conditions of the mother during pregnancy and the early life of the offspring can determine metabolic disease development during the offspring's later life. This concept, called “fetal programming”, suggests the possibility of finding molecular markers to make early estimations for the risk of developing metabolic syndrome and of working on prevention strategies. This paper reviews the potential of microRNAs as early detection biomarkers for metabolic syndrome, given that they are specific and stable, are present in body fluids routinely obtained in clinics and have been found in early stages of several diseases.
El síndrome metabólico (SM) es un factor de riesgo para el desarrollo de hipertensión y diabetes, enfermedades con altos índices de morbilidad y mortalidad. El SM y sus consecuencias representan un alto costo socioeconómico, proporcional a su prevalencia.
Una línea de investigación sobre el SM es el estudio de los mecanismos de desarrollo del trastorno, dentro de los cuales destaca la “programación fetal”, derivada de la exposición del feto a determinadas condiciones durante etapas críticas del embarazo y el posparto inmediato, que implican mayor riesgo de adquirir algún padecimiento en la vida adulta1. En el caso del SM, el estado nutricional y metabólico de la madre puede incrementar el riesgo de desarrollar el síndrome en la vida adulta del hijo2.
La detección del SM en etapas tempranas permitiría mejorar las estrategias de prevención y tratamiento. Por ello, la búsqueda de biomarcadores tempranos de SM se ha vuelto un área de investigación muy activa. Entre los potenciales biomarcadores tempranos destacan los microRNAs (miRNAs), que ya han sido asociados a etapas iniciales del SM.
Este trabajo revisa la relevancia epidemiológica del SM, la relación entre la programación fetal y el trastorno en la vida adulta y la posible utilidad de emplear algunos miRNAs como biomarcadores tempranos del síndrome.
Síndrome metabólicoEl SM engloba una serie de disfunciones que incrementan el riesgo de enfermedades cardiovasculares, hipertensión y diabetes mellitus de tipo 2 (DM2), tres de las principales causas de atención médica y mortalidad en México. Los principales síntomas del trastorno incluyen dislipidemia, presión arterial alta, desregulación en la homeostasis de glucosa, obesidad abdominal y resistencia a insulina3. Se calcula que en la actualidad más de 17 millones de adultos en el país presentan SM, lo cual representa un verdadero reto para el sistema de salud4.
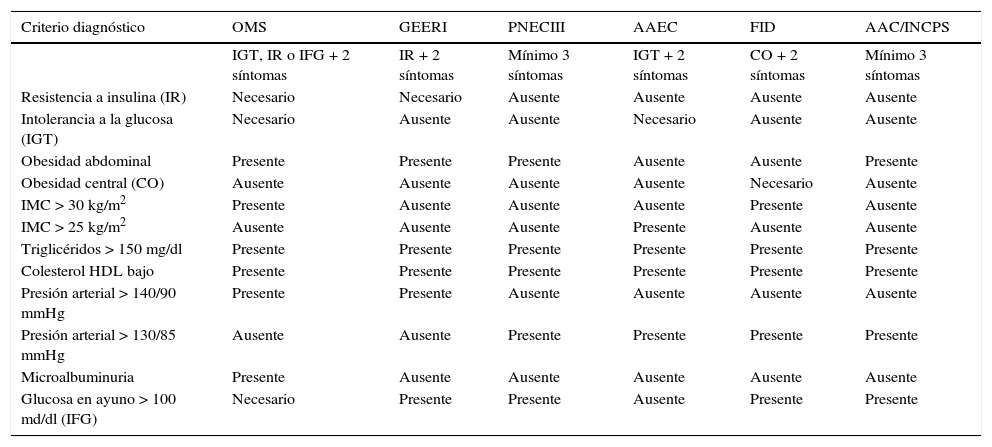
Existen diversos criterios para el diagnóstico del SM propuestos por organizaciones internacionales como la Organización Mundial de la Salud (OMS)5, el Grupo Europeo para el Estudio de la Resistencia a Insulina6 y la Federación Internacional de Diabetes7. Todas las definiciones del SM incluyen factores de disfunción en el metabolismo de la glucosa y los lípidos, sobrepeso u obesidad e hipertensión. No obstante, los parámetros para delimitar estos factores son diversos (Tabla 1). La definición que se use para diagnosticar el trastorno es un factor importante para calcular su prevalencia en una población específica8. Por ejemplo, utilizando los datos de adultos mexicanos mayores de 20 años que participaron en la Encuesta Nacional de Salud 2006, se calcularon prevalencias del síndrome de 36.8%, 41.6% y 49.8% usando tres definiciones diferentes4.
Criterios diagnósticos de síndrome metabólico por diversas organizaciones
| Criterio diagnóstico | OMS | GEERI | PNECIII | AAEC | FID | AAC/INCPS |
|---|---|---|---|---|---|---|
| IGT, IR o IFG + 2 síntomas | IR + 2 síntomas | Mínimo 3 síntomas | IGT + 2 síntomas | CO + 2 síntomas | Mínimo 3 síntomas | |
| Resistencia a insulina (IR) | Necesario | Necesario | Ausente | Ausente | Ausente | Ausente |
| Intolerancia a la glucosa (IGT) | Necesario | Ausente | Ausente | Necesario | Ausente | Ausente |
| Obesidad abdominal | Presente | Presente | Presente | Ausente | Ausente | Presente |
| Obesidad central (CO) | Ausente | Ausente | Ausente | Ausente | Necesario | Ausente |
| IMC > 30 kg/m2 | Presente | Ausente | Ausente | Ausente | Presente | Ausente |
| IMC > 25 kg/m2 | Ausente | Ausente | Ausente | Presente | Ausente | Ausente |
| Triglicéridos > 150 mg/dl | Presente | Presente | Presente | Presente | Presente | Presente |
| Colesterol HDL bajo | Presente | Presente | Presente | Presente | Presente | Presente |
| Presión arterial > 140/90 mmHg | Presente | Presente | Ausente | Ausente | Ausente | Ausente |
| Presión arterial > 130/85 mmHg | Ausente | Ausente | Presente | Presente | Presente | Presente |
| Microalbuminuria | Presente | Ausente | Ausente | Ausente | Ausente | Ausente |
| Glucosa en ayuno > 100 md/dl (IFG) | Necesario | Presente | Presente | Ausente | Presente | Presente |
AAC/INCPS: Asociación Americana del Corazón/Instituto Nacional del Corazón, los Pulmones y la Sangre; AAEC: Asociación Americana de Endocrinólogos Clínicos; FID: Federación Internacional de Diabetes; GEERI: Grupo Europeo para el Estudio de la Resistencia a Insulina; OMS; Organización Mundial de la Salud; PNECIII: Programa Nacional de Educación sobre el Colesterol – III Panel de Tratamiento de los Adultos.
A pesar de que la prevalencia del SM varía según los criterios empleados para definirlo, se ha observado un incremento constante en su diagnóstico a escala internacional, tanto en niños como en adultos; se predice que en el año 2025 el SM podría llegar a afectar al 40% de la población mundial9.
Programación fetal del síndrome metabólicoEl aumento en la prevalencia del SM ha llevado a invertir gran cantidad de recursos en la investigación de su etiología, diagnóstico y tratamiento. En el contexto de la etiología, desde mediados de la década de 1980 se han asociado síntomas tempranos del trastorno con la programación fetal10.
La programación fetal se refiere a la serie de condiciones que se presentan en un lapso crítico durante el desarrollo del feto, que pueden incrementar el riesgo de desarrollar trastornos metabólicos a lo largo de la vida11. Las evidencias sugieren que las condiciones nutricionales, hormonales y metabólicas de la madre gestante, así como el ambiente posparto temprano, pueden programar el desarrollo de enfermedades metabólicas en la vida adulta del hijo. Existen datos epidemiológicos que relacionan el peso o la talla al nacimiento con el riesgo subsecuente de desarrollar signos de SM, tales como resistencia a insulina y dislipidemia12,13.
Trabajos experimentales en animales han mostrado que se pueden inducir alteraciones características del SM, como hipertensión arterial, disfunción endotelial, hiperinsulinemia u obesidad, manipulando la nutrición materna durante el embarazo o al exponer a los animales gestantes a glucocorticoides sintéticos14.
El concepto de programación fetal implica la existencia de periodos críticos en el desarrollo humano, a saber: preimplantacional, gestación temprana, gestación media, gestación tardía y posnatal. En cada una de estas etapas el organismo es particularmente sensible a ciertas señales del ambiente, por lo cual los efectos de la programación fetal varían dependiendo del tipo de estrés y el momento en que este ocurre1.
Para analizar algunos de estos efectos en humanos se han estudiado poblaciones de niños concebidos por fecundación in vitro (FIV) como modelo de estrés preimplantacional. Se ha observado que los niños concebidos por FIV tienen un perfil metabólico distinto al de los niños concebidos de manera natural. Cabe destacar que esta diferencia se presenta desde el nacimiento, ya que los niños concebidos por FIV tienen un riesgo hasta 2.6 veces mayor de nacer con peso bajo15. Más aún, las consecuencias de la programación fetal se manifiestan más allá del nacimiento y la infancia temprana, puesto que jóvenes estudiados hasta los 18 años que fueron concebidos por FIV tienen parámetros más elevados del porcentaje de grasa corporal periférica, presión arterial y glucemia en ayuno, si los comparamos con jóvenes concebidos de forma natural16,17.
Se han estudiado diversos indicadores de estrés durante el desarrollo del feto, entre los cuales el peso bajo al nacer ha sido el más analizado. Sin embargo, no se puede considerar al peso bajo al nacer como la causa de los trastornos metabólicos, sino que los factores que producen bajo peso son los que podrían alterar el desarrollo metabólico y cardiovascular del feto2. El bajo peso al nacer se ha asociado con dislipidemia, hipertensión arterial, intolerancia a la glucosa y obesidad. Aunque es difícil hacer una asociación directa con el SM completo debido a las diferencias en los criterios de diagnóstico, se ha observado que el riesgo de presentar dos o más síntomas del SM es mayor en adultos que nacieron con peso bajo18.
Las evidencias que asocian indicadores fetales, como peso y talla, con el riesgo de desarrollar enfermedades en el futuro se siguen acumulando, pero se desconocen los mecanismos que llevan a presentar las distintas enfermedades en la edad adulta. El conocimiento de estos mecanismos permitiría desarrollar nuevas estrategias de prevención, que consideren tanto la predisposición causada por el estrés fetal como el estrés adicional en la vida posnatal. De acuerdo con esta visión, el desarrollo fetal predispone a enfermedades que solo se manifiestan si existe un estrés adicional en otra etapa de la vida. Un ejemplo podría ser la predisposición a la obesidad combinada con la ingesta de dietas hipercalóricas19.
Se han propuesto diferentes hipótesis para explicar los mecanismos de la programación fetal de las enfermedades de adultos, tales como alteraciones fisiológicas de órganos específicos, cambios en la expresión de factores de transcripción y modificaciones epigenéticas. Todos estos mecanismos se generarían durante el estrés fetal y, en conjunto, podrían explicar los efectos a largo plazo20.
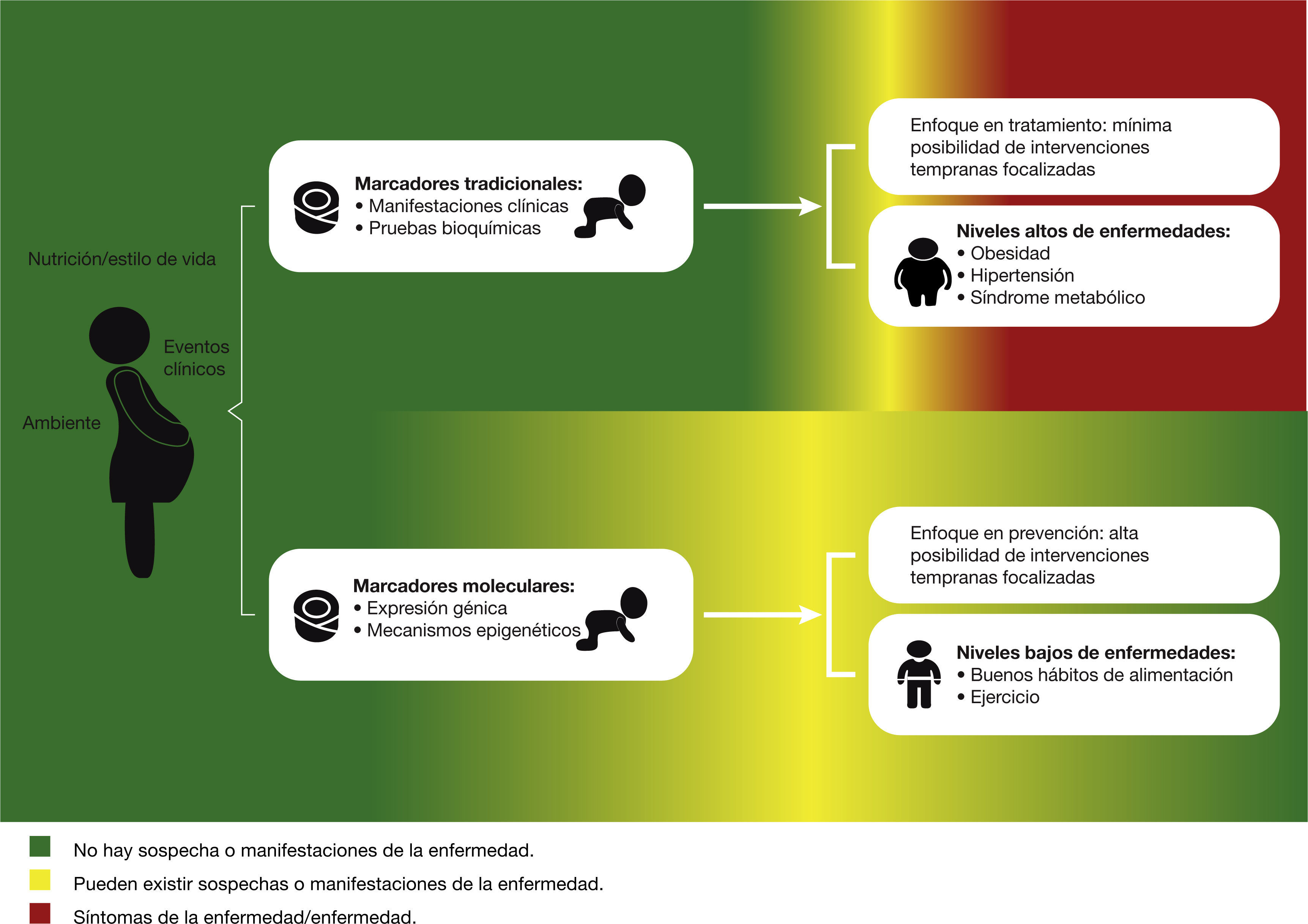
El conocimiento actual de la programación fetal sugiere que las intervenciones tempranas pueden ayudar a disminuir la incidencia del SM. Por lo tanto, el estudio de los mecanismos de programación fetal podría servir para identificar marcadores tempranos que permitan estimar el riesgo de una persona a desarrollar el trastorno. El uso de estos marcadores moleculares, como complemento a los marcadores tradicionales que se utilizan en la actualidad desde edades tempranas, ayudaría a prevenir el SM a través de un diagnóstico precoz (fig. 1), así como otras enfermedades asociadas, incluyendo las enfermedades cardiovasculares y la DM221.
Uso de marcadores moleculares como estrategia de prevención de síndrome metabólico y enfermedades asociadas. Las alteraciones moleculares relacionadas con el síndrome metabólico que ocurren durante el embarazo y el desarrollo fetal pueden detectarse en edades tempranas. El uso de marcadores moleculares permite identificar a las personas en riesgo, a diferencia de los marcadores tradicionales. Entonces, se puede ampliar el lapso de tiempo en el cual es posible realizar acciones de prevención.
Los biomarcadores son moléculas biológicas que al ser detectadas o cuantificadas pueden ayudar a evaluar un estado fisiológico. Las características deseables de los biomarcadores son tres: especificidad, sensibilidad y bajo costo. Los biomarcadores ideales también deberían ser estables a lo largo del tiempo y accesibles, de forma tal que se puedan obtener de forma mínimamente invasiva, por ejemplo a partir de líquidos corporales como pueden ser el suero y/o la orina22. Hay gran necesidad de biomarcadores estables, cuya expresión sea consistente con el desarrollo del SM, especialmente aquellos que sean observables en el periodo previo a la manifestación de síntomas, pues el diagnóstico temprano puede cambiar la evolución del trastorno y su progreso hacia otras enfermedades.
Los miRNAs son RNA pequeños, no codificantes de proteínas, que regulan la expresión génica de forma postranscripcional. Desde que se descubrió que la expresión de los miRNAs está alterada en enfermedades como el cáncer, se les ha propuesto como biomarcadores potenciales de diversas afecciones23.
Los miRNAs son un componente importante de la regulación postranscripcional, ya que se calcula que regulan hasta el 30% de los genes24. Por lo tanto, es poco probable que sean solo productos del estado patogénico; es factible que tengan una función en el desarrollo mismo de la enfermedad, ya que están implicados en redes de regulación25.
Los miRNAs tienen ventajas que los hacen candidatos atractivos como biomarcadores. La primera es que son metabólicamente estables en diferentes tejidos y líquidos biológicos, incluyendo suero, plasma y orina26,27. Además, pueden ser específicos para diferentes tejidos y etapas de la enfermedad, como se ha observado en estudios oncológicos28.
Por lo anterior, es probable que la presencia de miRNAs en líquidos biológicos refleje el estado fisiológico o las condiciones patológicas. Incluso es posible que la información obtenida con el análisis de miRNAs sea más exacta que con RNA mensajeros, ya que estos necesitan traducirse a proteínas para realizar la función final, mientras que los miRNAs son en sí mismos las moléculas activas29. Otra ventaja de los miRNAs es que pueden funcionar como marcadores tempranos, pues se cree que la desregulación generada por los miRNAs está presente desde el inicio de las enfermedades.
MicroRNAs como biomarcadores tempranosMuchos estudios para el empleo de los miRNAs como marcadores se han realizado en diferentes tipos de cánceres, donde se han observado alteraciones en los niveles de miRNAs circulantes y han sido propuestos como marcadores para la detección temprana de estos padecimientos30–32. También se han realizado estudios en enfermedades infecciosas como la tosferina, una enfermedad cuyos métodos tradicionales de detección son laboriosos y tardados. Un estudio reciente encontró que, en conjunto, los miRNAs miR-202, miR-576-5p, miR-342-5p, miR-487b y miR-206, pueden ser útiles para diagnosticar tosferina con un 97.4% de sensibilidad y 94.3% de especificidad33.
También se han propuesto los miRNAs como marcadores tempranos de enfermedades o condiciones fisiológicas alteradas, incluyendo trastornos metabólicos y el embarazo34. Aunque en todos los casos mencionados ya se encuentra presente el estado patológico, los miRNAs pueden ser útiles como biomarcadores en etapas más tempranas, antes de que existan síntomas o incluso la sospecha de enfermedad. Por ejemplo, se ha sugerido que el miR-21 es un marcador de rinitis alérgica que se puede medir desde el nacimiento y se mantiene al menos hasta los 6 años de edad35.
MicroRNAs y síndrome metabólicoDiversas investigaciones relacionan algunos factores tempranos del SM con cambios en la expresión de miRNAs. Tal es el caso de miR-124a36 y miR-37537, que se expresan desde la gestación durante la diferenciación de las células beta pancreáticas. Otro ejemplo interesante es el proceso de adipogénesis, que en caso de alterarse puede ser un componente inicial de obesidad. Sobre el papel de la expresión de miRNAs durante la adipogénesis se han hecho revisiones exhaustivas38,39, de las cuales se puede resaltar el papel de miR-27 y miR-519d, que tienen como blanco genes clave en la diferenciación adiposa.
Además de los estudios a nivel celular se ha propuesto una hipótesis para el uso de miRNAs como marcadores tempranos de arterioesclerosis en niños obesos con SM. Aun cuando en este estudio pretenden analizar los miRNAs de niños que ya han desarrollado SM, su estudio podría dar resultados interesantes sobre la desregulación de los miRNAs en la infancia40.
En pacientes adultos se ha investigado la utilidad del análisis de miRNAs en alteraciones relacionadas con el SM. Por ejemplo, para detectar el grado del daño al corazón en enfermedades cardiovasculares41 o para generar patrones característicos de prediabetes y diabetes42. A pesar de los estudios que revelan la posibilidad de identificar miRNAs en etapas tempranas de las alteraciones metabólicas, se ha investigado poco la relación de los miRNAs con la programación fetal del SM.
Un estudio reciente de Ferland-McCollough y cols.43 abordó el papel de los miRNAs en la programación fetal de la DM2. En este análisis, los cambios en la expresión de miRNAs se asociaron con la nutrición durante las primeras etapas de la vida y la salud a largo plazo. La sobreexpresión de miR-483-3p se encontró en el tejido adiposo de adultos que nacieron con bajo peso, por lo que se realizó un estudio controlado en ratas. Se expuso a las ratas a mala nutrición durante el principio de su vida y eventualmente estas desarrollaron prediabetes y sobreexpresaron el miR-483-3p.
El miR-483-3p modula la capacidad de los adipocitos para diferenciarse y almacenar lípidos. El aumento en la expresión de este miRNA parece dar por resultado una programación fetal que limita el almacenamiento de lípidos en el tejido adiposo, asociada a lipotoxicidad y resistencia a insulina, alteraciones que eventualmente aumentan la predisposición a enfermedades metabólicas43.
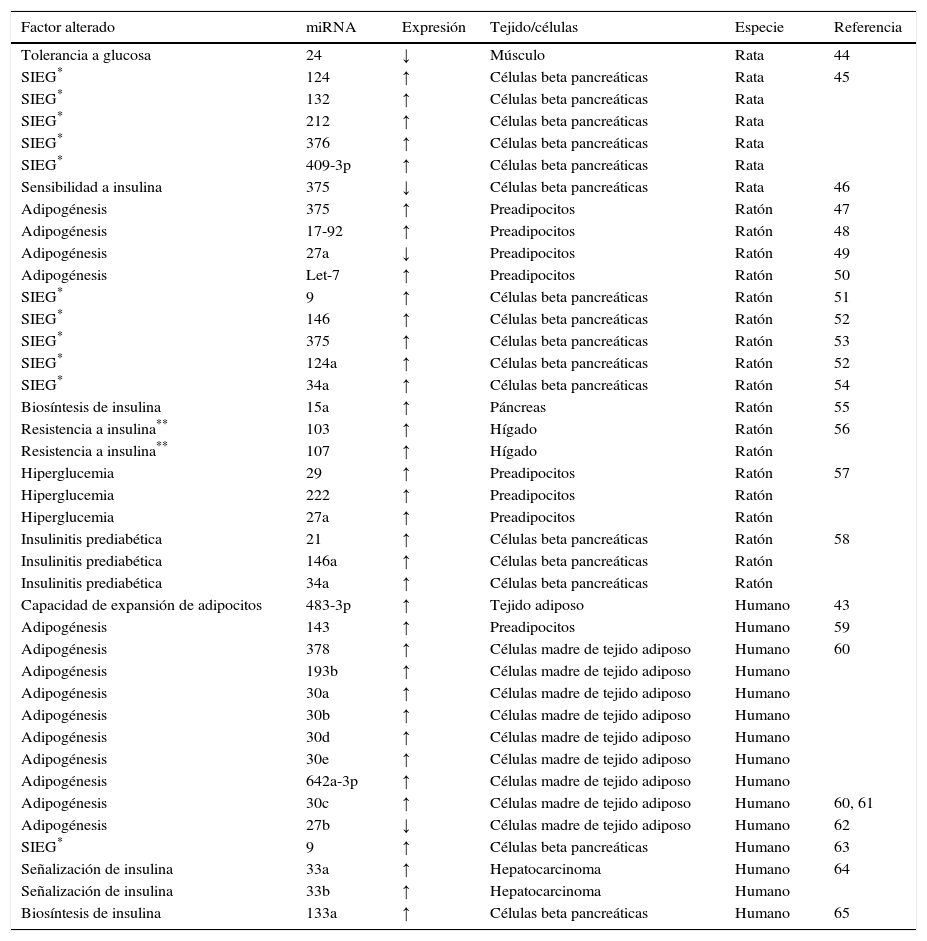
Hasta ahora todos los estudios sobre modificaciones en miRNAs se han realizado en animales o en personas adultas, pero no en poblaciones pediátricas. Una serie de miRNAs son atractivos como biomarcadores tempranos del SM (Tabla 2), pues han sido asociados a factores iniciales del síndrome y podrían participar en la programación fetal del mismo.
MicroRNAs en etapas tempranas del síndrome metabólico
| Factor alterado | miRNA | Expresión | Tejido/células | Especie | Referencia |
|---|---|---|---|---|---|
| Tolerancia a glucosa | 24 | ↓ | Músculo | Rata | 44 |
| SIEG* | 124 | ↑ | Células beta pancreáticas | Rata | 45 |
| SIEG* | 132 | ↑ | Células beta pancreáticas | Rata | |
| SIEG* | 212 | ↑ | Células beta pancreáticas | Rata | |
| SIEG* | 376 | ↑ | Células beta pancreáticas | Rata | |
| SIEG* | 409-3p | ↑ | Células beta pancreáticas | Rata | |
| Sensibilidad a insulina | 375 | ↓ | Células beta pancreáticas | Rata | 46 |
| Adipogénesis | 375 | ↑ | Preadipocitos | Ratón | 47 |
| Adipogénesis | 17-92 | ↑ | Preadipocitos | Ratón | 48 |
| Adipogénesis | 27a | ↓ | Preadipocitos | Ratón | 49 |
| Adipogénesis | Let-7 | ↑ | Preadipocitos | Ratón | 50 |
| SIEG* | 9 | ↑ | Células beta pancreáticas | Ratón | 51 |
| SIEG* | 146 | ↑ | Células beta pancreáticas | Ratón | 52 |
| SIEG* | 375 | ↑ | Células beta pancreáticas | Ratón | 53 |
| SIEG* | 124a | ↑ | Células beta pancreáticas | Ratón | 52 |
| SIEG* | 34a | ↑ | Células beta pancreáticas | Ratón | 54 |
| Biosíntesis de insulina | 15a | ↑ | Páncreas | Ratón | 55 |
| Resistencia a insulina** | 103 | ↑ | Hígado | Ratón | 56 |
| Resistencia a insulina** | 107 | ↑ | Hígado | Ratón | |
| Hiperglucemia | 29 | ↑ | Preadipocitos | Ratón | 57 |
| Hiperglucemia | 222 | ↑ | Preadipocitos | Ratón | |
| Hiperglucemia | 27a | ↑ | Preadipocitos | Ratón | |
| Insulinitis prediabética | 21 | ↑ | Células beta pancreáticas | Ratón | 58 |
| Insulinitis prediabética | 146a | ↑ | Células beta pancreáticas | Ratón | |
| Insulinitis prediabética | 34a | ↑ | Células beta pancreáticas | Ratón | |
| Capacidad de expansión de adipocitos | 483-3p | ↑ | Tejido adiposo | Humano | 43 |
| Adipogénesis | 143 | ↑ | Preadipocitos | Humano | 59 |
| Adipogénesis | 378 | ↑ | Células madre de tejido adiposo | Humano | 60 |
| Adipogénesis | 193b | ↑ | Células madre de tejido adiposo | Humano | |
| Adipogénesis | 30a | ↑ | Células madre de tejido adiposo | Humano | |
| Adipogénesis | 30b | ↑ | Células madre de tejido adiposo | Humano | |
| Adipogénesis | 30d | ↑ | Células madre de tejido adiposo | Humano | |
| Adipogénesis | 30e | ↑ | Células madre de tejido adiposo | Humano | |
| Adipogénesis | 642a-3p | ↑ | Células madre de tejido adiposo | Humano | |
| Adipogénesis | 30c | ↑ | Células madre de tejido adiposo | Humano | 60, 61 |
| Adipogénesis | 27b | ↓ | Células madre de tejido adiposo | Humano | 62 |
| SIEG* | 9 | ↑ | Células beta pancreáticas | Humano | 63 |
| Señalización de insulina | 33a | ↑ | Hepatocarcinoma | Humano | 64 |
| Señalización de insulina | 33b | ↑ | Hepatocarcinoma | Humano | |
| Biosíntesis de insulina | 133a | ↑ | Células beta pancreáticas | Humano | 65 |
*SIEG: Secreción de insulina estimulada por glucosa.
**Inducida por obesidad.
↑ Sobreexpresión; ↑ Subexpresión.
Numerosas evidencias relacionan la programación fetal con el desarrollo de trastornos metabólicos y sugieren la posibilidad de encontrar biomarcadores tempranos de dichos trastornos. Los miRNAs tienen potencial como biomarcadores tempranos que pueden encontrarse alterados en etapas tempranas del desarrollo del trastorno del SM. Si efectivamente pueden identificarse como biomarcadores tempranos en neonatos y lactantes, podría servir para llevar a cabo intervenciones preventivas en etapas muy tempranas de la vida de las personas en riesgo. Hasta el momento, los miRNAs asociados tempranamente al SM se han encontrado en líneas celulares o en adultos. Su estudio en niños y neonatos representa una oportunidad interesante para identificar biomarcadores del SM en etapas tempranas de la vida.
Este trabajo se realizó con apoyo financiero de FOMIX-SLP (FMSLP-2012-C01-195024). SPRG contó con una beca del Consejo Nacional de Ciencia y Tecnología (CONACYT-279196). Agradecemos a los Drs. Rubén López Revilla y Lina Riego Ruiz (IPICYT) sus valiosos comentarios.