Desde la autorización, en 1995, de una vacuna contra la hepatitis A, los Centers for Disease Control and Prevention (CDC) y la American Academy of Pediatrics (AAP) han instaurado una estrategia creciente de vacunación de los niños contra la hepatitis A. En 1996, el objetivo de la vacunación fue la población infantil que vivía en poblaciones con las máximas tasas de enfermedad, y en 1999, el programa se amplió a la vacunación de los niños de 2 o más años de edad que vivían en estados y condados con tasas de hepatitis A históricamente mayores que la media nacional. El programa de 1999 tuvo éxito; la tasa actual de hepatitis A es la mínima de las notificadas en Estados Unidos. Se han eliminado las diferencias regionales, étnicas y raciales de la incidencia de la hepatitis A. La incidencia de la hepatitis A en los adultos ha disminuido significativa-mente en los estados con vacunación, lo que sugiere un potente efecto de la inmunidad colectiva asociado con la vacunación. En 2005, la US Food and Drug Administration (FDA) disminuyó la edad mínima aprobada para la administración de la vacuna contra la hepatitis A de 24 a 12 meses de edad, lo que facilitó la incorporación de la vacuna a la pauta recomendada de vacunación infantil. Como paso siguiente en la ampliación de la estrategia de vacunación, la AAP recomienda ahora la administración rutinaria de una vacuna contra la hepatitis A autorizada por la FDA a todos los niños de 12 a 23 meses de edad y en todos los estados, siguiendo una pauta de administración aprobada por los CDC.
Los datos disponibles indican que la vacuna contra la hepatitis A puede coadministrarse con otras vacunas infantiles sin disminuir la capacidad inmunógena. Las vacunas contra la hepatitis A han demostrado una seguridad extrema. En los ensayos clínicos previos a la autorización de Havrix (GlaxoSmithKline, Rixensart, Bélgica) y de Vaqta (Merck & Co Inc, Whitehouse Station, NJ), los acontecimientos adversos fueron infrecuentes y leves cuando se produjeron, resolviéndose típicamente en menos de 1 día. La vacuna contra la hepatitis A está contraindicada en las personas con una historia de grave reacción alérgica a una dosis anterior de vacuna contra la hepatitis A o a un componente de la vacuna. Como la vacuna contra la hepatitis A es un producto inactivado, no son necesarias precauciones especiales para la administración a personas inmunodeprimidas. No existen datos acerca de la administración de la vacuna contra la hepatitis A a mujeres embarazadas, pero al no ser una vacuna viva, el riesgo para la madre y el feto debe ser sumamente escaso o nulo.
GENERALIDADES Y FUNDAMENTOS DE LAS RECOMENDACIONESEl objetivo de este informe es ofrecer el fundamento y las recomendaciones para la administración universal de la vacuna contra la hepatitis A a los niños que viven en Estados Unidos. El fundamento de la instauración de la vacunación universal se basa en varias consideraciones. Durante los 15 años precedentes a la disponibilidad de las vacunas contra la hepatitis A (1980-1995) se notificaron unos 30.000 casos anuales de infecciones sintomáticas por hepatitis A (enfermedad) en Estados Unidos1. Dada la infranotificación y el gran número de infecciones asintomáticas en los niños pequeños, el número real de casos anuales se calculó en cerca de 300.000 en Estados Unidos1. La FDA autorizó la primera vacuna inactivada contra la hepatitis A (Havrix [GlaxoSmithKline, Rixensart, Bélgica]) en 1995 y un segundo producto (Vaqta [Merck & Co Inc, Whitehouse Station, NJ]) en 1996. La autorización inicial limitó el empleo a personas de 2 o más años de edad. Con la disponibilidad de una vacuna contra la hepatitis A, la infección pasó a ser una de las infecciones más comunes evitable mediante vacuna en Estados Unidos.
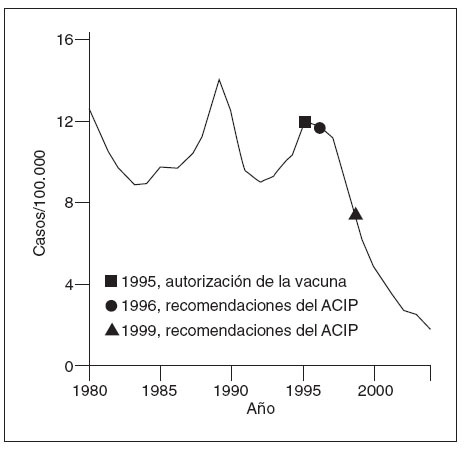
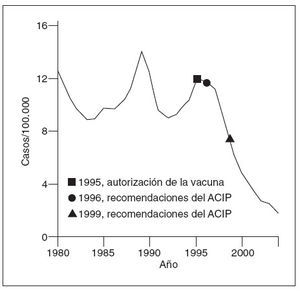
En 1996, los CDC y la AAP presentaron una guía para el empleo de la vacuna contra la hepatitis A2,3. Como parte de una estrategia de aumento, se recomendó el empleo de la vacuna en grupos específicos de alto riesgo, incluyendo a los niños de 2 o más años de edad que viven en comunidades definidas y circunscritas con grandes tasas endémicas o brotes periódicos, a personas con hepatopatía crónica, a varones con relaciones homosexuales, a consumidores de drogas ilícitas y a personas con riesgos laborales que les colocan en mayor riesgo de contraer la hepatitis A2. Pese a la instauración de la parte inicial de la estrategia, la hepatitis A siguió siendo una de las enfermedades evitables mediante vacuna con mayor frecuencia de notificación, informándose más de 23.000 casos en 1996 (fig. 1). En 1999, los CDC ampliaron el programa de vacunación contra la hepatitis A para incluir a los niños que vivían en estados, condados y comunidades con tasas de hepatitis A considerablemente mayores que la media nacional entre 1987 y 19974. Se aconsejó a 11 estados con una tasa al menos del doble de la media nacional (µ 20 casos/ 100.000 habitantes) que “recomendasen” la vacunación de los niños a los 2 años de edad, y a otros 6 estados (10-20 casos/100.000 habitantes) que “considerasen” la vacunación de los niños4.
Fig. 1. Incidencia de hepatitis A, Estados Unidos, 1980-2004. ACIP: Advisory Committee on Immunization Practices de los Centers for Disease Control and Prevention.
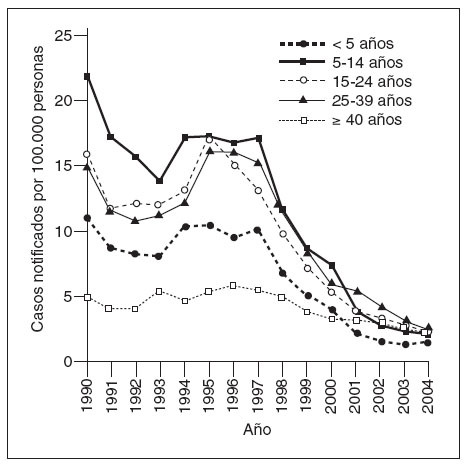
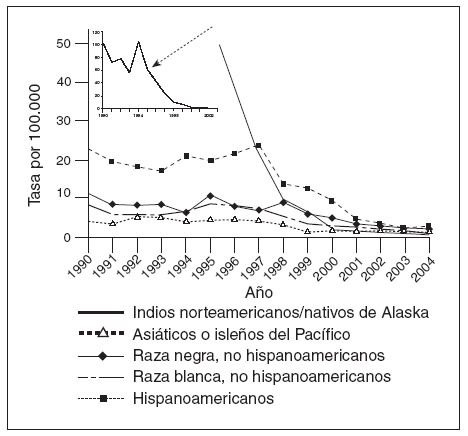
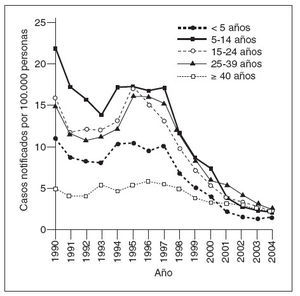
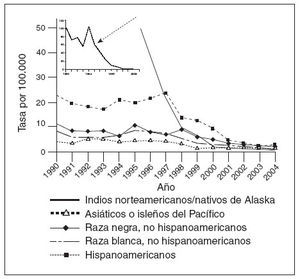
Coincidiendo con la instauración de la recomendación de 1999, las tasas de hepatitis A disminuyeron a las mínimas tasas registradas en Estados Unidos, y en 2003, fueron inferiores en un 76% a las anteriores al inicio de la vacunación, en 19965 (fig. 1). Antes de la vacunación contra la hepatitis A, la incidencia era máxima en los niños pequeños y en las comunidades de indios norteame-ricanos/nativos de Alaska y de hispanoamericanos5 (figs. 2 y 3). Sin embargo, desde 1999, estas diferencias de incidencia por edad, etnia y región prácticamente han sido eliminadas (figs. 2 y 3). En 2003-2004, las tasas de hepatitis A fueron máximas en los varones de 18 a 39 años de edad que residían en los 17 estados que no fueron aconsejados, en 1999, a vacunar contra el virus de la hepatitis A (estados no vacunadores).
Fig. 2. Incidencia de hepatitis A por edad, Estados Unidos, 1990-2004.
Fig. 3. Incidencia de hepatitis A por raza/etnia, 1990-2004.
Otro hallazgo asociado con la instauración de la vacunación de los niños contra la hepatitis A fue la importante disminución de la incidencia de la enfermedad en los adultos, lo que sugiere un potente efecto de inmunidad colectiva del programa de vacunación6. Se han notificado hallazgos similares en Israel, donde a los 2 años del inicio de la vacunación rutinaria contra la hepatitis A de los niños de 18 a 24 meses de edad se observó una disminución del 90% de la enfermedad por hepatitis A en los adultos de todo el país7. Estos datos indican que la administración rutinaria de la vacuna contra la hepatitis A a los niños pequeños ejercerá un importante efecto sobre la incidencia de la enfermedad en el resto de la población.
El éxito de la estrategia provisional de 1999 brindó la oportunidad de considerar la vacunación universal de los lactantes de Estados Unidos contra el virus de la hepatitis A. La FDA aprobó, en 2005, el empleo de la vacuna contra la hepatitis A en los niños de incluso 12 meses de edad, lo que permite su incorporación a la pauta recomendada de vacunación infantil temprana. Esta aprobación se siguió de la reciente recomendación de los CDC de la administración rutinaria de la vacuna contra la hepatitis A a todos los niños de 12 o más meses de edad, sea cual sea su estado de residencia8. El que la coadministración de las vacunas contra la hepatitis A con otras inmunizaciones rutinarias no se haya asociado con una alteración de la inmunidad inducida por la vacuna también ayuda a la incorporación de la vacuna a la pauta rutinaria de vacunación infantil. Además, la equiparación de las tasas de enfermedad entre las regiones y entre los grupos étnicos en Estados Unidos impide la sostenibilidad de un programa vacunal basado en el fundamento utilizado para instaurar la estrategia provisional. La ampliación del programa a la vacunación rutinaria nacional de los lactantes resultaría en una nueva disminución de la incidencia de la enfermedad en el país y posiblemente conduciría a la eliminación final de la infección indígena por hepatitis A en Estados Unidos.
EPIDEMIOLOGÍAIncidencia y prevalenciaEl virus de la hepatitis A tiene una distribución mundial, aunque la prevalencia de la infección varía considerablemente según las condiciones higiénicas y sanitarias. En áreas con hacinamiento, acceso limitado al agua limpia y sistema de alcantarillado inadecuado, la infección por hepatitis A aparece de forma casi universal en las personas a edad temprana. Como la mayoría de los niños pequeños que contraen la hepatitis A son asintomáticos, las tasas de enfermedad en áreas muy endémicas del mundo son bajas. Aunque los adultos seronegativos de estas áreas del mundo corren grave riesgo de infección y enfermedad, los brotes son poco frecuentes por la gran prevalencia de anticuerpos al virus de la hepatitis A en la población9. También se observan grandes patrones de endemia en regiones geográficas o grupos étnicos de los países desarrollados, incluyendo a Estados Unidos antes de esta década10-12.
Históricamente, la incidencia de la enfermedad por hepatitis A ha sido de naturaleza cíclica. En los países desarrollados con climas templados, la incidencia ha mostrado, en general, picos cada 10 o 15 años. Espectaculares disminuciones de las tasas de infección por el virus de la hepatitis A durante la década anterior y después de la autorización de la primera vacuna contra la hepatitis A han amortiguado significativamente este patrón epidémico en Estados Unidos5,13. En la era prevacunal, las tasas de infección por hepatitis A eran máximas entre los niños pequeños y los indios nortea-mericanos/nativos de Alaska y las personas hispanoamericanas; estas diferencias prácticamente habían desaparecido en 20065. El éxito del programa de la vacunación contra la hepatitis A ha resultado en la virtual eliminación de las diferencias de edad, étnicas, raciales y regionales en la incidencia de la infección por hepatitis A durante la última década5,14.
Modo de transmisiónLas personas, los grandes simios y algunas especies de monos pueden ser infectados por el virus de la hepatitis A. La fuente principal de hepatitis A en la transmisiónhumana es el contagio interpersonal a través de la vía fecal oral. En raras ocasiones, la infección por la hepatitis A ha sido transmitida por la transfusión de sangre o productos sanguíneos tomados de donantes durante la fase viré-mica de la infección15,16. Desde 2002 se han aplicado pruebas de amplificación de ácido nucleico, como la determinación por reacción en cadena de la polimerasa (PCR), para el estudio sistemático del plasma utilizado en la fabricación de productos derivados del plasma17.
La transmisión suele limitarse a los contactos estrechos, y la hepatitis A raras veces se contagia por interacciones casuales. El contagio de la hepatitis A en las familias es habitual, y la enfermedad aparece con mayor frecuencia en los miembros ancianos de la familia tras ser introducida en el domicilio por un niño pequeño con una infección asintomática12. En los brotes de las guarderías, el contacto con las deposiciones y el posterior contacto personal son medios importantes de contagio, y se han producido casos en los trabajadores de la guardería y en miembros del domicilio de los niños que acuden a ella18,19. El contagio de la hepatitis A por los alimentos puede producirse por alimentos contaminados durante la preparación por un manipulador infectado (alimentos no cocinados tras la preparación, como ensaladas o bocadillos) o durante el crecimiento o el procesado (p. ej., productos agrícolas), pero este modo de transmisión produce una proporción relativamente pequeña de casos de hepatitis A notificados en Estados Unidos20. Los brotes por agua son raros en los países desarrollados con sistemas sanitarios adecuados. Cerca de la mitad de las personas con infección esporádica por hepatitis A contraída en la comunidad carece de una fuente conocida de infección12,13,21.
Las deposiciones de una persona infectada por el virus de la hepatitis A muestran su máxima infecciosidad entre unos 14 a 21 días antes y cerca de 8 días después del inicio de la ictericia22. Se ha informado que el ARN de la hepatitis A es detectable en las deposiciones mediante la PCR hasta 3 meses después de la enfermedad aguda23, y que los niños pueden excretar el virus de la hepatitis A hasta 10 semanas después del inicio de la enfermedad clínica24. Aunque el virus de la hepatitis A no se excreta de forma crónica, pueden aparecer recidivas clínicas entre el 10% y el 15% de los pacientes, que pueden estar asociadas con la recurrencia de la excreción del virus por las heces25,26. El virus de la hepatitis A se puede detectar en el suero durante el período de ictericia y aumento de las enzimas hepáticas, lo que es compatible con la posible transmisión de la infección por vía sanguínea15.
La hepatitis A es la enfermedad evitable mediante vacuna más importante en los viajeros. El riesgo de hepatitis A es de 4 a 30 casos por 100.000 meses de estancia en un área con hepatitis A endémica en los viajeros no vacunados contra la hepatitis A27. En 2003, los viajes internacionales fueron el origen de la hepatitis A en más del 25% de los casos de niños menores de 15 años de edad. Aunque ni los padres ni el médico del niño lo suelen considerar un viaje internacional, la visita a familiares que viven en áreas con hepatitis A endémica constituye un origen frecuente de los casos notificados en Estados Unidos28. Se ha producido la diseminación del virus de la hepatitis A en guarderías por la exposición a niños que han contraído la hepatitis A tras visitar los países de nacimiento de sus padres.
MANIFESTACIONES CLÍNICAS DE LA ENFERMEDADEl virus de la hepatitis A es un virus ARN de la familia Picornaviridiae. Este virus infecta al hígado, y la infección puede ser ictérica o anictérica. La probabilidad de infección ictérica (clínicamente evidente) muestra una relación inversa con la edad de la persona que contrae la hepatitis A. En los niños menores de 6 años de edad, más del 90% de las infecciones por hepatitis A son asintomáticas. Por el contrario, más de dos terceras partes de los niños mayores y los adultos desarrollarán ictericia tras la infección por hepatitis A29. Estas estadísticas explican por qué los brotes de hepatitis A en las guarderías suelen ser detectados por primera vez cuando los contactos adultos presentan ictericia30.
El virus de la hepatitis A es resistencia al ácido, lo que le permite pasar por el estómago hasta el intestino delgado. Tras un período de incubación de 28 días31 (límites: 15-50 días), las personas infectadas suelen presentar síntomas vagos e inespecíficos. Uno de los primeros síntomas por el que se suele solicitar asistencia médica es la orina oscura, suele estar precedida de una enfermedad prodrómica leve de 1 a 7 días, que puede consistir en anorexia, malestar, fiebre, náuseas y vómi-32,33. Pocos días después del inicio de la bilirrubinuria, las heces toman color de arcilla y la esclerótica, la piel y las membranas mucosas muestran ictericia. La exploración física detecta una hepatomegalia. La alteración del color de las heces se resuelve al cabo de 2 a 3 semanas, lo que con frecuencia indica la resolución de la enfermedad. El prurito es poco frecuente. La duración de la enfermedad es variable, pero la mayoría de los pacientes se encuentra mucho mejor al cabo de 3 a 4 semanas, incluyendo la resolución de las elevadas concentraciones de enzimas hepatocelulares. En las mujeres estadounidenses, el embarazo no constituye un factor de riesgo de infecciones más graves por el virus de la hepatitis A. Aunque la transmisión al feto no es habitual, se han publicado dos casos clínicos en los que la madre desarrolló hepatitis A durante el primer trimestre del embarazo y sus hijos desarrollaron posteriormente peritonitis meconial34,35. El riesgo de transmisión de una mujer que desarrolle hepatitis A en el tercer trimestre del embarazo a su hijo parece ser escaso36. Los lactantes infectados por este medio están típicamente asintomáticos, pero se ha publicado un brote entre el personal hospitalario relacionado con la exposición a estos lactantes37.
Los efectos anatomopatológicos de la hepatitis A se limitan al hígado. Como el virus replica en las células hepáticas, los viriones pasan de los hepatocitos infectados a los sinusoides hepáticos y a los canalículos biliares, y desde allí al intestino y se excretan por las heces. La infecciosidad máxima se produce durante las 2 semanas previas al inicio de la ictericia o el aumento de las enzimas hepáticas en el suero38. La viremia se produce poco después de contraer la infección y persiste durante el período de elevadas concentraciones de enzimas hepatocelulares, pero las concentraciones virales sanguíneas son mucho menores que las fecales39.
COMPLICACIONESCerca del 10% al 15% de los pacientes con enfermedad atribuible a hepatitis A tienen una enfermedad recidivante de hasta 6 meses de duración, y cerca del 20% de estas personas presentan numerosas recidivas25,40. Durante la recidiva se puede detectar el virus de la hepatitis A en las heces de algunos pacientes25,26. Los resultados globales son muy buenos, incluso en la enfermedad recidivante26,41. Los hallazgos clínicos, de laboratorio y anatomopatológicos en personas con ictericia prolongada se asocian con una hepatitis colestática. Una tanda corta de corticoides, con disminución rápida, puede reducir los síntomas y acelerar la resolución de la enfermedad42.
La infección por hepatitis A raras veces provoca la muerte. Antes del reciente éxito con la vacunación contra la hepatitis A en Estados Unidos había unas 100 muertes anuales por infecciones por el virus de la hepatitis A en este país. Las tasas de mortalidad de caso notificadas en las infecciones virales por hepatitis A oscilan entre el 0,01% y el 2%. La infección fulminante por el virus de la hepatitis A se caracteriza por una creciente gravedad de la ictericia, un deterioro de la función hepática, problemas de la coagulación y encefalopatía. La enfermedad fulminante es más común en las personas de más de 50 años de edad43 y en pacientes con hepatopatía crónica, incluyendo las infecciones crónicas por hepatitis B o hepatitis C44-46. En los niños pueden producirse infecciones graves, incluso fatales, por el virus de la hepatitis 47,48, aunque con menos frecuencia que en las personas con estos otros factores de riesgo. La recuperación espontánea se produce en el 30% a 60% de las personas con enfermedad fulminante por el virus de la hepatitis A, y los supervivientes recuperan por completo la función hepática. El pronóstico está influido por la edad, los valores de los factores de coagulación, la etapa del coma y la presencia de una enfermedad renal.
VACUNADescripciónLas vacunas contra la hepatitis A autorizadas en Estados Unidos son inactivadas, de célula viral completa, producidas a partir de virus de la hepatitis A cultivados en fibroblastos diploides humanos. Existen 2 vacunas de un solo antígeno, Vaqta49 y Havrix50, y una vacuna combinada contra la hepatitis A/hepatitis B, Twinrix (GlaxoSmithKline, Rixensart, Bélgica). Una vez adaptado el virus de la hepatitis A al crecimiento en el cultivo celular, se atenúa. Luego, el virus purificado se inactiva en formalina y se absorbe en hidróxido alumínico51 (alumbre). Havrix y Twinrix tienen como conservante 2-fe-noxietanol, y Vaqta carece de conservante. Todas las preparaciones de vacuna contra la hepatitis A se administran por vía intramuscular. Ninguna vacuna contra la hepatitis A autorizada en Estados Unidos ha contenido jamás timerosal.
La actividad de la vacuna en Havrix se mide frente a un patrón mediante un análisis enzimático ligado a inmunoabsorbente, por lo que se expresa en unidades del análisis enzimático ligado a inmunoabsorbente (ELU). El contenido en antígeno de Vaqta se expresa en unidades (U) del antígeno de la hepatitis A. La dosis pediátri-ca/adolescente (12 meses-18 años) de Havrix es 0,5 ml y contiene unas 720 ELU de antígeno de la hepatitis A, y la formulación para adultos, de 1 ml, contiene unas 1.440 ELU de antígeno de la hepatitis A. Vaqta también se administra en 2 formulaciones, una para utilizar en niños de 12 meses a 18 años de edad y otra para utilizar en personas de 19 o más años de edad. Twinrix contiene una combinación de antígeno de la hepatitis A (720 ELU) y antígeno de la hepatitis B (20 µg) y se administra como una serie de 3 dosis en una pauta a los 0, 1 y 6 meses. En Estados Unidos, Twinrix sólo está autorizada para su administración a personas de 18 o más años de edad. Al finalizar la serie de 3 dosis de Twinrix, la capacidad inmunógena a la hepatitis A y la hepatitis B es equivalente a la de personas que recibieron vacunas de un solo antígeno administradas por separado, según las pautas habituales52.
Capacidad inmunógenaAl mes de recibir la primera dosis de una vacuna contra la hepatitis A, el 97% de los niños y adolescentes y el 95% de los adultos desarrolló concentraciones protectoras de anticuerpos, y la segunda dosis resultó en la protección de virtualmente el 100% de las personas contra la infección53. Aunque los datos son limitados, la vacuna tiene menor capacidad inmunógena en los pacientes con hepatopatía crónica, las personas inmunodeprimidas, los receptores de trasplante y las personas ancianas. Dada la gran tasa de seroconversión en los niños sanos y la insensibilidad de las determinaciones habituales, no se recomienda el estudio de los anticuerpos tras la vacunación.
Los datos acerca de la respuesta inmunológica al administrar las vacunas contra la hepatitis A junto con otras vacunaciones rutinarias de la infancia son limitados. No obstante, los datos disponibles indican que la administración simultánea de la vacuna contra la hepatitis A y los toxoides diftérico y tetánico y la tos ferina acelular (DTaP), el virus de la poliomielitis (oral e inactivado), las vacunas contra Haemophilus influenzae tipo b (Hib), la hepatitis B o la triple viral (MMR) no modifica la capacidad inmunógena ni la de producir reacciones adversas54. No disponemos de datos acerca de la administración simultánea de la vacuna contra la hepatitis A y la conjugada neumocócica (Prevnar [Wyeth Pharmaceuticals, Madison, NJ]), pero no hay razón para asumir que existan interacciones entre las vacunas.
Aunque las vacunas que contienen virus de la hepatitis A estimulan eficazmente la producción de anticuerpos, las concentraciones de anticuerpos alcanzadas tras la vacunación son de 10 a 100 veces menores que las observadas tras una infección natural55. Además, muchas determinaciones comerciales carecen de la sensibilidad suficiente para detectar la presencia de anticuerpos contra el virus de la hepatitis A provocados por la vacuna56. Así pues, las personas vacunadas contra el virus de la hepatitis A pueden estar protegidas contra la infección pero tener unos anticuerpos negativos en las determinaciones habituales.
Eficacia y efectividadSe han realizado dos grandes ensayos para evaluar la eficacia de la vacuna contra la hepatitis A en los niños. Uno, realizado en Tailandia, incluyó a más de 38.000 niños de 1 a 16 años de edad, que fueron asignados aleatoriamente a recibir 2 dosis, distanciadas en 1 mes, de vacuna contra la hepatitis A (Havrix, 360 ELU/dosis) o contra la hepatitis B57. La eficacia se calculó según el desarrollo de anticuerpos a la hepatitis A más de 21 días después de la recepción de la vacuna. El 97% de los niños desarrolló un título protector al mes de la vacunación, y la eficacia calculada durante un período de observación de 1 año tras la vacunación fue del 94%57 (intervalo de confianza [IC] del 95%: 79%-99%). El otro ensayo se realizó sobre 1.037 niños de 2 a 16 años de edad que vivían en un área del interior del estado de New York, con grandes tasas, históricamente sostenidas, de transmisión de la hepatitis A58. Los participantes en el estudio fueron vacunados con 1 dosis de Vaqta, y la eficacia calculada durante el período de observación fue del 100%58 (límite inferior del IC 95%: 87%). Aunque es necesario medir la eficacia de la vacuna a largo plazo, los modelos matemáticos predicen la persistencia de concentraciones protectoras de anticuerpos más de 25 años después de la finalización de la serie recomendada de 2 dosis de vacuna59.
La efectividad tras la autorización de la vacuna contra la hepatitis A ha demostrado ser similar a la eficacia notificada. Entre 1996 y 2000 se administró gratuitamente la vacuna contra la hepatitis A a los niños que vivían en Butte County, California60. De los 45.000 niños elegibles para el programa, unos 30.000 (66%) recibieron 1 dosis y 17.600 niños recibieron 3 dosis de vacuna contra la hepatitis A. Durante los 5 años de supervisión, las tasas globales de hepatitis disminuyeron un 94% en el condado, y la efectividad calculada de la vacuna fue del 98%60. De forma similar, en Cataluña, España, los casos de hepatitis A en los niños de 11 a 14 años de edad cayeron desde 10,3/100.000 niños antes de la vacunación rutinaria contra la hepatitis A a 1,8 casos/100.000 tras la instauración de un programa de vacunación contra la hepatitis A, lo que resulta en una efectividad del 97%61.
SeguridadLas vacunas contra la hepatitis A han demostrado ser sumamente seguras. En los ensayos clínicos previos a la autorización tanto de Havrix como de Vaqta, los acontecimientos adversos fueron poco frecuentes y leves, resolviéndose típicamente en menos de 1 día57. Los acontecimientos adversos más habituales, notificados en el 10% al 15% de los sujetos, fueron dolor en el lugar de la inyección, enrojecimiento y tumefacción. Ningún acontecimiento adverso grave se ha asociado definitivamente con Vaqta o con Havrix. En un estudio sobre más de 38.000 niños tailandeses que recibieron Havrix en un ensayo de eficacia no hubo acontecimientos adversos graves57. Desde su autorización en 1995 se han administrado millones de dosis de vacuna contra la hepatitis A, sin que se haya asociado acontecimiento adverso importante alguno con ninguna de las vacunas contra la hepatitis A (datos no publicados, FDA). Se realizó un estudio de farmacovigilancia de Vaqta en la población de una gran organización de mantenimiento de la salud del norte de California. Durante un período de 18 meses se sometió a los pacientes a la observación del empleo del servicio de urgencias y de la consulta en el mes posterior a la recepción de la vacuna contra la hepatitis A. Se administraron más de 49.000 dosis de vacuna contra la hepatitis A (15.000 a niños menores de 18 años de edad) sin observar ningún acontecimiento adverso grave62. El único acontecimiento adverso relacionado con la vacuna que ocurrió con cierta frecuencia tras la administración de la vacuna contra la hepatitis A fue una leve diarrea en los adultos inmunizados. Un resumen de los acontecimientos adversos notificados mediante el Vaccine Adverse Event Reporting System (VAERS) demostró que hubo 871 acontecimientos adversos en relación temporal con la recepción de las vacunas contra la hepatitis A. Sin embargo, sólo la fiebre, las reacciones en el punto de la inyección y las reacciones alérgicas parecieron estar relacionadas con la vacuna. Los episodios notificados mediante VAERS fueron similares, en tipo y número, para Vaqta y Havrix.
RentabilidadSe ha evaluado la rentabilidad de la vacunación rutinaria nacional contra la hepatitis A. Comparado con la ausencia de vacunación infantil contra la hepatitis A, la vacunación rutinaria al año de edad resultaría en 183.806 infecciones menos y en 32 muertes menos en cada cohorte63. El coste se estimó en 173.000 dólares por año de vida conseguido y en 24.000 dólares por año de vida ajustado por calidad (QALY) conseguido. Al considerar la inmunidad colectiva fuera de la cohorte, la vacunación al año de edad tuvo un coste social de 1.000 dólares por QALY conseguido. Otro análisis económico que incluyó la reducción estimada de los casos secundarios entre los contactos domiciliarios de los niños infectados obtuvo resultados similares64. Colocando estos valores en su contexto, los costes proyectados de la aplicación de un programa de vacunación universal contra la hepatitis A equivalen a los de un programa de vacunación antipertúsica acelular en los adolescentes y a cerca del 10% del coste del programa de vacunación antimeningocócica, basado en los QALY.
Administración y conservación de la vacunaAntes de la administración es necesario agitar las preparaciones vacunales que, cuando estén bien mezcladas, formarán una suspensión ligeramente opaca de color blanco. La vacuna se debe administrar por vía intramuscular, con una aguja de longitud adecuada a la edad y el tamaño del paciente65 (véase la tabla 1.5 de Red Book: Lugar y longitud de la aguja por edad para la administración intramuscular). En los niños, la vacuna contra la hepatitis A se administra en una serie de 2 dosis, y la primera dosis de Vaqta o Havrix se inyecta a los 12 meses de edad. La segunda dosis de Havrix se debe administrar de 6 a 12 meses después de la primera dosis, y la de Vaqta de 6 a 18 meses después de la primera dosis. Twinrix necesita una serie de 3 dosis administradas según una pauta de 0, 1 y 6 meses. Si se interrumpe la pauta de administración de vacunas que contengan la inmunización contra la hepatitis A, sólo es necesario administrar las vacunaciones omitidas, sin reiniciar la serie66.
La vacuna contra la hepatitis A se debe conservar y transportar entre 2 y 8 °C. Sin embargo, ni la capacidad inmunógena ni la reactogenicidad de Vaqta o de Havrix resultaron afectadas por una conservación hasta 37 °C durante una semana67. No se debe congelar la vacuna, porque se destruiría su potencia.
RECOMENDACIONESLas siguientes recomendaciones constituyen un nuevo paso en la estrategia de vacunación para prevenir la hepatitis A:
NiñosTABLA 1. Dosis y pautas recomendadas para las vacunas inactivadas contra la hepatitis A
Personas en mayor riesgo de infección por el virus de la hepatitis A
La seguridad de las vacunas contra la hepatitis A seguirá siendo evaluada mediante la monitorización continua de los datos de VAERS y otros sistemas de farmacovigilancia. Toda sospecha de acontecimiento adverso asociada con la vacunación contra la hepatitis A debe ser notificada a VAERS. La información de cómo notificar los acontecimientos adversos se encuentra en http://www.fda.gov/cber/vaers/vaers.htm. También se puede conseguir impresos VAERS telefoneando a 800-822-7967.
NECESIDADES E INVESTIGACIÓN EN EL FUTUROSupervisión sostenida de la enfermedad
La incidencia de la hepatitis A siempre ha sido baja en Estados Unidos5. La disminución de la tasa de la enfermedad se asocia temporalmente con la aplicación de un programa de vacunación contra la infección. Pese a la probabilidad de que la vacunación haya contribuido en gran medida a esta disminución, otros factores característicos de la epidemiología del virus de la hepatitis A en el pasado, como la mejora de la higiene o el ciclado de la enfermedad, pueden haber contribuido a la disminución de la incidencia de hepatitis A durante la última década. La información exhaustiva sobre cobertura de la vacunación contra la hepatitis A es vital para evaluar por completo el efecto de la vacunación sobre la disminución de la incidencia de la infección. Por desgracia, sólo se dispone de datos limitados, y la cobertura de la vacunación en los adultos no se evalúa de forma sistemática.
Aunque los datos de la Third National Health and Nutrition Examination Survey69 contribuyeron al conocimiento de la hepatitis A, la información conseguida se centra en la prevalencia de la infección. A medida que aumente la aplicación de la vacuna tendrá mayor importancia la recogida de datos prospectivos de la incidencia de la enfermedad investigando por completo los brotes y alentando a la notificación nacional de los casos mediante los departamentos estatales y locales de salud al National Notifiable Diseases Surveillance System. Sólo podremos determinar todo el impacto y el valor añadido de estos programas de vacunación masiva si disponemos de estos datos.
Posible necesidad de una pauta de recuperaciónLas estrategias para la recuperación de la vacunación suelen formar parte de los programas de vacunación universal. Sin embargo, los datos actualmente disponibles de Estados Unidos, Israel y algunos países europeos indican la existencia de un significativo efecto de inmunidad colectiva asociada con la vacunación de los niños pequeños contra la hepatitis A6,7,70. La recomendación para la vacunación de recuperación deberá aguardar a nueva supervisión para determinar si se mantiene el efecto indirecto sobre los grupos no vacunados de mayor edad.
Observación de la necesidad de una dosis de recuerdo para los adultosLa infección por hepatitis A en la infancia es típicamente leve, y el 90% de las infecciones de los niños menores de 6 años de edad no presenta síntomas. Sin embargo, si se contrae la infección durante la adolescencia y la edad adulta es típica la asociación con infecciones sintomáticas que pueden provocar debilidad durante varias semanas. Así pues, para que un programa de vacunación contra la hepatitis A sea efectivo, la vacuna debe conferir protección a largo plazo. De otra manera, una infección infantil asintomática puede ser sustituida por una enfermedad sintomática en una exposición más adelantada la vida. Como sólo se dispone comercialmente de la vacuna desde hace 10 años, los datos sobre la persistencia de los anticuerpos se basan en gran medida en la información recogida de ensayos que estudiaron la capacidad inmunógena y la eficacia de la vacuna. Sin embargo, los datos disponibles son alentadores, y muestran la persistencia de concentraciones protectoras de anticuerpos más de 10 años después de la vacunación71. Además, el modelo matemático sugiere que las concentraciones protectoras de anticuerpos pueden persistir más de 25 años después de la vacunación59. Finalmente, los estudios indican que la inmunidad puede persistir una vez extinguida la capacidad de detectar anticuerpos circulantes71. Así pues, aunque no se considera necesaria la vacunación de recuerdo en una persona sana completamente vacunada, será necesaria la observación para determinar si esta recomendación basada en la evidencia deberá cambiar con el tiempo.
Evaluación de la capacidad inmunógena con la coadministración de las vacunasSe dispone de datos limitados, que indican que la coadministración de la vacuna contra la hepatitis A con otras vacunas en la serie infantil recomendada no modifica la capacidad inmunógena de las vacunas54. Será necesario realizar y evaluar otros estudios para evaluar la capacidad inmunógena de la vacuna contra la hepatitis A junto con otras vacunas, especialmente las vacunas contra la varicela y la conjugada neumocócica. Sin embargo, a menos que los datos indiquen lo contrario, se debe suponer que la administración concomitante de la vacuna contra la hepatitis A con otras vacunas recomendadas para los niños es segura e inmunógena.
Evaluación de la aceptación de la vacunaEl éxito del programa de vacunación contra la hepatitis A dependerá del entusiasmo que muestren los médicos y los miembros del equipo de asistencia sanitaria respecto a la aplicación del programa. Las actitudes de las familias respecto a la incorporación de “otra vacuna” a la atestada pauta de vacunación también afectarán de forma crucial al programa. En una revisión de 2003, sólo el 51% de los niños elegibles por su edad que vivían en los 11 estados con recomendación de vacunar contra la hepatitis A había recibido al menos 1 dosis de la vacuna72. Sólo el 1% de los niños que vivían en estados sin recomendación de la vacuna contra la hepatitis A había recibido 1 dosis de la vacuna. Pese a esta moderada recepción de la vacuna en los estados “vacunadores”, se produjo una significativa disminución de la enfermedad por hepatitis A, lo que sugiere una gran efectividad de la vacuna, por lo que, junto con su excelente perfil de seguridad, puede ofrecer la alentadora información necesaria para apoyar el programa de vacunación.
AGRADECIMIENTOSEste informe de la AAP se preparó al mismo tiempo que las recomendaciones del informe de los CDC “Prevención de la hepatitis A mediante la inmunización activa o pasiva: recomendaciones del Advisory Committee on Immunization Practices (ACIP)” (Morbidity and mortality weekly report. 2006;55[RR-7]:1-23.) Gran parte de las generalidades de este informe se basan en la revisión bibliográfica, el análisis de datos no publicados y las deliberaciones del personal de los CDC en colaboración con el ACIP Hepatitis Working Group. Los autores agradecen a la CDC Division of Viral Hepatitis y especialmente a las Dras. Beth Bell y Tracy Liu, del Hepatitis Working Group, su extraordinaria experiencia y supervisión técnica.