La displasia broncopulmonar (DBP) es una enfermedad multifactorial, caracterizada por problemas en el desarrollo alveolar y vascular de los pulmones. Los factores ambientales, como altos niveles de exposición a oxígeno, ventilación mecánica o infecciones repetidas, juegan un importante papel en la etiología, aunque estudios recientes han sugerido una importante predisposición genética1. Los niños con BPD tienen un riesgo aumentado de muerte, complicaciones respiratorias en la infancia y problemas a largo plazo de desarrollo neuro-lógico2,3. La falta de beneficios clínicos mantenidos de las intervenciones terapéuticas posnatales tardías y los perjudiciales efectos indeseables de los corticosteroides han acrecentado el interés en la búsqueda de marcadores biológicos precoces útiles en la selección de intervenciones terapéuticas encaminadas a promover los beneficios pulmonares y de desarrollo neurológico a largo plazo4,5.
Dos estudios previos comunicaron las influencias genéticas en la etiología de la BPD. El primero fue un estudio familiar de Parker el at, que mostró una gran concordancia para BPD entre parejas de hermanos afectados. Este estudio indicó que la BPD tenía un componente familiar, pero no fue capaz de diferenciar si el incremento de concordancia en hermanos era debido a genes susceptibles compartidos entre hermanos o era por factores ambientales a los que habían sido expuestos ambos hermanos6. Por el contrario, los estudios de gemelos son una potente herramienta para separar los efectos genéticos y ambientales, comparando los índices de aparición de enfermedades en parejas de gemelos monocigóticos (MZ) y dicigóticos (DZ). La mayor semejanza entre parejas MZ que DZ implica la presencia de influencias genéticas, debido a la semejanza genética dos veces mayor en gemelos MZ que en DZ. Utilizando los datos combinados de cuatro centros de neonatología de EE. UU., Bhandari et al1 comunicaron que el 53% de la variabilidad observada en la incidencia de BPD fue atribuible directamente a diferencias genéticas (denominadas h2 o heredabilidad). Sin embargo, por razones prácticas, los investigadores usaron una definición arbitraria de BPD (p. ej.: la necesidad de oxígeno suplementario a las 36 semanas) que se sabe que tiene poca correlación con el resultado del desarrollo neurológico tardío, en particular en la población con riesgo de ELBW7.
Para tratar este tema, aplicamos la definición de BDP del National Institute of Child Health and Human Development (NICHD)/National Heart, Lung, and Blood Institute Workshop desarrollada en el año 20008. Las ventajas más importantes de esta definición, comparada con otras definiciones7, es que reconoce distintos niveles de gravedad de la enfermedad y predice de forma más precisa el espectro de riesgo de resultados adversos de desarrollo neurológico en una edad temprana.
Por lo tanto, el objetivo del presente estudio es determinar la magnitud de los efectos genéticos en la susceptibilidad y los factores de riesgo para la BPD, comparando definiciones validadas clínicamente para resultados respiratorios y de desarrollo neurológico a largo plazo.
MÉTODOSPacientes y base de datosLa muestra consistió en 478 gemelos que nacieron entre el 15 de noviembre de 1993 y el 31 de diciembre de 2006, y que fueron ingresados en el Children’s & Women’s Health Centre of British Columbia (BC) en Vancouver, Canadá (tablas 1 y 2). Este centro es del nivel primario provincial III/IV NICU, que ingresa cerca de 600 neonatos anualmente, incluyendo la mayoría de los niños de peso extremadamente bajo al nacer, nacidos en la provincia de BC. Se recogieron de forma prospectiva los datos de todos los niños desde el ingreso hasta el alta o el fallecimiento, utilizando criterios preestructurados definidos objetivamente. La información recogida incluía datos demográficos, historia maternal pre y perinatal, del parto y evolución neonatal y los resultados neonatales más importantes. La exactitud de la información en los registros de las bases de datos se confirmó por encima del 95%, tal y como lo estableció una revisión secundaria de la mayoría de los informes médicos de los niños en este estudio. La población del estudio incluyó a todos los niños de 30 semanas completas o menos de gestación. Los pacientes que fallecieron en los primeros 28 días de vida o antes de las 36 semanas PMA se excluyeron para el análisis de BPD a los 28 días o a las 36 semanas, respectivamente (ver definiciones posteriores). La cigosidad se determinó utilizando la corionicidad proveniente de los ultrasonidos fetales precoces o del examen histológico de la placenta realizado en el Children’s & Wo-men’s Health Centre of British Columbia. La confirmación histológica de la corionicidad fue anterior a los ultrasonidos fe-tales excepto en 2 casos en los que se había realizado septostomía antenatal de las membranas. Los gemelos dicoriónicos sólo se consideraron dicigóticos si diferían en el grupo sanguíneo o el género y si no fueron excluidos del análisis. Los gemelos monocoriónicos se consideraron monocigóticos por defecto pues son extremadamente raros los dicigóticos en estos casos9. El estudio fue aprobado por el Comité Ético de Investigación de la University of British Columbia.
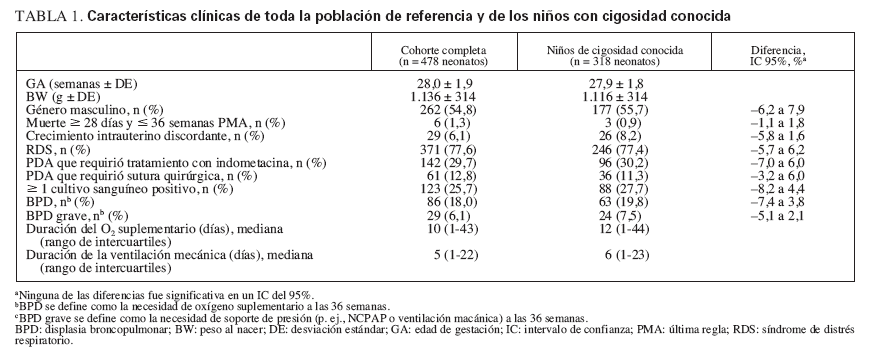
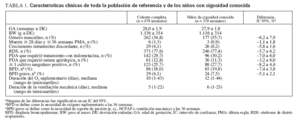
TABLA 1. Características clínicas de toda la población de referencia y de los niños con cigosidad conocida
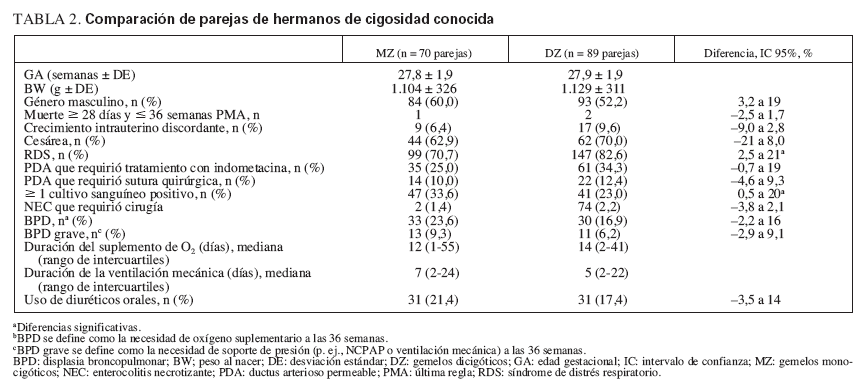
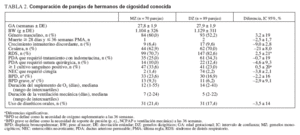
TABLA 2. Comparación de parejas de hermanos de cigosidad conocida
DefinicionesEn el análisis se incluyeron tres definiciones ampliamente utilizadas y validadas clínicamente: 1) necesidad de suplemento de oxígeno crónico durante al menos 28 días10 (BPD-28 DÍAS); 2) necesidad de suplemento de oxígeno a las 36 semanas de la última regla (PMA) o parto domiciliario fuera cual fuera el primero11 (BPD-36 SEM); y 3) BPD definido categóricamente (leve, moderado o grave) basado en la definición de consenso de NICH8 (BPD-NICHD). Según la definición de consenso de NICHD, se definió “BPD leve” como la necesidad de oxígeno suplementario durante al menos 28 días. Se definió “BPD moderado” como la necesidad de suplemento de oxígeno a las 36 semanas PMA sin soporte de presión positivo (p. ej., NCPAP o ventilación mecánica). “BPD grave” se definió como la necesidad de soporte de presión positivo (p. ej., NCPAP o ventilación mecánica) para enfermedad pulmonar crónica a las 36 semanas PMA. La información sobre el estatus respiratorio del niño hasta el momento del alta también se obtuvo en todos los niños que fueron trasladados antes de las 36 semanas PMA. Nuestra institución no utilizó un test fisiológico confirmando las necesidades de oxígeno en el momento de la valoración12.
La edad gestacional se determinó basándose en el primer día del último ciclo menstrual si se consideraron exactas las fechas del ciclo, o en caso contrario, datándolo por ultrasonido precoz. El crecimiento intrauterino discordante se definió como la discrepancia mayor del 20% en las medidas de crecimiento entre los fetos. Se definió el síndrome de distrés respiratorio (RDS) según los criterios clínicos de los síntomas de distrés respiratorio en las primeras 24 h de vida/o la necesidad de administración de surfactante. El ductus arterioso permeable (PDA) se definió por signos clínicos apoyados por confirmación ecocardiográfica. Sin embargo, sólo se incluyeron en el análisis aquellos con PDA hemodinámicamente significativa que precisaba tratamiento, ya fuera con indometacina (PDA-INDO), ya con sutura quirúrgica (PDA-SURG).
Análisis estadísticoEl potencial hereditario se estima por comparación de la similitud intra-pareja (por ejemplo, indexada por un coeficiente de correlación) entre parejas MZ y DZ. Al contrario que en artículos publicados previamente, el presente estudio utiliza modelos de ecuaciones estructurales para producir estimaciones de la contribución relativa de las influencias genéticas aditivas (A), o de las influencias ambientales compartidas (C) y no compartidas (E). Las influencias genéticas aditivas reflejan los efectos genéticos transmitidos directamente de los padres a su descendencia. Los efectos ambientales compartidos incluyen todas aquellas experiencias que influyan en los niños dentro de una familia en el mismo grado (por ejemplo, estado socioeconómico, prácticas institucionales, etc.). Los efectos ambientales no compartidos incluyen los eventos que tienen efectos diferenciales sobre cada miembro de la familia (por ejemplo, enfermedades intercurrentes, etc.). La adaptación del modelo de ecuación estructural se ha convertido en el método estándar para estimar la heredabilidad principalmente porque permite realizar una evaluación estadística de la significación de los efectos genéticos y ambientales y computarizar los intervalos de confianza, algo imposible de realizar con los métodos anteriores (comentado en 13, 14).
Las similitudes intra-par de cada definición se estimaron con el software estadístico PRELIS 2.315. Este programa estadístico selecciona el coeficiente de correlación adecuado (r) para tener en cuenta el nivel de medición de cada definición14 (por ejemplo, intervalo o datos categóricos). Para BPD-28DAYS, BPD36WKS, RDS, PDA-INO, y PDA-SURG (codificado como 0 = ausencia o 1 = presencia) se computarizaron las correlaciones canónicas a partir de tablas de contingencia creadas entre hermanos para cada cigosidad. Se calculó una correlación Pearson de producto-momento para BPD-NICHD (codificado como 0 = ausencia, 1 = leve, 2 = moderado y 3 = grave) y diversos cultivos en sangre positivos. La introducción de la fecha de nacimiento como covariado no modificó significativamente las correlaciones de gemelos intra-par.
El estudio utilizó una estrategia de ajuste de un modelo de ecuación estructural que adaptaba cuatro modelos separados a las correlaciones MZ y DZ intra-par para cada definición, con el fin de estimar la magnitud y probar la significación estadística de los parámetros A, C y E por el método de al menos cuadrados ponderados utilizando software estadístico Mx14,16. El medio principal para valorar el ajuste relativo de cada modelo es comparando la magnitud del ratio de probabilidad chi cuadrado (µ2) computarizado para cada modelo frente a otro. Los modelos con µ2 indican un ajuste superior en comparación con los modelos con valores más altos de µ2. Las diferencias entre modelos se prueban frente a la distribución µ2 (p < 0,05). El modelo 1 es el modelo basal que estima la magnitud de las influencias A, C y E (modelo ACE). El modelo 2 (modelo AE) prueba la significación estadística del ambiente familiar compartido (p. ej., C) en comparación con el modelo basal. La significación de C se prueba sustrayendo del valor de µ2 del modelo basal (modelo 1) del valor de µ2 asociado al modelo AE (modelo 2) y probado frente a la distribución de µ2. La ausencia de cambios significativos en µ2 entre los modelos indica que el parámetro eliminado no tenía efecto. Por el contrario, un cambio significativo en µ2 indica que el parámetro contribuye significativamente a la variabilidad observada y debe conservarse. De forma similar, el modelo 3 prueba la significación de la influencia genética especificando sólo influencias ambientales compartidas y no compartidas (CE), mientras que el modelo 4 (sólo E) prueba si los eventos o circunstancias únicos en un individuo pueden influir satisfactoriamente en los datos.
Además de µ2, el ajuste del modelo se valora también usando el Criterio de Información de Akaike17 (AIC = µ2 – 2df; df = grado de libertad). El AIC se utiliza porque incluye en la magnitud del cociente de verosimilitud µ2 el principio de parsimonia, en el que los modelos que pueden explicar los datos con menos parámetros se consideran superiores a los modelos que especifican más parámetros. En resumen, el modelo más satisfactorio en el presente estudio es uno que no incremente significativa-mente µ2, proporcione el valor más pequeño de AIC y explique la varianza con el menor número de parámetros. Las estimaciones de los parámetros A, C y E del mejor ajuste están elevados al cuadrado para proporcionar las proporciones estandarizadas familiares (%) de la varianza atribuible a cada efecto h2A, c2 , y e2, respectivamente.
RESULTADOSLas características clínicas eran similares entre toda la cohorte de 478 neonatos y el subgrupo de 318 neonatos de cigosidad conocida utilizados para el análisis (véase tabla 1). Dentro del grupo de cigosidad conocida, los neonatos NZ y DZ eran similares en términos de variables de confusión potenciales, con excepción de que había una incidencia más alta de RDS y una incidencia más baja de bacteriemia en los gemelos DZ (tabla 2).
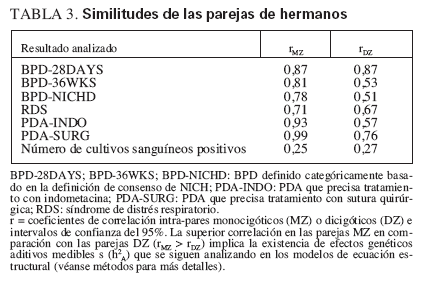
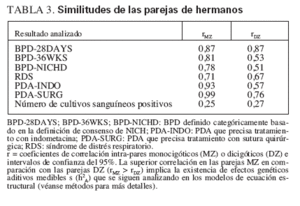
En el análisis inicial, se determinaron las correlaciones intra-par en los gemelos MZ y DZ para las tres definiciones de BPD: BPD-28DAYS, BPD-36WKS y BPDNICHD (véanse definiciones detalladas en métodos). Como muestra la tabla 3, los coeficientes de correlación (r) en los pares MZ fueron mayores para BPD36WKS y BPD-NICHD, lo que sugiere la presencia de una influencia genética significativa de la necesidad de oxígeno suplementario a las 36 semanas. De forma similar, MZ superó también las correlaciones DZ para ductus arterioso permeable (PDA) que requirió indometacina (PDA-INDO) o tratamiento quirúrgico (PDASURG), lo que sugiere la presencia de una responsabilidad genética para un PDA hemodinámicamente significativo. Se sugirió una pequeña influencia genética para BPD-28DAYS, síndrome de distrés respiratorio o el número de cultivos sanguíneos positivos (tabla 3).
TABLA 3. Similitudes de las parejas de hermanos
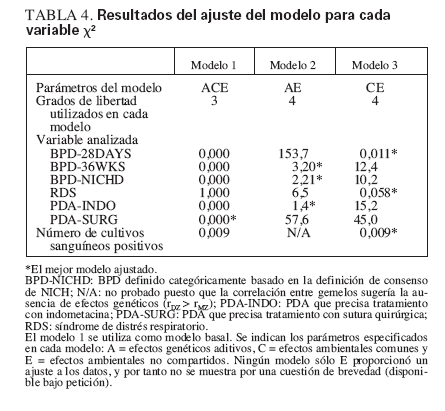
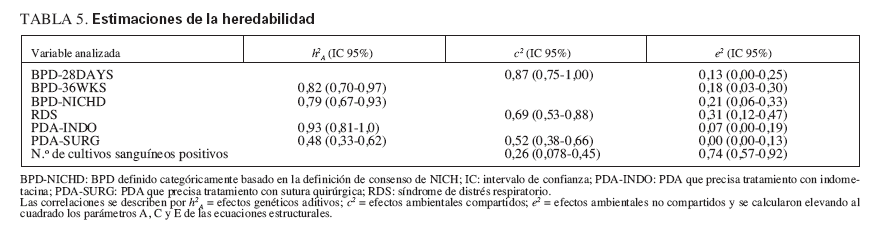
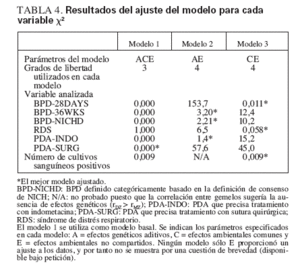
Las ecuaciones estructurales ajustadas a los coeficientes de las correlaciones confirmaron los resultados sugeridos por las correlaciones de gemelos. Como se muestra en la tabla 4, para PDA-INDO, BPD-36WKS y BPD-NICHD la supresión de los efectos ambientales compartidos (C) en el modelo 2 (en comparación con el valor basal) no aumentó significativamente los cocientes de verosimilitud (µ2), lo que indica por tanto que los efectos ambientales compartidos (C) son insignificantes. Sin embargo, la supresión de los efectos genéticos aditivos (A) del modelo 3 (modelo CE) ocasionó un aumento significativo de µ2 para estas variables, lo que indica una contribución genética significativa. El modelo 4 (sólo E), que suprime tanto los efectos genéticos (A) como los efectos ambientales compartidos (C), ocasionó un incremento significativo de µ2 para todas las definiciones probadas (no mostradas). Así pues, el modelo 2, que especifica sólo las influencias genéticas aditivas y las ambientales compartidas, proporciona la explicación más satisfactoria para la variabilidad observada en estos resultados. Por el contrario, la variabilidad en BPD28DAYS y RDS podría explicarse completamente por los efectos ambientales compartidos y no compartidos; tal como se muestra en la tabla 4, los efectos ambientales compartidos (C) aumentan significativamente µ2, mientras que la supresión de los efectos genéticos aditivos (A) no se tradujo en ningún cambio significativo en µ2. Respecto a los cultivos sanguíneos positivos, puesto que la correlación entre gemelos DZ supera la correlación entre gemelos MZ, no se sugieren efectos genéticos aditivos. Esto se ve confirmado por un ajuste idéntico del modelo basal al modelo 3, que estima sólo los efectos ambientales compartidos (C) y no compartidos (E). Finalmente, para PDA-SURG, la supresión de los parámetros A y C aumentó significativamente µ2, lo que indica que los efectos A, C y E afectan significativamente la variabilidad de este resultado. Las estimaciones de este parámetro para A, C y E eran elevadas al cuadrado para proporcionar las estimaciones de la heratabilidad 2A, c2 , y e2. Para las definiciones con un componente heredable significativo, las estimaciones de h2 fueron del 78% para BPD-NICHD; 82% para BPD-36WKS; 48% para PDA-SURG; y 93% para PDA-INDO (tabla 5).
TABLA 4. Resultados del ajuste del modelo para cada variable X2
TABLA 5. Estimaciones de la heredabilidad
DISCUSIÓNEl presente estudio indica que la susceptibilidad a BPD es significativamente heredable en recién nacidos µ30 semanas de edad gestacional utilizando definiciones validadas clínicamente de la evolución pulmonar y de desarrollo neurológico a largo plazo. Comunicamos también por primera vez efectos genéticos significativos sobre el PDA hemodinámicamente significativo, un factor de riesgo para BPD. Al contrario que en estudios previos, la estrategia metodológica utilizada en nuestro análisis permite también la definición del papel de los estresores ambientales comunes, así como de los factores únicos en cada niño (es decir, factores ambientales no compartidos). Esto tiene especial importancia para comprender la etiología multifactorial de la BPD. Para BPD-36WKS y BPD-NICHD, las estimaciones del potencial hereditario fueron algo más altas que las comunicadas anteriormente, quizá debido a las diferencias en la magnitud relativa de los estresores ambientales, la inclusión en nuestro estudio de recién nacidos de edad gestacional baja o las diferencias en el método utilizado1.
Es especialmente interesante destacar que la contribución relativa de los factores genéticos y ambientales parece variar dependiendo de la gravedad de la BPD. Las variaciones en la BPD-28DAYS fueron completamente atribuibles a los efectos ambientales, predominantemente a los efectos ambientales compartidos.
La dependencia de oxígeno suplementario a los 28 días refleja probablemente una fase inicial en el proceso de la enfermedad, claramente determinada por factores comunes a los gemelos, como la edad gestacional, mientras que la condición a las 36 semanas parece reflejar mejor una susceptibilidad biológica subyacente8.
Aunque este estudio indica un componente genético significativo en la susceptibilidad a BPD, no puede conocerse la naturaleza molecular de este efecto. Igual que en otras enfermedades complejas, es probable que las influencias ambientales interactúen para alterar la susceptibilidad genética. La ventilación por presión positiva que induce el estiramiento alveolar y el oxígeno desencadena respuestas inflamatorias locales y sistémicas que pueden ser lesivas para los pulmones del niño pretérmino inmaduro inmunológicamente18. Los animales modificados genéticamente para tener niveles alterados de proteínas surfactantes, una producción excesiva de citosina (p. ej., interleucina 6 o 13) o una deficiencia del receptor tipo Toll 4, que es un receptor clave para la respuesta inflamatoria a los lipopolisacáridos de las bacterias gramnegativas, muestran una susceptibilidad aumentada al daño pulmonar inducido por hiperoxia19-23. En humanos, los polimorfismos en los genes de la proteína A & B surfactante, TNF-µ, enzima convertidora de la angiotensina y glutation-S-transferasa-P1, con funciones biológicas alteradas conocidas, se han asociado en pequeños estudios con variaciones en el riesgo de BPD o en su gravedad24-27, aunque otros no han podido demostrar asociaciones similares en poblaciones inde-pendientes28,29.
La persistencia de PDA también fue claramente heredable en nuestro análisis, un hallazgo coherente con la contribución significativa de los antecedentes étnicos individuales en la susceptibilidad30. El cierre del PDA depende principalmente de los niveles circulantes de prostaglandinas endógenas, producidas por la ciclooxigenasa (COX), además del óxido nítrico (NO), que media la relajación ductal en neonatos altamente inmaduros31. Hasta ahora, sólo un estudio ha comunicado una asociación entre el polimorfismo A1166C en el gen del receptor tipo 1 de la angiotensina II y la persistencia de PDA, aunque no está claro el mecanismo subyacente en esta asociación32. En humanos, se han descrito numerosas variantes genéticas de COX, que potencialmente podrían explicar las diferencias interindividuales en la respuesta farmacológica a los inhibidores de la COX33.
Una limitación de todos los análisis retrospectivos de gemelos, incluyendo el nuestro, es la posibilidad de clasificar erróneamente la enfermedad. Esto puede afectar significativamente las estimaciones de la heredabilidad (véase la referencia 13 para una revisión). Esto se ilustra mejor con nuestros hallazgos de efectos genéticos compartidos potentes pero ausencia de efectos genéticos significativos en RDS, en claro contraste con comunicaciones previas34. La definición de RDS utilizada en nuestra cohorte no incorporó específicamente criterios radiológicos, y la clasificación de la enfermedad podría haber sido sesgada por nuestra práctica de administrar precoz-mente de forma rutinaria surfactante a los neonatos con un peso inferior a los 1.000 g, lo que podría enmascarar la capacidad de medir los efectos genéticos. A pesar de ello, esta observación subraya el impacto considerable que pueden tener las variaciones institucionales en la práctica clínica, la incidencia de la enfermedad o los errores en la clasificación de enfermedades sobre las estimaciones de la heredabilidad. En relación con la BPD, una enfermedad definida de forma algo arbitraria, creemos que nuestra metodología de verificar rigurosamente la exactitud de la información clínica y utilizar aproximaciones validadas a largo plazo maximiza nuestra capacidad de detectar los efectos genéticos clínicamente más relevantes.
Los avances en el mapeo del genoma humano abren la excitante posibilidad de poder utilizar el conocimiento de variantes genéticas en una terapia dirigida basada en la estratificación del riesgo. Nuestros resultados proporcionan una corroboración independiente esencial de una significativa contribución de la heredabilidad en la etiología y gravedad de la BPD, así como del PDA persistente. Además, detallamos la contribución relativa de los efectos ambientales potencialmente modificables a los cambios en la práctica clínica. El uso de la definición de consenso NICHD refuerza notablemente la base para identificar marcadores genéticos útiles para estratificar el riesgo y determinar intervenciones para prevenir la BPD y sus consecuencias más indeseables durante toda la vida en niños nacidos prematuramente.
AGRADECIMIENTOSEl Dr. Pascal M. Lavoie está becado por un premio del Programa científico-clínico de salud infantil canadiense del Canadian Institute of Health Research (CIHR). Este estudio fue financiado por el premio Telethon de la BC Children’s Hospital Foundation (PML). Queremos expresar también nuestro agradecimiento a nuestros compañeros neonatólogos por la cuidadosa lectura y comentarios del manuscrito.
Correspondencia: Pascal M. Lavoie, MD, PhD, FRCPC, Departamento de Pediatría, División de Neonatología, Centro de Salud de niños y mujeres de la Columbia Británica, Room 1R47, 4480 Oak St, Vancouver BC, Canadá V6H 3V4, Canadá.
Correo electrónico: plavoie@cw.bc.ca