En la infancia las fracturas óseas son frecuentes y, durante los 30 últimos años, se ha producido un aumento constante de su incidencia en niños1. Con menos frecuencia, éstos experimentarán más de una. En general, en los que presentan antecedentes de múltiples fracturas la salud ósea es normal pero están predispuestos a ellas debido a una elevada exposición a los traumatismos (tal como en los deportes de contacto) o tan sólo por mala suerte. Sin embargo, estos antecedentes también podrían ser un signo de fragilidad ósea subyacente debido a una osteopatía metabólica no diagnosticada. Por consiguiente, estos niños plantean un dilema tanto a su pediatra como al cirujano ortopédico; ¿cuál es la evaluación necesaria para niños con antecedentes de múltiples fracturas? El presente estudio se diseñó para abordar esta cuestión.
Está bien documentado que una baja densidad mineral ósea (DMO) y los antecedentes de fractura son factores de riesgo de futuras fracturas en el adulto2,3. No obstante, sólo unos pocos investigadores han estudiado la asociación de una disminución de la DMO y las fracturas en niños. Goulding et al4 documentaron que en niñas con antecedentes de fractura la puntuación Z media de la DMO era de –0,5. De éstas, en el 34% se identificaron puntuaciones Z de la DMO en la columna vertebral lumbar inferiores a –1,0, más del doble que la tasa predecible si no estuviera presente una asociación. Para niños se han documentado resultados similares5. Este mismo grupo de investigadores reevaluó a esas niñas 4 años más tarde en busca de fracturas posteriores6. Los investigadores encontraron que los antecedentes de fractura aumentaron el riesgo de una fractura posterior en 3,3 veces y una puntuación Z de la DMO corporal total < –1,0 aumentó el riesgo 1,9 veces. Los antecedentes de ambos aumentaron el riesgo de fractura ulterior en 9,4 veces. En un metaanálisis reciente de estudios de casos-controles se confirmó una diferencia media (diferencia media estandarizada) de la puntuación Z de la DMO de –0,32 entre niños con y sin fracturas7. Recientemente, un gran estudio prospectivo (Avon Longitudinal Study of Parents and Children) describió a 6.213 niños que se sometieron a una DXA efectuada a los 9,9 años de edad8. De ellos, al cabo de 2 años de la exploración, 550 experimentaron una o más fracturas. De nuevo, aquellos con fracturas se caracterizaron por una disminución de la DMO (diferencia media estandarizada –0,26). Estos autores determinaron que la odds ratio del riesgo de fractura fue de 1,12 por cada disminución de la DE de la DMO. Estos datos sugirieron que, al igual que los adultos, los niños con antecedentes de fracturas o unos valores anormales de DMO corren un riesgo de futuras fracturas y que dicho riesgo aumenta sustancialmente en presencia de ambos. La implicación de estos estudios es que la exploración con DXA de niños con antecedentes de fracturas podría permitir que los médicos detectaran a un grupo con riesgo elevado de fracturas posteriores. Se han identificado otros factores de riesgo de fracturas en la infancia, caso de un mayor peso corporal5 y la evitación de los lácteos en la dieta9. No obstante, ninguno de estos estudios incluyó un análisis bioquímico para evaluar otras posibles causas de una baja DMO o de un aumento del riesgo de fracturas.
Además de la predicción de futuras fracturas, la determinación de la densidad mineral ósea también sirve de cribado de la osteopatía metabólica. Se ha demostrado que un número sustancial de procesos se asocian con una baja DMO10 y fracturas11 en niños. La mayor parte de estos procesos afectan a la DMO debido a las alteraciones del crecimiento y de la pubertad, trastornos del metabolismo del calcio o el fósforo, inflamación crónica o fármacos. Muchos de estos procesos pueden debutar con pocos síntomas y escapar de un diagnóstico inmediato. Tannenbaum et al12 describieron los contribuidores secundarios de la osteoporosis en mujeres posmenopáusicas, por lo demás, sanas. Revelaron que el 32% presentaba pruebas de una alteración no diagnosticada del metabolismo óseo y mineral, incluido un hiperparatiroidismo primario, déficit de vitamina D, pérdida de calcio renal, malabsorción, hipertiroidismo y síndrome de Cushing. En niños nunca se ha llevado a cabo un estudio similar.
Estudiamos a niños, por lo demás, sanos que habían experimentado múltiples fracturas asociadas a un traumatismo de baja energía para determinar la incidencia de osteopatía no diagnosticada. Acto seguido, utilizamos estos datos para recomendar una evaluación apropiada de niños que presentan estos antecedentes.
MÉTODOSCasosLos casos se identificaron a partir de los pacientes de la clínica ortopédica de la Nemours Children’s Clinic-Jacksonville.
Los criterios de inclusión fueron niños sanos de 3 a < 18 años de edad, con antecedentes de dos o más casos de fractura asociada a un traumatismo de baja energía. Para este estudio, una “fractura de baja energía” excluyó los accidentes relacionados con vehículos a motor, bicicletas, monopatines, barras para trepar y caídas desde una altura mayor que la estatura en bipedestación. Los individuos de control fueron los hermanos sanos de los casos (n = 32, 56%) y niños sanos no emparentados (n = 25, 44%) sin antecedentes de fractura. Los individuos de control no emparentados con los casos se extrajeron de la misma población del noreste de Florida. Excluimos específicamente del estudio a niños con antecedentes de cualquier enfermedad o síndrome asociado a una baja DMO o fracturas, antecedentes de tratamiento con corticosteroides o anticonvulsionantes, antecedentes de inmovilización prolongada, espina bífida o antecedentes de cirugía raquídea. El estudio fue aprobado por el comité de investigación del hospital y, antes de cualquier procedimiento del estudio, los padres de todos los individuos firmaron formularios de consentimiento.
Exploración DXALa exploración DXA se efectuó usando el sistema Discovery A (Hologic, Bedford, MA). Las exploraciones se emprendieron una vez se hubieron retirado las escayolas. El tiempo mediano desde la última fractura hasta la exploración DXA fue de 24 semanas, con unos límites de 6-83 semanas. Las exploraciones de la columna vertebral lumbar se obtuvieron utilizando el modo con antena de “fase array”. Las exploraciones corporales totales se obtuvieron usando el modo “auto whole body”, que también proporciona datos sobre la composición corporal. Un técnico efectuó el análisis de las imágenes usando el programa QDR para Windows XP (versión 12.4, Hologic). Con el mismo programa, se determinaron las puntuaciones Z de la densidad mineral ósea, usando los límites de referencia pediátricos específicos de Hologic13.
AntropometríaLa estatura se determinó utilizando un estadiómetro Harpendon montado en la pared y los pesos, mediante una balanza digital. Las puntuaciones DE de la estatura, peso e índice de masa corporal (IMC) se calcularon utilizando los datos del estudio NHANES para la población sana14. Un observador (RCO) efectuó la exploración física de todos los individuos, incluida la clasificación del estadio de Tanner.
Puntuación de la actividadLa puntuación de la actividad con carga se determinó usando un cuestionario determinado por la entrevista (Weight Bearing Activity Questionnaire for Kids)15. Este instrumento validado estima los minutos a la semana invertidos en actividades con carga específicas. Previamente, a cada actividad se le ha asignado un factor de valoración de la intensidad determinado empíricamente. La puntuación se calcula multiplicando el tiempo semanal invertido en cada actividad por el factor de valoración de dicha actividad y sumando los resultados de todas las actividades.
Evaluación de la dieta-nutrientesLa dieta e ingesta de nutrientes se examinó mediante un registro de los alimentos en diarios durante 3 días. Se solicitó a los participantes que registraran el consumo de todos los alimentos y bebidas durante 2 días lectivos de la semana y uno de los dos del fin de semana. Utilizando el programa de análisis de la dieta Nutritionist IV (versión 3.5.2, First DataBank, San Bruno, CA), un dietista clínico analizó los diarios para el número total de calorías e ingesta de proteínas, calcio, fósforo, magnesio, vitamina D, sodio y potasio. La ingesta dietética de estos nutrientes se estimó calculando como promedio los resultados durante los 3 días. Para calcular el porcentaje de la cantidad diaria recomendada (CDR) o el porcentaje de la ingesta adecuada (IA) de estos nutrientes se usaron las ingestas dietéticas de referencia para oligoelementos y vitaminas del Food and Nutrition Board of the Institute of Medicine of the National Academies (www.iom.edu).
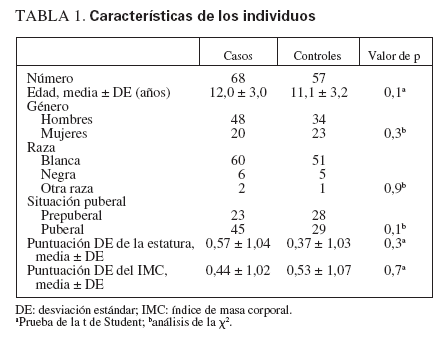
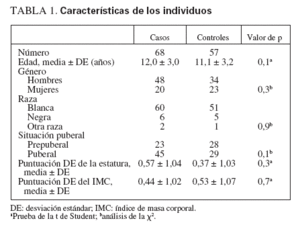
TABLA 1. Características de los individuos
BioquímicaSe obtuvieron muestras de sangre en ayunas para efectuar un hemograma completo; velocidad de sedimentación; panel bioquímico exhaustivo; fósforo; magnesio; parathormona (PTH) intacta y hormona tiroestimulante (TSH), determinados por el laboratorio clínico local; Quest Diagnostics llevó a cabo la determinación de 25-hidroxivitamina D, 1,25-dihidroxivitamina D, y anticuerpos antitransglutaminasa tisular. De forma ambulatoria, se obtuvieron muestras de orina de 24 h para determinación de calcio, fósforo y creatinina y unas gotas de orina para el resto de análisis efectuado en el laboratorio local. La excreción renal de calcio se calculó usando la ecuación siguiente: [calcio urinario] x volumen de orina de 24 h/peso corporal. La reabsorción tubular renal de fosfato por la tasa de filtración glomerular (TP/TFG) se calculó usando la ecuación siguiente16: [fosfato sérico] – ([fosfato urinario] x [creatinina sérica]/[creatinina urinaria]).
Análisis estadísticoCuando se compararon utilizando pruebas de la t de Student se encontró que los datos de intervalo tenían una distribución normal. Para los datos de la puntuación Z de la DMO, la hipótesis fue que los niños con antecedentes de fracturas frecuentes presentarían puntuaciones Z más bajas que los individuos de control. Por esta razón, se efectuaron pruebas de una cola. Para los análisis restantes se efectuaron pruebas de dos colas. Mediante un análisis ANOVA con comparaciones post hoc, pairwise de Holm se efectuó un análisis de subgrupo para comparar a los individuos con hipercalciuria. Los datos no distribuidos normalmente fueron la puntuación de la actividad con carga y las ingestas dietéticas. Para estos análisis se utilizaron pruebas del orden con signo de Mann-Whitney. Los análisis de subgrupo de estos datos se efectuaron mediante pruebas de Kruskal-Wallis. Los datos nominales se analizaron mediante una prueba de la µ2. Las correlaciones lineales se determinaron ajustando una línea a los datos utilizando un análisis de mínimos cuadrados y efectuando una regresión lineal. El programa utilizado para estos análisis fue Primer of Biostatistics (versión 5.0, Mc-Graw Hill Medical). La significación se estableció con un valor de p < 0,05.
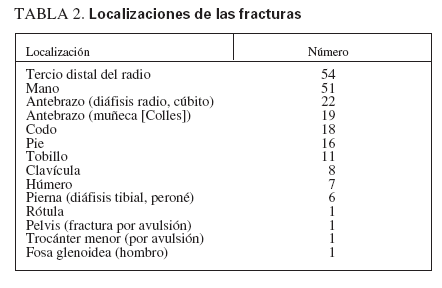
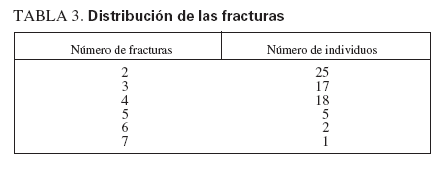
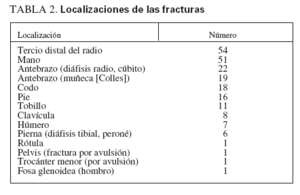
RESULTADOSIndividuos del estudioSe estudiaron 68 niños sanos con antecedentes de fracturas frecuentes y 57 individuos de control, sanos. Los grupos del estudio estuvieron razonablemente bien emparejados, sin diferencias en la distribución de edad, sexo, raza, puntuación DE de la estatura o puntuación DE del IMC (tabla 1). En el grupo de control se identificó una tendencia no significativa hacia una menor edad y a incluir una mayor proporción de individuos prepuberales. En la tabla 2 se muestran las localizaciones de las fracturas experimentadas por el grupo de casos. Las fracturas más frecuentes fueron las de Colles y de los huesos de la mano. La mayor parte de los casos habían experimentado sólo dos, aunque un individuo refirió siete (tabla 3). El número de fracturas se correlacionó positivamente con la edad (r2 = 0,165, p = 0,006).
TABLA 2. Localizaciones de las fracturas
TABLA 3. Distribución de las fracturas
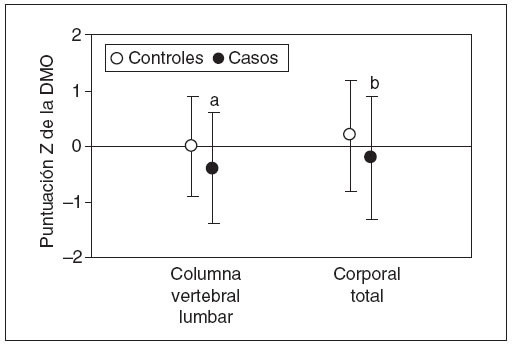
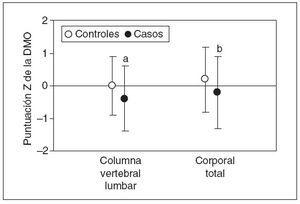
Densidad mineral óseaLa densidad mineral ósea fue más baja entre los casos que entre los controles (fig. 1). Las puntuaciones Z de la DMO en columna vertebral lumbar fueron de –0,2 ± 1,1 (media ± DE) para los casos y de 0,2 ± 1,0 para los controles (p = 0,03). Las puntuaciones Z de la DMO corporal total fueron de –0,4 ± 1,1 para los casos y de 0,0 ± 0,9 para los controles (p = 0,006). Entre los casos, en tres se detectó una densidad mineral ósea inferior a los límites esperados17 (definida como cualquier puntuación Z de la DMO inferior a –2). Esta proporción (4,4%) no fue significativamente diferente de la de los individuos de control (1,8%, p = 0,8) ni de la predecible en la población sana (2,3%, p = 0,8). Este análisis contó con una potencia del 93%.
Fig. 1. Densidad mineral ósea en niños con fracturas frecuentes. La densidad mineral ósea se determinó mediante absorciometría de rayos X de doble nivel de energía (DXA) en la columna vertebral lumbar y corporal total y los resultados se expresan como puntuaciones Z. Los círculos blancos muestran a los individuos de control (n = 57); los círculos negros muestran los casos (n = 68). Los puntos muestran la media; las barras de error muestran la DE. DMO: densidad mineral ósea. ap< 0,03; bp < 0,006.
De los casos con una DMO baja, dos eran niñas que evitaban los lácteos, una por alergia a la leche y otra por la asociación percibida con sus migrañas. La ingesta de calcio fue el 65% y el 66% de la ingesta adecuada (IA) y la de vitamina D, del 30% y 20%, respectivamente. Además, en una de estas niñas se documentó una puntuación de 0 de la actividad con carga. El otro caso con una baja DMO era un niño de 16 años de edad con una estatura baja (en comparación con los límites predecibles por la estatura media de sus progenitores), con antecedentes de pubertad retrasada y una puntuación DE de la edad ósea de –2,6. En este niño se estableció el diagnóstico de retraso constitucional del crecimiento y la maduración.
Entre los casos, no se detectó una correlación entre el número de fracturas y la puntuación Z de la DMO (r2 = 0,001 para la de columna vertebral lumbar, p = 0,8 y 0,003 para la corporal total, p = 0,7).
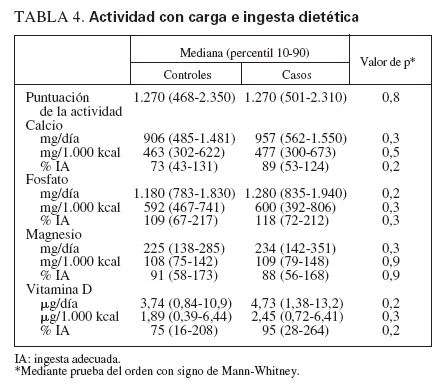
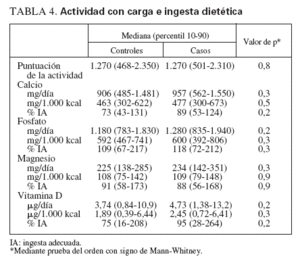
Actividad con cargaLas puntuaciones de la actividad con carga (determinadas mediante el Weight Bearing Activity Question-naire for Kids) fueron idénticas entre los casos y los controles (tabla 4). No se identificaron correlaciones entre la puntuación de la actividad con carga y el número de fracturas (sólo para los casos) o la puntuación Z de la DMO (casos o controles) (valores de r2 inferiores a 0,07, valor de p = no significativo).
TABLA 4. Actividad con carga e ingesta dietética
Ingesta de nutrientes a partir de la dietaNo se observaron diferencias significativas entre grupos para la ingesta dietética de calcio, fosfato, magnesio o vitamina D (tabla 4). Los niveles de ingesta para los casos tuvieron tendencia a ser algo mayores, probablemente debido al número de individuos a los que se había aconsejado un aumento de la ingesta de calcio y vitamina D por los antecedentes de fracturas. Para los grupos combinados, sólo el 31% cumplía la IA para la ingesta de calcio y sólo el 41% cumplía la IA para la ingesta de vitamina D.
Entre los casos, no hubo correlaciones entre el nivel de ingesta de cualquier nutriente y el número de fracturas (valores de r2 inferiores a 0,07, valor de p = no significativo). Para ambos grupos no hubo correlaciones entre el nivel de ingesta de cualquier nutriente y la puntuación Z de la DMO (valores de r2 inferiores a 0,06, valor de p = no significativo).
Pruebas de laboratorio generalesPara todos los componentes del hemograma completo, velocidad de sedimentación, panel de bioquímica exhaustivo y análisis de orina, no hubo diferencias entre el grupo de casos y el de controles (datos no mostrados). No se observaron casos de valores anómalos de velocidad de sedimentación, concentración de TSH o niveles de anticuerpos antitransglutaminasa tisular. Los valores séricos de calcio, fosfato, magnesio, fosfatasa alcalina, PTH, 25-hidroxivitamina D, 1,25-dihidroxivitamina D fueron comparables entre el grupo de casos y el de controles. Utilizando un valor de punto de corte de los niveles de 25-hidroxivitamina D < 20 ng/ml para la insuficiencia de esta vitamina, se identificó en el 21% de casos y el 18% de los controles (valor de p = no significativo mediante prueba de la µ2). No hubo casos de déficit (niveles de 25-hidroxivitamina D < 10 ng/ml).
En un caso (pero en ninguno de los individuos del grupo de control) el nivel de 25-hidroxivitamina D se encontró en los límites de insuficiencia (15,5 ng/ml), junto con una concentración elevada de PTH (77 pg/ml, límites normales 9-52 pg/ml), lo que sugería un déficit funcional de la vitamina asociado a un hiperparatiroidismo secundario. En este individuo las concentraciones séricas de calcio, fósforo y fosfatasa alcalina fueron normales. Para este individuo las puntuaciones Z de la DMO de columna vertebral lumbar y corporal total también fueron normales (0,5 y 0,2, respectivamente).
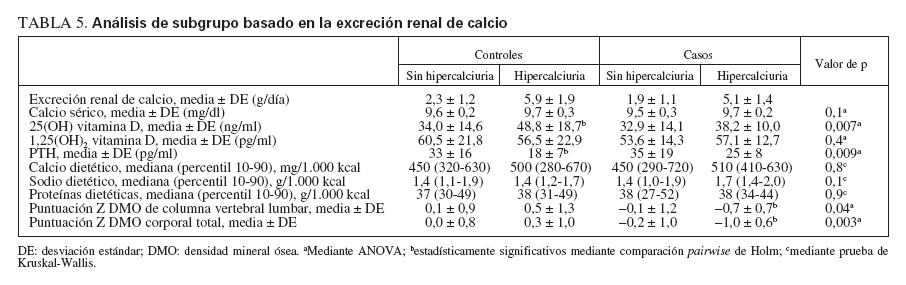
Excreción renal de calcioLa excreción renal diaria de calcio determinada mediante muestras de orina de 24 h no difirió entre grupos. Sin embargo, en ambos, encontramos un número elevado de individuos con hipercalciuria (definida como una excreción diaria de calcio en orina > 4 mg/kg/día18,19).
Para los casos, se detectó hipercalciuria en 13 de 66 (20%) y, entre los controles, en 13 de 57 (23%). Ninguno de los individuos refirió antecedentes de litiasis renal. El resto de pruebas de laboratorio renales fue normal, incluida la concentración sérica de creatinina y TP/TFG. Para identificar otras diferencias entre individuos con y sin hipercalciuria, se efectuaron análisis de subgrupo post hoc (tabla 5). Los niveles de 25-hidroxi-vitamina D fueron mayores en los individuos de control con hipercalciuria que en aquellos sin ella o en los casos con o sin hipercalciuria (p = 0,007 mediante análisis ANOVA, p = 0,001 mediante comparaciones pair-wise de Holm). No obstante, ninguno de estos valores se encontró en unos límites sugestivos de intoxicación por vitamina D. De forma parecida, la concentración de PTH fue más baja en los individuos de control con hipercalciuria que en aquellos sin ella o en los casos con o sin hipercalciuria (p = 0,009 mediante análisis ANOVA, p = 0,007 mediante comparaciones pair-wise de Holm).
TABLA 5. Análisis de subgrupo basado en la excreción renal de calcio
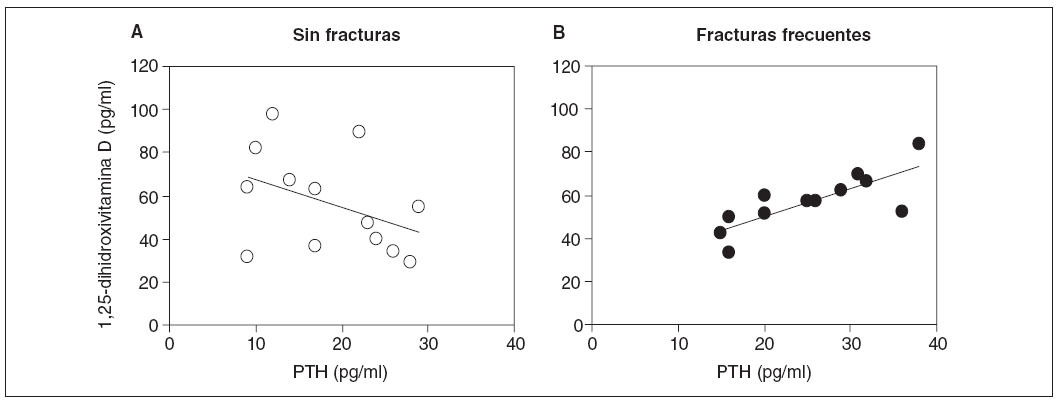
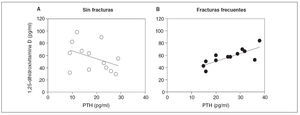
Otras comparaciones incluyeron los valores antropométricos, la puntuación de actividad con carga, ingestas dietéticas y valores de laboratorio. No se identificaron diferencias en las ingestas dietéticas de calcio, fosfato, magnesio, potasio o proteínas entre subgrupos. La in-gesta de sodio tuvo tendencia a ser mayor en los casos con hipercalciuria (tabla 5) pero la diferencia no alcanzó significación estadística. Este análisis no contó con la potencia para detectar este grado de diferencia. Los niveles de 1,25-dihidroxivitamina D no fueron diferentes entre grupos. Sin embargo, la relación entre la concentración de PTH y los niveles de 1,25-dihidroxivitamina D fue diferente entre grupos (fig. 2). Para los casos, entre la concentración de PTH y la de la vitamina se observó una correlación lineal positiva (r = 0,78, p = 0,003, n = 12), mientras que, entre individuos de control, se identificó una correlación negativa que no fue significativa (r = –0,40, p = 0,2, n = 13). La comparación de las dos regresiones demostró que eran significativamente diferentes (F = 3,8, p = 0,04); las pendientes fueron significativamente diferentes (1,29 ± 0,33 [± EE] comparado con –1,26 ± 0,87, p = 0,01).
Fig. 2. Correlación entre la concentración de PTH y 1,25-dihidroxivitamina D en niños con hipercalciuria idiopática. A la izquierda, correlación para niños con HI que nunca habían experimentado una fractura. Se muestra la línea de regresión (r = –0,40, p = 0,2, n = 13). A la derecha, niños con HI y antecedentes de fracturas frecuentes (r = 0,78, p = 0,003, n = 12). PTH: parathormona.
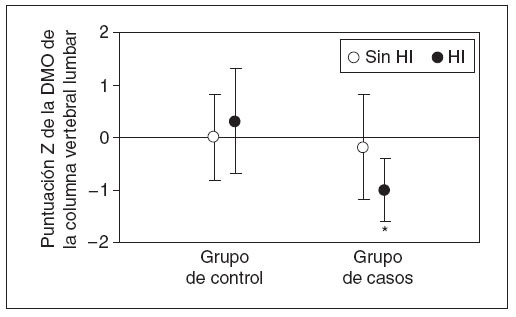
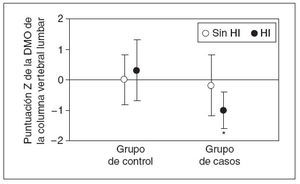
Acto seguido, se reexaminó la información obtenida en la DXA, segregando a los individuos con hipercalciuria (tabla 5, fig. 3). Los casos con hipercalciuria obtuvieron puntuaciones Z de la DMO sustancialmente más bajas comparado con los otros casos y con los individuos de control con o sin hipercalciuria. Además, en los casos con hipercalciuria, la disminución de la DMO representó prácticamente todos los valores bajos observados en el grupo de casos en conjunto.
Fig. 3. Efecto de la hipercalciuria idiopática sobre la densidad mineral ósea (DMO) corporal total. Se muestra la puntuación Z media de la DMO corporal total para individuos con excreción renal normal de calcio (< 4 mg/kg/día, círculos blancos) y elevada (> 4 mg/kg/día, círculos negros). En individuos con excreción normal, no hubo diferencias entre los casos y controles. Para individuos con excreción alta, en niños con fracturas frecuentes se observaron puntuaciones Z de la DMO significativamente más bajas (ANOVA, p = 0,003, *p = 0,002 comparado con grupo de control, p = 0,01 comparado con los casos sin hipercalciuria). DMO: densidad mineral ósea; HI: hipercalciuria idiopática.
DISCUSIÓNEl objetivo del presente estudio fue determinar el grado hasta el cual niños, por lo demás sanos, con antecedentes de múltiples fracturas deberían ser evaluados para una osteopatía metabólica oculta. Efectuamos una evaluación exhaustiva de la salud ósea en un grupo de estos niños junto con uno comparable de niños sin antecedentes de fracturas. En 68 niños con fracturas, encontramos tres casos (4%) de (probable) insuficiencia de calcio/vitamina D y un caso (1%) de retraso constitucional del crecimiento y la maduración. También identificamos 13 casos (20%) de hipercalciuria idiopática. Por lo tanto, en el 25% de niños que se presentaron con antecedentes de fracturas frecuentes, se puso de relieve una anomalía subyacente que potencialmente podía afectar a su salud ósea.
Los datos del presente estudio confirman las investigaciones previas en diversos aspectos. En niños con antecedentes de fracturas se observan valores más bajos de DMO que en aquellos sin estos antecedentes4,20 y los niños que evitan la leche corren un riesgo de reducción de la densidad mineral ósea y de fracturas21. En el presente estudio la mayor parte de niños y adolescentes no cumplían las directrices para la ingesta de calcio y vitamina D, hoy día un hallazgo habitual. No obstante, a diferencia de otros estudios20, no pudimos demostrar que estos déficit dietéticos produjeran un impacto en la densidad mineral ósea y no se asociaron con antecedentes de múltiples fracturas. De forma parecida, no demostramos una asociación entre la actividad con carga y la DMO, como se ha demostrado previamente15. Esto podría ser consecuencia de un tamaño de la muestra relativamente reducido, al igual que del uso de hermanos en el grupo de control.
En niños la utilización de una exploración DXA sigue suscitando controversia. Aunque la mayoría de investigadores coinciden en que, cuando se usa esta exploración, deben tenerse en cuenta la edad, sexo, raza/etnici-dad, estatura, peso, tamaño óseo y desarrollo sexual, no se ha alcanzado un consenso sobre el mejor modo de hacerlo22. Para el presente estudio, usamos datos de referencia basados en la edad y sexo, el protocolo disponible más ampliamente para los médicos.
En el presente estudio, en el 21% de niños se detectó hipercalciuria. Es probable que los niveles urinarios de calcio observados en el presente estudio sean en cierto modo una subestimación, debido a la obtención incompleta de muestras de orina. Ninguno de los individuos refirió antecedentes familiares de litiasis renal y no se observaron antecedentes o resultados de laboratorio sugestivos de las causas conocidas de hipercalciuria, incluido el hipertiroidismo, uso de glucocorticoides, inmovilización prolongada, intoxicación por vitamina D, hipercalcemia, hiperparatiroidismo primario, hiperfosfaturia o acidosis tubular renal. Además, en ninguno de los individuos se observó hiper o hipocalcemia. Por consiguiente, en estos niños se habría establecido el diagnóstico de hipercalciuria idiopática23 (HI). Al igual que la mayor parte de niños con HI, ninguno de los individuos tenía antecedentes de urolitiasis. Los datos del presente estudio sugieren que una mayor ingesta de so-dio, un factor de riesgo conocido de este proceso, podría haber sido un factor de contribución en los casos.
La hipercalciuria idiopática puede dividirse en tres tipos, partiendo de la etiología24. La hipercalciuria “absortiva” es consecuencia de una absorción excesiva de calcio a partir del tubo digestivo, por aumento directo de la absorción (es decir, ingesta excesiva de calcio) o a través de una absorción excesiva mediada por 1,25-dihi-droxivitamina D. En estos casos, la hipercalciuria es una respuesta fisiológica para prevenir la hipercalcemia. Los mecanismos de retroalimentación dan lugar (entre otras cosas) a una disminución de la concentración de PTH para limitar aún más la activación de vitamina D. La hipercalciuria “renal” es consecuencia de la disminución de la reabsorción de calcio en el riñón, a través de un defecto renal primario o debido a otros factores, tal como el aporte excesivo de sodio a los riñones. La pérdida consiguiente de calcio se traduce en mayores concentraciones de PTH para extraer el calcio del hueso y aumentar la activación de vitamina D con el objetivo de prevenir la hipocalcemia. La tercera categoría es la hipercalciuria “resortiva” y es consecuencia de una reabsorción ósea excesiva. Es la causa menos frecuente de HI. En los países industrializados la incidencia de este proceso ha aumentado, supuestamente debido a los cambios de la dieta25. La disminución de la DMO se ha asociado con HI en niños26-28, aunque no se han publicado estudios que demuestren una asociación con un mayor riesgo de fracturas. Borghi et al29 demostraron que en adultos con urolitiasis, la DMO era más baja en los individuos con hipercalciuria “independiente de la dieta” (en general, hipercalciuria “renal”) (puntuación Z media de la DMO de la columna vertebral lumbar –1,3) pero no en aquellos con hipercalciuria “dependiente de la dieta” (en general, hipercalciuria “absortiva”) (puntuación Z media de la DMO de la columna vertebral lumbar –0,3).
Comparamos a niños con y sin HI y con y sin antecedentes de fracturas frecuentes para identificar otras diferencias entre estos grupos. Para niños con fracturas e HI, se encontró una correlación firme, positiva entre la concentración de PTH y los niveles de 1,25-dihidroxivi-tamina D, característica de la HI “renal”24. En estos niños también se observó una disminución sustancial de la DMO. En ellos, la PTH fue el determinante primario de la 1alfa-hidroxilación de la 25-hidroxivitamina D y eran portadores de un hiperparatiroidismo relativo, secundario a la pérdida de calcio a partir de la hipercalciuria primaria. Por esta razón, estos problemas se combinan y disminuyen la acumulación de DMO por lo que aumentan el riesgo de fractura. En comparación, para los niños sin antecedentes de fracturas e HI, los niveles de 25-hi-droxivitamina D eran más altos, la concentración de PTH era más baja y no estaba presente una correlación entre ambos, lo que sugiere HI “absortiva”. En estos niños, la absorción excesiva de calcio redujo la concentración de PTH y no fue el determinante primario de la activación de vitamina D. En ellos la DMO no estaba afectada y, por lo tanto, no corrían un mayor riesgo de fracturas óseas.
CONCLUSIONESConcluimos que, aun cuando la incidencia de HI fue similar entre ambos grupos de casos y controles, sus etiologías fueron muy diferentes. En los individuos de control, la HI fue principalmente de naturaleza “absortiva” y, por lo tanto, no se asoció con valores bajos de DMO ni con un mayor riesgo de fractura. Entre los casos, la HI fue sobre todo de etiología “renal”, asociada con una disminución de la DMO y una causa potencial de un mayor riesgo de fracturas. Es importante destacar que, en el presente estudio, los hallazgos del calcio urinario se identificaron mediante un análisis post hoc y no fueron predecibles a priori. Por lo tanto, es muy probable que estas asociaciones observadas en el estudio se produjeran por casualidad. Además, esta investigación fue un estudio observacional de casos-controles. El emparejamiento imperfecto de los controles y un sesgo de selección involuntario podrían haber desempeñado un papel significativo en los hallazgos. Se requieren estudios prospectivos para una confirmación.
De forma parecida, Tannenbaum et al12 identificaron una HI no diagnosticada como factor contribuidor secundario de osteoporosis en el 9,8% de 173 mujeres posmenopáusicas.
El tratamiento recomendado de la hipercalciuria idiopática consiste en una pauta escalonada23. Inicialmente, el niño sigue una dieta que limita la ingesta de sodio a 2,0-2,4 g/día y se añade fruta y verduras para aumentar el aporte de potasio hasta 3,0-3,5 g/día. Si, después de 4-6 semanas, la hipercalciuria persiste, se añade citrato potásico en dosis de 1-1,5 mEq/kg/día. Si persiste la hipercalciuria (o el niño no tolera esta sal) se recomienda un diurético tiacídico. No se recomienda una limitación del calcio en la dieta del niño con HI, ya que puede traducirse en un balance negativo del mineral aumentando el riesgo de una menor mineralización ósea. Es preferible que su evaluación y tratamiento se dejen en manos de un médico experto en este proceso.
Hemos encontrado que, en niños con antecedentes de múltiples fracturas, la hipercalciuria se asocia con una disminución de la densidad mineral ósea. Además, en tres niños con múltiples fracturas se detectaron pruebas de ingesta insuficiente de calcio y/o vitamina D y en un niño se diagnosticó un retraso de la pubertad. A partir de estos hallazgos, concluimos que, para niños que se presentan con antecedentes de múltiples fracturas, la evaluación apropiada debe incluir tres fases. La primera es obtener una anamnesis de la dieta dirigida a la ingesta de calcio y vitamina D. En un niño con antecedentes sugestivos de déficit dietético, además de una exploración DXA, sería apropiado obtener unos niveles de 25-hidro-xivitamina D y una concentración de PTH. El segundo paso de cribado es una exploración física para evaluar un posible retraso puberal. En caso de sospecha, sería apropiada una exploración DXA y la derivación a un endocrinólogo para una evaluación adicional. El tercer paso es un examen de cribado para la hipercalciuria. Puede efectuarse fácilmente mediante una muestra de orina al azar para determinar el cociente calcio:creatini-na. En caso de aumento30 (cociente mg/mg > 0,2), está indicada una DXA y una evaluación en profundidad de la hipercalciuria. Para los niños en los que se observa una disminución de la DMO, se advertirá a las familias del posible aumento del riesgo de futuras fracturas hasta que se trate adecuadamente el problema subyacente.
Concluimos que, en ausencia de estos hallazgos en el examen de cribado, en niños con antecedentes de múltiples fracturas no es necesario solicitar una DXA. Es preciso destacar que, en niños que se presentan con antecedentes de fracturas pero que no muestran otros signos y síntomas y carecen de antecedentes familiares este algoritmo propuesto no detectaría las osteopatías primarias de carácter leve (como la osteogénesis imperfecta de tipo I). Esta situación es excepcional pero es preciso que los pediatras la consideren.
AGRADECIMIENTOEl presente estudio se financió mediante el Nemours Clinical Management Program.
Los autores desean agradecer la participación de las familias en el presente estudio, la ayuda de Kristen Farnham en las evaluaciones nutricionales y la excelente ayuda administrativa de Yvette Lui-Hing.
Correspondencia: Robert C. Olney, MD, Division of Pediatric Endocrinology, Nemours Children’s Clinic-Jacksonville, Jacksonville, FL 32207, Estados Unidos.
Correo electrónico: rolney@nemours.org