En individuos de raza blanca, la fibrosis quística (FQ) es la más frecuente enfermedad autosómica recesiva, progresiva, que amenaza la vida del paciente, afectando µ 1/2.500 recién nacidos1. El diagnóstico clínico (DC) puede ser difícil a menos que el paciente presente obstrucción intestinal2 (característicamente en alrededor del 13% de casos se produce un íleo meconial [IM]). En el resto de pacientes, la FQ se enmascara como infecciones persistentes de las vías respiratorias inferiores, falta de medro o estados diarreicos que se traducen en un retraso diagnóstico o en diagnósticos erróneos3-5. Por esta razón, numerosos países y estados están deliberando sobre el cribado del recién nacido (CRN) en busca de la FQ que puede facilitar el diagnóstico precoz (µ 2 meses de edad) de más del 90% de verdaderos positivos. Tanto los estudios prospectivos como los transversales que han comparado cohortes CRN y DC documentan una menor detención del crecimiento6-8. No obstante, algunos estudios9-13 pero no otros8,14,15 documentan mejores resultados pulmonares y el problema sigue siendo controvertido.
Una limitación de los datos actuales de resultados es la comparación de pacientes CRN con todos los pacientes DC con independencia de su edad en el momento del diagnóstico clínico. Algunos estudios han abordado parcialmente este problema excluyendo las presentaciones con un íleo meconial6,7,9-12,14,15 ya que no se benefician del cribado del recién nacido, principalmente porque presentan síntomas antes de completar el procesamiento de un resultado del CRN y una prueba confirmatoria del sudor (6-8 semanas). En consecuencia, es predecible que el CRN sólo beneficie a lactantes cuya presentación, por lo demás, se produciría después de este período de procesamiento, designado pragmáticamente en el presente estudio como el período más allá de los 2 primeros meses de vida (DC tardío).
Utilizando la UK CF Database (UKCFD), un registro de enfermedad validado apropiadamente8,16-18, probamos la hipótesis de que el diagnóstico en un plazo de dos meses del nacimiento mediante CRN o en los individuos sintomáticos, mediante DC precoz, se asocia con una mejora del resultado clínico comparado con el DC tardío. Por otra parte, probamos si los resultados se confundieron por diferencias intercohorte en la intensidad del tratamiento. Puesto que, en el momento del diagnóstico, la edad/fenotipo clínico de la FQ varían considerablemente y dependen parcialmente del genotipo cystic fibrosis transmembrane conductance regulator19,20 (CFTR), limitamos el presente análisis a los pacientes homocigotos para la mutación µF508 (el 50% de la mayor parte de poblaciones de ascendencia del norte de Europa) en los que se establecería el diagnóstico mediante la mayor parte de programas de CRN. Esta limitación tenía la ventaja adicional de que más del 95% de estos pacientes se presentan clínicamente en la primera infancia y, por lo tanto, disminuye el sesgo de verificación.
PACIENTES Y MÉTODOSCohorte del estudioSe obtuvieron datos de la UKCFD, se verificaron y se revisaron los errores según lo descrito recientemente8,17,21 y así mismo en la página www.cystic-fibrosis.org.uk. Todos los procedimientos cumplieron con los protocolos multicéntricos de ética de la investigación y con la legislación del Reino Unido con respecto a la confidencialidad de los pacientes. Fueron elegibles para el estudio los pacientes de 1-10 años de edad (entre el 2000 y 2002) a partir de la población de 7.294 de clínicas de fibrosis quística registrados en la UKCFD. Como se ha descrito previamente, en el Reino Unido el CRN para la FQ se limita a un reducido número de centros de FQ regionales8,16 (en 2002, µ 12% de pacientes se diagnosticaron mediante CRN). Además, el área geográfica en la que está disponible el cribado no siempre es congruente desde un punto de vista geográfico con la población remitida. Por lo tanto, algunos centros tratarán tanto a pacientes diagnosticados mediante CRN como a los diagnosticados partiendo de la presentación de síntomas. Por consiguiente, la población FQ del Reino Unido brinda la oportunidad de comparar los resultados entre cohortes de pacientes diagnosticados mediante CRN y DC.
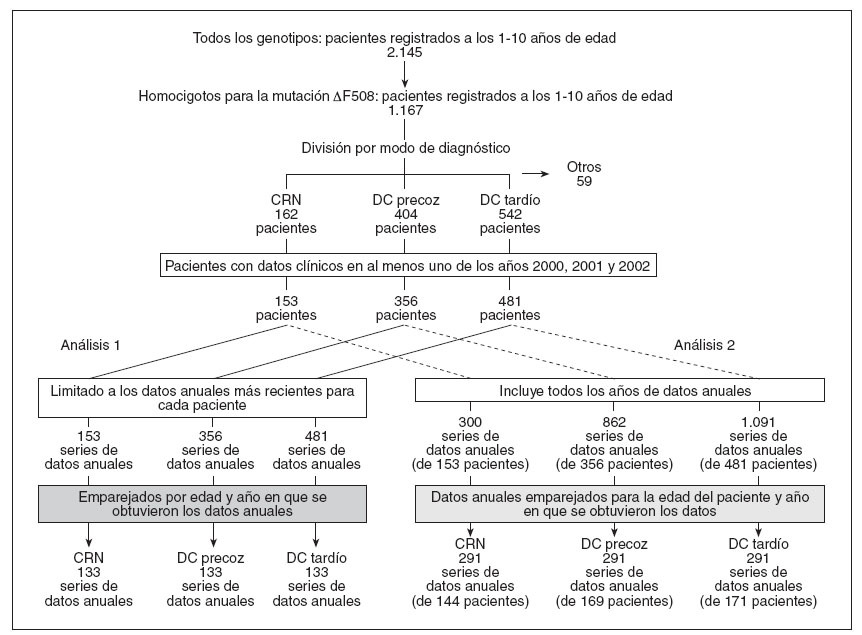
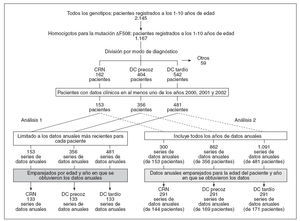
Como se resume en la figura 1, se crearon tres cohortes: CRN (diagnosticada mediante cribado de una gota de sangre seguido de una prueba del sudor confirmatoria a los dos meses del nacimiento; 162 pacientes), DC precoz (diagnosticados por la presentación clínica en un plazo de dos meses del nacimiento incluidos los diagnosticados mediante IM; 404 pacientes) y DC tardío (diagnosticados por la presentación clínica en cualquier momento después de los dos meses del nacimiento; 542 pacientes). Puesto que los pacientes diagnosticados mediante DC precoz siempre presentarían síntomas en un plazo de dos meses de nacer con independencia de la existencia de un programa de CRN, los pacientes diagnosticados tanto mediante CRN como DC precoz se incluyeron en la cohorte DC precoz. Se excluyó a los pacientes para los que no se dispuso de la edad en el momento del diagnóstico o el modo de presentación clínica, o para los que el diagnóstico de FQ se basó en antecedentes familiares significativos (con o sin presentación clínica), ya que estos pacientes se habrían diagnosticado precozmente con independencia del CRN (59 pacientes). En el Reino Unido, el cribado ante-natal o prenatal en busca de FQ se basa principalmente en la ecografía. Cuando se identifican pruebas de intestino ecogénico, puede efectuarse una amniocentesis para confirmar el diagnóstico. Con la excepción de un paciente DC precoz y otro DC tardío, todos los pacientes elegibles del estudio recibían tratamiento de reposición de enzimas pancreáticas según lo predecible para homocigotos para la mutación µF508.
Fig. 1. Identificación de las cohortes del estudio CRN, DC precoz y DC tardío para el análisis primario y secundario. Los pacientes UKCFD de 1-10 años de edad, homocigotos para la mutación F508, se estratificaron en las cohortes CRN, DC precoz y DC tardía. Los números de los pacientes están indicados a cada nivel. Se muestra el número final de series de datos emparejados en el análisis primario y secundario (columna izquierda y derecha, respectivamente). CRN: cribado del recién nacido; DC: diagnóstico clínico.
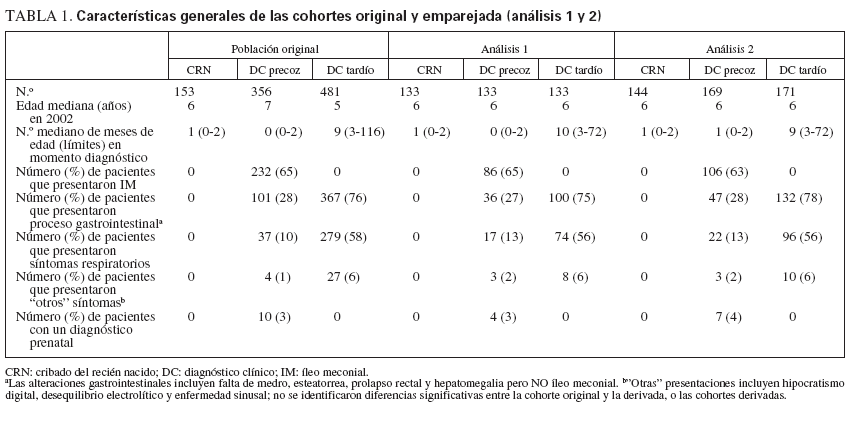
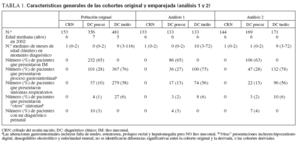
Se efectuaron dos análisis: en el análisis primario, se realizó un análisis transversal de las cohortes establecidas retrospectivamente para los años 2000 a 2002. Siguiendo la limitación del año más reciente de la obtención de los datos (AOD), los pacientes CRN se emparejaron en una base 1:1:1, por edad del paciente y AOD, utilizando un proceso de aleatorización basado en el identificador alfa numérico del paciente, con las series de datos DC precoz y DC tardío equivalentes. Se identificaron 133 pacientes por cohorte diagnóstica (fig. 1; análisis primario), cuyos datos demográficos se detallan en la tabla 1. Aunque este análisis facilitó la comparación directa de las cohortes, la restricción de los datos disponibles a la serie de datos más recientes por paciente generó una preponderancia de pacientes de 10 años de edad (31 de 133 [alrededor del 23%]). Dada la asociación de una gravedad creciente de la enfermedad con una edad cada vez mayor, esto podría haber sesgado el análisis del presente estudio hacia una población de mayor edad y, por lo tanto, con una afectación más grave. Para resolver este potencial factor de confusión, efectuamos un análisis secundario. En este análisis secundario, se incluyeron los tres años consecutivos de datos para cada paciente (fig. 1, análisis secundario) y los pacientes se emparejaron según lo descrito para el análisis primario. En este proceso de emparejamiento para pacientes con datos clínicos registrados entre 2000-2002 se incluyeron hasta 3 series anuales de datos (153 pacientes CRN, 356 DC precoz y 481 DC tardío). Tras la exclusión de los casos no emparejados, se identificaron 291 emparejamientos exclusivos de 3 vías que generaron datos de 144 CRN, 169 DC precoz y 171 DC tardío (tabla 1). En comparación con el análisis primario, en el análisis secundario, las series de datos emparejados se distribuyeron uniformemente a través de todas las edades.
TABLA 1. Características generales de las cohortes original y emparejada (análisis 1 y 2)
Los resultados clínicos de pacientes DC precoz y DC tardío se compararon frente a los resultados de la cohorte CRN (no se efectuó una comparación de los pacientes DC precoz frente a DC tardío). En el análisis tanto primario como secundario no fue posible emparejar las cohortes por centro de tratamiento debido al número insuficiente de pacientes. Como se detalla en la tabla 1, no se identificaron diferencias en la edad en 2002 o la edad en el momento del diagnóstico de la FQ, o la proporción de pacientes cuya presentación fue un IM, otras alteraciones gastrointestinales o síntomas respiratorios entre las poblaciones originales y las cohortes emparejadas del estudio.
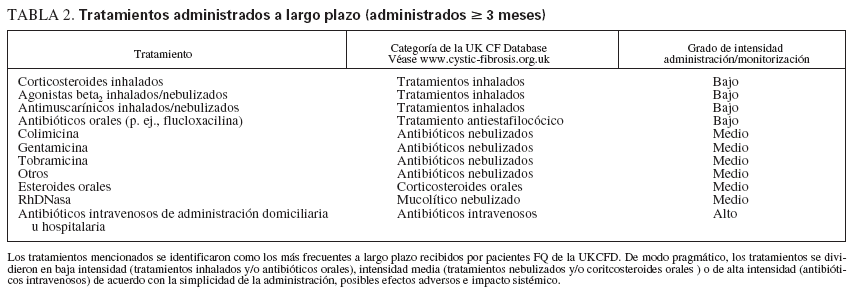
Variables analizadasPara cada cohorte diagnóstica se compararon las medianas de las variables: puntuaciones z de la estatura y peso, puntuaciones de morbilidad de Shwachman-Kulczyki (puntuación de Shwachman) y volumen espiratorio forzado en el primer segundo como % del valor de referencia (FEV1 %; sólo pacientes µ 6 años de edad). Cuando estuvieron disponibles dos o más registros de una variable con el mismo AOD, se utilizó la media de los valores, según lo descrito previamente8,21. También se compararon el número total mediano de tratamientos a largo plazo (prescritos durante > 3 meses; tabla 2) y la proporción de pacientes tratados con una baja intensidad del tratamiento, intensidad moderada o intensidad alta (según lo definido en la tabla 2); > 3 tratamientos a largo plazo, µ 2 tratamientos nebulizados, sin antibióticos intravenosos (IV) y µ 2 tandas de antibióticos IV. Para determinar si el tratamiento reflejó la gravedad de la enfermedad, como marcador indirecto de la gravedad se utilizó la infección por Pseudomonas aeruginosa. La UKCFD define la infección por Pseudomonas aeruginosa como intermitente (1 o 2 cultivos positivos en 12 meses) o crónica (3 o más cultivos positivos en 12 meses). Las cohortes CRN, DC precoz y DC tardío se estratificaron de acuerdo con el estado de la infección por Pseudomonas aeruginosa y se determinaron las necesidades de tratamiento a largo plazo. Las variables examinadas en el análisis secundario fueron las puntuaciones z de la estatura y peso, puntuación de Shwachman, FEV1 % y el número total de tratamientos a largo plazo. Debido a la posibilidad de confusión por las medidas repetidas, para este análisis secundario no se permitieron comparaciones directas intercohorte aunque el uso de múltiples datos por paciente facilitó las comparaciones transversales múltiples emparejadas para la edad de forma similar a las efectuadas prospectivamente por Farell et al6,7,14.
TABLA 2. Tratamientos administrados a largo plazo (administrados ≥ 3 meses)
Análisis estadísticoEn los análisis de la UCKFD se utilizaron Microsoft Access y Excel (Microsoft Corporation, Redmond, Washington, EE.UU.), con gráficos creados en SigmaPlot (SigmaPlot para Windows version 4.01; SPSS Inc., Chicago, IL, EE.UU.). Los análisis estadísticos se efectuaron utilizando el programa MINITAB versión 13.1 (Minitab Inc., State College, Pensilvania, EE.UU.) y el programa Stata SE 8.2 (StataCorp LP, College Station, Texas, EE.UU.) En el análisis primario los datos no tuvieron una distribución normal. Para determinar diferencias estadísticamente significativas entre medianas se utilizó la prueba de Mann-Whitney. Para la comparación de las proporciones de cada cohorte, se consideró que los tamaños de la cohorte eran lo suficientemente extensos como para aplicar el teorema del límite central22. Dadas las comparaciones múltiples, se consideró que un valor de p < 0,01 representaba una diferencia significativa. De hecho, utilizando la corrección de Bonferroni para comparaciones múltiples, el valor de p real debía ser de 0,017 pero decidimos reducirlo para ser más conservadores. En el análisis secundario, la puntuación z de la estatura y peso, puntuación SK y el FEV1 % se compararon utilizando un modelo ANOVA de efectos aleatorios, lo que permitió la variación entre niños en el número de años de los datos que contribuyeron e incluyó un efecto de cohorte, una tendencia temporal y una interacción.
Los tratamientos a largo plazo se compararon utilizando un modelo ANOVA de efectos aleatorios de Poisson y los resultados se presentaron como riesgos relativos (RR).
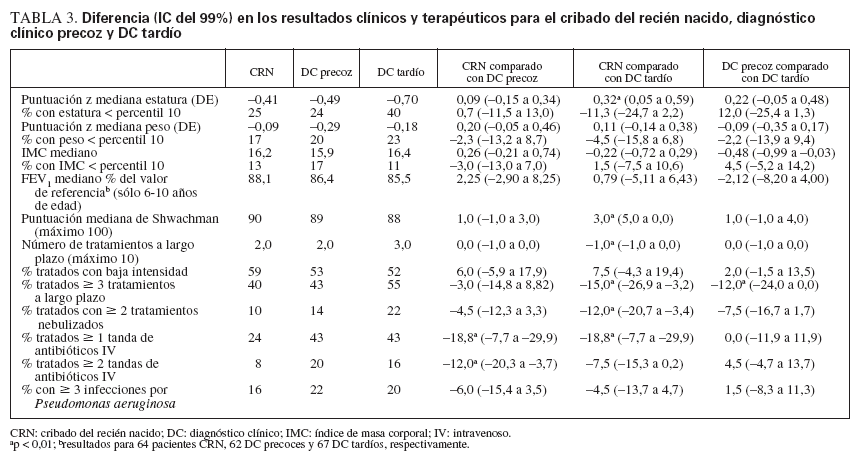
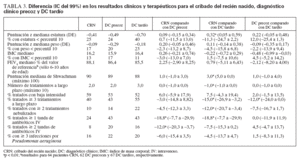
RESULTADOSAnálisis primarioEn pacientes CRN se identificaron puntuaciones z de estatura y una puntuación de Shwachman significativa-mente más altas (es decir, gozaban de mejor salud), y un menor número de pacientes se encontraron por debajo del percentil 10 para la estatura comparado con pacientes DC tardío (tabla 3). No se identificaron diferencias en el FEV1 %. No se identificaron diferencias en los resultados clínicos entre las cohortes CRN comparado con DC precoz o entre las cohortes DC precoz comparado con DC tardío.
TABLA 3. Diferencia (IC del 99%) en los resultados clínicos y terapéuticos para el cribado del recién nacido, diagnóstico clínico precoz y DC tardío
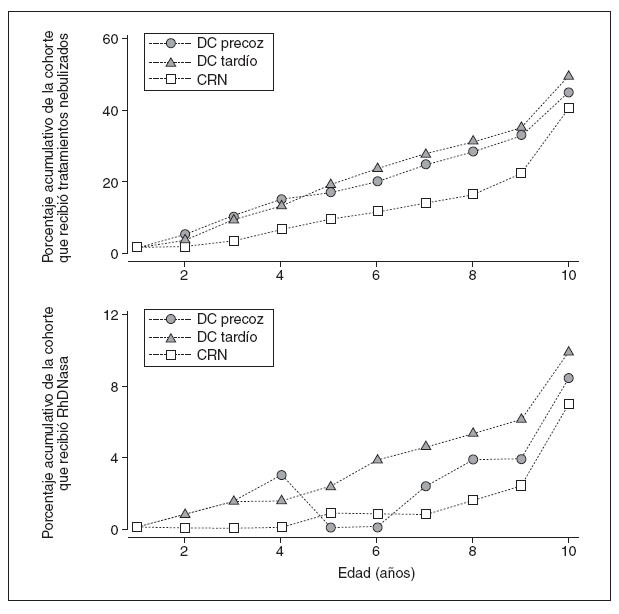
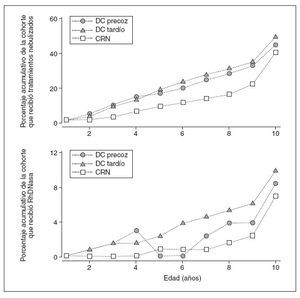
Los pacientes CRN recibían un número significativa-mente menor de tratamientos a largo plazo que los pacientes DC tardío. Además, un menor número de pacientes CRN recibía µ 3 tratamientos a largo plazo, µ 2 tratamientos nebulizados o antibióticos IV. De hecho, una mayor proporción acumulativa de pacientes de las cohortes DC precoz y DC tardío recibía tratamientos nebulizados y, de manera específica, RhDNasa, comparado con los de la cohorte CRN (fig. 2). En conjunto, no se identificaron diferencias en los resultados del tratamiento a largo plazo para las cohortes DC precoz frente a DC tardío.
Fig. 2. Mayor uso de tratamientos nebulizados y RhDNasa en las cohortes de pacientes DC precoz y DC tardío comparado con la CRN (análisis primario). Porcentaje acumulativo relacionado con la edad de los pacientes de las cohortes DC precoz, DC tardía y CRN que recibieron cualquier tratamiento nebulizado a largo plazo (> 3 meses) (figura superior; definido como un antibiótico [v. tabla 2] o RhDNasa), o RhDNasa (figura inferior). Obsérvese la diferencia en la escala del eje y. CRN: cribado del recién nacido; DC: diagnóstico clínico.
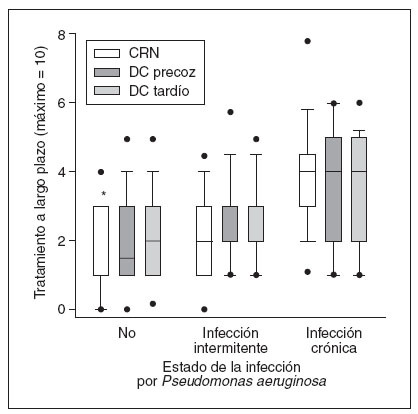
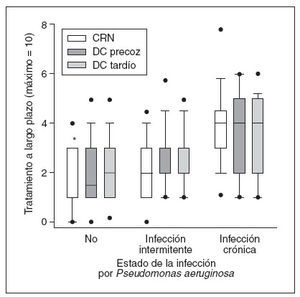
La infección crónica por Pseudomonas aeruginosa (PA) es un marcador de mal pronóstico. En conjunto, no se identificaron diferencias en la prevalencia de infección crónica o intermitente entre cohortes, pero de la cohorte CRN en un número significativamente menor de pacientes de 1-5 años de edad se documentó infección crónica comparado con la cohorte DC tardía (3% comparado con 14%; diferencia del –11%; IC del 95%: –1,4 a –20,5). Los pacientes CRN sin infección por PA (fig. 3) recibían un menor número de tratamientos a largo plazo comparado con los pacientes emparejados de la cohorte DC tardío pero no de la cohorte DC precoz. No se observó una diferencia en los tratamientos a largo plazo entre cohortes con infección intermitente o crónica por PA. Para todas las cohortes, un mayor número de tratamientos a largo plazo se asoció con el estado de la infección por PA en un orden de categoría sin infección por PA < infección intermitente por PA < infección crónica por PA. Entre la cohorte DC precoz y DC tardío no se observaron diferencias en la proporción de pacientes con infección por PA (intermitente o crónica) o con respecto a las necesidades de tratamiento para pacientes con y sin infección por PA (datos no mostrados).
Fig. 3. El grado creciente de la infección por Pseudomonas aeruginosa (PA), y no el modo de diagnóstico, determina las necesidades de tratamiento a largo plazo (análisis primario). Número mediano (límites intercuartil) de tratamientos a largo plazo para las cohortes DC precoz (cuadros oscuros), DC tardío (cuadros grises) y CRN (cuadros blancos) estratificados de acuerdo con la ausencia de infección por PA, infección intermitente o crónica. Las barras negras indican un valor mediano y los topos negros muestran el IC del 5/95%. *Indica una diferencia significativa entre las cohortes CRN y DC tardío. Para las barras 1, 5 y 6, el número mediano de tratamientos a largo plazo es de 1, 2 y 2, respectivamente. CRN: cribado del recién nacido; DC: diagnóstico clínico.
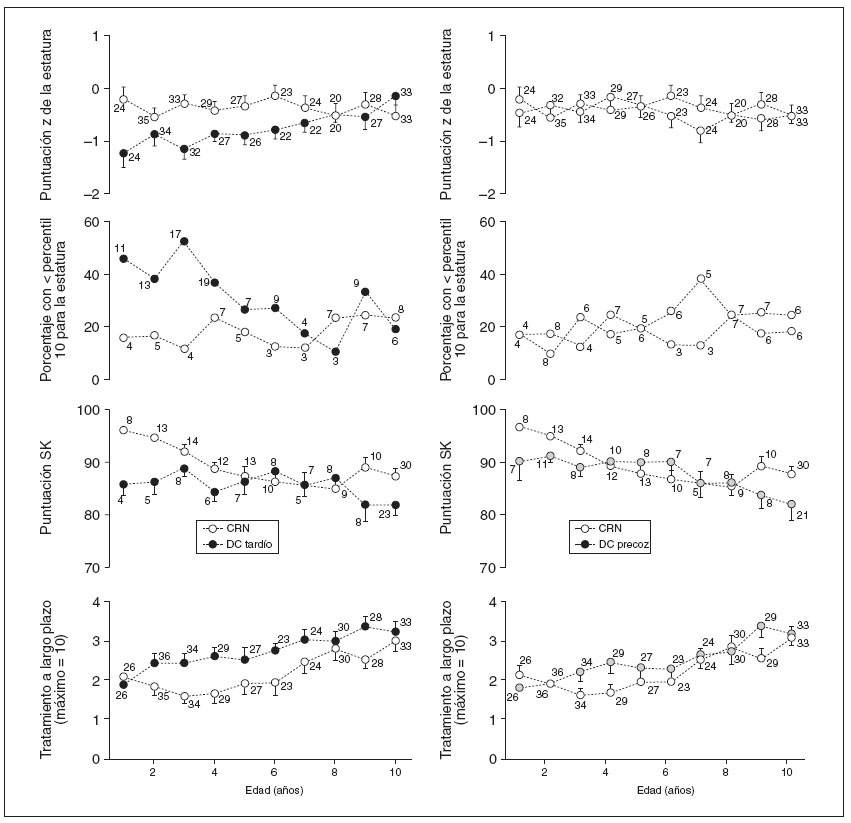
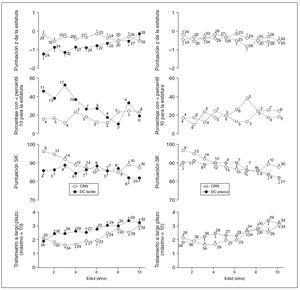
Análisis secundarioEn pacientes DC tardío pero no DC precoz se identificaron puntuaciones z de estatura significativamente más bajas comparado con pacientes CRN, que persistieron hasta los 7,5 años de edad (diferencia media –0,87 DE [IC del 95%: –0,48 a –1,25; p = 0,0001] y –0,12 DE [IC del 95%: –0,27 a 0,51; p = 0,555], respectivamente; fig. 4). Comparado con la cohorte CRN, sólo la puntuación z para la estatura aumentó significativamente con el tiempo para la cohorte DC tardío (media de 0,09 DE por año; IC del 95%: 0,03 a 0,15). Tanto en la cohorte DC tardío como DC precoz se identificó una puntuación de Shwachman más baja comparado con la cohorte CRN, aunque la diferencia entre esta cohorte y la cohorte DC precoz no alcanzó significación estadística (diferencia media de –6,36 [IC del 95%: –10,73 a –2,00; p = 0,004] y –3,47 [IC del 95%: –7,72 a 0,78; p = 0,110], respectivamente; fig. 3). Con independencia del modo de diagnóstico, se puso de relieve que la puntuación de Shwachman disminuía significativamente con el tiempo (–0,97/año; IC del 95%: –1,41 a –0,53; p < 0,001). No obstante, no se identificaron diferencias en la tendencia temporal para la puntuación de Shwachman entre las cohortes CRN y DC tardío o CRN y DC precoz (0,49/año; –0,19 a 1,15 y 0,14/año; –0,52 a 0,80, respectivamente). Para la puntuación z de la estatura y el FEV1 %, no se identificaron diferencias entre las cohortes CRN y DC tardío o la cohorte CRN y DC precoz.
Comparado con la cohorte CRN, para la cohorte DC tardío se observó una tendencia hacia una mayor necesidad de tratamiento a largo plazo (RR medio 1,30; IC del 95%: 0,99 a 1,70; p = 0,063), pero no la cohorte DC precoz (1,10 [IC del 95%: 0,83 a 1,45; p = 0,505]), aunque la diferencia casi alcanzó significación estadística (fig. 4). Como es predecible para una enfermedad crónica, con independencia del modo de diagnóstico, una edad cada vez mayor se asoció con un aumento del 6% anual en la necesidad de tratamiento a largo plazo (RR medio 1,06; IC del 95%: 1,03 a 1,10; p < 0,001).
DISCUSIÓNDe acuerdo con la base de datos de fibrosis quística del Reino Unido (UK CF Database), en ausencia de un programa de CRN, con frecuencia, los pacientes FQ homocigotos para la mutación común µF508 se presentan después de los dos meses de edad, estableciéndose el diagnóstico en más del 95% a los 6 años de edad (E. Sims, datos no publicados). Los datos del presente estudio demuestran que los beneficios del CRN se asocian con un diagnóstico presintomático, precoz (al cabo de dos meses de nacer) comparado con un diagnóstico clínico después de la típica ventana de notificación a los dos meses del CRN. Comparado con individuos emparejados genéticamente, diagnosticados de forma tardía, los pacientes diagnosticados mediante CRN eran de mayor estatura, presentaron una menor morbilidad (es decir mayor puntuación de Shwachman), recibían menos tratamientos aunque presentaban una función pulmonar similar. Y lo que es más importante, demostramos que aun recibiendo un menor número de tratamientos, pueden obtenerse resultados pulmonares similares en pacientes FQ genéticamente similares diagnosticados mediante CRN comparado con pacientes DC. De hecho, puesto que los médicos responden a los signos y síntomas de gravedad creciente de la enfermedad, los datos del presente estudio y de otros estudios de pacientes FQ de genotipos mixtos8,16 sugieren que la carga del tratamiento es un marcador indirecto razonable y justificable de la gravedad creciente de la enfermedad (es decir, una menor puntuación de Shwachaman) más que una peor función pulmonar que se manifiesta más tarde. Una explicación alternativa de los resultados del presente estudio podría ser que los médicos tratan a los pacientes DC tardío más agresivamente que a los sometidos a CRN partiendo de que en aquéllos se ha establecido el diagnóstico más tarde. Sin embargo, la mayor morbilidad y la peor puntuación z para la estatura observadas en la cohorte DC tardío y como respuesta a la infección intermitente o crónica por PA el tratamiento comparable al de pacientes CRN o DC precoz sugeriría que, con independencia del modo de diagnóstico, los pacientes recibieron un tratamiento proporcional a los signos y síntomas más que partiendo de una base preventiva. De hecho, las directrices de la Cystic Fibrosis Trust del Reino Unido recomiendan un tratamiento apropiado a la gravedad de la enfermedad, con la excepción del tratamiento profiláctico para la infección por Staphylococcus aureus (flucloxacilina oral). Como sería predecible, no identificamos una diferencia terapéutica o nutricional entre las cohortes CRN y DC precoz, lo que sugiere que el cribado del recién nacido beneficia a la mayor parte de estos pacientes que de otro modo se habrían pasado por alto o habrían experimentado un retraso del diagnóstico (p. ej., cohorte DC tardío), la precisa razón de un programa de cribado.
No se han descrito comparaciones previas de cohortes CRN y DC precoz, a pesar de que se han descrito dos comparaciones de cohortes CRN y de diagnóstico de 23,24. En ambos estudios se observaron resultados clínicos comparables a los del presente estudio, aunque en comparación con éste, los estudios mencionados previamente revelaron un valor significativamente más bajo del FEV1 % para las cohortes diagnosticadas con IM comparado con CRN. Sin embargo, la limitación de la cohorte DC precoz del paciente estudio a pacientes con un diagnóstico de IM (86 de 133) no alteró los resultados del presente estudio (datos no mostrados). Li et al24 describieron que la disminución del FEV1 % para la cohorte diagnosticada con IM sólo se hizo evidente a los 8-10 años de edad y la edad más joven de las cohortes del presente estudio podría explicar esta discrepancia. Por otra parte, las mejoras del tratamiento quirúrgico, o el tratamiento más agresivo de la infección por Pseudomonas aeruginosa en el Reino Unido25 comparado con el de Australia23 y el de EE.UU.24 podrían ser factores explicativos. Otra posibilidad remota es que, aunque todos los pacientes del presente estudio eran homocigotos para el genotipo µF508, la cohorte DC precoz podría representar un subgrupo que manifestara un fenotipo más grave en el espectro de la gravedad del genotipo µF508.
En un estudio de un centro individual se compararon pacientes DC precoz y DC tardío26. Coincidiendo con este estudio, no identificamos diferencias en los resultados clínicos de cohortes DC precoz y DC tardío de pacientes emparejados. Sin embargo, a diferencia de dicho estudio longitudinal, sólo identificamos diferencias mínimas en las necesidades de tratamiento. Puesto que los pacientes de este estudio se reclutaron durante un período de 17 años durante el que se introdujeron nuevos tratamientos de la insuficiencia pancreática y protocolos clínicos y dietéticos/antimicrobianos6,14, es posible que dicho estudio pudiera haber estado confundido por un efecto de cohorte27.
Las diferencias en la distribución de edad de las cohortes en el análisis primario y secundario podrían explicar el exceso significativo de tratamientos a largo plazo observado en la cohorte DC tardío comparado con la cohorte CRN en el análisis primario, pero esto sólo se observó como tendencia en el análisis secundario. La persistencia de menores necesidades de tratamiento y una mejora de la morbilidad después del CRN con una edad creciente podría explicar la razón de que las mujeres embarazadas con FQ presenten resultados significativamente mejores de la fertilidad si su diagnóstico se estableció mediante CRN28, lo que sugieren que el estrés del embarazo es mejor tolerado en cohortes sometidas a un cribado. Por lo tanto, el CRN podría beneficiar a la próxima generación de familias afectadas por el CRN.
Los análisis del presente estudio podrían ser propensos a diversos sesgos. En primer lugar, el uso del emparejamiento de pacientes podría haber introducido un sesgo de selección. No obstante, puesto que los pacientes se emparejaron aleatoriamente y no se identificaron diferencias en la edad en el momento del diagnóstico entre la población original y las cohortes derivadas, es poco probable. Así mismo, aunque la restricción de las cohortes del estudio a los pacientes homocigotos para el genotipo µF508 aumentó al máximo la comparabilidad de las cohortes desde un punto de vista de la gravedad potencial de la enfermedad, redujo la probabilidad de inclusión de pacientes con fenotipos FQ atípicos asociados con genotipos diferentes del homocigoto para µF508 que podrían diagnosticarse a través del CRN (según el protocolo de cribado), lo que potencialmente sesgaría el estudio en contra de éste. En segundo lugar, la estratificación de pacientes en CRN, DC precoz y DC tardío podría haber introducido un sesgo de verificación. Además, algunos pacientes homocigotos para la mutación µF508 con un fenotipo de FQ muy leve podrían estar representados en el grupo de cribado del RN pero no en la cohorte DC tardío porque no habrían recibido el diagnóstico dentro del marco de tiempo del estudio, lo que sesgaría el estudio a favor del CRN. No obstante, puesto que sólo 64 de 3.797 pacientes (1,68%) homocigotos para el genotipo µF508 recibieron el diagnóstico después de los 10 años de edad, es poco probable que esto produjera una repercusión significativa en los resultados del presente estudio. Así mismo, los pacientes DC con una enfermedad muy grave que de otro modo se habrían incluido en la cohorte de diagnóstico tardío podrían haber fallecido antes de que se hubiera llevado a cabo el estudio, sesgando potencialmente el estudio en contra del CRN. Sin embargo, una vez más, esto es poco probable ya que una revisión reciente de las muertes FQ reveló que, en 2002, sólo habían fallecido 3 pacientes menores de 10 años de edad, de los que 2 eran DC precoz (ambos IM) y uno era DC tardío (A. Mehta, datos no publicados, 2005). De hecho, en una revisión sistemática reciente cuyos autores examinaron el impacto potencial del cribado del recién nacido en la supervivencia de los pacientes se llegó a la conclusión de que, hasta los 10 años de edad, el CRN se asocia con una disminución del riesgo de mortalidad de 2-10/100 niños con FQ (sin IM) comparado con niños FQ DC29. En tercer lugar, el uso de datos que se extendieron durante un período de tiempo de 3 años, cuya agrupación produce una población del estudio que se extiende hasta 13 años, podría haber introducido un sesgo de cohorte27. No obstante, puesto que el tratamiento nutricional moderno (en especial el tratamiento de reposición con enzimas pancreáticas resistentes al ácido) ha estado disponible para todos los pacientes desde finales de la década de los ochenta, es poco probable que la mejora de la nutrición hubiera introducido un amplio efecto de cohorte. Además, puesto que todos los pacientes del presente estudio recibían tratamiento en centros especializados en FQ o tratamiento proveído en asociación con un centro especializado en FQ según un marco de tratamiento compartido, es probable que las cohortes hubieran recibido un tratamiento comparable y tratamiento antimicrobiano de acuerdo con las directrices nacionales25,30, aunque puedan existir algunas preferencias clínicas. De hecho, entre 1990 y 2002, no se han efectuado cambios sustanciales en las estrategias o directrices de tratamiento de la 25,30. Además, dada la comparabilidad directa de los datos de los resultados CRN en el RU con los de un estudio prospectivo de EE.UU.8, y la similitud con los datos de los resultados de otros registros nacionales descritos en los estudios publicados6,7,9,13,15, es poco probable que los resultados del presente estudio puedan explicarse por un sesgo desconocido o los problemas potenciales asociados a los análisis de bases de datos como se describen con detalle en otras publicaciones31,32. Puesto que en el Reino Unido sólo están instaurados programas CRN en una minoría de centros especializados en FQ, podría argumentarse que las diferencias descritas en el presente estudio serían atribuibles a las diferencias de la práctica clínica dentro del reducido número de centros FQ que llevan a cabo un cribado del recién nacido, y no al modo de diagnóstico. Sin embargo, esto es poco probable, ya que previamente demostramos una magnitud comparable de beneficio desde un punto de vista de la estatura, puntuación de Shwachman y número de tratamientos a largo plazo para pacientes CRN comparado con pacientes DC cuando limitamos los análisis del presente estudio exclusivamente a los centros que recibían el 15-85% de remisiones de CRN, comparado con todos los centros especializados en FQ del Reino Unido16. Por último, aunque describimos diferencias significativas en los resultados clínicos y de tratamiento entre pacientes que se presentarían clínicamente con FQ antes de los 10 años de edad, no pudimos determinar si un diagnóstico mediante CRN habría sido beneficioso sobre un DC en pacientes con FQ leve y que de otro modo se presentarían con síntomas más tarde en la vida.
Hasta 2002 inclusive, en el RU en el tratamiento de la FQ se utilizaba una estrategia reactiva más que proactiva25. En realidad, con la excepción del tratamiento oral a largo plazo con flucloxacilina, el uso de tratamientos a largo plazo incluido el mucolítico rhDNasa (debido a las limitaciones de financiación) y los antibióticos nebulizados (incluida una solución de tobramicina [TOBI]) se centraba principalmente en atenuar más que prevenir la gravedad creciente de la enfermedad. También es preciso destacar que, hasta 2002 inclusive, en el RU el antibiótico nebulizado TOBI se usaba principalmente como tratamiento de segunda línea para la infección crónica por Pseudomonas aeruginosa tras la resistencia o intolerancia a colistina o gentamicina, mientras que la azitromicina, un macrólido con propiedades inmunomoduladoras, sólo se utilizaba en un número muy reducido de centros. Las menores necesidades de tratamiento asociadas con el cribado del recién nacido demostradas en el presente estudio sugerirían que pueden implicarse ahorros considerables de los costes en favor del CRN. Sin embargo, la demostración de que la rhDNasa es potencialmente más beneficiosa en pacientes con FQ leve más que en aquellos con enfermedad moderada o grave ha propiciado su uso proactivo cada vez más precoz en pacientes más jóvenes con una enfermedad más leve33. Dados los elevados costes asociados con el tratamiento a largo plazo con rhDNasa y TOBI, el uso cada vez mayor de estos tratamientos puede absorber algunos de estos ahorros potenciales. Por otra parte, si en pacientes con un diagnóstico CRN y una enfermedad muy leve el uso de rhDNasa conserva adicionalmente su buena salud, el menor número de visitas hospitalarias podría traducirse en sustanciales reducciones de los costes hospitalarios e indirectos.
De crucial importancia, los responsables de la política han utilizado de manera difundida el razonamiento de que el cribado de la fibrosis quística no es beneficioso puesto que la función pulmonar no es mejor para pacientes FQ diagnosticados mediante aquél. Sin embargo, a pesar de que los datos del presente estudio confirman que no están presentes diferencias de la función pulmonar entre pacientes pediátricos con un diagnóstico CRN o DC tardío, los niños diagnosticados mediante el cribado al nacer reciben un número significativamente menor de tratamientos a largo plazo y presentan un mejor crecimiento y menos morbilidad que los individuos de control DC tardío. Además, puesto que la tasa de disminución de la puntuación de Shwachman (1% anual) coincidió a través de todas las cohortes y no se observó un cambio temporal, la menor puntuación para la cohorte DC tardío podría deberse a la mayor morbilidad (posiblemente relacionada con una inflamación de las vías respiratorias, desnutrición o infección pulmonar no tratadas) en el período previo al diagnóstico. Puesto que en pacientes que recibieron un menor número de tratamientos a largo plazo se identificó una menor morbilidad, es razonable sugerir que es probable que estos pacientes incurran en un menor coste de asistencia sanitaria. Por lo tanto, el diagnóstico presintomático, precoz mediante cribado del recién nacido, puede ofrecer ahorros a largo plazo potenciales en el presupuesto de los fármacos y de asistencia sanitaria sobre la presentación clínica tardía, que podría compensar parte o todo el coste de instaurar un programa de CRN, a pesar de que el coste del uso creciente de los tratamientos profilácticos (p. ej., rhD-Nasa) en pacientes con síntomas leves sería mayor que algunos de estos ahorros potenciales.
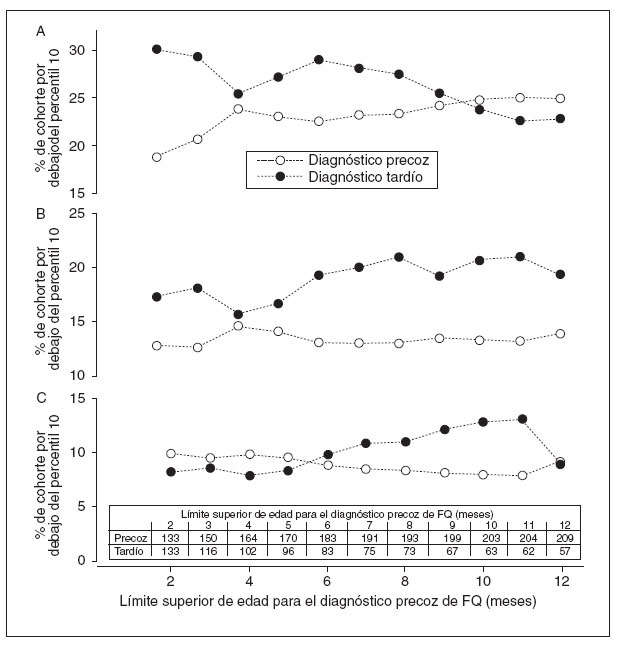
Shwachman et al34 crearon la definición actual de diagnóstico precoz de la FQ en un plazo de 3 meses del nacimiento en la década de los setenta. No obstante, desde la publicación de este artículo que marcó un hito, las mejoras significativas de la tecnología rápida, basada en el laboratorio, de los análisis de tripsinógeno inmunorreactivo (TIR) y el cribado de la mutación ADN CFTR significan que en la actualidad es posible un diagnóstico positivo de la FQ utilizando un programa de cribado TIR/TIR o TIR/ADN (o una combinación) para efectuar en un plazo de dos meses del nacimiento. De hecho, como se indica en la figura 5, la exclusión de pacientes diagnosticados por la presentación de síntomas al cabo de dos meses de nacer (es decir, grupo DC precoz), aumentando la ventana del diagnóstico desde los dos a los tres meses o más allá, incrementa la proporción de pacientes con problemas de crecimiento a largo plazo (es decir, estatura por debajo del percentil 10). Por lo tanto, partiendo de los resultados del presente estudio, proponemos una nueva definición del diagnóstico precoz de FQ para establecer el diagnóstico a los dos meses del nacimiento.
Fig. 4. El CRN se asocia con una mejora de los resultados clínicos y un menor número de tratamientos a largo plazo comparado con el DC tardío pero no el DC precoz (análisis secundario). Comparación de la media (EEM) de la puntuación z de la estatura (figura superior), puntuación de Shwachman (segunda a inferior) y necesidades de tratamiento a largo plazo (inferior) para la cohorte CRN (símbolos blancos) comparado con la cohorte DC tardío (símbolos negros; columna izquierda), y las cohortes CRN comparado con DC precoz (símbolos grises; columna derecha). Los números indican el número de pacientes. Las figuras segunda a superior muestran la proporción de cada cohorte por edad por debajo del percentil 10 para la estatura. En las figuras superiores se muestra el número total de pacientes en cada grupo de edad. CRN: cribado del recién nacido; DC: diagnóstico clínico.
Fig. 5. La ventana cada vez mayor de diagnóstico precoz se asocia con un peor resultado del crecimiento. Análisis de sensibilidad del porcentaje de pacientes por debajo del percentil 10 para la estatura (figura superior), peso (figura del centro) e IMC (figura inferior) en la cohorte de diagnóstico precoz y diagnóstico tardío con una ventana cada vez mayor del diagnóstico precoz. Se excluyen de este análisis los pacientes diagnosticados por la presentación de síntomas clínicos en un plazo de dos meses de edad. Para todas las figuras, los resultados mostrados a los dos meses de edad corresponden a los resultados mostrados en la tabla 3. Puesto que la definición de diagnóstico precoz aumenta a la derecha, los pacientes con diagnóstico tardío se introducen en la cohorte de diagnóstico precoz aumentando el tamaño de esta cohorte como se muestra en la tabla en la parte inferior de la figura. FQ: fibrosis quística.
CONCLUSIONESEn ausencia de un programa de cribado del recién nacido, los pacientes FQ, cuyo diagnóstico se establece por la presentación de síntomas después de los dos meses de edad, manifiestan peores resultados clínicos pese a recibir mayores niveles de tratamiento a largo plazo durante como mínimo los 10 primeros años. El cribado del recién nacido en busca de fibrosis quística brinda la oportunidad de aumentar al máximo el potencial clínico de los pacientes cuya supervivencia de otro modo puede limitarse a la edad adulta temprana. Aunque el cribado del recién nacido no beneficiará a pacientes que presentan síntomas en el plazo de dos meses necesario para obtener y confirmar un resultado CRN (DC precoz), hemos demostrado que estos pacientes obtienen resultados comparables a los de pacientes sin síntomas diagnosticados mediante el cribado del recién nacido, aunque requieren tratamiento de mayor intensidad. En la evaluación de los méritos de implementar un programa de cribado del recién nacido, sugerimos que es preciso reconocer las diferencias en la intensidad del tratamiento como una importante variable de confusión.
AGRADECIMIENTOSLos autores desean expresar su agradecimiento por el apoyo económico de la CF Trust y la National Services Division del NHS (Escocia). También dan las gracias a M. Fraser y a S. Krawczyk (UK CF Database, University of Dundee, Reino Unido) por su experta validación de los datos y a los Directores y organizadores de los datos de los Specialist CF Centers y clínicas de fibrosis quística del Reino Unido que contribuyeron con datos a la UK CF Database. Así mismo, agradecen la revisión crítica de Anne Thomson (Oxford). Ninguno de ambos organismos de financiación desempeñó algún papel en el diseño o conducción del estudio, análisis e interpretación de los datos y preparación, revisión o aprobación del manuscrito. Ambos organismos proporcionaron financiación que contribuyó a la obtención y organización de los datos de este proyecto. Conflictos de interés: las Dras. Sims y Mehta recibieron financiación a través de una beca de la Cystic Fibrosis Trust en el momento de efectuar el presente estudio. A. Mehta era Director de la UK CF Database y recibió becas de la Cystic Fibrosis Trust. El resto de autores no declararon conflictos de interés.
Correspondencia: Dra. Erika J. Sims, PhD, School of Medicine, Health Policy and Practice, University of East Anglia, University Plain, Norwich NR4 7TJ, Reino Unido.
Correo electrónico: e.sims@uea.ac.uk