Recientemente, el National Heart, Lung and Blood de los National Institutes of Health hizo pública una actualización de las directrices de práctica clínica de Estados Unidos para el asma, el Expert Panel Report 3: Guidelines for the Diagnosis and Management of Asthma1 (Informe n.o 3 del panel de expertos: directrices para el diagnóstico y tratamiento del asma). Este nuevo documento incorpora una evaluación basada en la evidencia de las antiguas directrices y los estudios publicados actuales para la revisión de las recomendaciones de práctica clínica.
A pesar de los mejores conocimientos sobre la enfermedad, mejora de las estrategias terapéuticas y modestas mejoras obtenidas en la morbilidad, la carga relativa del asma en relación con otras enfermedades crónicas sigue siendo elevada, en particular en niños2. En Estados Unidos su prevalencia es mayor en niños que en adultos3 (8,9% comparado con 7,2%, datos de 2005). Afecta a más de 6,5 millones de niños (0-17 años de edad); ~1,4 millones tienen < 5 años de edad3. En niños es más probable un control subóptimo de la enfermedad según lo demostrado por las exacerbaciones y el uso de servicios de asistencia urgente. En 2005, las tasas documentadas de exacerbaciones para los 12 meses previos fueron del 5,2% y del 3,9% para niños y adultos con asma, respectivamente3. Se contabilizaron 103 visitas al servicio de urgencias (SU) por 10.000 niños comparado con 50 por 10.000 adultos; las tasas de hospitalización fueron de 27 por 10.000 niños comparado con 14 por 10.000 adultos. En niños < 5 años de edad se identificaron las mayores tasas: 168 visitas al servicio de urgencias y 60 hospitalizaciones por 10.000 niños3. En 2003, el asma dio lugar a ≥ 1 día de absentismo escolar para casi 13 millones de niños3 (5-17 años de edad).
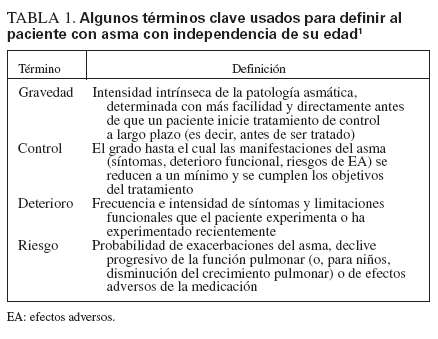
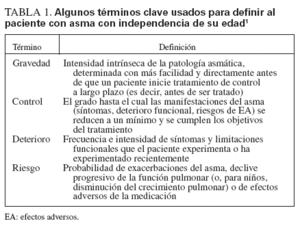
Para la mayor parte de los pacientes, el inicio del asma tiene lugar precozmente en la vida y su persistencia se asocia con factores de riesgo reconocibles, incluida la enfermedad atópica, sibilancias recurrentes y antecedentes de alergia y/o la enfermedad en los progenitores. Las pruebas indican que el tratamiento con los fármacos antiinflamatorios actuales no impide la progresión de la enfermedad subyacente1. En comparación con las directrices previas que prestaban atención a reducir la gravedad, las nuevas se dirigen a su control como objetivo terapéutico primario. La clasificación de su gravedad para iniciar el tratamiento se diferencia de la evaluación de su control para la monitorización continuada y ambas se analizan en las esferas propuestas recientemente de deterioro y riesgo para definir los objetivos terapéuticos1 (tabla 1).
TABLA 1. A algunos términos clave usados para definir al paciente con asma con independencia de su edad1
El objetivo del tratamiento del asma es obtener su control a través de la reducción del deterioro y el riesgo en función de los criterios1 mostrados en la tabla 2. Al igual que en las directrices previas, los corticosteroides inhalados (CEI) son la clase de fármaco de elección para el control a largo plazo del asma persistente en todos los grupos de edad. En numerosos estudios efectuados en niños con asma se ha establecido que estos fármacos mejoran la función pulmonar, reducen la necesidad de administrar medicación de rescate, mejoran la calidad de vida, aumentan la tolerancia al ejercicio y reducen las hospitalizaciones1. Por esta razón, aunque una intervención precoz con CEI para el asma infantil no altera su historia natural, estos fármacos son importantes para obtener y mantener su control1. No obstante, en ninguna revisión hasta la fecha se ha examinado su efecto sobre el asma infantil en lo referente al deterioro y riesgo según lo definido en el EPR3. El objetivo de la presente revisión es evaluar los datos sobre los CEI en el asma infantil prestando atención específica a las esferas de definición reciente de riesgo y deterioro.
TABLA 2. Criterios para obtener el control del asma dirigido a las esferas del deterioro y el riesgo1
MÉTODOSSe efectuó una revisión sistemática de los artÃculos publicados que describÃan los estudios aleatorizados, controlados con placebo, que evaluaron la monoterapia con CEI en niños. Mediante el vocabulario controlado Medical Subject Headings (MeSH), se efectuaron búsquedas en las bases de datos Medline y Embase (enero de 1996 a octubre de 2007) con los términos asma, dipropionato de beclometasona, budesonida, flunisolida, ensayos clÃnicos controlados, propionato de fluticasona, mometasona, ensayos aleatorizados, controlados, y acetónido de triamcinolona y las palabras de texto asma infantil, asma pediátrica, asma persistente y CEI. Las búsquedas se limitaron a artÃculos que describÃan estudios efectuados en seres humanos de 0 a 17 años de edad, y escritos en inglés.
Eficacia de los CEI en niñosDe acuerdo con las nuevas directrices, “los CEI son la medicación más potente y constantemente eficaz para el control del asma a largo plazo en adultos y niños”1. Es la única clase de fármacos para la que se demuestra con regularidad que cumple los objetivos de la farmacoterapia del asma:
- Control (en condiciones ideales, prevención) de los síntomas de asma
- Inversión de la obstrucción del flujo aéreo
- Mejora de la calidad de vida
- Disminución del número y gravedad de exacerbaciones del asma (y asistencia médica urgente asociada)
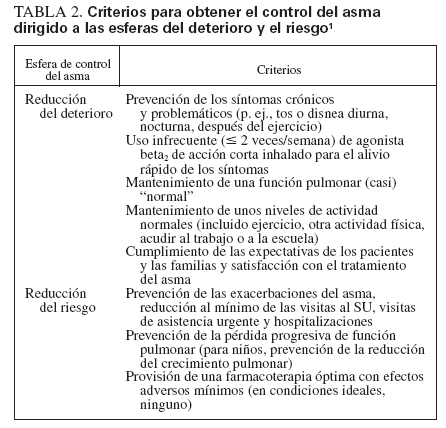
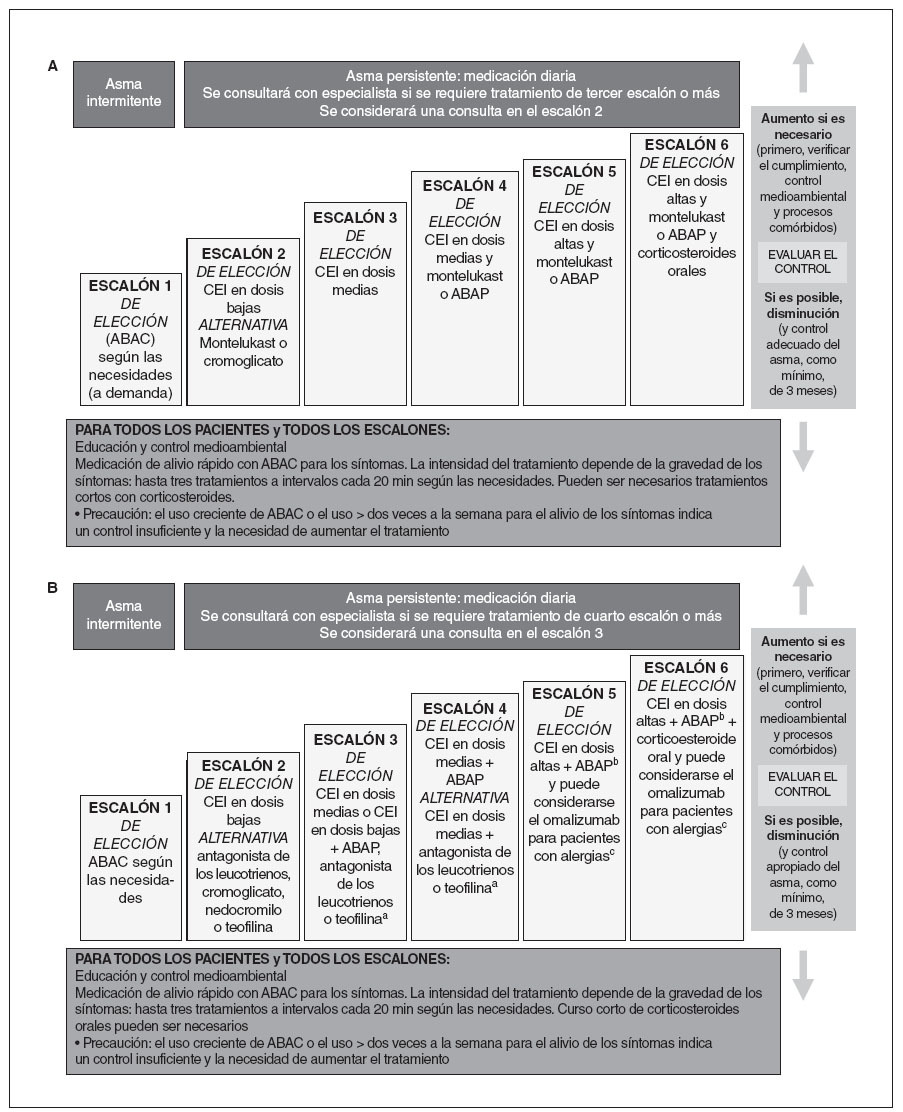
En la estrategia terapéutica escalonada, los CEI son la base del tratamiento para todos los pacientes con asma persistente (fig. 1, escalones 2 a 6). El tratamiento para adolescentes (12-18 años de edad) es igual que el de adultos; se muestran los cambios del algoritmo para niños < 12 años de edad. En la tabla 3 se muestran los CEI disponibles en la actualidad en Estados Unidos indicados para administrar a niños.
Fig. 1. A. Estrategia escalonada de tratamiento del asma en pacientes de 0-4 años de edad1. B. Estrategia escalonada de tratamiento del asma en pacientes ≥ 5 años de edad1. aEl zileuton puede considerarse en pacientes de 7-12 años de edad; balternativa en pacientes de 5-11 años de edad: dosis altas de un corticosteroide inhalado más un antagonista de los leucotrienos o teofilina. ABAC: agonista beta2 de acción corta; ABAP: agonista beta2 de acción prolongada; c12 años de edad o más. (Adaptado de National Asthma Education and Prevention rogram. Expert Panel Report 3: Guidelines for the Diagnosis and Management of Asthma. Bethesda, MD: National Institute of Health; 2007 [tablas 41a y 1b]). CEI: corticosteroide inhalado.
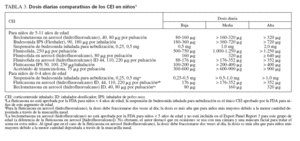
TABLA 3. Dosis diarias comparativas de los CEI en niños1
Está bien documentada la amplia acción de los CEI sobre la inflamación de las vías respiratorias y los marcadores clínicos asociados en el asma y está fuera del alcance del presente artículo una descripción de sus efectos terapéuticos4-7.
La mayoría de los beneficios clínicos observados a partir del tratamiento con CEI en niños se obtienen con dosis bajas. No obstante, al igual que en los adultos, en niños la respuesta a la dosis del CEI puede variar de acuerdo con el criterio de valoración clínico analizado (p. ej., mejora de la función pulmonar, prevención de las exacerbaciones) y las características del paciente. Los niños con asma más grave pueden responder a dosis más altas, mientras que en aquellos en los que la enfermedad es de carácter leve o de gravedad moderada suele observarse una meseta del efecto con dosis bajas y medias8-11. No obstante, el incremento de la dosis puede conferir un beneficio añadido para algunos niños con asma leve o de gravedad moderada durante las exacerbaciones o los incrementos estacionales de la gravedad de los síntomas1 (p. ej., a los alergenos o a los virus respiratorios). Esta estrategia terapéutica de “dosis flexible” sugiere que es posible incrementar temporalmente la dosis de los CEI como respuesta a algún índice de agravación del asma, en general, un aumento de los síntomas, despertares nocturnos, disminución de la tasa de flujo pico o uso de medicación de rescate; esto sigue constituyendo un tema de estudio y discusión continuados12-15. En el futuro, estos ajustes de la dosis podrían basarse en la determinación de un biomarcador simple de inflamación de las vías respiratorias en niños; se están estudiando el recuento de eosinófilos en el esputo y el óxido nítrico espirado pero ambos requieren una validación adicional16,17.
Administración de CEI a lactantes y niños pequeños (≤ 5 años de edad)Al igual que en niños más mayores y adultos, la administración de CEI a lactantes y niños pequeños se dirige al control de los síntomas, la prevención de las exacerbaciones y la mejora de la calidad de vida del niño (y de la familia). El tratamiento con CEI no debe iniciarse o prolongarse para alterar su progresión o gravedad subyacente1.
Los datos sobre administración de CEI para tratar el asma en niños pequeños, en particular lactantes, son limitados. La mayoría de las recomendaciones del tratamiento se basan en la opinión de expertos y extrapolaciones de estudios en niños más mayores y adultos1. En esta población los síntomas más habituales son las sibilancias y la tos, que, con frecuencia, se asocian a otros procesos18-20. Si se sospecha asma, se recomienda un tratamiento de prueba con un CEI que servirá para su diagnóstico.
A partir del Tucson Children’s Respiratory Study18,21, se ha desarrollado y validado un índice clínico predictivo (Modified Asthma Predictive Index [mAPI]) para identificar a los niños ≤ 3 años de edad que pueden correr un riesgo elevado de desarro-llar la enfermedad. En niños en edad preescolar un mAPI positivo se asoció con ≥ 4 episodios de sibilancias graves que requirieron la administración de corticoesteroides orales (CEO) en un período de 12 meses y un mayor número de hospitalizaciones y visitas de asistencia urgente para el asma21,22. La recomendación del EPR3 con respecto a los niños pequeños en los que es apropiado el tratamiento con CEI se basa en este índice (tabla 4).
TABLA 4. CEI como tratamiento de control del asma en lactantes y niños pequeños1
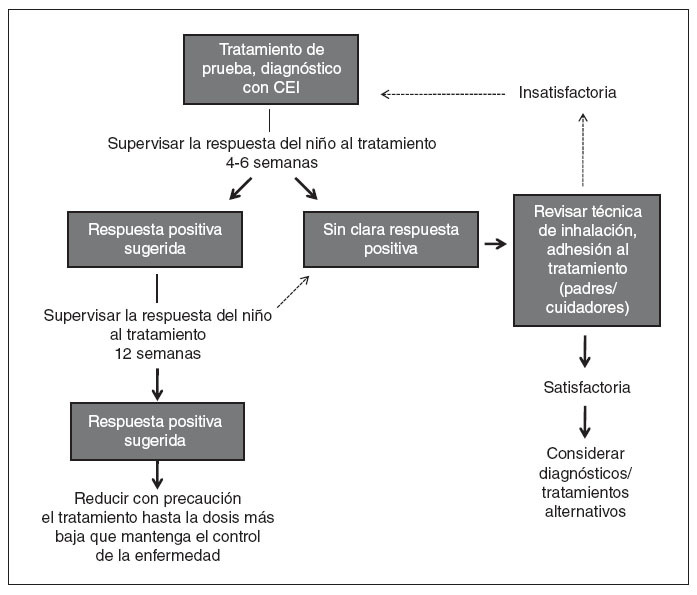
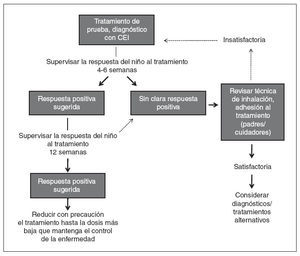
En Estados Unidos los CEI aprobados por la Food and Drug Administration (FDA) para niños pequeños (≤ 5 años de edad) incluyen la suspensión de budesonida para inhalación (SBI), aprobada para niños desde los 12 meses de edad y las formulaciones de propionato de fluticasona (PF) en inhalador de polvo seco (IPS) y en aerosol (hidrofluoroalcano), aprobadas para niños desde los 4 años de edad. El dipropionato de beclometasona (DPB) en aerosol (hidrofluoroalcano) es el único aprobado para niños ≥ 5 años de edad. A pesar de que no están aprobados para niños pequeños y no se dispone de datos sobre posologÃa, eficacia y tolerabilidad/seguridad en esta población, muchos pediatras efectuarán un tratamiento de prueba con cualquiera de estos CEI cuando lo consideren necesario. En la figura 2 se presenta un algoritmo para un tratamiento de prueba, diagnóstico con un CEI en lactantes y niños pequeños.
Fig. 2. Algoritmo para un tratamiento de prueba, diagnóstico con un corticosteroide inhalado (CEI) en lactantes y niños pequeños (< 5 años de edad) con sospecha de asma1.
Tolerabilidad/seguridad de los CEI niñosCon independencia de la edad, pocos pacientes refieren efectos adversos (EA) graves con los CEI en las dosis recomendadas, incluso con la administración a largo plazo23-26. La mayor parte del beneficio clÃnico se obtiene con dosis relativamente bajas, lo que reduce aún más el riesgo potencial de EA1. No obstante, al igual que con cualquier medicación administrada con regularidad, es preciso supervisar a los niños para posibles EA sistémicos, en particular porque algunos pueden ser más vulnerables a sus efectos incluso en dosis convencionales. En la tabla 5 se muestran sugerencias para reducir los EA asociados a los CEI.
TABLA 5. Sugerencias para reducir el potencial de efectos adversos de los CEI en niños1
Los datos sobre los posibles efectos adversos de los CEI en dosis bajas o medias sobre el eje hipotálamo-hipofisario- suprarrenal en niños demuestran acontecimientos poco frecuentes, que suelen ser insignificantes desde un punto de vista clÃnico27,28.
De mayor preocupación ha sido el efecto potencial de los CEI sobre el crecimiento lineal. Una vez más, los datos disponibles para CEI administrados en dosis bajas o medias muestran un efecto mÃnimo sobre la velocidad de crecimiento: una reducción de ~1 cm en el primer año de tratamiento en algunos niños. Cuando se observa, esta disminución no suele progresar con el tiempo y los estudios a largo plazo han indicado que estos niños alcanzan una estatura final normal18,28-32. En todos los niños tratados con estos fármacos se requiere una supervisión mediante estadiometrÃa y, si es posible, en cada visita clÃnica, debe efectuar la determinación el mismo miembro del personal sanitario1. Aunque en el EPR3 no se proporcionan puntos de corte clÃnicos especÃficos, en la práctica clÃnica, la estrategia del autor de la presente revisión es (1) reducir la dosis del CEI si en la visita a los 3 meses se observa un retraso del crecimiento y el asma del niño permanece estable y (2) interrumpir el tratamiento y considerar un cambio de medicación o de dispositivo si, después de 6 meses, persiste el retraso del crecimiento.
Para niños con asma difÃcil de controlar, que requieren dosis más altas de CEI, se recomienda la administración de un tratamiento de control adyuvante, a largo plazo para reducir la dosis del CEI y, en consecuencia, disminuir a un mÃnimo los posibles efectos a largo plazo sobre el crecimiento relacionados con la dosis1 (fig. 1). Dosis altas de CEI administradas durante perÃodos prolongados de tiempo (p. ej., > un año), en particular, en combinación con tandas frecuentes de CS orales, pueden asociarse con efectos adversos sobre el crecimiento. No obstante, los beneficios de una intervención inmediata con un CEI pueden ser mayores que la posible ligera reducción de la velocidad de cre-cimiento en estos niños1,18,32 (tabla 6).
TABLA 6. Resumen de los CEI y el crecimiento lineal en niños basado en la opinión de un panel de expertos1
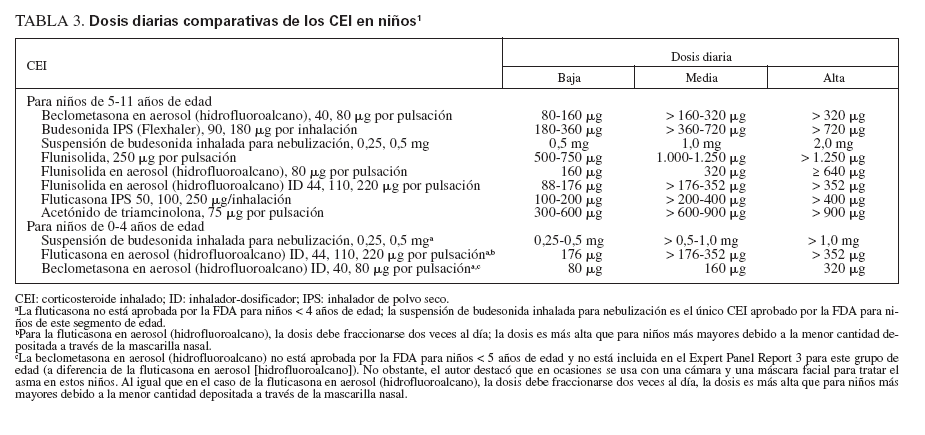
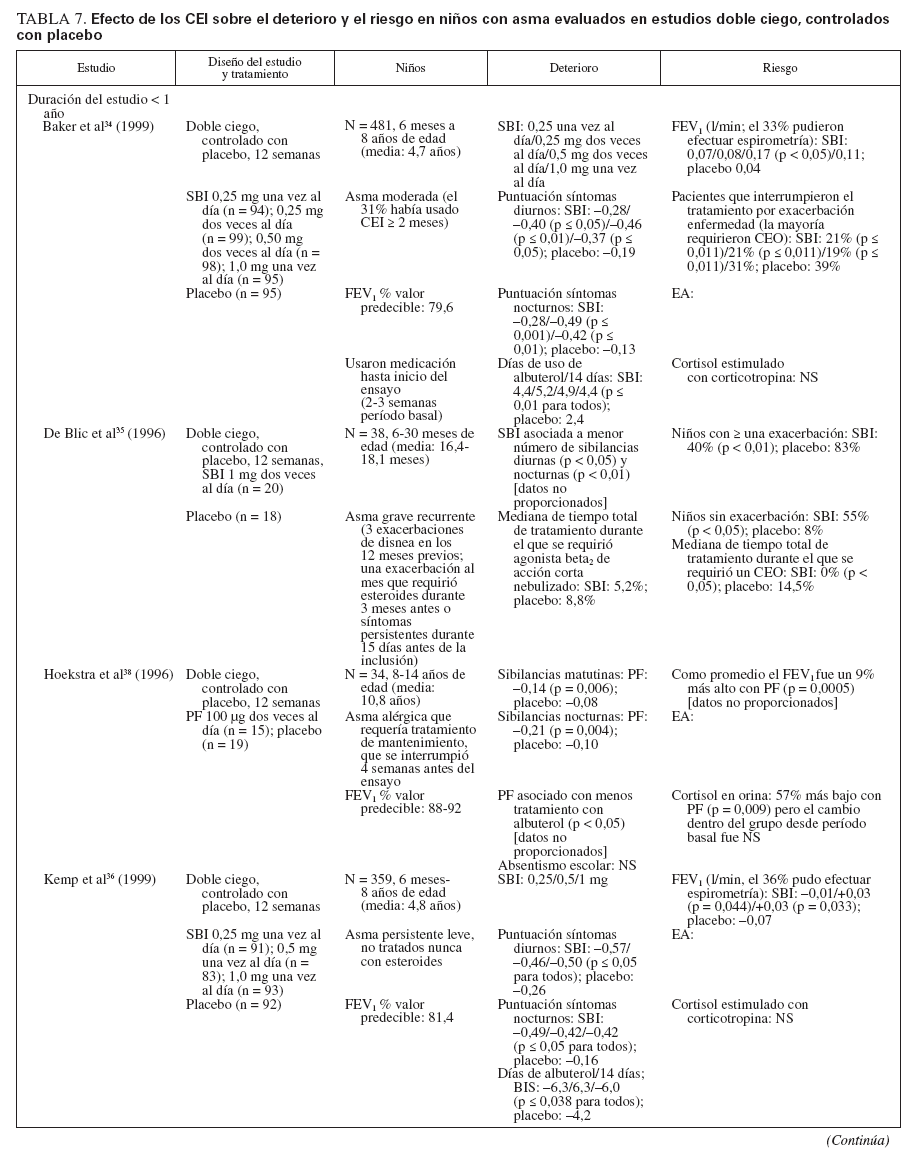
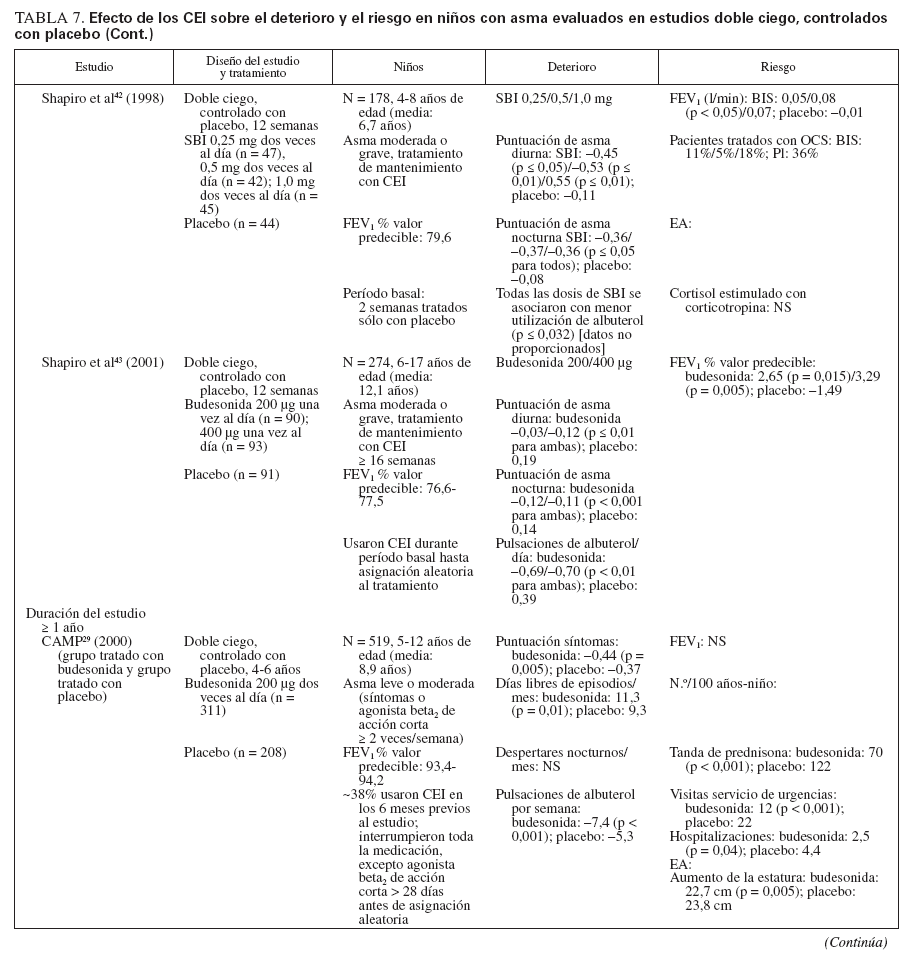
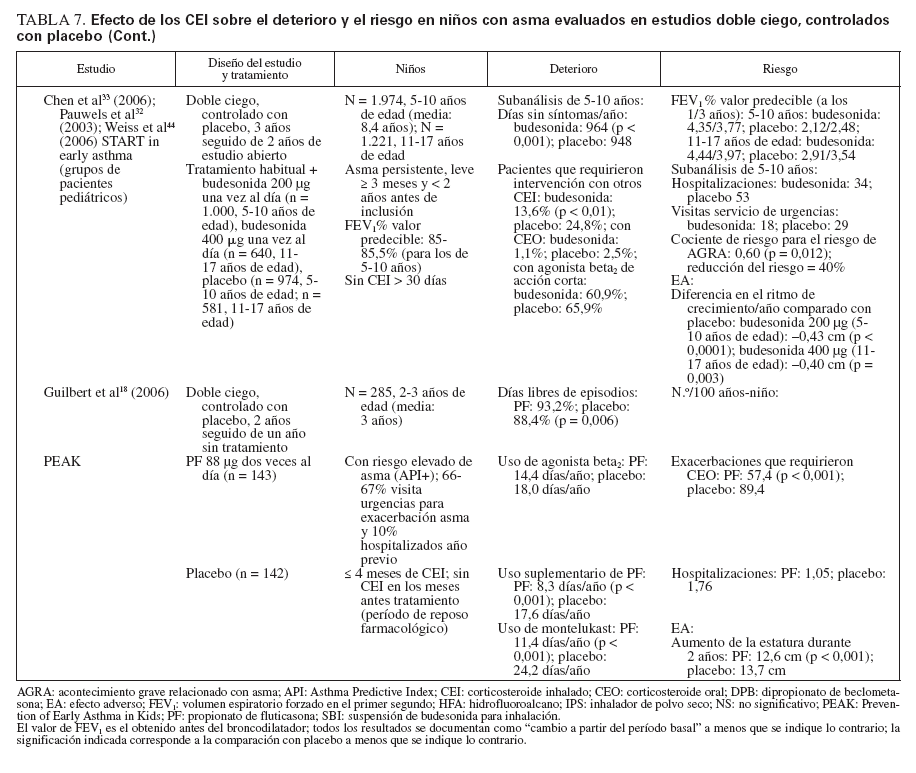
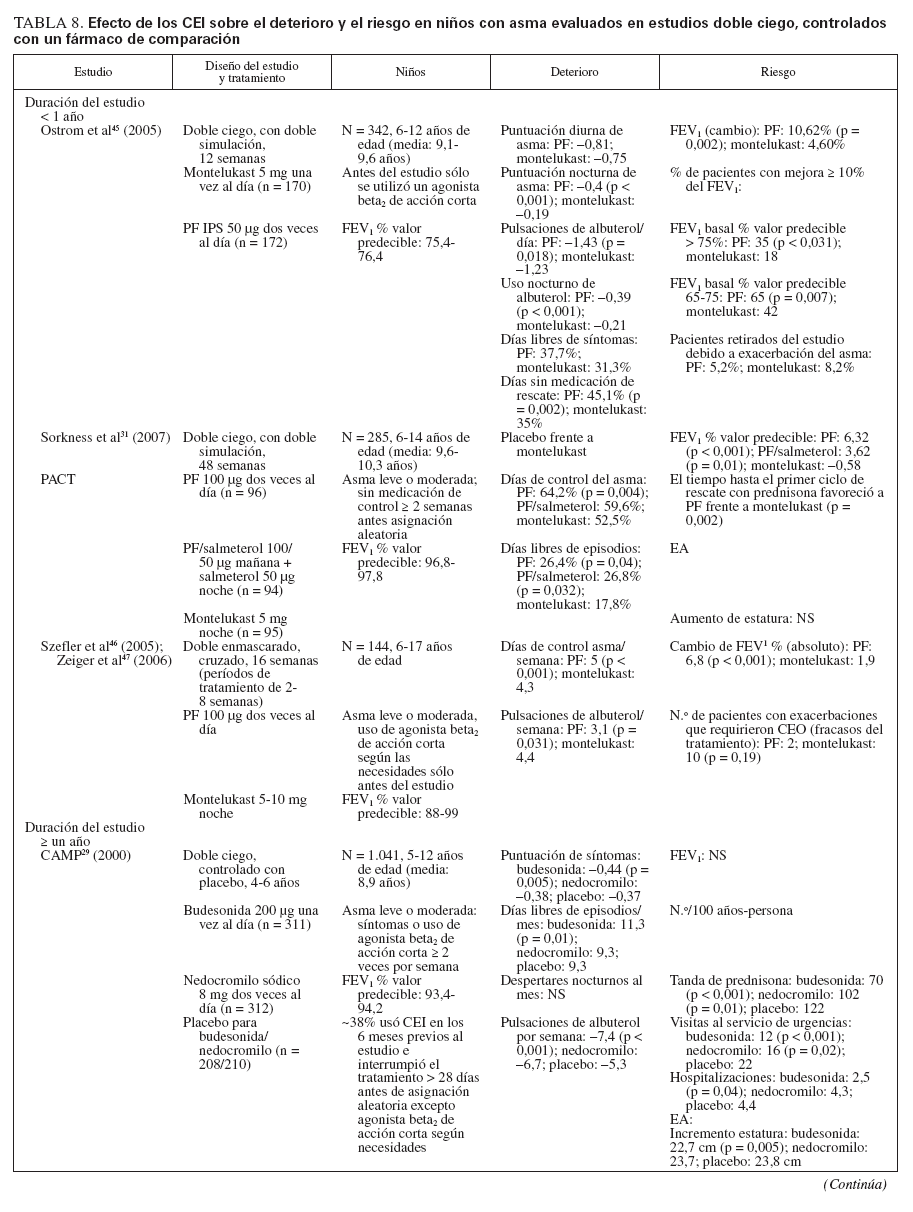
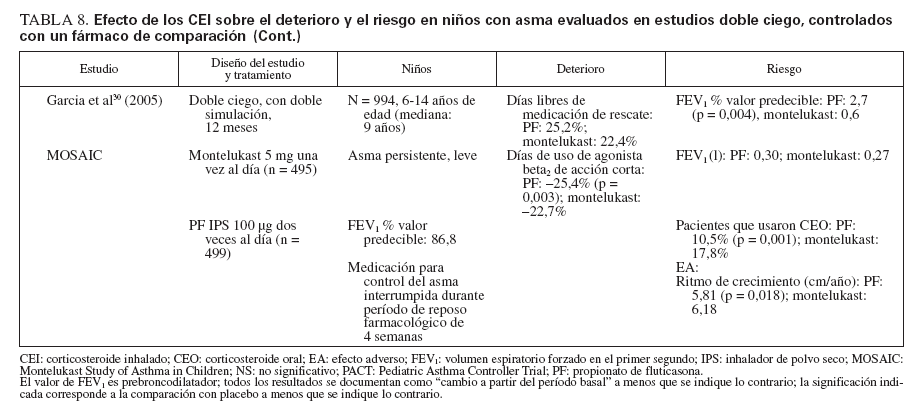
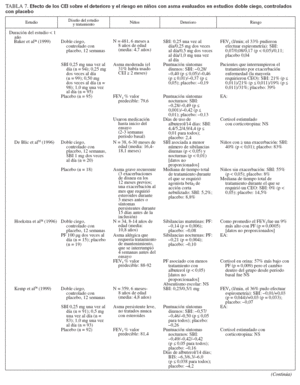
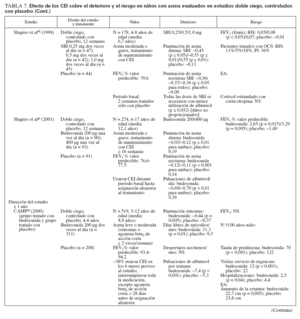
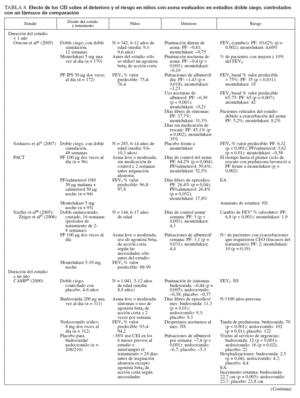
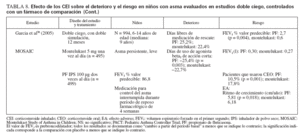
Efecto sobre las esferas de deterioro y riesgo en niñosCumplieron los criterios de revisión de la monoterapia con CEI 18 estudios aleatorizados, controlados con placebo, que incluyeron > 8.000 niños (0-17 años de edad): 13 estudios doble ciego sobre CEI solos (tabla 7), y 4 estudios con doble simulación que comparaban los CEI con un fármaco antiinflamatorio no esteroideo (tabla 5). Un estudio, el Childhood Asthma Management Program (CAMP), era un ensayo doble ciego que comparó el nedocromilo sódico (NS), la budesonida y el correspondiente placebo y se incluye en las tablas 7 y 8. En estos estudios alrededor de 4.900 niños se expusieron a los CEI.
TABLA 7. Efecto de los CEI sobre el deterioro y el riesgo en niños con asma evaluados en estudios doble ciego, controlados con placebo
TABLA 7. Efecto de los CEI sobre el deterioro y el riesgo en niños con asma evaluados en estudios doble ciego, controlados con placebo (cont)
TABLA 7. Efecto de los CEI sobre el deterioro y el riesgo en niños con asma evaluados en estudios doble ciego, controlados con placebo (cont)
TABLA 7. Efecto de los CEI sobre el deterioro y el riesgo en niños con asma evaluados en estudios doble ciego, controlados con placebo (cont)
TABLA 8. Efecto de los CEI sobre el deterioro y el riesgo en niños con asma evaluados en estudios doble ciego, controlados con un fármaco de comparación
TABLA 8. Efecto de los CEI sobre el deterioro y el riesgo en niños con asma evaluados en estudios doble ciego, controlados con un fármaco de comparación (cont)
En la mayor parte de los estudios, los niños experimentaban asma persistente, leve o de gravedad moderada, según lo definido por los síntomas, uso de un agonista beta2 de acción corta (ABAC) y/o necesidad de medicación antiasmática diaria. En el momento de la inclusión en el estudio todos los niños utilizaban ≥ una medicación antiasmática, un ABAC con o sin un fármaco para el control de la enfermedad (CEI, cromoglicato sódico). Para niños capaces de efectuar una espirometría, el volumen espiratorio forzado en el primer segundo (FEV1) varió desde el 70% a > 90% del valor de referencia.
La duración de los estudios fue ≥ 12 semanas y para los CEI la pauta posológica fue de dos o menos veces al día.
Estudios doble ciego, controlados con placeboUn total de 5.479 niños recibió placebo (n = 2.696) o un CEI (n = 4.004) durante ≥ 12 semanas. Los CEI incluyeron budesonida en dosis de 200 a 2.000 µg/día (n = 294), PF, en dosis de 100 a 200 µg/día (n = 826), o DPB en aerosol de hidrofluoroalcano, en dosis de 80 a 160 µg/día (n = 237).
En tres estudios se evaluaron > 2 años de tratamiento con budesonida (n = 1.951) o PF18,29,33 (n = 143). En cinco estudios se evaluaron niños pequeños y/o lactantes18,34-37 (edad media: < 5 años). Los resultados fueron comparables a los estudios efectuados en niños en edad escolar (edad media > 5 años).
El tratamiento con CEI mejoró claramente las variables de deterioro. En los estudios en los que se documentaba, también se observaron beneficios en la esfera del riesgo.
Esfera de deterioro
Comparado con placebo, con los CEI fueron evidentes mejoras significativas de los síntomas en forma de reducciones medias de las puntuaciones de síntomas y un aumento del número de días sin (síntomas) de asma o “días sin episodios”18,29,33-43. En los niños pequeños (< 30 meses de edad), con SBI comparado con placebo se refirió un número significativamente menor de sibilancias diurnas y nocturnas (p < 0,05 y p < 0,01, respectivamente), pero no se proporcionaron las puntuaciones específicas y/o los cambios entre tratamientos35. En una población similar tratada con PF se observó un aumento significativo del porcentaje de días sin tos (p = 0,011) o sibilancias17 (p = 0,002). Las mejoras de los síntomas se mantuvieron con el tratamiento a largo plazo18,29,33 (≥ 2 años).
Las mejoras de los síntomas se observaron con independencia del tratamiento administrado al paciente antes de la asignación aleatoria. En algunos estudios, se permitió que los pacientes usaran su medicación antiasmática habitual (incluidos los CEI) hasta el momento de la asignación aleatoria; otros estudios se efectuaron en pacientes no tratados nunca con esteroides o requirieron un período de reposo farmacológico sin esteroides antes de la inclusión en el estudio. En los estudios publicados por Baker et al34 (1999) y Peden et al41 (1998), se permitió que los niños usaran su medicación antiasmática habitual durante el período de reposo farmacológico; en estos estudios el 31% y 45% de los niños usaron CEI hasta la asignación aleatoria a SBI y PF, respectivamente. Shapiro et al43 (2001) evaluaron específicamente la capacidad de la budesonida administrada una vez al día para mantener el control del asma en niños que previamente habían recibido CEI; todos los niños usaron el CEI de mantenimiento hasta la asignación aleatoria, y el 87% lo usaron dos veces al día. En la mayor parte de los estudios, todas las medicaciones antiasmáticas administradas para el control de la enfermedad se suspendieron antes de la asignación aleatoria. No obstante, Chen et al33 (2006) publicaron un subanálisis de los datos de los niños de 5-10 años de edad incluidos en el Steroid Treatment as Regular Therapy (START), un estudio de 3 años de duración en el que la budesonida se añadió al tratamiento habitual de pacientes en los que se había establecido el diagnóstico de asma leve y que habían usado CEI con regularidad32,33. Se monitorizaron los efectos de los fármacos adyuvantes pero no los cambios de la medicación habitual32,33.
Además de asociarse con un menor número de síntomas, la administración de CEI se asoció con una disminución significativa del uso del agonista beta2 de acción corta, administrado a diario y/o a demanda29,34,36-43. En lactantes tratados con SBI comparado con placebo, De Blic et al35 (1996) observaron que la duración del tratamiento con albuterol nebulizado fue ligeramente más breve pero la diferencia no fue estadísticamente significativa. Aunque no se mencionó el uso de un agonista beta2 de acción corta según las necesidades, los niños pequeños tratados con PF durante 2 años requirieron menos medicación adyuvante para controlar el asma (montelukast [p < 0,001] o PF [p < 0,001]) que los tratados con placebo18. En el ensayo START se observó una tendencia similar en niños más mayores tratados con budesonida durante 3 años; una vez más, no se mencionó el uso específico de un agonista beta2 de acción corta según las necesidades33.
Es difícil hacer comparaciones entre estudios con respecto al grado de mejora de los síntomas debido a las diferencias en las poblaciones y diseño de los estudios. Es posible que, para pacientes que usaron CEI durante todo el período de reposo farmacológico, cualquier diferencia estadísticamente significativa entre tratamientos fuera consecuencia del deterioro del control del asma en el grupo placebo más que de aumentos sustanciales del control con el CEI. No obstante, no se efectuaron subanálisis, por lo que esto sólo es una especulación.
Esfera del riesgo
De los 10 estudios de 12 semanas de duración, ocho describían resultados de las pruebas de función pulmonar34,36,38-43. En todos los casos, en niños tratados con CEI se observó un aumento significativo de FEV1, comparado con los tratados con placebo con independencia del uso de CEI antes de la asignación aleatoria.
En dos de los estudios a largo plazo (CAMP y START) se incluyeron niños capaces de efectuar una espirometría. En ambos, el uso de CEI se asoció con ligeras mejoras del FEV1 en el primer año que gradualmente disminuyó en el curso del período de tratamiento, de modo que, al término del ensayo, no fueron evidentes diferencias significativas entre tratamientos29,32,33.
En cinco estudios se evaluaban las exacerbaciones o una agravación del asma que requirió una tanda breve de CEO18,29,35,40,42. Los niños tratados con CEI requirieron un número significativamente menor de tandas de tratamiento con independencia de que tuvieran ≥ o < 5 años de edad18,29,35. Aunque no se hacía mención de la significación estadística, en dos estudios se documentaron más tandas de CEO para la “agravación del asma” en niños en edad escolar tratados con placebo o la estrategia habitual comparado con budesonida33,42. Comparado con el tratamiento con placebo, un mayor número de lactantes y niños en edad preescolar (< 48 meses de edad) se encontraron libres de exacerbaciones mientras recibieron tratamiento con PF37 (p = 0,033).
Nayak et al40 (2002) describieron una tendencia hacia una prolongación del “tiempo hasta la primera exacerbación” con un inicio más tardío de ésta con DPB en aerosol de hidrofluoroalcano, pero sin que la tendencia alcanzase significación estadística. En el ensayo START, la adición de budesonida una vez al día al tratamiento habitual se asoció con una prolongación significativa del tiempo hasta el primer acontecimiento grave relacionado con el asma (AGRA) en niños de 5-10 años de edad33. El riesgo de un AGRA disminuyó en un 40% con la adición de budesonida al tratamiento habitual33 (cociente de riesgo: 0,60; p = 0,012).
Durante los 4-6 años del estudio CAMP en los niños tratados con budesonida se produjo un número significativamente menor de hospitalizaciones y visitas de asistencia urgente que en los tratados con placebo29. Durante los 2 años de tratamiento con PF también se describió un menor número de hospitalizaciones, aunque sin que esto alcanzase significación estadística18. En el ensayo START, la adición de budesonida al tratamiento habitual se asoció con una reducción del 50% de las hospitalizaciones y una disminución del 34% de las visitas a servicios de urgencias durante 3 años; las cifras estuvieron próximas a la significación estadística33,44. Son difíciles las comparaciones adicionales debido a las diferencias tanto en el diseño como en las poblaciones de estudio.
Todos los CEI usados en estos estudios fueron bien tolerados y no se produjeron EA graves relacionados con ninguno de los fármacos usados. En siete estudios se evaluó la función del eje hipotálamo-hipofisario-suprarrenal14,36,38-41,43. No se observaron cambios específicos de los CEI excepto una ligera disminución de la concentración de cortisol en orina descrita en algunos niños tratados con PF que previamente habían usado CEI38.
En dos estudios de 12 semanas de duración no se describían cambios del crecimiento con los CEI34,35. Sin embargo, en los tres estudios a largo plazo se describían ligeras disminuciones del crecimiento con los CEI18,29,32. En el ensayo START, comparado con el tratamiento habitual solo, en niños tratados con budesonida se demostró una reducción del crecimiento de 0,43 cm/año (p < 0,001), con independencia de la dosis de 400 o 200 µg/día32. En el estudio CAMP, el aumento medio de la estatura también fue menor (en 1,1 cm) con budesonida29. En el estudio a largo plazo sobre PF se demostró una ligera pero significativa diferencia en los percentiles de estatura después de 2 años18 (PF: 51,5%; placebo: 56,4% [p < 0,001]). Cuando se evaluó, estos cambios del ritmo de crecimiento fueron predominantes durante el primer año de tratamiento, y en todos los grupos se obtuvieron ritmos de crecimiento similares al término de los períodos de tratamiento18,29. No se evaluó el “crecimiento acelerado”. En estos estudios no se observaron otros efectos sistémicos.
Comparaciones controladas con fármacos antiinflamatorios no esteroideosEn la tabla 8 se describen cinco estudios controlados con placebo sobre comparación de un CEI con un fármaco antiinflamatorio no esteroideo29-31,45-47. Estos estudios incluyeron a 2.806 niños: 1.222 se expusieron a un CEI (budesonida, en dosis de 200 µg dos veces al día [n = 311]; PF, en dosis de 50-100 µg dos veces al día [n = 908]) y 1.216 recibieron fármacos no esteroideos como comparador (NED, 8 mg dos veces día [n = 312]; montelukast, 5-10 mg una vez al día [n = 904]). En el estudio CAMP se incluyeron los correspondientes placebos para budesonida y NED29 (n = 418). Además, uno de los ensayos que comparaba el PF y el montelukast incluyó un tercer grupo de niños tratados con la combinación de PF y salmeterol, en dosis de 100 µg/50 µg por la mañana, y salmeterol solo, en dosis de 50 µg por la noche31.
Cada ensayo tuvo un diseño exclusivo, por lo que las comparaciones son difíciles. La duración del tratamiento varió desde 12 semanas a 6 años. La medicación inhalada se administró dos veces al día; el montelukast (en comprimidos recubiertos o granulado) se administró una vez al día, en general, por la noche. En el momento de la asignación aleatoria, todos los niños usaban exclusivamente un agonista beta2 de acción corta.
En conjunto, el tratamiento con CEI mejoró las variables de deterioro y riesgo hasta un mayor grado que los fármacos antiinflamatorios no esteroideos.
Esfera de deterioro
El deterioro se evaluó por las puntuaciones de síntomas, días sin episodios (o días de control del asma) y uso de medicación de rescate. Comparado con montelukast, en pacientes tratados con PF se identificaron un mayor número de días de control del asma, de días sin episodios, y días sin medicación de rescate30,31,45,46. Ostrom et al45 (2005) también documentaron reducciones significativas de los síntomas nocturnos de asma (p < 0,001) y de uso de albuterol de rescate (p = 0,018) con PF comparado con montelukast.
En el estudio CAMP, tanto el nedocromilo sódico como la budesonida mejoraron los síntomas de asma, aumentaron el número de días sin episodios y de días sin usar albuterol comparado con tratamiento con placebo29. Las diferencias entre los tratamientos activos no alcanzaron significación estadística, pero las mejoras clínicas se consideraron mayores con budesonida; sólo ésta alcanzó significación estadística comparada con placebo29.
Esfera de riesgo
Los cinco estudios incluyeron la determinación de FEV1, y en todos, excepto en el estudio CAMP, fueron evidentes aumentos significativos con los CEI comparado con los fármacos antiinflamatorios no esteroideos29-31,45-47.
Las mejoras en las exacerbaciones del asma favorecieron a PF sobre montelukast cuando se determinó como tiempo transcurrido hasta el primer ciclo de rescate con prednisona31 (p = 0,002) o agravación del asma que requirió una tanda breve de CEO30,46 (p = 0,019; p = 0,001). Comparado con placebo, tanto budesonida como el nedocromilo redujeron significativamente el número de tandas de prednisona por 100 años-persona y el número de visitas de asistencia urgente relacionadas con el asma29. Sólo budesonida disminuyó significativamente el número de hospitalizaciones relacionadas con la enfermedad29.
En los estudios con un fármaco comparador todos los tratamientos fueron bien tolerados, sin diferencias significativas entre tratamientos para los EA y los EA no graves relacionados con cualquiera de los fármacos de estudio. Con los CEI comparado con los otros fármacos activos se observaron ligeras reducciones del ritmo de crecimiento en los dos estudios a largo plazo29-31. No se observaron otros efectos sistémicos.
RESUMENPara el pediatra los niños con asma siguen representando un reto sustancial, en particular porque todavía no está definida claramente la relación entre el tratamiento precoz de los síntomas y el desarrollo de la enfermedad del adulto. Los CEI se recomiendan como medicación primaria de control para niños (al igual que en adultos) con la enfermedad. Su eficacia y tolerabilidad en el tratamiento pediátrico están bien documentadas, aunque los datos son más limitados que para adultos1. Cuando se administran en las dosis indicadas, son bien tolerados. No obstante, el aumento de la dosis no se acompaña de un aumento lineal de su efecto antiinflamatorio o terapéutico sino que su eficacia alcanza una meseta; por esta razón, cuando un niño se encuentra sintomático, puede ser preferible añadir otro fármaco más que aumentar la dosis media del CEI1. Está fuera del alcance del presente artículo proporcionar una discusión sobre los fármacos adyuvantes. Las pruebas revisadas en el EPR3 sugieren que la adición de un agonista beta2 de acción prolongada (ABAP) confiere un mayor control del asma que el aumento de la dosis del CEI o la adición de un modificador de los leucotrienos1. Sin embargo, para niños de 5-11 años de edad el tratamiento no se ha estudiado con la suficiente profundidad, y para los más pequeños, no se dispone de datos1. El lector puede consultar el EPR31, y pueden ser de utilidad otros recursos para padres de niños con asma48.
Las directrices del National Asthma Education and Prevention Program continúan sirviendo de base para las recomendaciones de tratamiento; en el último informe se describe un nuevo paradigma dirigido al control del asma a través de las esferas de deterioro y riesgo1. En esta revisión sistemática se refuerzan las pruebas previas (descritas en el EPR3 y en las guías de práctica clínica) que respaldan la tolerabilidad y eficacia de los CEI para tratar a niños con asma. Además, los datos proporcionan nuevas pruebas que relacionan su administración con una mejora del control de la enfermedad según lo definido en la actualidad por el EPR3 de acuerdo con las esferas de riesgo y deterioro. Los datos procedentes de los estudios controlados con placebo confirman que el tratamiento con CEI mejora ambas esferas en niños18,29-43,45-47 (0-17 años de edad).
Las comparaciones en mayor profundidad son difíciles debido a las diferencias en los protocolos de los estudios.
Están justificados estudios adicionales que usen indicadores apropiados para evaluar el deterioro y el riesgo. Para el primero, como indicadores, se recomiendan el uso de medicación de rescate, las puntuaciones de síntomas diurnos y nocturnos y días sin asma/episodios. Para el riesgo, en niños capaces de efectuar una espirometría debe documentarse el FEV1; como indicadores, también se sugieren las exacerbaciones que requieren CEO y el uso de asistencia urgente. También es preciso prestar atención a estandarizar variables que puedan usarse para comparar los criterios de valoración entre estudios.
La mayor parte de los datos pediátricos corresponden a niños ≤ 12 años de edad; sólo en cinco de los 18 estudios se incluían adolescentes30,31,38,43,46 (13-18 años de edad). Cuando se evalúa a niños con asma, los datos de esta población se pierden, porque se agrupan con los de adultos (p. ej., estudios en pacientes ≥ 12 años de edad) o no se incluyen (estudios de niños en edad escolar ≤ 12 años de edad). Se requiere un mayor número de estudios para evaluar si el diagnóstico y el inicio precoces del tratamiento afectan al curso de esta enfermedad en la adolescencia. También se requiere mayor información para evaluar cómo el tratamiento puede satisfacer mejor las necesidades de pacientes de este segmento de edad.
La evidencia presentada en esta obtención y revisión sistemática de los estudios publicados no se ha clasificado en categorías porque representa la investigación de un autor individual y no la de un comité. No obstante, los estudios elegidos se separaron de acuerdo con el diseño: estudios doble ciego, controlados con placebo, y ensayos aleatorizados, controlados de comparación. No se incluyeron ensayos no aleatorizados o estudios observacionales. Por esta razón, todos los datos obtenidos en la presente revisión se clasificarían en una categoría de evidencia A y B, de acuerdo con las definiciones descritas en el EPR31.
El asma es una enfermedad compleja y heterogénea. Numerosos factores afectan al deterioro y riesgo e influyen en la elección del tratamiento. Aunque no se abordan en el presente artículo, tienen una influencia sustancial la adhesión al tratamiento, el control medioambiental, los procesos comórbidos, las diferencias en los dispositivos de distribución y la penetración de la medicación en las vías respiratorias de pequeño calibre. El lector puede consultar el EPR3 para obtener información adicional1.
En resumen, los datos disponibles indican que los CEI mejoran el control del asma en niños a través de una reducción tanto del riesgo como del deterioro asociados a la enfermedad y respaldan las recomendaciones actuales de tratamiento.
Correspondencia: Gary Rachelefsky, MD, FAAP, Executive Care Center for Asthma, Allergy, and Respiratory Diseases, Gef- fen School of Medicine at UCLA, 200 Medical Plaza, Suite 140-17, Los Ãngeles, CA 90095, Estados Unidos.
Correo electrónico: grachelefsky@mednet.ucla.edu