INTRODUCCIÓN
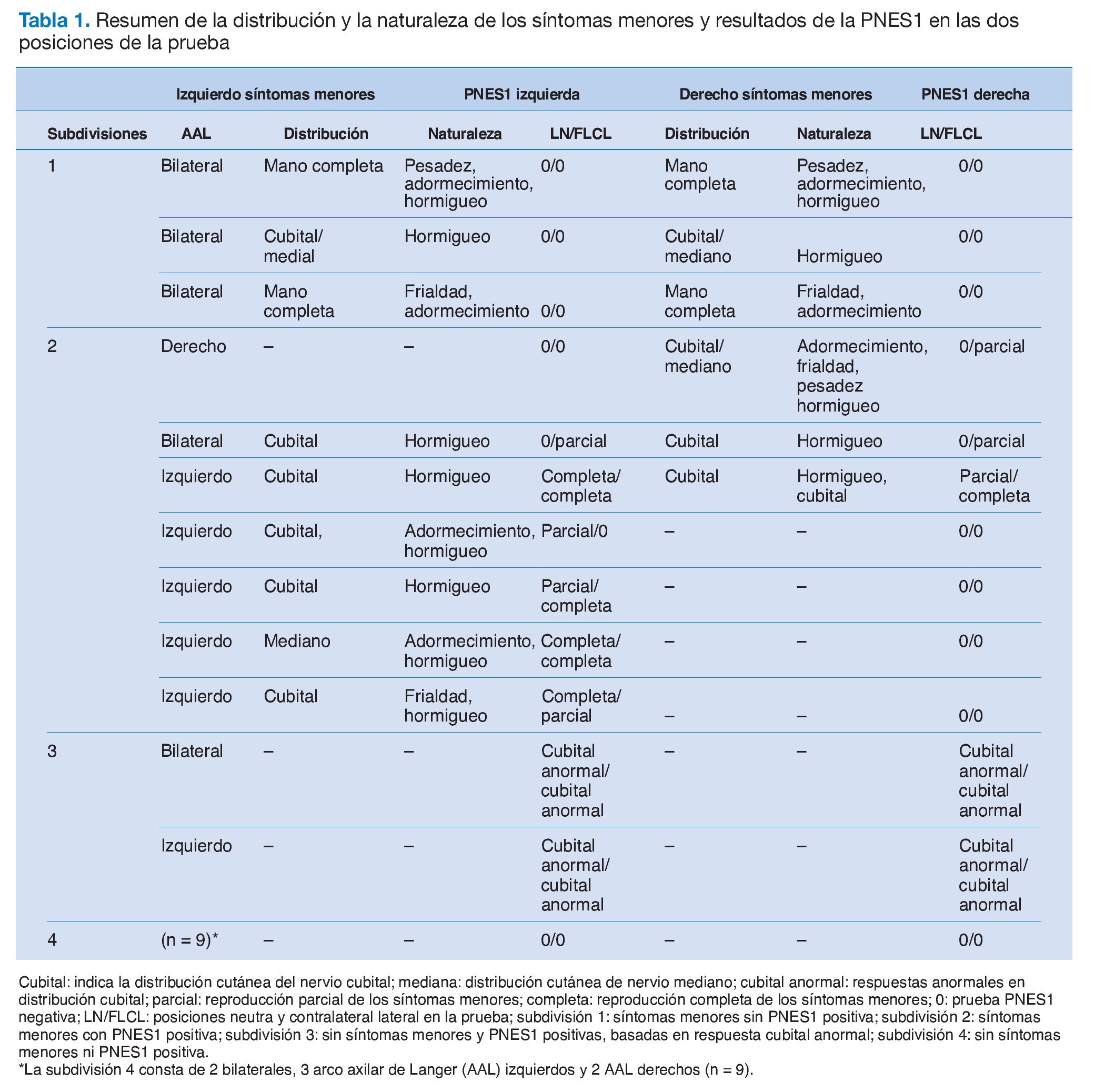
El arco axilar de Langer (AAL) es un arco muscular en la axila estrechamente relacionado con el haz neurovascular subyacente. Es una variante muscular anómala que se extiende desde el borde lateral del latísimo del dorso, atraviesa los vasos axilares y el plexo braquial distal hasta el tendón de inserción del pectoral mayor (fig. 1)1,2 pero también puede insertarse en el proceso coracoides1,3. Este arco, que es la principal variación anatómica de la axila, se observa en aproximadamente el 7% de la población general, aunque se han publicado incidencias variables que oscilan entre el 0,25 y el 27%3,4.
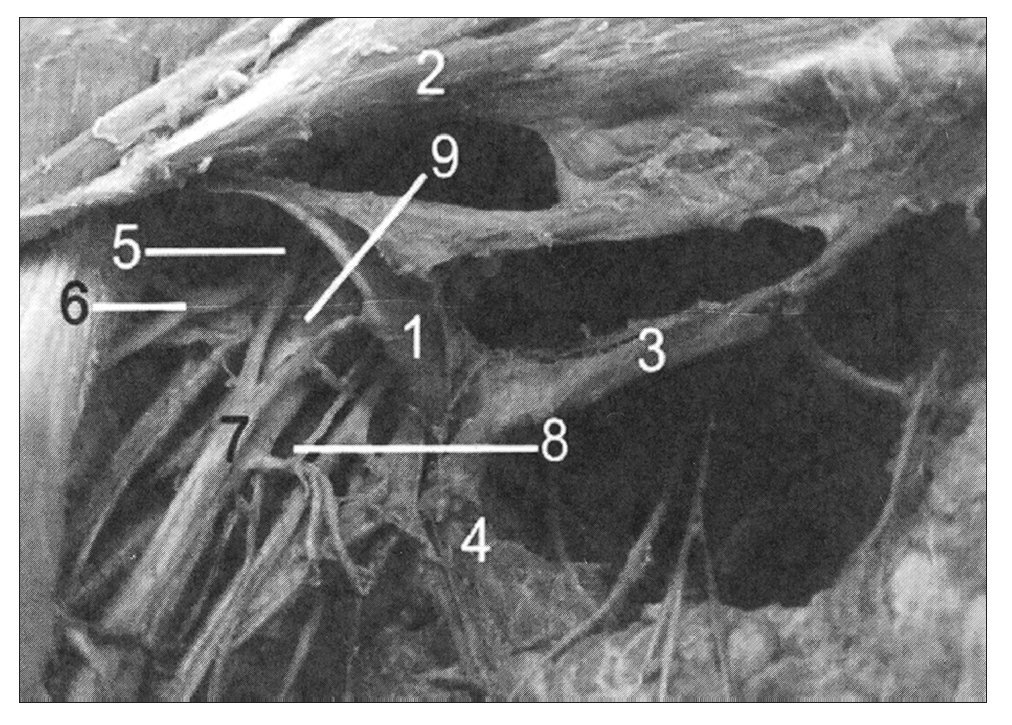
Figura 1. Arco axilar de Langer del lado derecho disecado que cruza el haz neurovascular axilar: 1: arco axilar de Langer; 2: pectoral mayor; 3: pectoralis quartus (variación muscular); 4: latísimo del dorso; 5: cordón lateral del plexo braquial; 6: nervio músculo cutáneo; 7: nervio mediano; 8: nervio cubital; 9: arteria axilar.
Debido a sus características anatómicas, demostradas en intervención quirúrgica axilar y cadáveres5-8, el AAL se tensa en rotación externa-abducción y elevación del hombro. Cuando esto ocurre, el AAL comprime el haz neurovascular subyacente, lo que puede causar síntomas neurológicos o vasculares1,9. Por esta razón, se ha formulado la hipótesis de que el arco puede causar trastornos por compresión, lo que puede ser una indicación de síndrome de salida torácica (también denominado síndrome de Paget-Schoetter) y, por consiguiente, debe considerarse en el diagnóstico diferencial de este síndrome4,10-12. No obstante, no todos los AAL causan síntomas. Muchos son detectados durante una intervención quirúrgica rutinaria de la axila en pacientes sin antecedentes de síntomas neurovasculares en la extremidad superior13,14.
Hasta ahora se ha prestado poca atención a la relación entre las pruebas neurodinámicas y las variaciones congénitas en la anatomía muscular del miembro superior. Por esta razón, en este estudio investigamos la repercusión del AAL en los resultados de las pruebas neurodinámicas del nervio mediano (PNES1) en extremidades superiores de un grupo de voluntarios sanos.
Un primer objetivo fue investigar las respuestas sensoriales a la PNES1 de una población sana con AAL. El propósito era detectar PNES1 positivas que pudiesen indicar una posible interacción entre el AAL y el haz neurovascular tras una perturbación transitoria del funcionamiento normal de este último.
El cuestionario clínico adicional, realizado después del proceso inicial de selección, reveló que algunos de los sujetos incluidos presentaban "síntomas menores". Los síntomas menores eran de tal naturaleza que no interferían con sus actividades diarias, ni los indujeron a buscar asistencia médica ni tratamiento, así que no se podían clasificar como trastornos y, por consiguiente, los criterios de exclusión no era aplicables. El presente estudio investiga, por tanto, si estos síntomas menores pueden reproducirse mediante la PNES1 en sujetos con AAL que presentan dichos síntomas menores. En el subconjunto de sujetos con AAL sin síntomas menores se investigó si la PNES1 produce respuestas sensoriales anormales. En la etapa temprana subclínica de compresión nerviosa, las respuestas positivas a una prueba de provocación como la PNES1 pueden ser el único hallazgo positivo15.
Además de estas respuestas sensoriales, nuestro interés se centró de forma especial en el arco de movimiento durante la extensión de codo (AM-EC). A pesar de que, desde un punto de vista clínico, la "reproducción de síntomas" se valora como un criterio de importancia máxima en la puntuación de la prueba, la restricción en el AM-EC es, además, una característica para identificar PNES1 positivas16. El AM-EC se ha convertido en un factor decisivo cuando no se consiguen reproducir la molestias del paciente con la PNES1 o cuando la restricción del AM-EC es el único signo detectado en la zona afectada como posible "respuesta anormal encubierta"17. La literatura científica especializada y los informes clínicos publicados coinciden en que, en la población sana, el AM-EC no muestra diferencias entre los lados izquierdo y derecho, lo que permite comparar el lado contralateral para detectar asimetrías17-20. No obstante, Byng21 observó restricciones significativas en el AM-EC de un grupo de individuos sanos usuarios de teclados, lo que cuestiona la simetría del AM-EC en individuos sanos, especialmente en subgrupos específicos. Los participantes con AAL comprendían un subgrupo de ese tipo. Por consiguiente, el presente estudio se centra también en el AM-EC, concretamente en relación con la presencia de una variante muscular potencialmente perjudicial (el AAL). En consecuencia, el segundo objetivo de este estudio fue analizar si el AAL es capaz de afectar al AM-EC.
MATERIAL Y MÉTODOS
Cribado
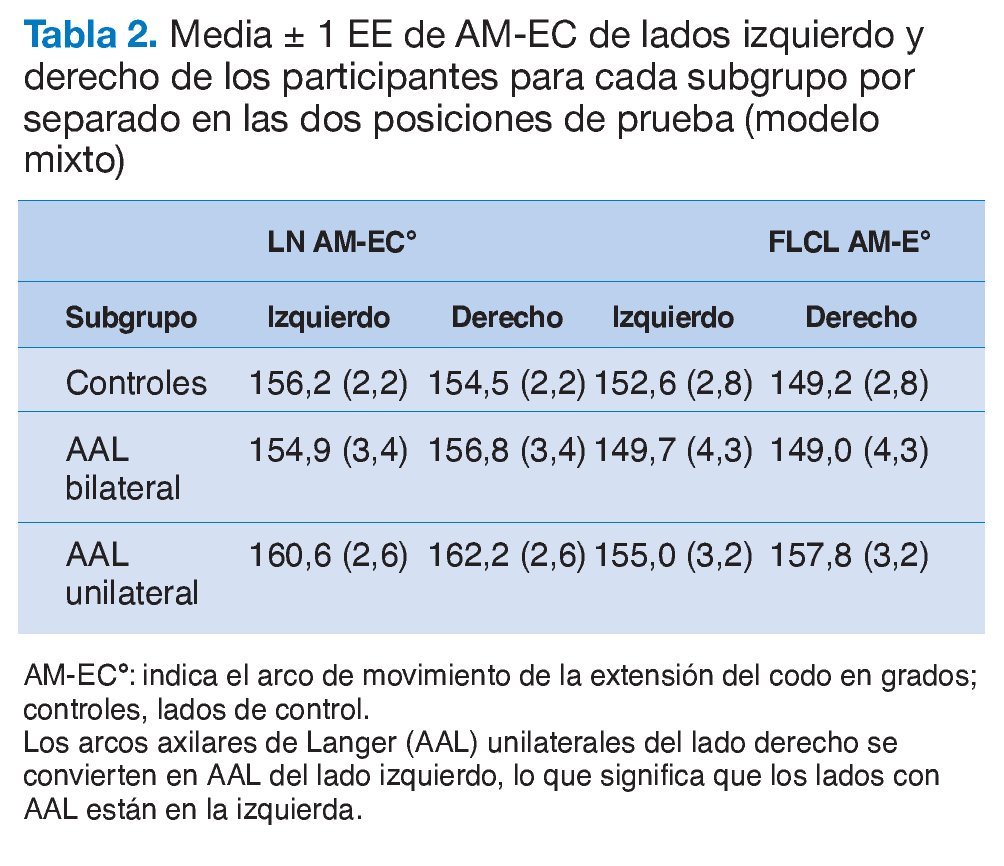
Un total de 640 estudiantes sanos fueron sometidos a un proceso de cribado para detectar la presencia de AAL (fig. 2). Cada brazo fue colocado de forma consecutiva en el hombro del examinador con el codo extendido, la muñeca en posición neutra y el hombro flexionado a 90°. Posteriormente, los sujetos realizaron abducción de hombro, isométricamente, con fuerza submáxima, mientras que el examinador palpaba el borde medial del latísimo del dorso hasta la inserción humeral del pectoral mayor22. En la mayoría de los casos, el AAL era claramente detectable como una masa axilar anómala.
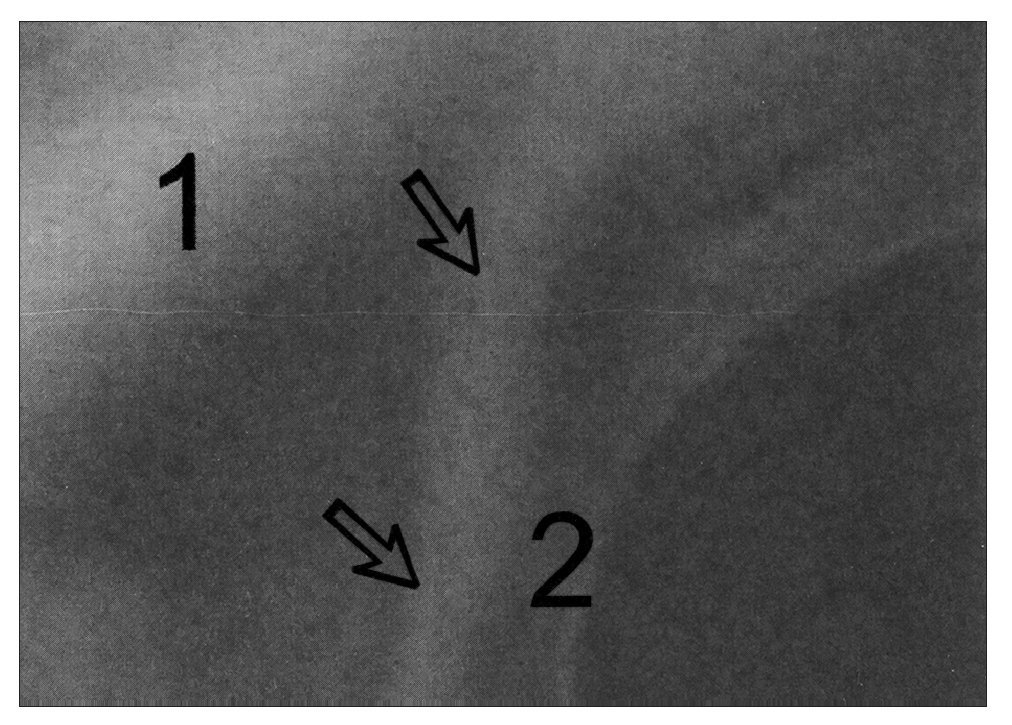
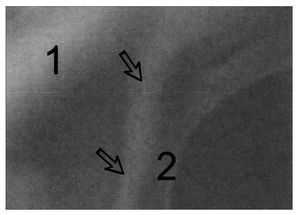
Figura 2. Arco axilar de Langer del lado izquierdo con contracción isométrica y hombro izquierdo en abducción de 90°. Flechas: arco axilar; 1: pectoralis mayor; 2: latísimo del dorso. El arco axilar de Langer es el relieve que se observa desde la parte inferior de la imagen a la derecha de las flechas y a la izquierda del "2" y se funde con el pectoral mayor en la parte superior de la imagen.
Los participantes que fueron diagnosticados con AAL fueron sometidos a examen ecográfico, realizado por un médico experimentado, para evaluar la autenticidad de la anomalía. Se utilizó un equipo de ultrasonido Sienna Sonoline (Siemens, Erlangen, Alemania) con una sonda lineal de 7,5 MHz y se visualizó el AAL en vista transversal y longitudinal, tanto contraído como relajado.
Se excluyó del estudio a los sujetos con arcos no musculares o en los que la autenticidad del AAL era debatible, así como a aquellos sujetos que habían presentado trastornos osteomusculares en el cuadrante superior durante los 6 meses anteriores, tenían enfermedades estrechamente relacionadas con neuropatías o presentaban afecciones del sistema nervioso periférico o central. Cada sujeto fue sometido a una exploración física y para ser incluido en el estudio tenía que demostrar un AM completo y sin dolor en los miembros superiores ni en la columna cervical. Con los mismos criterios, se creó un grupo de control emparejado, compuesto por sujetos sin AAL según el examen manual de la axila.
De los 640 voluntarios, a 30 se les detectó inicialmente AAL. Después de la ecografía, 11 de ellos fueron excluidos porque no se confirmó el AAL. De los 19 sujetos restantes, ninguno fue excluido del estudio por los criterios descritos anteriormente. En el grupo de control, un participante fue excluido debido al tratamiento médico que recibía, que podía afectar al sistema nervioso. Por tanto, el grupo de AAL quedo constituido por 19 voluntarios asintomáticos (8 varones, 11 mujeres; edad [media ± 1 EE], 20,55 años ± 0,65 años; índice de masa corporal, 21,87 ± 0,52) y 17 individuos asintomáticos se ofrecieron como voluntarios para el grupo de control (5 varones, 12 mujeres; edad, 22,44 ± 0,33 años; índice de masa corporal, 21,40 ± 0,34). El comité de ética de la universidad de Ghent aprobó este estudio y los 640 voluntarios firmaron un formulario de consentimiento informado.
Descripción de la prueba
La PNES1 se realizó en cada sujeto bilateralmente y en 2 posiciones diferentes: columna cervical en posición neutra (LN) y columna cervical en flexión lateral contralateral submáxima (FLCL), o sea, un recorrido pasivo máximo de flexión lateral sin provocar malestar. Para cada posición, la prueba se repitió 3 veces. Antes de la prueba, se realizó la extensión submáxima de muñeca (extensión total de muñeca menos 10°) mediante una férula termoplástica.
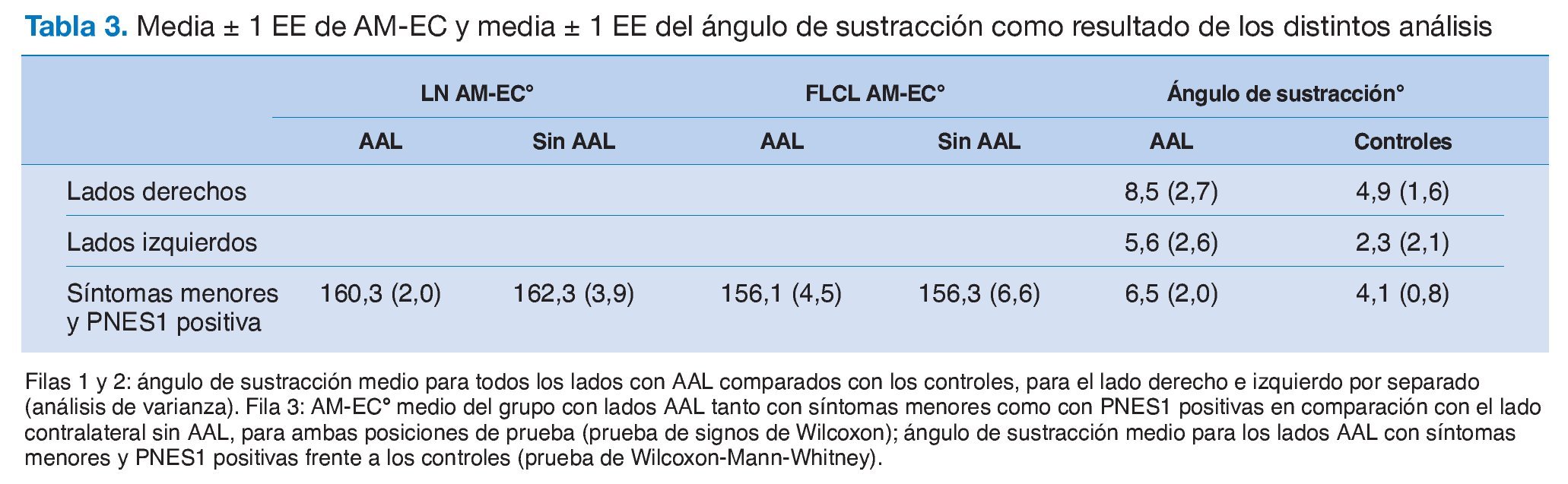
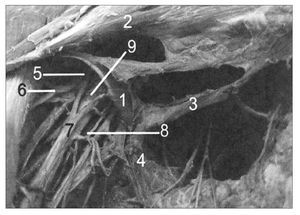
La cabeza y la columna cervical se colocaron suavemente en posición y, con un dispositivo diseñado a la medida, se colocó un soporte acolchado vertical contra el lado de la cabeza para impedir la flexión lateral de la columna cervical hacia el miembro bajo examen. Después, se realizó abdución del hombro hasta que la escápula se comenzaba a elevar. Al llegar a este punto, se colocaba soporte acolchado regulable horizontal encima del acromion, sin aplicar presión caudal adicional para impedir que la escápula se elevase más23,24. Después, se continuaba la abdución de hombro hasta completar el arco, con el antebrazo en posición supina, y el hombro lateralmente rotado, seguido finalmente de una extensión de codo, cuyo AM era la principal medición de la prueba (figs. 3 y 4).
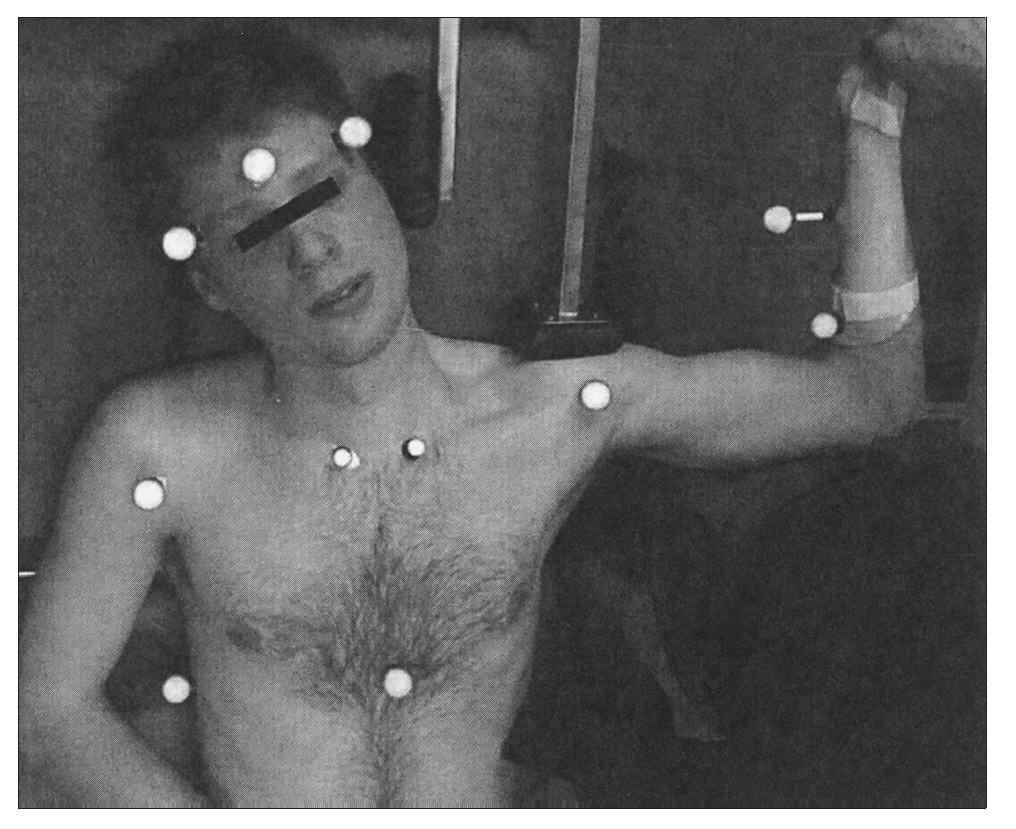
Figura 3. Dispositivo diseñado a medida para fijar la escápula y la columna cervical. Las flechas blancas indican la dirección en la que se pueden ajustar los soportes acolchados. 1: soporte acolchado para fijar la escápula; 2: soporte acolchado para fijar la columna cervical.
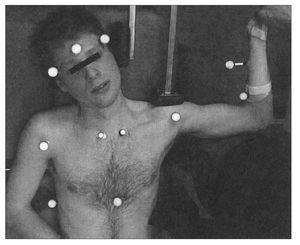
Figura 4. La columna cervical del participante se coloca en FLCL; el soporte acolchado vertical se coloca contra el lateral de la cabeza para impedir flexión lateral de la columna cervical hacia el miembro examinado y el soporte acolchado horizontal fija la escápula durante la prueba. VICON utiliza marcadores en la frente, tórax y extremidad superior para determinar la posición y calcular el AM de la extensión de codo.
La extensión del codo era detenida por el examinador cuando se alcanzaba la resistencia final máxima (R2)23. Los participantes fueron bien informados sobre la posibilidad de interrumpir la prueba tan pronto como detectasen un "malestar submáximo", que se definió de acuerdo con Coppieters et al25 como "el nivel de tolerancia máxima de la prueba con el conocimiento del sujeto de que la prueba debe realizarse de forma repetida".
Procedimiento
El sistema electro-óptico VICON (VIdeo CONvector; Oxford Metrix, Oxford, Reino Unido) midió el AM final de la extensión de codo como el ángulo entre el eje longitudinal del antebrazo y la extensión del eje longitudinal del brazo superior. Este ángulo se convirtió posteriormente en el ángulo complementario y se le denominó arco de movimiento en extensión de codo (AM-EC).
Para comparar el AM-EC entre los sujetos, utilizamos el ángulo de sustracción que consiste en el déficit de AM-EC entre ambas posiciones de la prueba21,26. Por tanto, básicamente expresa el efecto de agregar una maniobra sensibilizadora (p. ej., una FLCL). Selvaratnam et al26 mostraron ángulos de sustracción superiores en un grupo con afectación del plexo braquial al compararlos con los controles, lo que sugiere que las diferencias de dichos ángulos de sustracción podrían atribuirse a la tensión del tejido nervioso. Además, los ángulos de sustracción son valores normalizados apropiados para el análisis entre grupos de individuos, algo que sería difícil de lograr con el AM-EC debido a la gran variabilidad natural que existe entre sujetos (déficit normal de AM-EC, 16,5°-53,2°)27. A pesar de que este procedimiento se ha utilizado con éxito en estudios previos21,26, los autores creen que las características del ángulo de sustracción necesita investigarse en más profundidad.
El orden de la posición inicial se aleatorizó entre la NL y la FLCL para impedir sesgos en la prueba. A intervalos de 1 y 3 min, se repetía la prueba y se cambiaba la posición de la prueba, respectivamente. Todas las pruebas fueron administradas por el mismo investigador con enmascaramiento del AM-EC pero no de la presencia de AAL.
Antes de comenzar las pruebas PNES1, los participantes fueron sometidos a un cuestionario clínico adicional a modo de historial que prestó atención especial a los signos y síntomas neurológicos y vasculares relacionados con actividades y posturas sostenidas de la vida cotidiana y del deporte. Dado que los participantes incluidos en el estudio no presentaban ningún trastorno en el cuadrante superior, el historial adicional se centró en desvelar sintomatología menor pero relevante. El término "síntomas menores" se definió como aquellos signos o síntomas de naturaleza vascular o neurológica que no resultaban perturbadores, ni interferían con las actividades cotidianas ni la práctica del deporte, de modo que los individuos no habían solicitado asistencia médica ni tratamiento. Los síntomas menores se producían en actividades o posturas específicas —la mayoría incluía un componente de rotación externa escapulohumeral y abdución— y se caracterizaba por una ligera irritación28, que desaparecía de inmediato tan pronto como el factor desencadenante se interrumpía.
Durante cada PNES1, se registraron las respuestas sensoriales producidas en un gráfico corporal y se compararon posteriormente a los resultados del historial adicional recopilado. Para los participantes con síntomas menores, la PNES1 se calificó como positiva si dichos síntomas menores eran parcial o completamente reproducidos, o cuando se lograban respuestas sensoriales anormales en una o ambas posiciones de la prueba, y en los participantes "asintomáticos" cuando se registraban respuestas sensoriales anormales en una o ambas posiciones de la prueba. Las respuestas sensoriales anormales se definen tradicionalmente como aquellas que se apartan de las respuestas normales durante una PNES1; estas son: a) estiramiento en la región anterior del hombro; b) estiramiento profundo en la fosa cubital, que se extiende hacia los aspectos anteriores y radiales del antebrazo y continúa al aspecto radial de la mano, y c) una sensación de cosquilleo manifiesto en el pulgar y los 3 primeros dedos29.
En consecuencia, en este estudio se estableció que la PNES1 era positiva de forma independiente de la AM-EC.
Esto también permitía, en caso de necesidad, analizar la interrelación de estos 2 parámetros lo que puede ayudar a dilucidar mejor los mecanismos subyacentes en las pruebas neurodinámicas.
Análisis estadístico
Los coeficientes de correlación intraclase se calcularon como medida de la fiabilidad intraexaminador, mediante las 3 repeticiones realizadas para cada posición de la prueba. Para el análisis se realizó un modelo lineal mixto usando a los sujetos como factor aleatorio. El coeficiente de correlación intraclase se define como el cociente de la varianza intersujeto sobre la varianza total. Para analizar los datos categóricos, que son la aparición de síntomas menores y PNES positiva, se utilizó la prueba de la c2.
El AM-EC se analizó de 2 formas. El símbolo (a) indica el análisis entre ambos lados, intraindividualmente; (b) indica el análisis entre los lados AAL y de control, interindividualmente; además (a) y (b) aparecen también en el apartado "análisis estadístico" para recalcar que el texto pertinente se refiere a o está relacionado con el enfoque intraindividual o el interindividual. Para equiparar el procedimiento habitual en la PNES1 que consiste en comparar el AM-EC del paciente al lado sin afectación o menos afectado, analizamos el AM-EC de ambos lados (a) con un interés particular en los participantes con AAL unilateral. Posteriormente, también se analizó el AM-EC entre los lados AAL y de control (b): según mencionamos con anterioridad, utilizamos el ángulo de sustracción para este propósito.
Investigamos si el AM-EC entre los lados diferían entre los subgrupos (es decir, los controles, AAL bilateral y AAL unilateral) y si la lateralidad manual, es decir, el predominio de una mano sobre la otra, influía en la AM-EC. Nuestro modelo completo incluía, por tanto, los efectos interactivos entre lado y subgrupos, y el efecto principal de lateralidad manual. Se determinó el nivel de significación mediante un modelo lineal mixto corregido para incluir medidas múltiples del mismo individuo (a). Posteriormente, se utilizó un análisis del modelo de varianza para analizar las diferencias en el ángulo de sustracción entre los controles y los AAL, para lados izquierdo y derecho por separado (b).
Para investigar los lados con AAL, síntomas menores y PNES1 positiva, se crearon subconjuntos con tamaños de muestra más pequeños, que no cumplían los supuestos paramétricos. Por tanto, el análisis se realizó mediante pruebas no paramétricas.
La prueba de rango con signos de Wilcoxon para muestras pareadas se utilizó para comparar el AM-EC en los lados AAL con síntomas menores y PNES1 positiva, y el lado contralateral sin AAL. Finalmente, se utilizó la prueba de Wilcoxon-Mann-Whitney para analizar las diferencias en el ángulo de sustracción entre los lados de control y los lados con AAL que mostraban síntomas menores y PNES1 (b) positiva. El AM-EC siempre se evaluó en ambas posiciones de prueba, es decir, en NL y FLCL. Los resultados que se presentan a continuación se expresan como ángulos medios (± 1 EE) y el nivel de significación se estableció en p < 0,05.
RESULTADOS
Los participantes tuvieron la oportunidad de finalizar la prueba si sentían "malestar submáximo". A pesar de ello, ningún participante interrumpió la prueba. Por tanto, el AM-EC se midió en la resistencia final determinada por el examinador. La fiabilidad intraexaminador media para la medición del AM-EC en las 4 pruebas fue de 0,97 (intervalo, 0,96-0,98), con un error estándar de medición medio de 1,9º (intervalo, 1,6°-2,3°). Se observó un efecto significativo de la lateralidad manual sobre el AM-EC, por lo que se ajustó en los modelos estadísticos usados (restricción media de 2,6° ± 1,7° en el lado dominante, p < 0,006).
Síntomas menores y PNES1 positiva
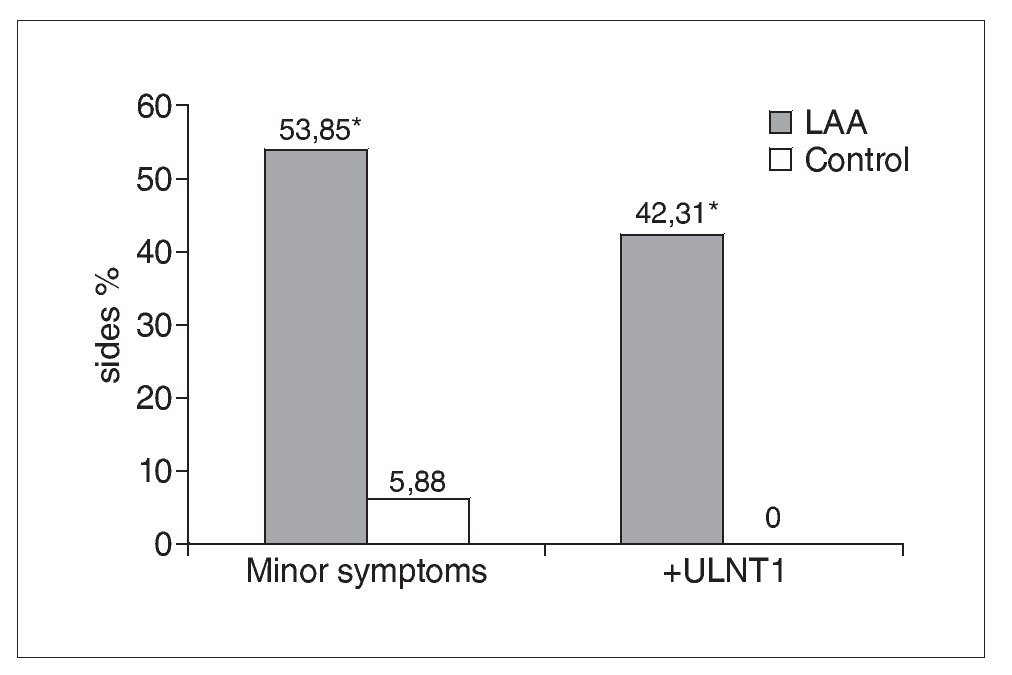
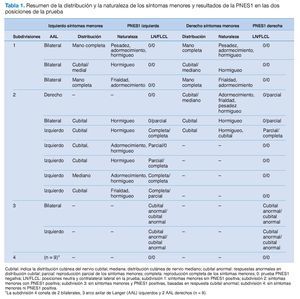
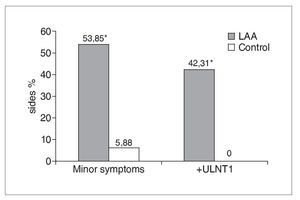
De los 19 participantes con AAL, 12 presentaban una distribución unilateral y 7 bilateral, lo que dio lugar a un total de 26 lados con AAL (tabla 1). La figura 5 muestra que un 54% (14/26) de los lados con AAL mostraban síntomas menores en comparación con el 6% (2/34) de los obtenidos en los lados de control (c2 = 11,23: p = 0,0008). En el 42% (11/26) de los lados con AAL se registró una PNES1 positiva, lo que difería de forma significativa y patente de los controles (c2 = 11,62; p = 0,0007); en el grupo de control no se registraron pruebas PNES1 positivas (fig. 5).
Figura 5. En los lados AAL se obtienen de forma significativa más síntomas menores y pruebas PNES1 positivas que en los controles. El signo * indica un resultado significativo (p < 0,05).
En consecuencia, la sensibilidad de la PNES1 —basada en la provocación de síntomas menores o respuestas sensoriales anormales— en la población estudiada con AAL es del 42%, mientras que la especificidad es del 96%. Obviamente, este elevado grado de especificidad tiene que interpretarse con cautela ya que, en gran medida, se debe al empleo de un grupo de control formado sólo de individuos asintomáticos30. De los casos con AAL y síntomas menores, el 57% (8/14) produjo una PNES1 positiva.
Cuando se analizaron la distribución y la naturaleza de los síntomas menores y los resultados de la PNES1, surgieron 4 modelos diferenciados que se clasificaron en 4 subdivisiones (tabla 1). La primera subdivisión comprende los lados con AAL y síntomas menores pero sin PNES1 positiva; la segunda consta de AAL con síntomas menores y PNES1 positiva. En la tercera, el AAL no presenta ningún síntoma menor, pero la PNES1 es positiva, debido a respuestas sensoriales anormales, y en la cuarta subdivisión, el AAL no va acompañado de síntomas menores ni de PNES1 positiva.
Arco de movimiento de la extensión del codo y ángulo de sustracción
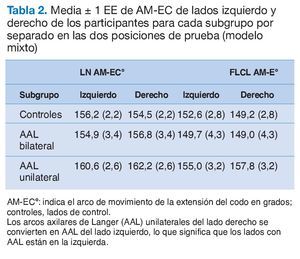
La tabla 2 resume el AM-EC medio para ambas posiciones de la prueba en ambos lados. El modelo mixto no reveló ningún efecto de interacción para el AM-EC entre el lado y los subgrupos al realizar la prueba en NL o FLCL (NL: F2,32 = 1,63, p = 0,21; FLCL: F2,32 = 2,63, p = 0,088) (tabla 2). Más específicamente, en el subgrupo con AAL unilaterales (tabla 2, línea 3), no se encontró ninguna diferencia significativa en el AM-EC entre el lateral con el AAL y el contralateral sin AAL (NL: t32 = 0,99, p = 0,92; FLCL: t32 = 1,32; p = 0,77; ajustado para la comparación múltiple mediante la prueba de Tukey).
Dado que no se observó interacción alguna entre ambos laterales y los subgrupos en el modelo mixto anterior (tabla 2), no era de esperar en el ángulo de sustracción ningún efecto del AAL. Para comprobar e ilustrar esta deducción, se realizó un análisis de varianza post hoc que no reveló diferencias para el ángulo de sustracción entre los lados AAL y de control (lado izquierdo: F1,29 = 0,26; p = 0,61; lado derecho: F1,23 = 2,06; p = 0,17) (tabla 3, filas 1 y 2).
Los análisis adicionales se centraron en los lados con AAL que mostraban tanto síntomas menores como una PNES1 positiva para investigar si el AM-EC sólo se vería afectado en este subconjunto de lados con AAL.
La prueba de rango con signos de Wilcoxon para muestras pareadas no mostró diferencias significativas para el AMEC, al comparar los lados con AAL unilateral, síntomas menores y PNES1 positiva con los contralaterales sin AAL. Vs = 4,00; p = 0,17; FLCL: Vs = 9,00; p = 0,34) (tabla 3, fila 3).
Finalmente, la prueba de Wilcoxon-Mann-Whitney no reveló diferencias significativas para el ángulo de sustracción entre los controles y los AAL con síntomas menores y PNES1 positiva (U = 126; p = 0,47) (tabla 3, fila 3).
DISCUSIÓN
El principal hallazgo del presente estudio es que el AAL se asocia a una mayor aparición de síntomas menores y PNES1 positivas, pero no afecta al AM-EC. En el 54% de los lados con AAL se detectaron síntomas menores, lo que suponía una diferencia significativa respecto a los controles (6%). Se han descrito muchos casos en los que diferentes variantes anatómicas pueden causar neuropatías de compresión en el nervio mediano. Entre estas variantes se encuentra el ligamento de Struthers, con músculos aberrantes en y alrededor del túnel carpiano, y, obviamente, el AAL31-35. En la mayoría de estos informes, las variantes se descubren durante procedimientos quirúrgicos para liberar el nervio de la compresión. En el presente estudio, sin embargo, los sujetos con AAL fueron seleccionados a partir de una población sana. Según el conocimiento de los autores, no existe ningún informe previo que relacione variantes anatómicas a síntomas menores en sujetos seleccionados a partir de una gran población sana y con un diseño del estudio similar.
Se obtuvo una PNES1 positiva en el 42% de los lados con AAL, en contraposición con la ausencia de positividad en todos los lados de control (fig. 5); el AM-EC en AAL, sin embargo, no mostró ninguna restricción respecto a los controles o al otro lado (tabla 3). Este estudio es, por consiguiente, también el primero que se publica sobre la obtención de PNES1 positivas de acuerdo con la reproducción de síntomas menores sin que exista restricción en el AM-EC en sujetos con esta variante muscular. El estudio de Byng's21 es el único otro hallazgo de PNES1 positivas en un grupo seleccionado a partir de una población sana. En dicho estudio, el AM-EC dio valores limitados en un grupo de individuos sanos que utilizaban teclados frente a controles sanos que lo no utilizaban de forma habitual. El hecho de que el AM-EC no se viese afectado con las PNES1 positivas en nuestro estudio se puede atribuir a las características del AAL.
Es posible establecer varias hipótesis respecto a los mecanismos causantes de los síntomas menores o de la reproducción de una "respuesta sensorial anormal". Debido a su estrecha relación con el haz neurovascular subyacente, es posible que el AAL comprima y produzca fricción en los tejidos neurales al deslizarse para acomodar el movimiento de la extremidad superior. Este proceso puede causar irritación y sensibilidad36,37 del nervio, lo que aumentaría su sensibilidad mecánica38,39. Según las características clínicas de los sujetos con AAL y síntomas menores de nuestro estudio, es probable que el tejido neural solo esté levemente sensibilizado. Dicha sensibilidad mecánica levemente superior puede causar la aparición y reproducción de síntomas menores, pero sólo cuando el sistema nervioso periférico se carga al máximo, o sea, durante la extensión completa del AM-EC en la PNES1.
Dependiendo de la pauta de distribución de los síntomas menores, especialmente en la subdivisión segunda (tabla 1), es probable que en vez del nervio mediano, los responsables sean el nervio cubital o el cordón medial. Kleinrensink et al40 señalaban que la PNES1 causaba mayor tensión en el cordón medial que la "PNES del nervio cubital". Shacklock41 observó respuestas anormales producidas por la PNES1 en neuropatía cubital quirúrgicamente comprobada, lo que respalda los resultados de Kleinrensink et al40 acerca de la distribución de la fuerza nerviosa en la extremidad superior. Estos hallazgos pueden posiblemente justificar que los síntomas menores que se observan en la distribución cubital en nuestro estudio se puedan reproducir con la PNES1: si el nervio mediano no está realmente implicado, no habrá restricción de la carga nerviosa máxima, como han demostrado nuestros resultados que no revelan restricción alguna en el AM-EC. El nervio mediano puede, por tanto, generar una tensión máxima que se transmite proximalmente a lo largo del nervio hasta la parte distal del cordón medial. Probablemente, el AAL ejerce compresión en esta parte del cordón medial, como resultado del desplazamiento distal del tejido neural durante esta fase final de la prueba42. De este forma, la tensión y compresión pueden interactuar para producir síntomas menores que se originen en el nervio cubital/cordón medial. Este estudio confirma los hallazgos de otras investigaciones en las que la especificidad anatómica de la PNES1 no es absoluta, como ilustran las respuestas sensoriales producidas en el territorio de distribución del nervio cubital40-44.
Otra posible explicación es que los síntomas sean de origen vascular. Wright45 describe un mecanismo en el que una hiperabducción del hombro compromete el flujo arterial axilar. La hiperabducción y la rotación externa escapulohumeral con abducción son posiciones extremas del hombro que se adoptan en las actividades de la vida cotidiana, por ejemplo, en tareas que requieran la colocación de los brazos por encima de la cabeza. Tales posiciones pueden deteriorar la circulación y, si se mantienen, conducir a trastornos neurológicos y síntomas vasculares de naturaleza intermitente, pero que reaparecen cuando el brazo vuelve a adoptar y mantener esta posición concreta45,46.
Se sabe que "la prueba de estrés del brazo elevado", que consiste en una rotación externa-abducción escapulohumeral de 90° y depresión escapular, es una maniobra que en el síndrome de salida torácica "provoca" al haz neurovascular47. Estas posiciones son componentes esenciales de la PNES1: la posición inicial comprende la rotación externa escapulohumeral con abducción y la escápula se fija en NL, lo que quiere decir que se impide su elevación mientras que se realiza hasta el final de su recorrido la abducción escapulohumeral, lo que da lugar a una fuerza de depresión escapular. Es razonable conjeturar que el efecto potencial de la posición inicial de la PNES1 junto con el efecto del AAL, que está tenso en esta posición, produzca ya un deterioro de la circulación que conduzca a síntomas menores. Esto supone que es muy probable que los demás componentes de la PNES1 (es decir, supinación del antebrazo, extensión de muñeca y, finalmente, extensión del codo, todos ellos movimientos que constituyen una carga adicional para el tejido nervioso)43 no contribuyan a la provocación de síntomas menores vasculares y, lo que es más importante, no se vean afectados. Esto también puede explicar los hallazgos de reproducción de síntomas menores sin que el AM-EC se encuentre limitado en los sujetos con AAL.
En los trastornos neuropáticos periféricos menores puede que sea necesario combinar varios procedimientos de examen para reproducir los síntomas o respuestas anormales. Esto ocurre cuando se ejerce compresión sostenida en el nervio en una posición neurodinámicamente cargada, por ejemplo, en la prueba de compresión carpiana con flexión de muñeca15,48. Esta acumulación de los efectos de distintos parámetros mecánicos hasta llegar al umbral sintomático puede ocurrir cuando la PNES1 se realiza en presencia de AAL, lo que validaría tanto la hipótesis neurogénica como la vascular18,49,50. Cuando al efecto de máxima tensión de la PNES1 en un AM-EC completo se le suma el efecto potencial de la compresión del AAL, es posible que se reproduzcan los síntomas menores. Otro ejemplo es la compresión de la tercera porción de la arteria axilar por la cabeza humeral durante la rotación externa-abducción escapulohumeral de 90°46,51. Si a esto se añade compresión del AAL, que se tensa en dicha posición, es probable que la circulación se deteriore y aparezcan síntomas.
La diferenciación entre los síntomas arteriales y las manifestaciones de una compresión neurológica, dependiendo de la naturaleza y la distribución de los síntomas menores puede ser difícil de establecer, especialmente en las etapas tempranas. En dicha etapa de atrapamiento vascular, los síntomas pueden ser leves y con frecuencia intermitentes, como se ha observado en nuestro estudio52,53.
Distintos observadores notificaron adormecimiento, frialdad, parestesia, cambio de coloración de la piel y un dolor difuso sordo como principales síntomas vasculares tempranos que ocurren en uno o más dedos, o en toda la mano46,54,55. No obstante, la interpretación de estos síntomas puede confundir ya que la frialdad, el adormecimiento, y la pesadez también puede tener un origen neurológico52. El cuadro clínico en el presente estudio era sumamente variable y, por consiguiente, es probable que ambos sistemas fueran responsables de los mismos, dependiendo de las partes del plexo braquial involucradas y del grado de implicación del sistema circulatorio.
Finalmente, este estudio revela que el AAL, con o sin síntomas menores, no suele tener repercusión en el AMEC. Por consiguiente, la hipótesis de que AAL puede inducir asimetría en el AM-EC debe rechazarse. Al mismo tiempo, la simetría en AM-EC tiene que interpretarse de forma crítica, aunque sólo sea porque el presente estudio observó que la lateralidad manual tenía un efecto considerable. El AM-EC de la mano dominante está restringido hasta 2,6° en comparación con el lado no dominante. Este efecto de la lateralidad sobre el AM-EC es importante desde un punto de vista clínico, pero es aún más importante desde la perspectiva investigadora y debe corregirse en los modelos estadísticos empleados.
Puesto que el AAL se ha detectado en aproximadamente el 7% de la población general, uno de cada 15 pacientes que visiten al fisioterapeuta por todo tipo de molestias probablemente presentará AAL sin saberlo. El arco axilar de Langer puede solaparse con otros trastornos neurogénicos o de otro origen, y presentarse de esa manera al fisioterapeuta. Además, es posible que el AAL esté presente en el lado no afectado, en el que también se realiza la PNES1 como procedimiento habitual. Por consiguiente, siempre que la PNES1 muestre resultados similares a los observados en nuestro estudio es aconsejable realizar un examen de la axila para detectar un posible AAL.
Nuestra metodología presenta algunas limitaciones que deben mencionarse. Primero, el examinador conocía la presencia de AAL (es decir, el diseño no aplicó enmascaramiento de AAL). Esto podría ser una fuente potencial de sesgo durante la recopilación del historial clínico adicional y a la hora de juzgar la PNES1. En segundo lugar, si se considera que los síntomas menores eran de origen neural, según la pauta de distribución de síntomas, esclarecida durante el cuestionario clínico adicional, lo más probable es que el responsable sea el nervio cubital y no el mediano. La exploración física durante el cribado no incluía la prueba de inestabilidad escapulohumeral, lo que podría haber sido una fuente potencial de sesgo, puesto que, la posición inicial de la PNES1 puede producir signos y síntomas en hombros inestables muy similares a los observados en nuestro estudio.
Los resultados del presente estudio muestran una asociación entre la presencia de AAL y la aparición de síntomas menores. Se obtuvo un número significativamente mayor de pruebas PNES1 positivas en los lados con AAL (42%) que en los controles (0%), mientras que no se observaron restricciones en el AM-EC.
Estos resultados indican que el AAL es probablemente capaz de provocar afectos transitorios en el haz neurovascular axilar. La ausencia de afectación del AM-EC puede deberse al origen vascular de los síntomas menores o, en el ámbito de una teoría neurogénica, una consecuencia típica de la respuesta del nervio cubital/cordón medial a la PNES1, que esencialmente está sesgada hacia el nervio mediano.
Cuando los resultados de la PNES1 se asemejen a los obtenidos en este estudio, es aconsejable realizar un examen de la axila en busca de AAL, que, si está presente, puede explicar hallazgos que de otro modo resultan ambiguos. Las investigaciones futuras deben centrarse en el AAL y su relación con el nervio cubital, evaluada mediante la prueba neurodinámica de la extremidad superior para el nervio de cubital (PNES2 o ULNT2 en inglés). La posible asociación entre el AAL y la arteria axilar debe también explorarse en más detalle mediante técnicas ultrasonido Doppler.
Aplicaciones prácticas
- El arco axilar de Langer puede causar trastornos neurológicos (y vasculares) en el miembro superior; sin embargo, no todos los arcos son sintomáticos.
- El arco de movimiento de extensión del codo (AMEC) de la prueba neurodinámica del nervio mediano (PNES1) no se vio influido por el arco axilar de Langer en los sujetos sanos.
- Se observó un aumento significativo en la presencia de síntomas menores y de pruebas PNES1 positivas (basadas en la reproducción de síntomas menores o en respuestas sensoriales anormales) en los sujetos sanos con arco axilar de Langer al compararlos con controles.
- La aparición y la reproducción de síntomas menores mediante la PNES1 puede tener origen vascular y/o neurológico.
AGRADECIMIENTOS
Los autores quisieran agradecer a Philip Moulaert sus consejos durante la preparación del procedimiento de la prueba, a Barbara De Bondt y a Iris Wojtowicz sus útiles observaciones durante la preparación de este artículo, y a Aron De Smet la captura y preparación de las imágenes. También deseamos dar nuestras gracias más sinceras a Nathalie Vermeire y a Ellen De Dobbelaere por las muchas horas que pasaron operando el sistema Vicon y a todos los participantes que se ofrecieron como voluntarios para este estudio.
CONFLICTO DE INTERESES
Los autores han declarado no tener ningún conflicto de intereses.
FINANCIACIÓN
Este estudio estuvo financiado por una beca de la Facultad de Medicina y Ciencias de la Salud de la Universidad de Ghent como apoyo a una tesis de Máster en Ciencias de la Rehabilitación y Fisioterapia.
Correspondencia:
T. Van Hoof, PT.
Department of Human Anatomy, Embryology, Histology and Medical Physics, University of Ghent.
De Pintelaan 185, 4B3. B-9000 Ghent. Bélgica.
Correo electrónico:
tom.vanhoof@ugent.be
Recibido el 17 de diciembre de 2007.
Aceptado el 30 de marzo de 2008.
Publicado en: J Manipulative Physiol Ther. 2008;31:474-83.
Derechos de autor © 2008
por la Universidad Nacional
de Ciencias de la Salud.
doi:10.1016/j.jmpt.2008.06.007