El desarrollo de nuevos síntomas como aparición o aumento de debilidad, dolor, atrofia y fatiga musculares, décadas después de haber padecido poliomielitis anterior aguda se conoce como síndrome pospolio (SPP). En Argentina no existen datos sobre su prevalencia.
ObjetivosDeterminar la afectación y las secuelas de los pacientes sobrevivientes de poliomielitis en Argentina. Identificar y caracterizar pacientes con SPP.
MétodosEstudio descriptivo de corte transversal que incluyó a 698 pacientes de diferentes provincias de Argentina con antecedentes de poliomielitis, entre 2019 y 2022. Se realizaron encuestas on-line y telefónicas acerca de variables socioeconómicas, edad de diagnóstico de polio, síntomas de SPP, estudios diagnósticos y tratamiento. Los participantes fueron convocados a participar voluntariamente a través de redes sociales, afiches y listas de correos de asociaciones que nuclean a individuos que presentaron poliomielitis anterior aguda.
ResultadosLa mayoría de los encuestados había padecido polio entre los 1 y 3 años (media 1,48). El SPP se observó en el 61,8% de los casos. Los síntomas de SPP refirieron mayor debilidad (89%), dolor muscular (77%), trastornos del sueño (76%) y fatiga (8%). La edad media de inicio de síntomas fue de 50 años. La mayoría de ellos refirió dificultades para recibir diagnóstico y tratamiento apropiado. El diagnóstico de SPP fue significativamente más frecuente en las mujeres (60,04%) con respecto a los varones (39,95%) (p=0,000).
ConclusionesEl 61,8% de los sobrevivientes de polio en Argentina presenta SPP. Reconocer el SPP y su prevalencia ayudará a planear políticas públicas dirigidas a un diagnóstico y tratamiento adecuados.
The development of new symptoms of weakness, pain and fatigue decades after having experienced poliomyelitis is known as post-polio syndrome (PPS). In Argentina, there is no data available on its prevalence.
ObjectivesTo determine the impact and sequelae of polio survivors in Argentina. To identify and characterize patients with PPS.
MethodsA descriptive cross-sectional study that included 698 patients from different provinces of Argentina with a history of poliomyelitis, between 2019 and 2022. Online and telephone surveys were conducted regarding socioeconomic variables, age of polio diagnosis, PPS symptoms, diagnostic studies, and treatment.
ResultsMost patients experienced polio between 1 and 3 years of age (mean 1.48). PPS was observed in 61,8% of the patients. Common PPS symptoms reported were increased weakness (89%), muscle pain (77%), sleep disorders (76%), and fatigue (8%). The average age of symptom onset was 50 years. Most patients reported difficulties in receiving a proper diagnosis and treatment. The diagnosis of PPS was significantly more frequent in women (60,04%) compared to men (39,95%) (p=0.000).
Conclusions61,8% of polio survivors in Argentina have PPS. Recognizing PPS and its prevalence will help in planning public policies aimed at proper diagnosis and treatment.
Hace alrededor de 3000 años que se conoce la poliomielitis anterior aguda o poliomielitis paralítica aguda o parálisis infantil (polio), cuyo poder para inmovilizar a sus víctimas fue descripto en un antiguo bajorrelieve egipcio. En su época de pleno apogeo, paralizó o mató alrededor de medio millón de personas todos los años, antes del descubrimiento de una vacuna1-3. Esta enfermedad, antes conocida como «parálisis infantil» ha afectado a la humanidad a lo largo de la historia. Se caracteriza por su transmisión fecal-oral y su alta capacidad de contagio, especialmente en niños y durante los meses cálidos. En promedio, uno de cada 200 niños infectados sufre un ataque viral a las neuronas motoras del asta anterior medular, lo cual ocasiona intensos dolores, fiebre y, como secuela, una parálisis muscular flácida. De los afectados, aproximadamente el 10% desarrolla parálisis en los músculos respiratorios y la mortalidad en los casos graves oscila entre el 5 y el 10%. Entre 1840 y 1890, el ortopedista alemán Jakof Heine y el pediatra sueco Oskar Medin realizaron publicaciones detallando la historia natural de la polio y sus complicaciones neurológicas; debido a sus contribuciones, fue conocida como la enfermedad de Heine-Medin4. Su naturaleza altamente contagiosa fue revelada a la comunidad médica en 1905 por el médico sueco Ivar Wickam, discípulo de Medin, pocos años después de la creación de la Organización Panamericana de la Salud (OPS) en 19025,6.
En Argentina, en 1936, debido a un brote de poliomielitis, el profesor de pediatría Juan Pedro Garrahan advirtió sobre el potencial epidémico de la enfermedad. Ese mismo año se promulgó la Ley 12317, que exigía la notificación obligatoria de enfermedades infecciosas transmisibles. En ese momento la tasa de incidencia fue de 10/100000 y fue creciendo paulatinamente hasta llegar a 33/100.000 en 19561.
En 1951, Jonas Salk y su equipo desarrollaron un método para cultivar el virus de la polio en el tejido renal de los monos para poder producir grandes cantidades de la vacuna. El gobierno de Estados Unidos dio luz verde para el uso de la vacuna de Salk el 12 de abril de 1955, después de que los resultados de los ensayos mostraran una efectividad del 80-90%. Sin embargo, las primeras dosis de la vacuna no llegaron a Argentina hasta septiembre de 19561,2,4,5,7,8. El 24 de agosto de 1960, otra vacuna contra la poliomielitis (vacuna oral de poliovirus [OPV]; vacuna oral contra la poliomielitis), creada por Albert Sabin, fue autorizada en los Estados Unidos. La vacuna Salk, también conocida como IPV (vacuna inactivada de poliovirus), está compuesta por poliovirus inactivados mediante formalina. En cambio, la vacuna Sabin, también conocida como OPV, contiene poliovirus vivos pero debilitados. Gracias a las vacunas, el 29 de septiembre de 1994 la poliomielitis fue declarada erradicada en las Américas por la Organización Mundial de la Salud. El último caso de polio reportado en Argentina ocurrió en el año 1984. La vacuna Salk proporciona una inmunidad individual, lo que significa que protege a la persona vacunada de desarrollar la enfermedad, pero no previene la propagación del virus a otras personas. Por otro lado, la vacuna Sabin, al ser administrada por vía oral, también genera inmunidad en el intestino, lo que ayuda a prevenir la propagación del virus a través de la ruta fecal-oral, lo que contribuye a la erradicación de la enfermedad a nivel comunitario. La vacuna Salk, al estar compuesta por virus inactivados, no presenta el riesgo de causar la enfermedad a la persona vacunada. Una versión mejorada de la vacuna IPV de Salk se introdujo de nuevo en 1997, porque la OPV Sabin tenía un mayor riesgo de infectar a los niños con el virus en la primera dosis1,4,9. A partir del 18 de agosto del 2014, se recomienda que los niños reciban la primera dosis de IPV a los 2 meses de edad, luego a los 4 meses, a los 6 meses y a los 4 o 6 años10.
Según la Organización Mundial de la Salud, los casos debidos al poliovirus salvaje han disminuido en más del 99% desde 1988, pasando de aproximadamente 350.000 casos en más de 125 países endémicos a solo 2países endémicos (hasta octubre del 2023): Afganistán y Pakistán8,11.
En casos muy raros, la vacuna Sabin puede causar la aparición de casos de poliomielitis paralítica asociada a la vacuna (VAPP, por sus siglas en inglés) en personas vacunadas y sus contactos cercanos. Además, existe el riesgo de que los poliovirus vivos atenuados presentes en la vacuna Sabin puedan mutar y generar cepas de poliovirus derivadas de la vacuna (VDPV, por sus siglas en inglés), que pueden causar brotes de poliomielitis en comunidades con baja cobertura de vacunación. A pesar de la disminución del virus salvaje, los casos de polio derivada de la vacuna han experimentado un aumento significativo: se triplicaron entre 2018 y 2019, y nuevamente entre 2019 y 2020. Desde enero del 2020 hasta abril del 2022, se han reportado casi 1.900 casos de polio derivada de la vacuna en 33 países12,13.
El número estimado de personas afectadas por la poliomielitis ronda los 15 millones en todo el mundo. Entre el 50-80% experimenta una debilidad nueva, progresiva, décadas después de la enfermedad primaria, que se conoce como síndrome pospolio (SPP)14-19. El primer caso de nueva atrofia y debilidad muchos años después de la poliomielitis paralítica aguda fue descripto por primera vez en 1875 por Raymond20. El término de SPP fue introducido por Halstead en 198521 y actualmente la Organización Mundial de la Salud la codifica como G14 en la Clasificación Estadística Internacional de Enfermedades y Problemas Relacionados con la Salud (CIE-10)22.
Aunque se han realizado numerosos estudios con respecto a la etiología del SPP, su patogenia no se ha entendido completamente. Algunos estudios lo atribuyen a la muerte precoz de las motoneuronas gigantes que se desarrollaron durante la recuperación después de la poliomielitis paralítica14-19. Los síntomas del SPP son los mismos en todas partes del mundo: debilidad muscular, atrofia, fatiga generalizada, fatiga postejercicio, dolor muscular, fasciculaciones, calambres, intolerancia al frío y dolor en las articulaciones14,15,21,23-34.
Los criterios de diagnóstico para el SPP que se consideran actualmente son los de la Federación Europea de Sociedades Neurológicas (EFNS)35:
- 1.
Poliomielitis paralítica previa con evidencia de pérdida de neuronas motoras, confirmada por antecedentes de enfermedad paralítica aguda.
- 2.
Un período de recuperación funcional parcial o bastante completa después de la poliomielitis paralítica aguda seguido de un intervalo (usualmente 15 años o más) de función neurológica estable.
- 3.
Inicio gradual o repentino de debilidad muscular progresiva y persistente o fatigabilidad muscular anormal (disminución resistencia) con o sin fatiga generalizada, atrofia muscular, debilidad en las extremidades o dolor muscular y articular.
- 4.
Los síntomas persisten durante al menos un año.
- 5.
Exclusión de otros problemas neurológicos, médicos y ortopédicos como causas de los síntomas.
La electromiografía (EMG) es una herramienta invaluable para evaluar casos sospechosos de SPP, ya que permite confirmar una historia previa de poliomielitis al tiempo que excluye diagnósticos diferenciales. La denervación en curso puede detectarse en la EMG convencional mediante la presencia de potenciales de fibrilación y fasciculación en músculos recientemente debilitados. La EMG con aguja también puede detectar fácilmente los músculos afectados de forma subclínica en el SPP. De todas maneras, dado que estos hallazgos tienen baja especificidad, no existen criterios puramente electromiográficos para confirmar el SPP18,36-38.
En Argentina, los registros de los pacientes que sobrevivieron a la polio tienen una antigüedad de 30 años y no están actualizados, lo que implica que no se disponen de datos cuantitativos sobre esta población ni se conoce la cantidad actual de personas afectadas por el SPP. Este estudio fue diseñado para obtener información socioeconómica, médica y funcional de los supervivientes de la poliomielitis y la prevalencia de SPP en Argentina.
Materiales y métodosEste es un estudio de corte transversal en Argentina, desarrollado a lo largo de 3 años (septiembre del 2019-septiembre del 2022) en los cuales se realizó una única encuesta anónima y voluntaria, telefónica, a 749 individuos con antecedentes de polio en la infancia. Todas las encuestas fueron realizadas por la misma especialista en Neurología. Los datos fueron procesados de acuerdo con la Ley de protección de datos personales.
La encuesta contenía preguntas sobre los siguientes aspectos: sociodemográficos (lugar de residencia actual, fecha de nacimiento, nivel de instrucción, ocupación); enfermedades concomitantes (diabetes mellitus, enfermedad pulmonar obstructiva crónica [EPOC], tabaquismo, trastorno depresivo, insuficiencia cardiaca); antecedente y secuelas de polio (a qué edad tuvo poliomielitis, en que año, si fue vacunado, partes del cuerpo que afectó la enfermedad y su severidad, secuelas actuales, presencia de deformidad articular); síntomas compatibles con SPP (nueva debilidad muscular o empeoramiento de la previa, fatiga, mayor atrofia, dolor articular o muscular, a qué edad ocurrió; si dejó de hacer actividades que antes hacía por el aumento de esta debilidad, cambios en el estado de ánimo, trastornos del sueño); síntoma inicial de SPP (debilidad, fatiga, dolor); estudios realizados (electromiografía en los últimos 10 años o para el diagnóstico de SPP); tratamiento que recibe para SPP (kinesiología, acuática, TO, rehabilitación multidisciplinaria).
Se realizó un análisis descriptivo de las variables en estudio, con el cálculo de la media, mediana y desviación estándar (DE). Para comparaciones de variables categóricas, se utilizó la prueba de la chi al cuadrado, con una significación del 5%. Utilizamos la mediana de la distribución en todos los sujetos para determinar el punto de corte para la dicotomización de variables continuas. Se realizó por último un análisis univariado para comprender la relación entre la polio, sus secuelas y el desarrollo de SPP. Se utilizó el software SPSS de IBM (IBM SPSS Statistics for Windows, Version 25.0.0, Armonk, NY, EE. UU.). Se realizó un análisis univariado para identificar los posibles factores de riesgo de SPP. La asociación entre un factor de riesgo y SPP se expresó utilizando la odds ratio (OR) con un intervalo de confianza del 95%. Se ajustaron las estimaciones de riesgo para el efecto de todos los demás factores utilizando modelos de regresión logística múltiple. Se consideró significativa una p<0,05.
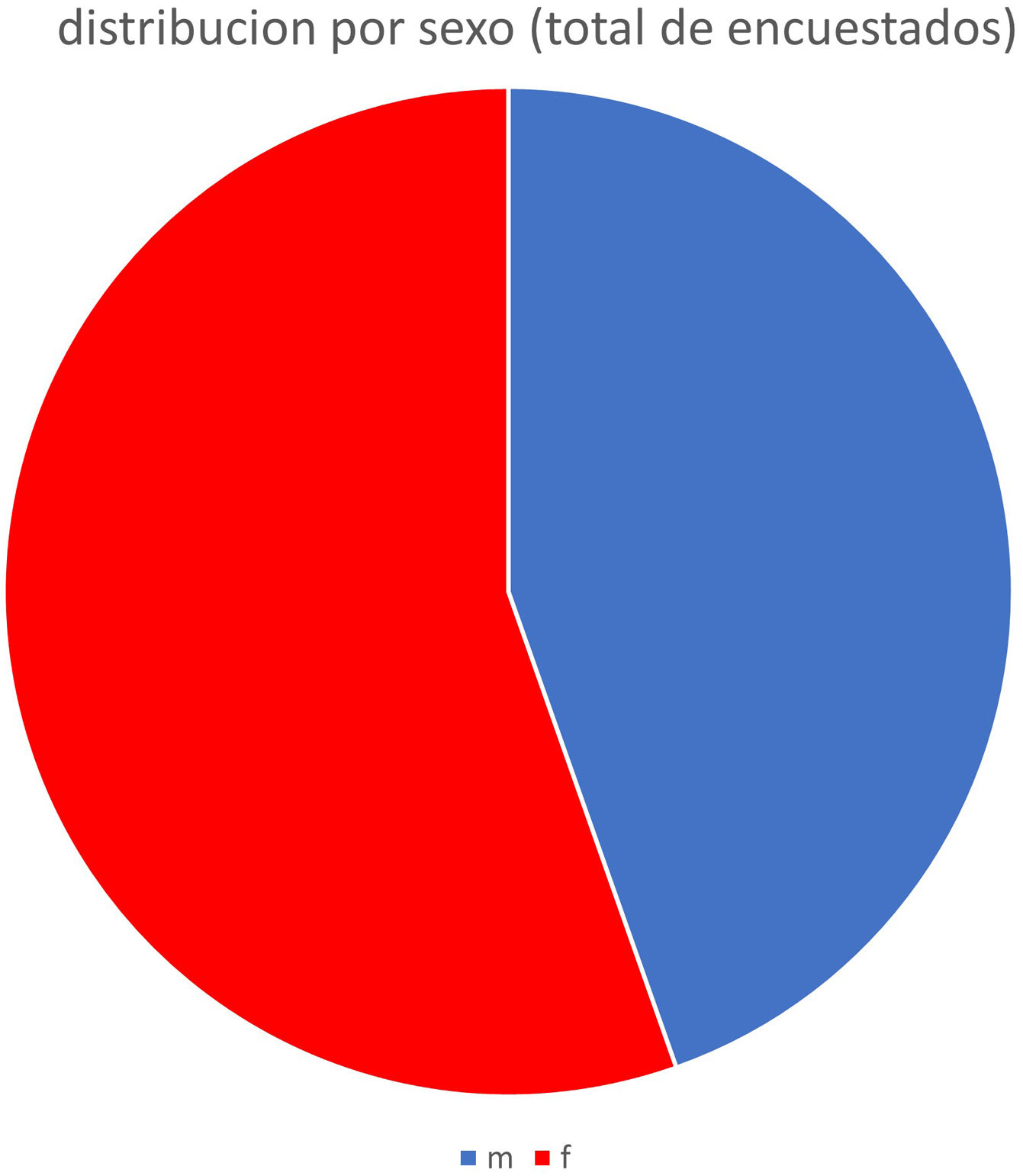
ResultadosUn total de 698 personas completaron la encuesta, 55,4% de sexo femenino y 44,6% masculino, con residencia en las distintas provincias de Argentina. Las edades oscilaban entre 49 y 74 años, con una media de 65 años.
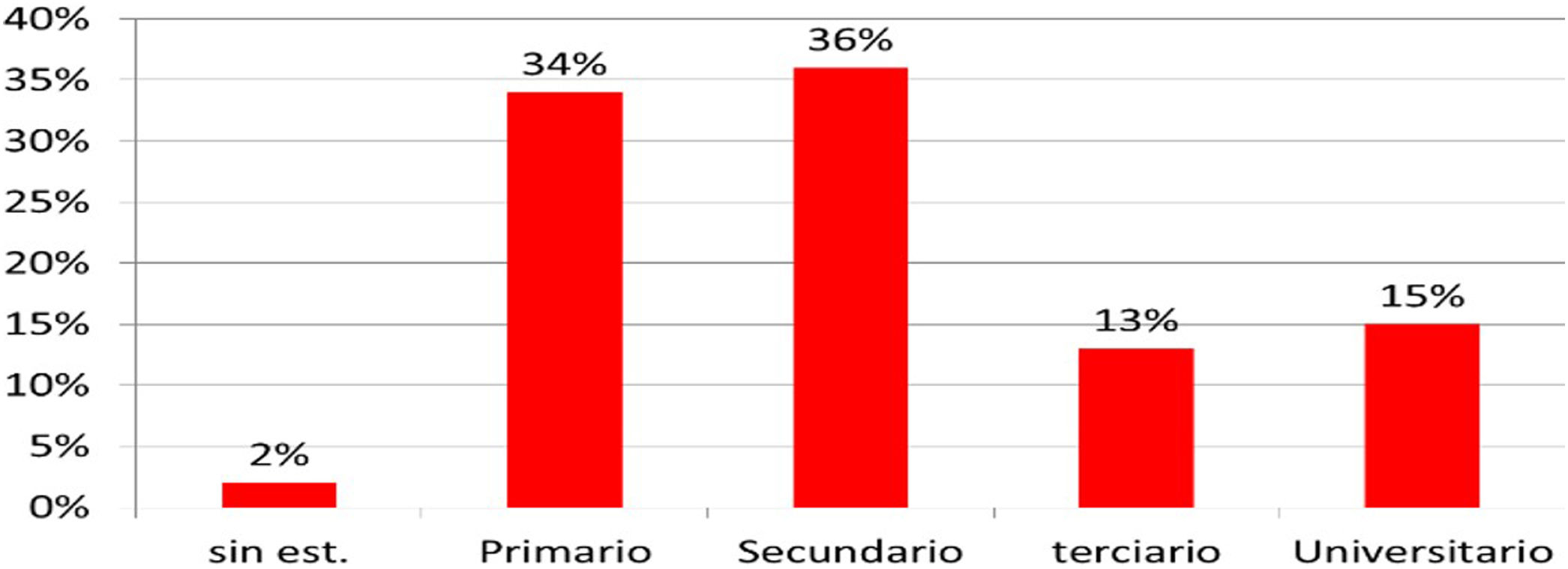
La mayor proporción de encuestados tiene nivel de instrucción secundario (36%) y actualmente, el 51% no trabaja; siendo la mayoría jubilados o pensionados y la principal ocupación trabajo particular, se incluyen aquí los profesionales sin sueldo (20%) y solo el 16% es empleado asalariado (fig. 1).
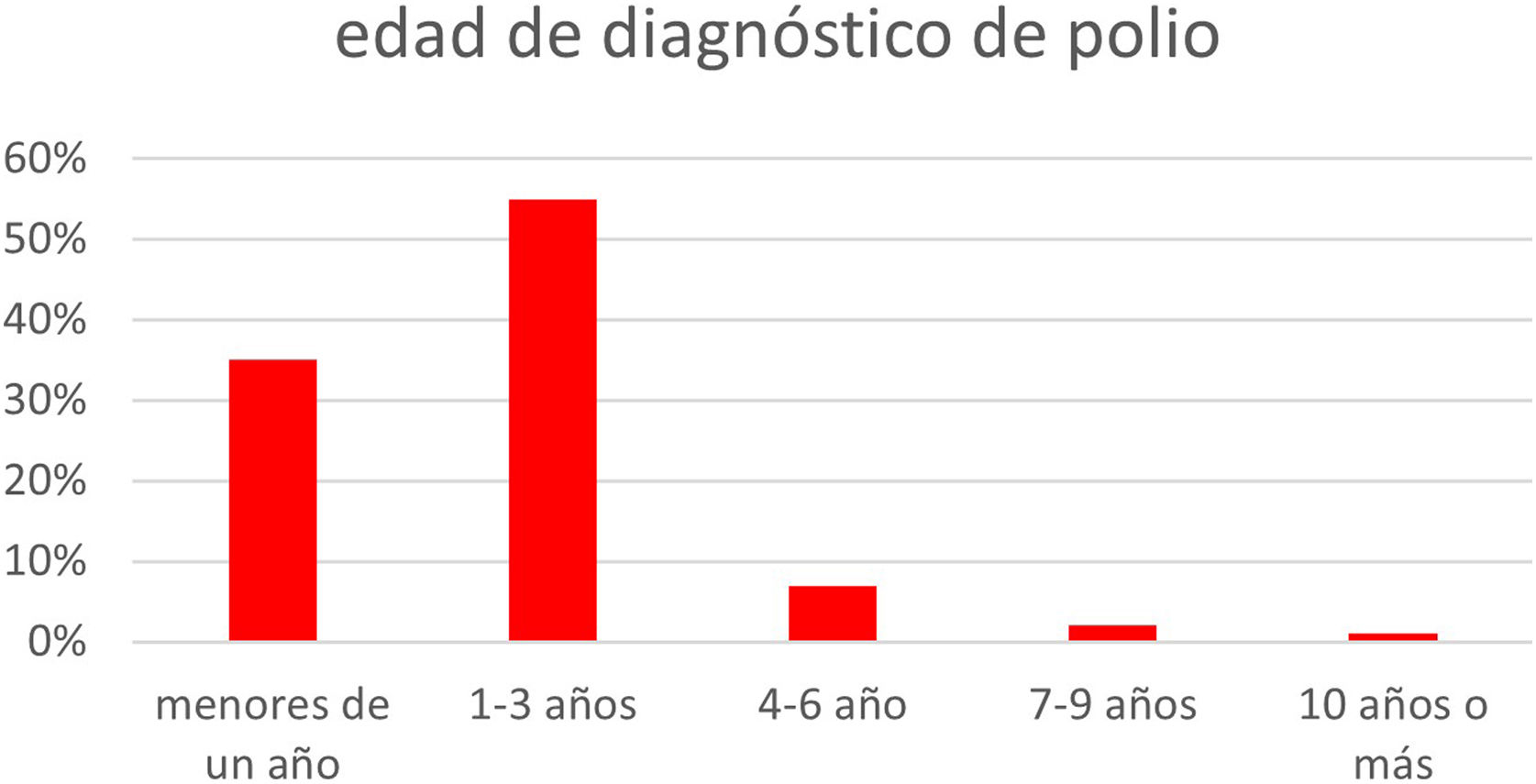
Sobrevivientes y secuelas de polio en ArgentinaLa edad del diagnóstico de poliomielitis de la mayoría de los pacientes fue entre 1 y 3 años (media=1,48 año). El 50% fue diagnosticado en la década del 1950 y el 38% en los años 60 (fig. 2).
El 81% de los encuestados no recibió vacunación contra la polio, el 14% recibió la vacuna Salk y el 5% la vacuna Sabin.
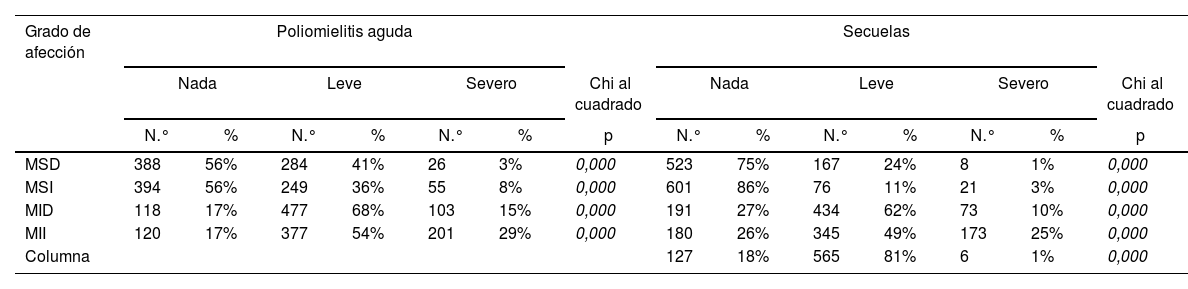
Del análisis según grado de afección en miembros superiores e inferiores se puede observar que el mayor predominio se vio en miembros inferiores, a predominio derecho, en grado leve tanto en la forma aguda como en las secuelas. En la columna como secuela se consideró la escoliosis, el 1% de los sujetos requirió cirugía para su corrección (tabla 1).
Poliomielitis, afección de inicio y secuelas
| Grado de afección | Poliomielitis aguda | Secuelas | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nada | Leve | Severo | Chi al cuadrado | Nada | Leve | Severo | Chi al cuadrado | |||||||
| N.° | % | N.° | % | N.° | % | p | N.° | % | N.° | % | N.° | % | p | |
| MSD | 388 | 56% | 284 | 41% | 26 | 3% | 0,000 | 523 | 75% | 167 | 24% | 8 | 1% | 0,000 |
| MSI | 394 | 56% | 249 | 36% | 55 | 8% | 0,000 | 601 | 86% | 76 | 11% | 21 | 3% | 0,000 |
| MID | 118 | 17% | 477 | 68% | 103 | 15% | 0,000 | 191 | 27% | 434 | 62% | 73 | 10% | 0,000 |
| MII | 120 | 17% | 377 | 54% | 201 | 29% | 0,000 | 180 | 26% | 345 | 49% | 173 | 25% | 0,000 |
| Columna | 127 | 18% | 565 | 81% | 6 | 1% | 0,000 | |||||||
MID: miembro inferior derecho; MII: miembro inferior izquierdo; MSD: miembro superior derecho; MSI: miembro superior izquierdo.
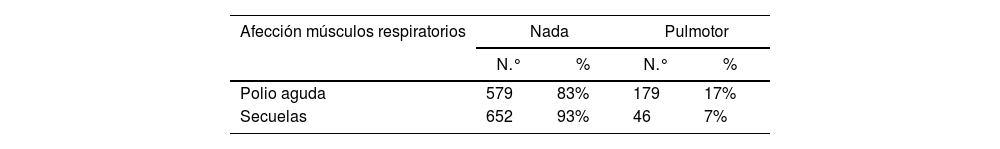
En cuanto a la afección en músculos respiratorios, si bien en la etapa aguda fueron afectados en un 17%, en la etapa secuelar solo quedaron afectados un 7%. Las secuelas que se consideraron fueron, disnea, EPOC, enfisema, asma, bronquitis a repetición (tabla 2).
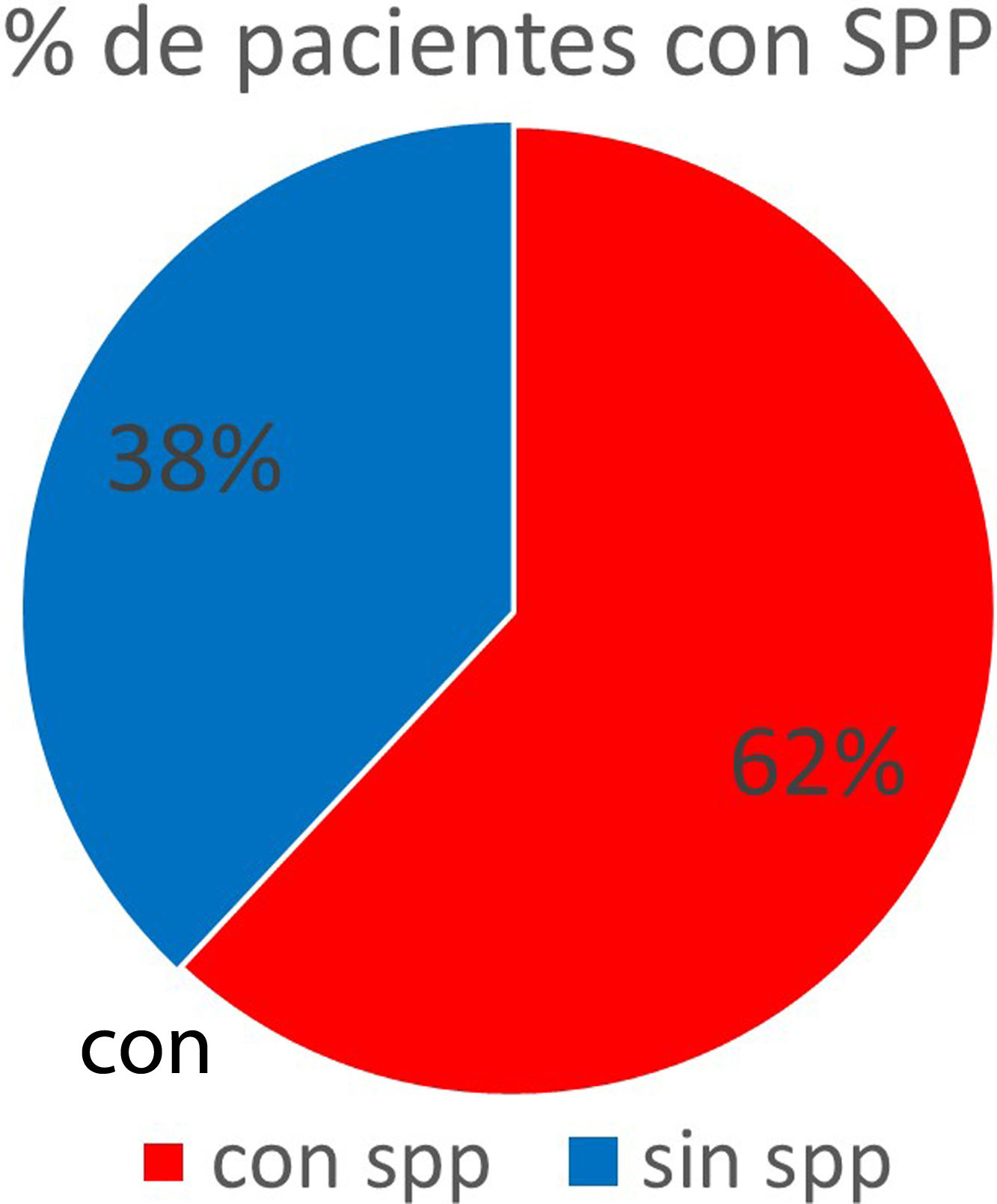
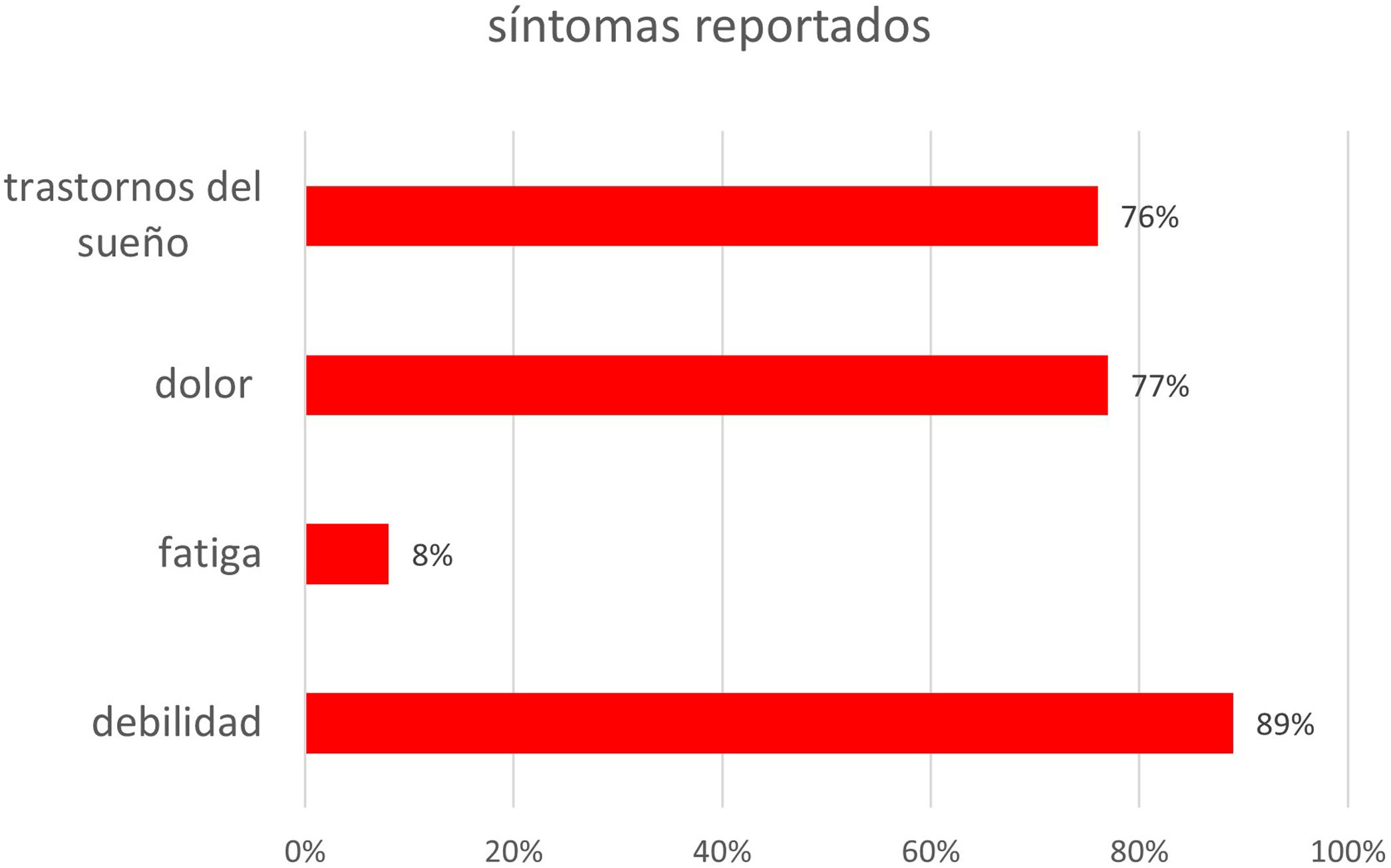
Síndrome pospolioLa presencia de SPP se observó en el 61,8% de los pacientes (fig. 3). Los participantes manifestaron la presencia de mayor debilidad en los miembros previamente afectados o nueva debilidad en otros segmentos (89%) dolor muscular (77%), trastornos del sueño (76%), entre los que se destacaron sueño poco reparador (93%), insomnio (44%) y apnea/hipopnea (3%). El abandono de actividades por el aumento de la debilidad muscular fue manifestado por el 52% de los sujetos. El 75% de los pacientes no realizaron EMG, 20% tenía EMG con otros diagnósticos y solo en el 5% (35) el SPP fue confirmado mediante este método (fig. 4).
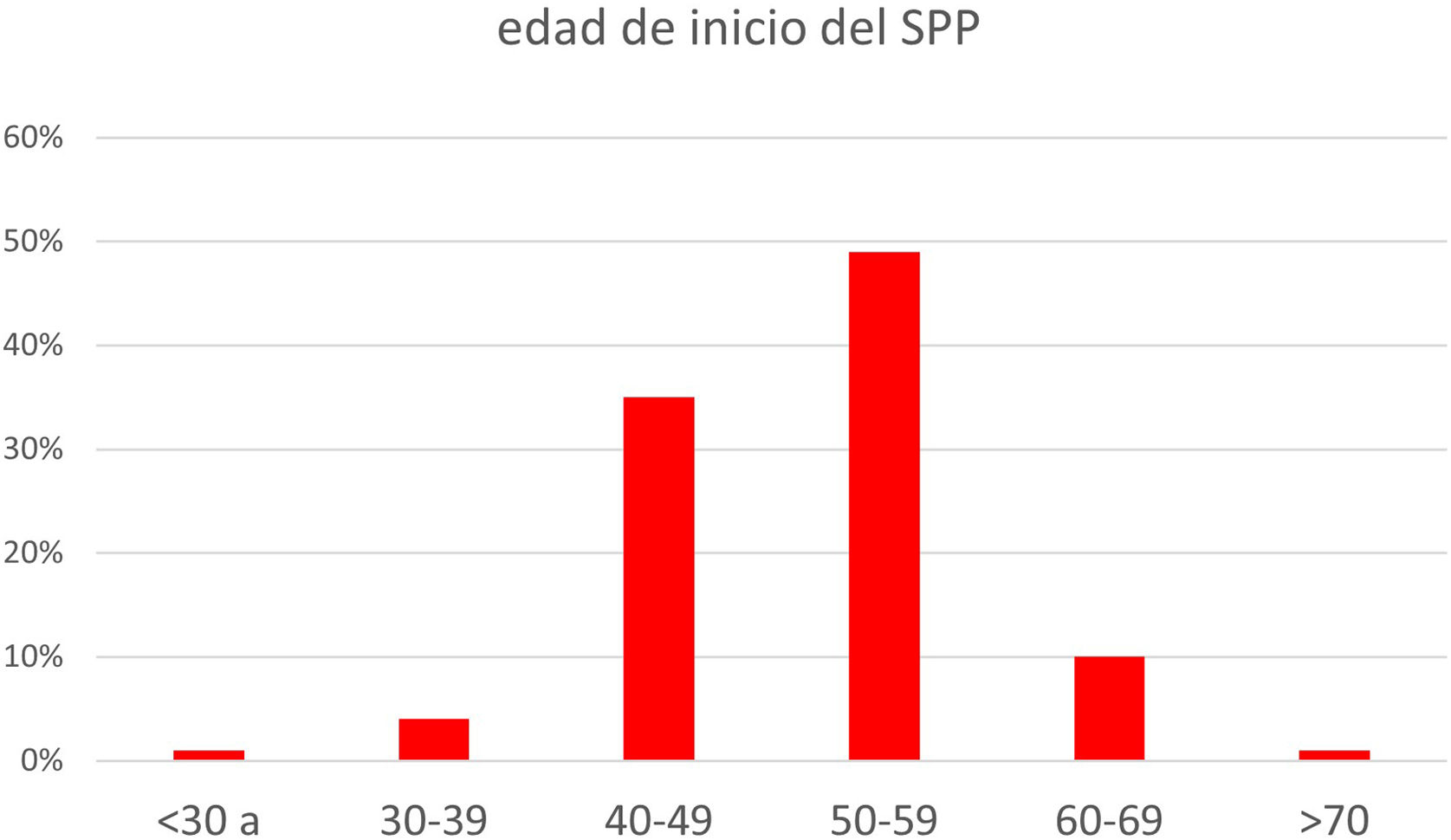
La edad de inicio del SPP fue con mayor frecuencia entre los 50 a 59 años (49%), seguido por la edad de 40 a 49 años (35%) (fig. 5). El tiempo desde la poliomielitis aguda hasta el diagnóstico de SPP variaba entre 35 y 70 años, mediana de 52,5 años y edad media de 50 años. La mayoría manifestó estos síntomas entre el año 2000 y 2020. El síntoma inicial fue debilidad en el 89% (n=342), le siguieron la fatiga con un 8% y el dolor en un 3% (fig. 6).
Al analizar el diagnóstico de SPP según sexo se pudo establecer que este es significativamente más frecuente en las mujeres (60,04%) (p=0,000). Se observó una asociación significativa en el análisis univariado de los factores de riesgo para SPP con el género femenino (OR 1,82 [1,09-3,06]; p=0,022). También se encontró una asociación estadísticamente significativa entre la severidad de la polio aguda y el desarrollo de SPP (OR 2,46 [1,44-4,20]; p=0,001), no así con la severidad de las secuelas (p=0,23). En el análisis de regresión logística múltiple, se confirmaron estos factores y se añadió la edad temprana de inicio de la poliomielitis como un factor de riesgo independiente para el desarrollo de PPS (OR 1,75 [1,0-2,94]; p=0,033). Ninguna de las demás variables mostró significación estadística.
Se detectó clínica de SPP en el 80% de los participantes a los que se les había realizado un electromiograma (EMG) por motivos diferentes al SPP. Por otro lado, el 100% de los pacientes diagnosticados con SPP a través de un EMG mostraron clínica compatible.
En cuanto al tratamiento de esta patología, solo el 29% realiza alguno, tal como kinesioterapia-rehabilitación. El 71% de los pacientes con SPP no realiza tratamiento ni rehabilitación.
DiscusiónSe estima que, en todo el mundo, alrededor de 15 millones de personas afectadas por la infección de polio que se produjo entre 1940 y 1950 sobreviven en la actualidad. Para 2004 se estimaron 250.000 pacientes con SPP en Europa y 20 millones en todo el mundo. La prevalencia del SPP reportada va desde el 15 al 80%, dependiendo de los criterios aplicados y la población estudiada, por ejemplo, Edimburgo reportó más del 60%, en Estonia se ha informado del 52%, Noruega 60% y Dinamarca 63%. Nuestros resultados muestran una prevalencia en Argentina del 62%, según los criterios diagnósticos recomendados por el grupo de trabajo EFNS sobre el diagnóstico y manejo del SPP35.
Un 90% de los pacientes fue afectado por la poliomielitis aguda en los primeros 3 años de vida, estos sobrevivientes hoy tienen un promedio de 65 años. La mayoría tiene como secuela afectación de miembros inferiores, con predominio del lado derecho y disfunción ambulatoria, con un alto riesgo de caídas. Más de la mitad de los pacientes tiene actualmente SPP. El síntoma más frecuente de inicio fue nueva debilidad, en segundo lugar, fatiga. En un 52% de la muestra esto motivó dejar de realizar determinados movimientos o abandonar su trabajo. Aquellos que presentan de trastornos respiratorios previos ven limitada aún más la capacidad para realizar tareas diarias, especialmente las relacionadas con pararse y subir escaleras lo que aumenta el riesgo de caídas, relatadas frecuentemente en las encuestas. El 76% presenta trastornos del sueño, con predominio de sueño poco reparador e insomnio.
Los factores de riesgo significativos para el SPP reportados incluyen el género femenino, la edad temprana de aparición de poliomielitis, el uso de ortesis o ayudas para caminar y una mayor debilidad durante la poliomielitis aguda15,27,28,35,39. Otros estudios mencionan además el estrés y el aumento reciente de peso como otros factores predisponentes40,41.
Se discute aún por qué los pacientes con SPP desarrollan una nueva, progresiva afectación de las motoneuronas inferiores. Una consideración potencial es que las respuestas compensatorias que conducen a la recuperación de la poliomielitis o a la estabilización de los síntomas se descompensan con el tiempo, especialmente con el envejecimiento. Una teoría popular conocida como «fatiga neural» sugiere que las infecciones agudas por el poliovirus atacan y matan células específicas de las astas anteriores de la médula espinal y los núcleos motores del tronco cerebral. La recuperación funcional se logra mediante el brote neurítico de las neuronas motoras sobrevivientes con la consiguiente reinervación del músculo esquelético denervado. El grado de eficacia de la reinervación puede dictar los niveles resultantes de fuerza. Sin embargo, el brote de reinervación conlleva el agrandamiento de las unidades motoras, lo que añade estrés metabólico a las neuronas motoras sobrevivientes. El estrés metabólico crónicamente aumentado podría eventualmente desencadenar una segunda ola de neurodegeneración y discapacidad, correspondiente a la aparición del SPP. Además, es importante tener en cuenta que, dentro del intervalo de 15 a 30 años entre la poliomielitis aguda y la pérdida de neuronas motoras asociada al SPP, los pacientes envejecen. El envejecimiento en sí mismo genera estrés oxidativo y metabólico a través de alteraciones en la señalización de insulina y disfunción mitocondrial. Por lo tanto, el estrés neuronal intrínseco relacionado con la expansión inducida por la recuperación de la unidad motora junto con el envejecimiento podría explicar el desarrollo del SPP en sobrevivientes a largo plazo de la poliomielitis. De manera similar, quizás el aumento del estrés oxidativo inducido por el ejercicio explique el empeoramiento de los síntomas del SPP con la actividad física. De hecho, uno de los objetivos con la primera rehabilitación era lograr que los pacientes caminaran a toda costa; quizás esto podría haber contribuido al desarrollo de SPP por el uso excesivo de los músculos, y la consiguiente degeneración acelerada de unidades motoras1.
Los estudios electrodiagnósticos desempeñan un papel importante en el proceso de diagnóstico de SPP, son importantes para excluir otras enfermedades neuromusculares como la esclerosis lateral amiotrófica, radiculopatías, polineuropatías, miastenia gravis, neuropatías y miopatías. Sin embargo, la mayoría de los pacientes no cuenta con un electromiograma. La electromiografía es una herramienta invaluable para evaluar los casos sospechosos de SPP, ya que permite confirmar antecedentes de poliomielitis y excluir diagnósticos diferenciales. La denervación en curso puede detectarse en la EMG convencional mediante la presencia de potenciales de fibrilación y fasciculación en músculos recientemente debilitados. La EMG con aguja también puede detectar fácilmente los músculos afectados de forma subclínica en el SPP. Las medidas de EMG se correlacionan bien con la fuerza y resistencia muscular18,36,37,42,43. De todas maneras, aunque la EMG proporciona información importante, el SPP es un diagnóstico clínico respaldado por pruebas electrodiagnósticas, que además descarten otras entidades.
También es importante excluir enfermedades ortopédicas y neurológicas similares al SPP como la espondilosis cervical, tumores de la columna cervical y torácica; así como, enfermedades cardíacas, hematológicas, endocrinas, cáncer, infecciones sistémicas crónicas, entre otras35,37,44,45. El diagnóstico del SPP en personas que experimentan fatiga crónica residual y debilidad muscular puede ser complicado debido a que los signos y síntomas se superponen con el síndrome de fatiga crónica46.
En cuanto al tratamiento del SPP, el principal objetivo es mejorar la calidad de vida a través de rehabilitación e intervención del grupo ortopédico. Es probablemente incorrecta la percepción de que aumentar la actividad física puede mejorar la recuperación y la fuerza después de la poliomielitis, ya que en realidad puede empeorar los síntomas del SPP y la gravedad de la discapacidad14,37,39.
Un enfoque individualizado para el manejo de la rehabilitación es fundamental. Las intervenciones pueden incluir estrategias de manejo de rehabilitación, equipo de adaptación, equipo ortopédico, ayudas para la marcha/movilidad y una variedad de ejercicios terapéuticos. La progresión de la debilidad muscular en el SPP suele ser lenta y gradual28,35,47,48.
El entrenamiento muscular supervisado, tanto isocinético (relativo a un movimiento muscular de velocidad constante, independientemente de la fuerza aplicada por el sujeto) como isométrico (que somete a los músculos a un movimiento contra una resistencia elevada a lo largo de un recorrido corto) es una forma segura y eficaz de prevenir una mayor disminución de la fuerza muscular en grupos de músculos leve o moderadamente débiles e incluso puede reducir los síntomas de fatiga y debilidad muscular. Se deben tomar precauciones para evitar el uso excesivo de los músculos39. Es importante destacar que la mayoría de los estudios de ejercicios han sido ejecutados con supervisión, carga de trabajo submáxima, pausas intermitentes y períodos de descanso entre sesiones de ejercicios para prevenir la probabilidad de efectos de uso excesivo, un aspecto importante para los pacientes con SPP. Así como se deben tomar precauciones para evitar el uso excesivo de los músculos, también se debe recomendar tener el peso adecuado a la edad y estatura39.
Se han realizado una serie de ensayos farmacológicos incluyendo esteroides, piridostigmina, inmunoglobulinas, amantadina y modafinilo, sin resultados37. El manejo sintomático de los síntomas no motores en el SPP también tiene beneficios significativos en la calidad de vida. El uso de analgésicos y antidepresivos como la amitriptilina, la duloxetina y la codeína puede disminuir el malestar físico y mejorar el estado de ánimo, pero se debe realizar un seguimiento cuidadoso, ya que pueden empeorar la fatiga y provocar dificultades de concentración. Las reacciones adversas a ciertos agentes anestésicos están bien documentadas en el SPP. La fatiga, la somnolencia y la debilidad después de la anestesia son bien reconocidas, y también se han informado resultados fatales debido a paro respiratorio49,50. El diagnóstico de SPP debe discutirse cuidadosamente con los anestesiólogos para que se puedan utilizar los relajantes musculares y anestésicos adecuados, y se debe informar a los pacientes sobre la posibilidad de una fase postoperatoria prolongada.
ConclusiónEl SPP continúa siendo un desafío mundial y se espera que su incidencia aumente a medida que los 15 millones de personas que sobrevivieron a la polio envejezcan. A pesar de ser una de las condiciones neurodegenerativas más devastadoras, sorprendentemente se realiza una investigación limitada sobre ella. Su patogénesis sigue siendo desconocida, no se han desarrollado herramientas de diagnóstico sensibles y faltan marcadores validados de pronóstico y monitoreo. Se necesitan estrategias exitosas de manejo individualizado para mantener la movilidad, la independencia y la autonomía del paciente. Por último, reconocer el SPP ayudará a planear políticas públicas dirigidas a un diagnóstico y tratamiento adecuados.
FinanciaciónLos autores no declaran financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.