Los antineoplásicos e inmunomoduladores son indicados para el tratamiento de cánceres y enfermedades inmunológicas, y presentan numerosas reacciones adversas medicamentosas (RAM). Muchos son probados en condiciones favorables, con algún grado de desconocimiento sobre las RAM al introducirlos en el mercado.
ObjetivosDescribir las RAM y su morbimortalidad, y analizar el sistema de farmacovigilancia argentino.
Materiales y métodosEstudio descriptivo sobre una base de datos de farmacovigilancia de Neurología. Se seleccionaron pacientes que recibieron antineoplásicos y/o inmunomoduladores y se utilizó el algoritmo de Naranjo para definir causalidad.
ResultadosSe incluyeron 15 RAM, producidas por 9 antineoplásicos y por 6 inmunomoduladores, siendo 5 biológicos. Del total, el 66,67% (n=10) fueron indicados para uso sistémico y el 33,33% (n=5) para uso neurológico. El 40% (n=6) correspondía a indicación «off-label». De las RAM, el 73,33% (n=11) fueron a nivel del sistema nervioso y el 26,67% (n=4) a nivel sistémico. Se reportaron 3 casos de PRES, 3 de encefalopatía, 3 de neuropatía, 4 de leucopenia, uno de cerebritis y uno de ACV isquémico. En el 73,33% (n=11), la RAM desapareció tras la suspensión del fármaco, en 3 no se pudo determinar y en uno no desapareció. El 93,33% (n=14) correspondieron a RAM serias.
ConclusionesEstos fármacos presentan numerosas RAM potencialmente serias, muchas de las cuales no se mencionan en los prospectos, a pesar de estar descriptas a lo largo de la literatura. Muchas veces el diagnóstico y eventual tratamiento se retrasan por no sospechar que la causa sea medicamentosa. Creemos que se debe reestructurar e incentivar el reporte de RAM y la farmacovigilancia.
Antineoplastic and immunomodulating drugs are indicated for the treatment of cancers and immunological diseases, and present numerous adverse drug reactions (ADR). Most are tested under favorable conditions; consequently, there could be a limitation in the knowledge of ADR at the time of their approval.
ObjectivesTo describe ADR and highlight the related morbimortality, and to analyze the Argentinean post-marketing drug surveillance system.
Materials and methodsA descriptive study was conducted based on a post-marketing drug surveillance database of the Department of Neurology. Patients who received antineoplastics and/or immunomodulators were selected, and the Naranjo algorithm was used to define causality.
ResultsWe included 15 ADR, produced by 9 antineoplastics and 6 immunomodulators, 5 being biological agents. Of all drugs, 66.67% (n=10) were indicated for systemic use and 33.33% (n=5) for neurological use. Off-label prescribing was 40% (n=6). Of the ADR, 73.33% (n=11) occurred in the nervous system and 26.67% (n=4) were systemic. We reported 3 cases of PRES, 3 of encephalopathy, 3 of neuropathy, 4 of leukopenia (1 with neutropenia), 1 of cerebritis and 1 of ischemic stroke. In 73.33% (n=11) of the cases, the ADR resolved after withdrawal, in 3 cases it could not be determined and in 1 case it did not resolve. Serious ADR accounted for 93.33% (n=14).
ConclusionsThese drugs have many serious ADR; many of which are not mentioned in the package insert, although they are described throughout the literature. Diagnosis and eventual treatment is delayed because the cause is not suspected as drug-related. We believe that ADR reporting and post-marketing drug surveillance should be restructured and encouraged.
Los fármacos antineoplásicos e inmunomoduladores son indicados para el tratamiento de varios tipos de cánceres y enfermedades inmunológicas1. Se llama «antineoplásico» a cualquier fármaco utilizado para el tratamiento de enfermedades malignas. Hay varias clases de estos fármacos, incluyendo antimetabolitos, agentes alquilantes, anticuerpos monoclonales, productos naturales y hormonas2,3. Los inmunomoduladores se utilizan para disminuir la respuesta inmune en enfermedades autoinmunes y trasplante de órganos. Las principales familias de estos fármacos incluyen los glucocorticoides, los inhibidores de calcineurina, los fármacos antiproliferativos/antimetabolitos y los biológicos3. Los biológicos son fármacos producidos a partir de un organismo vivo o sus productos, utilizados en la prevención, diagnóstico y tratamiento de cánceres y otras patologías4. A diferencia de los antineoplásicos e inmunomoduladores, que son fármacos de molécula pequeña, tienen características específicas que pueden influir en su perfil de seguridad. Por ejemplo, presentan un proceso de producción compleja, predictibilidad limitada de ensayos preclínicos, un alto potencial de inmunogenicidad, y reacciones adversas medicamentosas (RAM) que muchas veces pueden atribuirse a un mecanismo de acción excesivo. Las limitaciones de los ensayos aleatorizados y controlados resultan en un conocimiento acotado del perfil de seguridad de los productos biológicos5. Con base en esto, las actividades de farmacovigilancia requeridas para estos fármacos podrían diferir de las que se utilizan para los de moléculas pequeñas.
Los inmunomoduladores y antineoplásicos presentan numerosas RAM, siendo algunas de ellas potencialmente serias. La mayoría de estos fármacos son probados en condiciones favorables, es decir, que se prueban en pocos ensayos clínicos de corta duración, los cuales frecuentemente incluyen una menor cantidad de pacientes en comparación con los ensayos de fármacos convencionales1. Debido a esto, podría haber una limitación en el conocimiento de las RAM a la hora de introducir estos fármacos en el mercado, y la información acerca de potenciales problemas de seguridad a largo plazo podría ser desconocida.
Una RAM es definida, según la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT), como una reacción nociva y no deseada que se presenta tras la administración de un medicamento a dosis utilizadas habitualmente en la especie humana para prevenir, diagnosticar o tratar una enfermedad, o para modificar cualquier función biológica6. La farmacovigilancia es, según la Organización Mundial de la Salud (OMS), la ciencia y las actividades relacionadas con la detección, evaluación, comprensión y prevención de los efectos adversos de los medicamentos o cualquier otro problema relacionado con ellos7. La misma puede consistir en una variedad de actividades, incluyendo el reporte espontáneo de RAM (farmacovigilancia de rutina) y de estudios de seguridad postautorización (farmacovigilancia adicional)5. Actualmente, se estima que los efectos adversos farmacológicos corresponden a la cuarta a sexta causa de mortalidad8-10.
En Argentina, los reportes de RAM se hacen ante la ANMAT. Dichos reportes surgen en su mayoría de la industria farmacéutica y, en menor grado, de centros de farmacovigilancia establecidos en universidades, instituciones médicas, e incluso de los propios agentes de salud (médicos, farmacéuticos, etc.) o pacientes. En estudios europeos se demostró que los pacientes suministran información de RAM que no son reportadas incluso por los médicos, y que los reportes de los pacientes son un suplemento importante a los de los profesionales de la salud1.
El objetivo de este trabajo es describir las RAM, con impacto en el sistema nervioso, producidas por inmunomoduladores y antineoplásicos utilizados en un centro de alta complejidad; usando esta situación como ejemplo para destacar el impacto de la RAM en la morbimortalidad, así como también analizar las fortalezas y debilidades del sistema de farmacovigilancia de nuestro país.
Materiales y métodosSe realizó un estudio descriptivo sobre una base de datos de farmacovigilancia del Departamento de Neurología de nuestro centro (n=77), seleccionándose las que correspondieron a RAM por antineoplásicos e inmunomoduladores (n=15). Se tomaron las consultas efectuadas desde el 1 de julio de 2015 hasta el 27 de julio de 2018. Se seleccionaron aquellas que cumplían los siguientes criterios de inclusión:
- •
Producto inmunomodulador (incluyendo biológicos), utilizado para el tratamiento de una enfermedad neurológica, con RAM en cualquier sistema.
- •
Producto antineoplásico o inmunomodulador (incluyendo biológicos) prescripto para cualquier enfermedad, pero con RAM en el sistema nervioso.
Se excluyeron los pacientes con esclerosis múltiple debido a que estos pacientes se hallan bajo un sistema de farmacovigilancia activo a cargo de los laboratorios y del área de esclerosis múltiple
Las planillas utilizadas para completar la base de datos contenían los datos de filiación (edad, sexo, nacionalidad, escolaridad), historia farmacológica del paciente (medicación habitual, medicación previa, medicación indicada en la internación), datos de la internación (fecha de ingreso y egreso, motivo de internación, internación en sala general o unidad de cuidados críticos), RAM (tipo, puntaje de Naranjo, severidad, reexposición, notificación, comienzo y finalización de los síntomas, fecha de inicio y finalización, y posología de administración del fármaco), antecedentes y medicación habitual del paciente. Se adjunta el modelo de planilla en el apéndice 1 (material adicional).
Los medicamentos fueron clasificados según el Sistema de Clasificación Anatómica, Terapéutica, Química (ATC, según sus siglas en inglés) de la OMS11. Las RAM se clasificaron como «serias» si provocaron la muerte o amenaza de vida, requirieron o prolongaron la hospitalización, fueron mal utilizadas o causaron dependencia, o si dejaron una secuela permanente7; o «no serias».
Se realizó la búsqueda de los prospectos en el vademécum de la ANMAT12 de los fármacos analizados y se determinó si la RAM fue descripta previamente, incluyendo la frecuencia de presentación de la misma según los intervalos descriptos en los prospectos: muy frecuentes (≥1/10), frecuentes (≥1/100 a <1/10), poco frecuentes (≥1/1.000 a <1/100), rara (≥1/10.000 a <1/1.000), muy rara (<1/10.000), no conocida. Asimismo, se clasificaron los fármacos como de uso «off-label» si no presentaban indicación en el prospecto para la patología en que se utilizaron12. Para determinar la causalidad de las reacciones, se utilizó el puntaje de Naranjo13 y la clasificación de las categorías según el Centro de Monitoreo de Uppsala7. El puntaje de Naranjo se compone de 10 preguntas relacionadas con la exposición al fármaco en cuestión y la RAM presentada, con puntaje de −1 a +2 según cada pregunta, arribando a un puntaje total que clasificará la RAM como «definitiva» (>9 puntos), «probable» (5 a 8 puntos), «posible» (1 a 4 puntos), o «dudosa» (≤0 puntos). Mediante el mismo cuestionario, se descartaron causas alternativas de la RAM más allá del fármaco analizado. Se adjunta el cuestionario para calcular el puntaje de Naranjo en el apéndice 2 (material adicional).
Para analizar nuestro sistema de farmacovigilancia, incluyendo sus fortalezas y debilidades, se realizó una búsqueda bibliográfica en PubMed y Google Scholar a fin de encontrar problemas acerca de la farmacovigilancia a nivel nacional y mundial, incluyendo dificultades en el reporte de RAM de estos fármacos. Se incluyeron los términos «pharmacovigilance», «adverse drug reaction reporting», «post-authorization», «post-marketing», «underreporting» y «spontaneous reports».
Análisis estadísticoSe realizó análisis de frecuencias y estadística descriptiva para las variables citadas. Este estudio fue realizado de acuerdo con la normativa de las Buenas Prácticas Clínicas de la ICH, última revisión de 1964 de la Declaración de Helsinki. Debido al diseño del mismo, no se ha requerido la aprobación explícita de un comité ético de investigación científica, aunque se ha respetado escrupulosamente en todo momento la confidencialidad de los datos utilizados, de manera que se garantizase el anonimato de los pacientes. Para ello, los datos se han volcado de una vez en la base de datos, sin contener identificadores directos de su correspondencia con los pacientes.
ResultadosDel total de 15 pacientes incluidos, el 66,67% (n=10) fueron mujeres y el 33,33% (n=5) fueron hombres, presentando una edad media de 60,53 años (rango: 32-74 años).
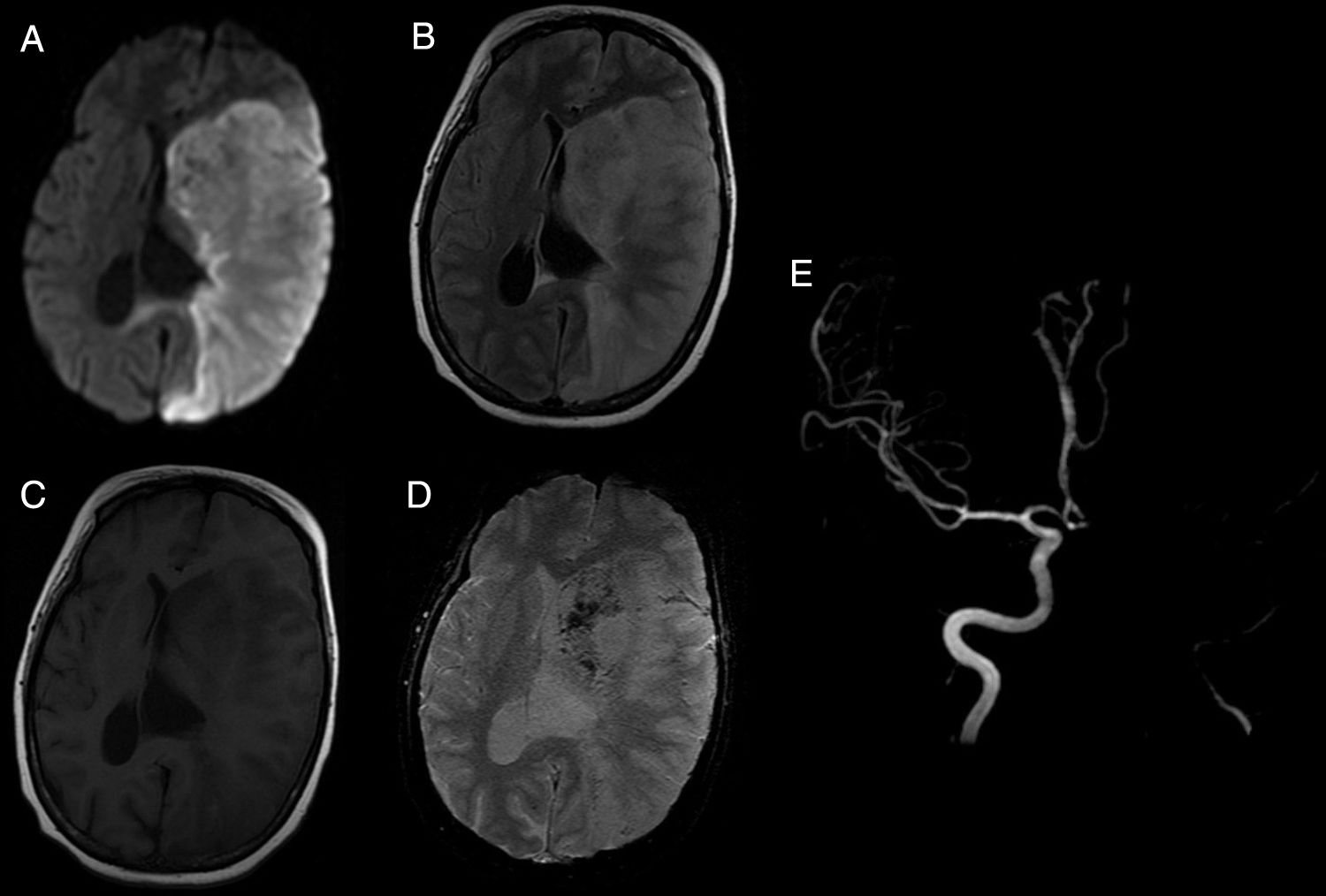
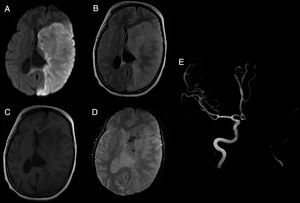
Al considerar el tipo de medicamento según la clasificación ATC, se incluyeron 9 fármacos antineoplásicos y 6 inmunomoduladores, de los cuales 5 fueron biológicos del grupo antiinfecciosos para uso sistémico. De estos fármacos, el 66,67% (n=10) fueron indicados para uso sistémico y el 33,33% (n=5) para uso neurológico. Con respecto a las RAM, el 73,33% (n=11) fueron a nivel del sistema nervioso y el 26,67% (n=4) fueron a nivel sistémico. Del total de RAM del sistema nervioso, el 73,73% (n=8) fueron en el sistema nervioso central (SNC) y el 27,27% (n=3) en el sistema nervioso periférico (SNP). Se reportaron 3 casos de síndrome de encefalopatía posterior reversible (PRES), 3 de encefalopatía, 3 de neuropatía, 4 de leucopenia (uno asociado a neutropenia), uno de cerebritis y uno de accidente cerebrovascular (ACV) isquémico. Con respecto a este último, se destaca que el mismo no estaba descripto en el prospecto del fármaco causal (venetoclax), por lo que se realizó una búsqueda bibliográfica hallándose un caso de ACV hemorrágico fatal reportado en el trabajo de investigación de fase II de desarrollo del mismo14 (fig. 1).
Accidente cerebrovascular isquémico secundario a venetoclax. (A-D) Lesiones isquémicas en territorio carotídeo izquierdo en secuencias DWI, FLAIR, T1 y GRE, respectivamente. (E) Angiorresonancia magnética intracraneal evidenciando ausencia de señal de flujo a nivel del origen de la arteria carótida interna izquierda.
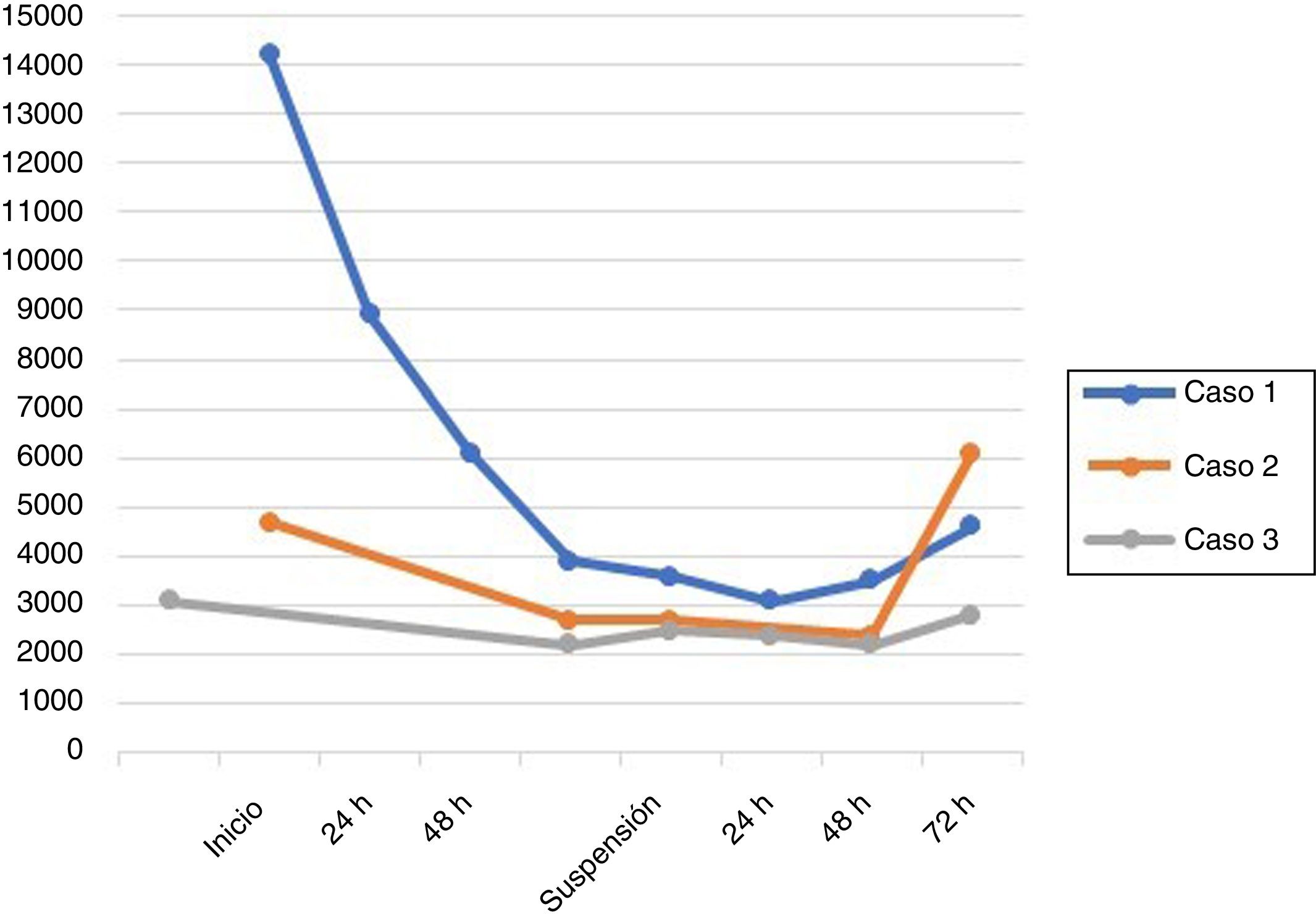
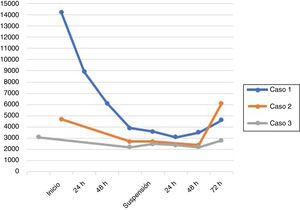
Para los casos de leucopenia producidos tras el uso de inmunoglobulina G humana endovenosa (IgEV), se realizó un trabajo de rastreo del fármaco, obteniéndose como resultado que todos los pacientes habían recibido IgEV del mismo lote, por lo que se notificó a la ANMAT y al laboratorio productor del fármaco. De estos 3 casos, 2 resolvieron la leucopenia a los 4 días de suspensión del fármaco. Un paciente de estos recibía micofenolato por trasplante renal, y otro paciente, azatioprina por miastenia gravis, sin embargo, tenían valores normales de glóbulos blancos previos al inicio del tratamiento y los mismos mejoraron inmediatamente luego de la suspensión de la IgEV (fig. 2). El restante caso de leucopenia, que presentó además neutropenia, fue producido por sunitinib a los 7 días de finalización del cuarto ciclo en un paciente con cáncer renal estadio IV con metástasis cerebrales, evaluado por epilepsia estructural. Este paciente evolucionó con neutropenia febril, por lo que requirió la administración de un factor estimulante de colonias de granulocitos (filgrastim) y antibioticoterapia. En el prospecto de este fármaco se describen casos fatales de infecciones asociadas a neutropenia.
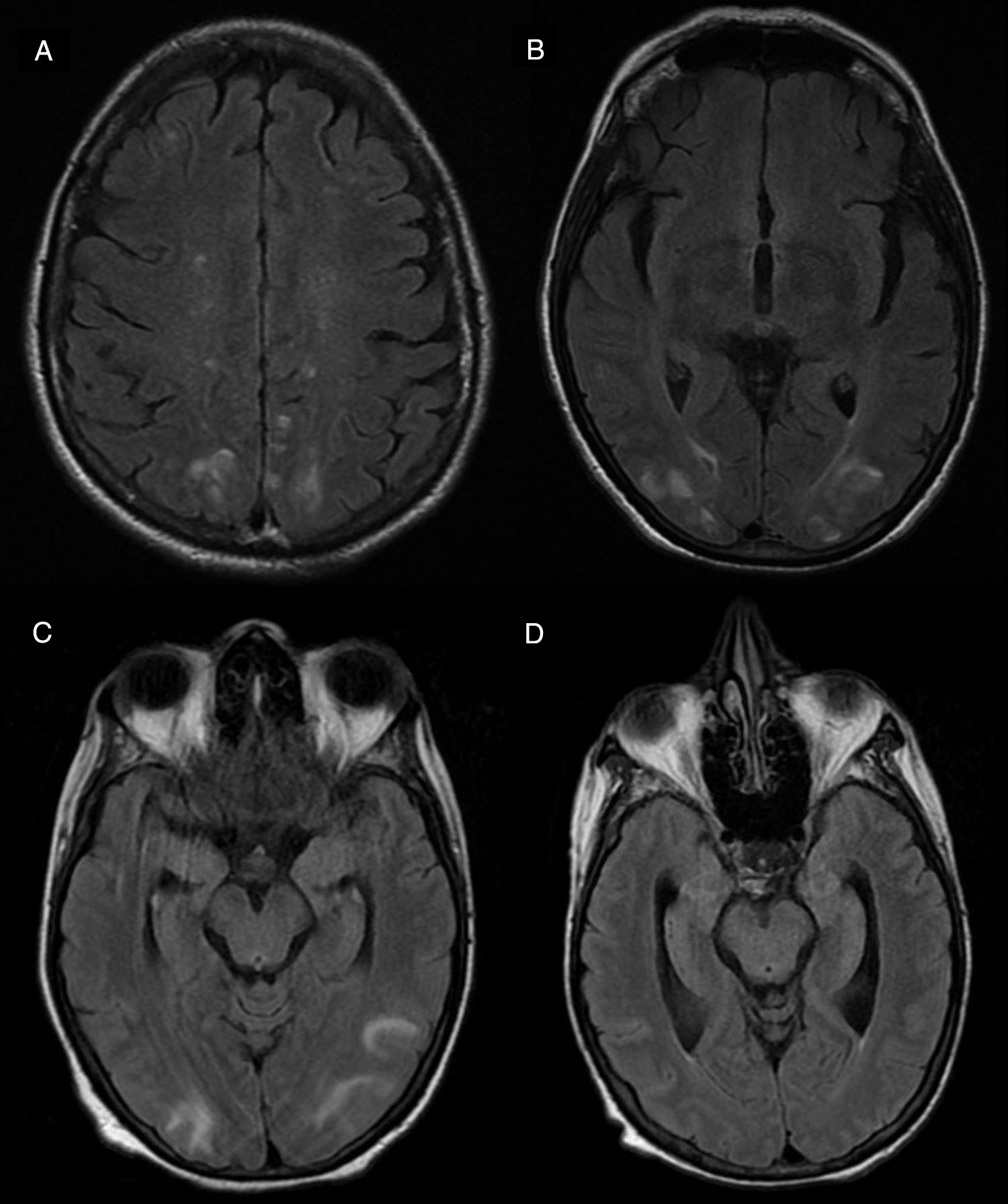
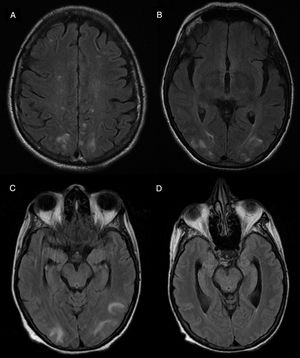
Uno de los efectos adversos más frecuentes en nuestra serie fue el PRES, el cual afectó al 20% (n=3) del total de los pacientes. Un caso fue producido por pazopanib, el cual se halla reportado en el prospecto, y los otros 2 casos fueron secundarios al uso de IgEV, los cuales no se hallaban mencionados en su prospecto. En todos los casos, el efecto adverso revirtió tras la suspensión de los fármacos (fig. 3).
PRES secundario a pazopanib (arriba) y a IgEV (abajo). (A y B) RM secuencia FLAIR que muestra múltiples imágenes hiperintensas bilaterales, relativamente simétricas. (C) RM en secuencia FLAIR que evidencia lesiones hiperintensas bilaterales a nivel occipitotemporales. (D) RM control al mes de suspensión de IgEV evidenciando resolución de lesiones previas.
IgEV: inmunoglobulina humana; PRES: síndrome de encefalopatía posterior reversible; RM: resonancia magnética.
De las RAM descriptas, en el 73,33% (n=11) de los casos la RAM desapareció tras la suspensión del fármaco, en 3 casos no se pudo determinar si la RAM desapareció y en un caso la RAM no desapareció. Al analizar la causalidad de las RAM mediante el algoritmo de Naranjo y la clasificación del Centro de Monitoreo de Uppsala, se evidenció que el 66,67% (n=10) correspondían a la categoría «posible» y el 33,33% (n=5) a la categoría «probable». El 93,33% (n=14) correspondieron a RAM serias, de acuerdo con la clasificación de la OMS previamente descripta en «Materiales y métodos». Es de mencionar que en nuestra muestra, ningún fármaco fue mal utilizado o causó dependencia.
Con respecto a la indicación del uso de estos fármacos, la mayoría (60%) fueron indicados como antineoplásicos y los restantes (40%) como inmunomoduladores. Al analizar si la indicación de los mismos correspondía a una indicación «off-label», se evidenció que el 40% (n=6) correspondía a este tipo de indicación, siendo el uso en la mayoría (n=5) como inmunomodulador (IgEV) y en un caso como antineoplásico (ifosfamida).
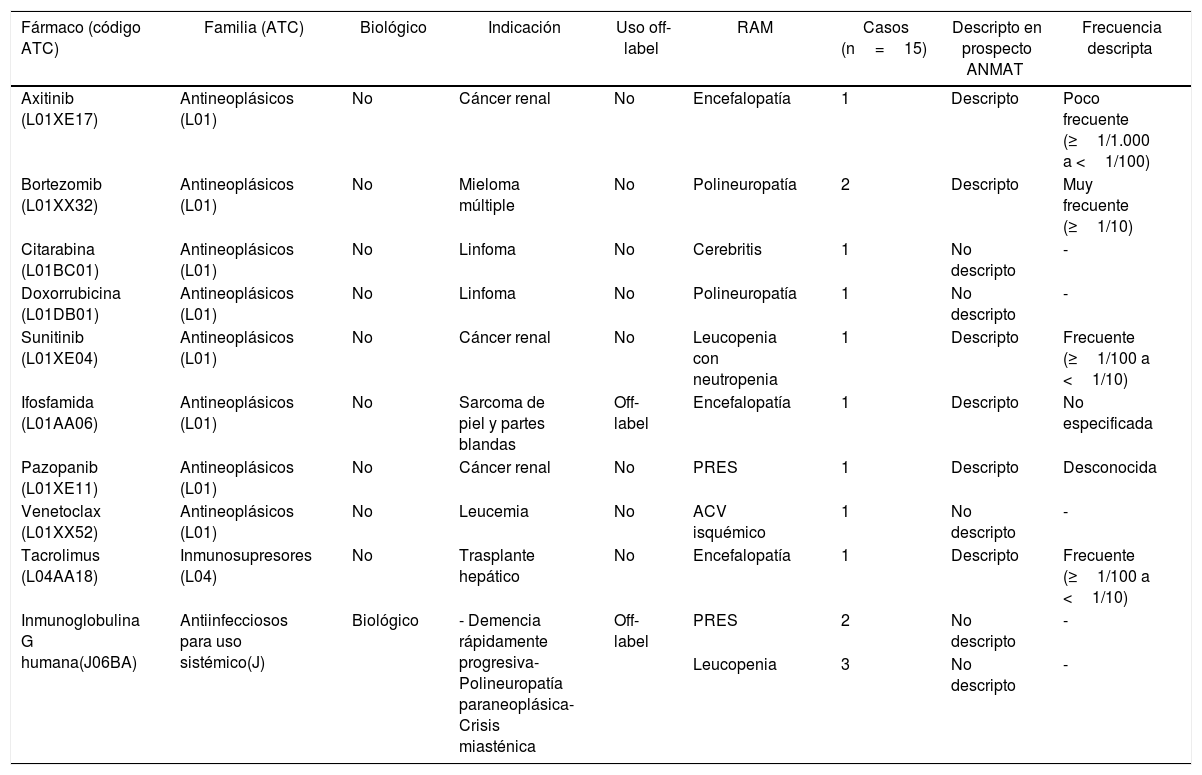
Al comparar las RAM presentadas en nuestros pacientes con las reportadas en los prospectos de la ANMAT de los fármacos aquí mencionados, el 60% (n=9) no estaban descriptas en el prospecto de la ANMAT y el 40% (n=5) sí lo estaban. Se adjuntan estos resultados en la tabla 1.
Efectos adversos de fármacos antineoplásicos e inmunomoduladores
| Fármaco (código ATC) | Familia (ATC) | Biológico | Indicación | Uso off-label | RAM | Casos (n=15) | Descripto en prospecto ANMAT | Frecuencia descripta |
|---|---|---|---|---|---|---|---|---|
| Axitinib (L01XE17) | Antineoplásicos (L01) | No | Cáncer renal | No | Encefalopatía | 1 | Descripto | Poco frecuente (≥1/1.000 a <1/100) |
| Bortezomib (L01XX32) | Antineoplásicos (L01) | No | Mieloma múltiple | No | Polineuropatía | 2 | Descripto | Muy frecuente (≥1/10) |
| Citarabina (L01BC01) | Antineoplásicos (L01) | No | Linfoma | No | Cerebritis | 1 | No descripto | - |
| Doxorrubicina (L01DB01) | Antineoplásicos (L01) | No | Linfoma | No | Polineuropatía | 1 | No descripto | - |
| Sunitinib (L01XE04) | Antineoplásicos (L01) | No | Cáncer renal | No | Leucopenia con neutropenia | 1 | Descripto | Frecuente (≥1/100 a <1/10) |
| Ifosfamida (L01AA06) | Antineoplásicos (L01) | No | Sarcoma de piel y partes blandas | Off-label | Encefalopatía | 1 | Descripto | No especificada |
| Pazopanib (L01XE11) | Antineoplásicos (L01) | No | Cáncer renal | No | PRES | 1 | Descripto | Desconocida |
| Venetoclax (L01XX52) | Antineoplásicos (L01) | No | Leucemia | No | ACV isquémico | 1 | No descripto | - |
| Tacrolimus (L04AA18) | Inmunosupresores (L04) | No | Trasplante hepático | No | Encefalopatía | 1 | Descripto | Frecuente (≥1/100 a <1/10) |
| Inmunoglobulina G humana(J06BA) | Antiinfecciosos para uso sistémico(J) | Biológico | - Demencia rápidamente progresiva- Polineuropatía paraneoplásica- Crisis miasténica | Off-label | PRES | 2 | No descripto | - |
| Leucopenia | 3 | No descripto | - |
ACV: accidente cerebrovascular; ANMAT: Administración Nacional de Medicamentos, Alimentos y Tecnología Médica; ATC: Sistema de Clasificación Anatómica, Terapéutica, Química; PRES: síndrome de encefalopatía posterior reversible; RAM: reacciones adversas medicamentosas.
Los fármacos inmunosupresores y antineoplásicos presentan numerosos efectos adversos, tanto a nivel del sistema nervioso como a nivel de otros sistemas. En el caso de los inmunosupresores, la incidencia de neurotoxicidad depende del órgano trasplantado y de si los efectos adversos menores son reportados. La prevalencia de la neurotoxicidad en general tiende a ser aproximada, ya que no se suele sospechar a menos que se solicite la consulta a un neurólogo para que la valore. Un gran número de pacientes experimentan temblor como RAM de este grupo de fármacos, llegando a presentarse también casos de síntomas psiquiátricos, incluyendo insomnio, desorientación y alucinaciones visuales. Se pueden producir también trastornos en la articulación del lenguaje, y en casos más graves síntomas extrapiramidales severos, ceguera cortical y crisis comiciales15. Con respecto a los antineoplásicos, la neurotoxicidad es una causa importante de toxicidad dosis-limitante16. Los efectos adversos reportados van desde cefalea hasta encefalopatía, hematomas intraparenquimatosos y deterioro cognitivo posquimioterapia. Además, presentan también numerosos efectos adversos a nivel de sistema nervioso periférico, incluyendo neuropatía, síntomas motores como caída de antepié, y disautonomía17.
Tras revisar los prospectos de los fármacos analizados en este trabajo, encontramos que el 60% de las RAM que presentaron nuestros pacientes no estaban descriptas en los mismos. Una de estas RAM son las neuropatías asociadas al uso de doxorrubicina, las cuales se hallan reportadas en numerosos trabajos18-22. Con respecto a la IgEV, a pesar de ser un medicamento con muchas indicaciones «off-label» para patologías neurológicas (a destacar entre nuestros casos: miastenia gravis y demencia rápidamente progresiva), nuestros pacientes presentaron dos efectos adversos que tampoco se describen en el prospecto, pero que sí están reportados en varios trabajos: PRES23-26 y leucopenia27-30. En este último caso, dado que se presentó en simultáneo en 3 pacientes que estaban recibiendo este fármaco por diferentes patologías, se realizó el rastreo del mismo, arribándose a un número de lote en común, por lo que se reportó al laboratorio productor y a la ANMAT.
Es de particular interés el caso del venetoclax, un fármaco recientemente aprobado como segunda línea para el tratamiento de la leucemia linfocítica aguda, cuyas RAM más frecuentemente reportadas son los trastornos del sistema sanguíneo, gastrointestinales e infecciones. En nuestro estudio, se describe un caso de ACV isquémico secundario al uso de este fármaco; una RAM no descripta en el prospecto del fármaco. Al realizar la búsqueda bibliográfica de esta RAM, si bien no pudimos encontrar casos de ACV isquémicos, encontramos un caso de ACV hemorrágico fatal reportado en el trabajo de fase II del desarrollo del fármaco14.
Los fármacos biológicos poseen además características especiales que pueden influir en su perfil de seguridad. Presentan un proceso de producción más complejo, una limitada predictibilidad a partir de ensayos preclínicos, un alto potencial de inmunogenicidad, y sus efectos adversos a menudo se pueden explicar por un mecanismo de acción exagerado. Si bien el completo conocimiento del perfil de seguridad de un fármaco se ve limitado a la hora de introducirlo al mercado debido a las limitaciones de los ensayos aleatorizados controlados (número de muestra limitado, población homogénea), en el caso de los biológicos esto es aún más complicado debido a la información acotada de ensayos en animales5.
La presencia de RAM no descriptas en los prospectos de estos medicamentos, incluidos también los antineoplásicos e inmunomoduladores, podría deberse a que muchos de estos fármacos son probados bajo condiciones médicas favorables, dentro de ensayos clínicos de pocos pacientes y poca duración1. Debido a esto, los efectos a largo plazo de muchos de estos fármacos se conocen poco.
A propósito de estos comentarios, es menester recordar el conocido caso de la talidomida y la teratogenia. La talidomida es un fármaco desarrollado durante la década de los 50 y que durante muchos años fue utilizado como antiemético para la emesis gravídica. Al poco tiempo se produjeron numerosos casos de malformaciones congénitas, por lo que fue retirado del mercado durante los años 60, para luego ser reintroducido para el tratamiento de enfermedades dermatológicas y neoplásicas31. Este fármaco marcó un antes y un después en lo que respecta a la farmacovigilancia a nivel mundial32.
Si bien la farmacovigilancia ha progresado notablemente desde aquel caso, un problema actual de la misma es el sub-reporte de las RAM. Se estima que solo el 6% de las RAM son reportadas, lo que conlleva un enlentecimiento para identificar las RAM no reportadas y para mantener un adecuado balance riesgo/beneficio del fármaco. Se cree que las razones de esto son múltiples, incluyendo desconocimiento, desinterés, falta de tiempo y falta de motivación33,34. Un estudio realizado por Callaghan et al. analizó el reporte de las RAM y la farmacovigilancia en el uso de biológicos en Irlanda, hallando que los farmacéuticos hospitalarios son quienes tienen mejor conocimiento y experiencia en el reporte de RAM con respecto al resto de los proveedores de los cuidados de la salud. Sin embargo, se demostró que los enfermeros son quienes tienen un contacto más estrecho con los pacientes en el momento de la presentación de las RAM, pero al mismo tiempo son quienes menos las advierten. De este modo, estos podrían ser la pieza clave para aumentar la prevalencia de los reportes35. En nuestro país, del mismo modo que en Norteamérica y Europa, los reportes los puede hacer cualquier integrante del sistema de salud, incluyendo los mismos pacientes, mediante diversos medios facilitados por la ANMAT. En estudios europeos se demostró que los pacientes suministran información de RAM que no son reportadas incluso por los médicos, y que los reportes de los pacientes son un suplemento importante a los de los profesionales de la salud34,35.
ConclusionesLos fármacos antineoplásicos e inmunomoduladores presentan numerosas RAM potencialmente serias, muchas de las cuales no se mencionan en los prospectos, si bien están descriptas a lo largo de la literatura. En muchos casos, el diagnóstico y eventual tratamiento se retrasan por no sospechar que la causa sea medicamentosa. De las RAM descriptas en nuestro trabajo, más del 90% fueron serias y más del 70% desaparecieron tras la suspensión del fármaco que las desencadenó.
El caso de la leucopenia por IgEV es un claro ejemplo de que el sistema de farmacovigilancia en nuestro país es defectuoso ya que al día de la fecha no obtuvimos respuesta ni se tomaron medidas por parte de la ANMAT, siendo esto particularmente preocupante en eventos de RAM serias. Al incrementar el reporte de las RAM, se podría llegar a tener eventualmente prospectos más completos y actualizados con respecto a la variabilidad de efectos adversos que presentan estos fármacos.
El presente trabajo es relevante para nuestro sistema de salud dado que creemos que se debe reestructurar, reformar e incentivar el reporte de las RAM y su aplicación en la farmacovigilancia, lo que permitiría aplicar políticas de salud para tener un mejor control de los medicamentos de alto costo.
FinanciaciónLos autores no recibieron subsidios ni otro tipo de financiación para la confección y publicación del presente trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.