Se ha indicado la existencia de factores farmacogenéticos que contribuyen al riesgo de desarrollar complicaciones motoras en pacientes con enfermedad de Parkinson (EP). La expresión de polimorfismos del gen del receptor de dopamina D2 (DRD2) se ha implicado en una mayor susceptibilidad a complicaciones derivadas del tratamiento con levodopa.
ObjetivoEl objetivo del presente trabajo es determinar la asociación entre los polimorfismos de DRD2 en pacientes con EP y el desarrollo de complicaciones motoras secundarias al tratamiento de reemplazo dopaminérgico.
Sujetos y métodosSe incluyó a un total de 236 pacientes con diagnóstico de EP. La presencia de discinesias o fluctuaciones motoras fue evaluada por un neurólogo especialista en movimientos anormales. Se obtuvo una muestra de sangre total para la genotipificación de los polimorfismos Taq1A y DRD2 -141C en cada paciente mediante enzimas restricción.
ResultadosEl 69,5% de los sujetos resultaron heterocigotos para el polimorfismo Taq1A (A1/A2). En lo que se refiere al polimorfismo –141C, el 63,4% presentó el genotipo Ins/Ins. La presencia del polimorfismo Del/Del en –141C se asoció significativamente al desarrollo de fluctuaciones motoras (p=0,04).
ConclusionesLa presencia del polimorfismo Del/Del en –141C parece estar asociada al desarrollo de fluctuaciones motoras secundarias al tratamiento con levodopa en sujetos con EP.
Pharmacogenetic factors may influence the development of motor complications in subjects with Parkinson's disease. Specifically, the expression of polymorphisms of the gene for the dopamine receptor D2 (DRD2) have been implicated in a greater susceptibility for complications secondary to levodopa treatment.
ObjectiveThe objective of this study is to determine an association between DRD2 and Taq1A polymorphisms and the presence of motor complications due to levodopa treatment.
Subjects and methodsWe included 236 subjects with Parkinson's disease. The presence of motor complications was assessed by a movement disorders specialist. The genotypification of the Taq1A and DRD2 -141C polymorphisms was done using restriction enzymes.
ResultsSixty-nine percent of subjects were heterozygote (A1/A2) for the Taq1A polymorphism. In regards to the -141C polymorphism, 63.4% presented the Ins/Ins genotype. The -141C polymorphism Del/Del was significantly associated with motor fluctuations (P=0.04).
ConclusionsThe presence of -141C Del/Del appears to be associated with the development of motor fluctuations secondary to levodopa treatment in subjects with PD.
La enfermedad de Parkinson (EP) es la segunda patología neurodegenerativa en frecuencia, superada únicamente por la enfermedad de Alzheimer1.
A la fecha, la utilización de precursores de dopamina (levodopa) es considerada la forma de tratamiento más efectiva, con una respuesta inicial aceptable en aproximadamente el 80% de los pacientes de forma. La respuesta a levodopa disminuye gradualmente en los siguientes 2 a 5 años, y hasta un 50% de los pacientes presentarán complicaciones secundarias al tratamiento2.
Estas complicaciones incluyen discinesias, síntomas psicóticos y fluctuaciones motoras3. Las fluctuaciones motoras implican una pérdida no anticipada del efecto de una dosis de levodopa, con oscilaciones en la función motora, mientras que las discinesias son un fenómeno motor, que consiste en la ejecución involuntaria de un movimiento en respuesta a la administración crónica de levodopa. La incidencia acumulada de discinesias en pacientes con EP en tratamiento con levodopa se ha reportado en aproximadamente un 40% a los 4 a 6 años4, mientras que la incidencia acumulada de fluctuaciones motoras es del 33,9% a 7 años5. Entre los factores de riesgo identificados para el desarrollo de estas complicaciones, se incluye una menor edad al inicio de los síntomas motores, al momento del diagnóstico de EP y al momento de iniciar terapia con levodopa. El predominio de síntomas rígidos-bradicinéticos al inicio de la enfermedad y una mayor dosis diaria de levodopa y de equivalentes de levodopa son otros factores de riesgo6,7.
Asimismo, se ha indicado la existencia de factores farmacogenéticos que contribuyen al riesgo de desarrollar complicaciones motoras en pacientes con EP. La proteína derivada del gen del receptor de dopamina D2 (DRD2, cromosoma 11q22-q23) es uno de los principales sitios de acción de la dopamina en el circuito nigroestriatal8. La expresión de polimorfismos de este gen se ha implicado en una mayor susceptibilidad a complicaciones derivadas del tratamiento con levodopa. Las variantes implicadas en la expresión de DRD2 incluyen Val96Ala, Pro310Ser, Ser311Cys y la inserción/deleción (INS/DEL) de cisteína en la posición –141 (DRD2 –141C) de la región promotora3. Otros genes estudiados incluyen DAT y CCK3,9. El gen ANKK1 se encuentra adyacente a DRD2. La proteína ANKK1 altera la expresión de los genes regulados por NF-κB, por lo que interactúa, de manera indirecta, con DRD2. Recientemente, se reconoció que el polimorfismo Taq1A (rs1800497), anteriormente considerado un polimorfismo de DRD210,11, en realidad corresponde a un polimorfismo presente en el exón 8 de ANKK112. Este polimorfismo ocasiona una transversión de glutamina a lisina en el residuo 713 de la proteína ANKK1 (E713K) creando 2 alelos, A1 y A2. La expresión del alelo A1, ya sea en forma heterocigota u homocigota se ha asociado a una menor densidad de receptores D2 en el estriado13,14. Este alelo se encuentra en desequilibrio de ligamiento con otros polimorfismos de DRD2, formando haplotipos; es decir, los distintos genotipos entre ambos genes no son heredados de manera independiente uno del otro. Uno de estos polimorfismos es DRD2 –141C15,16.
El objetivo del presente trabajo es determinar la asociación entre los polimorfismos de DRD2 en pacientes con EP y el desarrollo de complicaciones motoras secundarias al tratamiento de reemplazo dopaminérgico.
Sujetos y métodosSe incluyó a un total de 236 pacientes con diagnóstico de EP de acuerdo con los criterios del Banco de Cerebros de Reino Unido17, atendidos en la Clínica de Movimientos Anormales del Instituto Nacional de Neurología y Neurocirugía en México.
La presencia de complicaciones motoras, específicamente discinesias o fluctuaciones motoras, fue evaluada por un neurólogo especialista en movimientos anormales. En el caso de las discinesias, se incluyeron aquellas que coinciden con el mayor grado de mejoría clínica (pico dosis), aquellas que se extienden durante todo el periodo de beneficio motor (onda cuadrada) y los movimientos involuntarios que aparecen antes y después del efecto terapéutico de la levodopa (difásica). Las fluctuaciones motoras se categorizaron en acortamiento de la duración del efecto de la levodopa (deterioro de fin de dosis), pérdida súbita e impredecible del efecto con recurrencia de los síntomas de la enfermedad de Parkinson (on-off impredecible), demora del inicio del efecto tras la administración de la levodopa (retraso del on) y el empeoramiento transitorio al inicio del on (empeoramiento de inicio de dosis).
Se registró la información concerniente a la edad, el género del paciente, el antecedente familiar de EP, la edad en el momento del diagnóstico de EP, el síntoma predominante al inicio de la EP (rigidez, temblor o inestabilidad postural) y el lado predominantemente afectado (derecho o izquierdo). La gravedad de la enfermedad se clasificó acorde al estadio de Hoehn y Yahr (HY) en el momento de la evaluación18. Se registró la puntuación motora en la Escala Unificada de la Enfermedad de Parkinson de la Sociedad de Trastornos del Movimiento (MDS-UPDRS)19. Otras variables incluyeron la dosis diaria en miligramos de medicamento, la dosis equivalente de levodopa y el tiempo de utilización de levodopa.
Se obtuvo una muestra de sangre total para la genotipificación de los polimorfismos Taq1A y DRD2 –141C en cada paciente mediante enzimas restricción (RFLP)12,20,21.
Todos los participantes otorgaron su consentimiento informado. El estudio fue aprobado por el comité local de investigación y por el comité local de ética.
Análisis estadísticoSe realizó estadística descriptiva en términos de medias ± desviación estándar y porcentajes. Se utilizó la prueba de la chi al cuadrado con corrección de continuidad de Yates o la prueba exacta de Fisher (en caso de que la frecuencia esperada fuera menor de 5 en cualquier celda) para determinar la relación entre la presencia o ausencia de las complicaciones estudiadas con el genotipo de DRD2/ANKK1. Mediante un análisis bivariado, se identificaron las variables asociadas significativamente con el desarrollo de complicaciones motoras. Las variables significativas se incluyeron en un modelo de regresión logística, para determinar el impacto de las mismas en el desarrollo de complicaciones motoras. Se consideró significante estadísticamente una p < 0,05. Se utilizó el programa estadístico STATA 12 (StatCorp).
ResultadosSe incluyó a un total de 236 sujetos con diagnóstico de EP (52,5% hombres). La edad media fue de 61 ± 13,3 años. La duración media de la enfermedad fue de 6,6 ± 5,6 años, con una mediana en la escala de HY de 2 y una puntuación total media en la MDS-UPDRS de 31,8 ± 14,7. El 51,3% presentó temblor como el síntoma inicial y en el 60% de los sujetos los síntomas iniciaron en el hemicuerpo derecho. El 16,4% contaba con un antecedente familiar de EP.
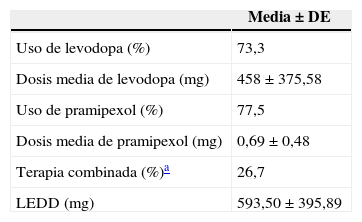
El 46,6% de los pacientes recibía levodopa en monoterapia, el 16,8% recibía únicamente pramipexol y el 26,7% recibía ambos medicamentos. La dosis media y frecuencia de los medicamentos antiparkinsonianos se muestran en la tabla 1.
Características del manejo terapéutico de la muestra de pacientes con enfermedad de Parkinson
| Media ± DE | |
|---|---|
| Uso de levodopa (%) | 73,3 |
| Dosis media de levodopa (mg) | 458 ± 375,58 |
| Uso de pramipexol (%) | 77,5 |
| Dosis media de pramipexol (mg) | 0,69 ± 0,48 |
| Terapia combinada (%)a | 26,7 |
| LEDD (mg) | 593,50 ± 395,89 |
DE: desviación estándar; LEDD: dosis diaria de equivalentes de levodopa.
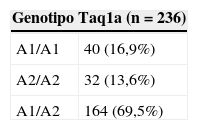
La frecuencia de los distintos genotipos de DRD2 se muestra en la tabla 2. En cuanto al polimorfismo Taq1A, la mayoría de los pacientes (69,5%) resultaron heterocigotos (A1/A2). En cuanto al polimorfismo –141C, debido a una muestra insuficiente, solo fue posible obtener el genotipo para 235 sujetos. La mayoría de los pacientes (63,4%) presentó el genotipo Ins/Ins.
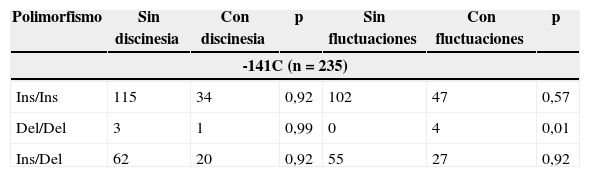
Fluctuaciones motorasUn 33,1% (n=78) de los sujetos presentaban fluctuaciones motoras. El fenómeno de deterioro de fin de dosis fue la fluctuación motora más frecuente (76,9%). Entre los factores involucrados con el desarrollo de fluctuaciones, se identificó el uso de levodopa (p < 0,001), el uso de terapia combinada (p < 0,001) y la dosis diaria equivalente de levodopa (p < 0,001). No se demostró una relación con la puntuación de la MDS-UPDRS. La asociación entre las fluctuaciones motoras y el genotipo se muestra en la tabla 3.
Relación entre el genotipo y el desarrollo de complicaciones motoras en pacientes con enfermedad de Parkinson
| Polimorfismo | Sin discinesia | Con discinesia | p | Sin fluctuaciones | Con fluctuaciones | p |
|---|---|---|---|---|---|---|
| -141C (n=235) | ||||||
| Ins/Ins | 115 | 34 | 0,92 | 102 | 47 | 0,57 |
| Del/Del | 3 | 1 | 0,99 | 0 | 4 | 0,01 |
| Ins/Del | 62 | 20 | 0,92 | 55 | 27 | 0,92 |
| Taq1A (n=236) | ||||||
|---|---|---|---|---|---|---|
| A1/A1 | 35 | 5 | 0,10 | 28 | 12 | 0,74 |
| A2/A2 | 20 | 12 | 0,08 | 19 | 13 | 0,47 |
| A1/A2 | 125 | 39 | 0,89 | 110 | 54 | 0,91 |
Mediante un análisis de regresión multivariada, se estableció que el uso de levodopa (B=1,2, p < 0,001), la dosis diaria equivalente de levodopa (B=0,3, p=0,01) y la el polimorfismo Del/Del de –141C (B=–20,8, p=0,04) fueron los factores independientes asociados de manera significativa al desarrollo de fluctuaciones.
Discinesias inducidas por levodopaUn 27,9% (n=66) de los sujetos presentaban discinesias. El tipo de discinesia más frecuente fue la de pico de dosis (70,5%).
Mediante el análisis bivariado, se identificó una relación significativa con el uso de levodopa (p < 0,001), terapia combinada levodopa-pramipexol (p < 0,001) y la predominancia de síntomas motores en el hemicuerpo derecho (p=0,02). La presencia del alelo A1 presentó una tendencia hacia la significación estadística (p=0,05).
No se demostró una relación con la puntuación de la MDS-UPDRS. La asociación entre la presencia de discinesias y el genotipo se muestra en la tabla 3.
Análisis de regresión multivariadaMediante una regresión multivariada, se determinó que los factores asociados en el desarrollo de discinesias en la muestra fueron el inicio de los síntomas en hemicuerpo derecho (B=–0,8, p=0,01) y el uso de levodopa (B=1,1, p=0,03).
DiscusiónLas complicaciones motoras, en la forma de discinesias o fluctuaciones motoras, son resultado del tratamiento con terapia de remplazo dopaminérgico. Se ha descrito una frecuencia del 30% en individuos que reciben levodopa por un periodo de 5 años22. Lo anterior es consistente con la frecuencia de complicaciones motoras en relación con el tiempo de evolución encontrada en la muestra del presente estudio.
En términos generales, los factores de riesgo para el desarrollo de fluctuaciones motoras o discinesias incluyeron, como era de esperarse, el uso de levodopa, ya sea en monoterapia o politerapia, y la dosis de esta. En estudios previos se ha indicado que las discinesias se presentan inicialmente en el hemicuerpo que se encuentra afectado con mayor severidad, lo cual correlaciona con una pérdida dopaminérgica temprana en el estriado dorsolateral23. El inicio de los síntomas en el hemicuerpo derecho fue un factor significativo para el desarrollo de discinesias, incluso después de realizar un análisis multivariado. Esto podría deberse a la mayor proporción de sujetos con síntomas de inicio en hemicuerpo derecho en la muestra estudiada.
Grevle et al. describieron que los pacientes con EP que expresan el alelo A1 poseen una densidad de receptores DRD2 un 30% menor que aquellos que expresan el alelo A224. Así mismo, se ha demostrado que la expresión del alelo A1 se encuentra relacionada con un aumento en la actividad estriatal de la L-amino decarboxilasa. Esta última es la enzima que cataliza la reacción final en para la síntesis de dopamina. En cuanto a la expresión de polimorfismos de DRD2/ANKK1, se ha reportado una expresión del alelo A1 en el 21% de los sujetos con EP. No obstante, el genotipo más frecuente parece ser el A2/A224. La expresión del alelo A1 en la muestra analizada en el presente estudio fue más frecuente a lo reportado previamente en otras poblaciones. De la misma manera, el genotipo A1/A1 se identificó en un mayor número de pacientes. En contraparte, la frecuencia del genotipo heterocigoto (A1/A2) fue menor a lo esperado basado en otras series11,24.
Se ha reportado una ausencia de asociación entre el polimorfismo Taq1A y el desarrollo de fluctuaciones motoras3,20. En el presente estudio tampoco se demostró una relación entre la expresión del alelo A1 y el desarrollo de fluctuaciones motoras, lo cual es consistente con lo reportado por otros autores.
En lo que respecta a las discinesias, un estudio reciente en población brasileña reportó una asociación entre polimorfismos de Taq1A y el desarrollo de discinesias en sujetos con EP25. En nuestra muestra de estudio, la expresión del alelo A1 del polimorfismo de DRD2/ANKK1 mostró una tendencia hacia la significación estadística. Sobre la base de lo anterior, no es posible concluir contundentemente que Taq1A no se relaciona con el desarrollo de discinesias y, probablemente, se requiera de un tamaño muestral mayor para definir esta asociación.
En relación con –141C, el polimorfismo más frecuente en la muestra estudiada fue el Ins/Ins. Existen solo un número reducido de estudios que analicen la relación que tiene el polimorfismo DRD2 –141C y las complicaciones motoras del tratamiento de la EP. Sin embargo, se ha descrito una asociación con el desarrollo de discinesia tardía secundaria al uso de antipsicóticos26. El estudio en población brasileña mencionado previamente no logró demostrar una relación del polimorfismo 141C Ins/Del con el desarrollo de complicaciones motoras.
La asociación entre el polimorfismo Del/Del y la presencia de fluctuaciones motoras no han sido reportadas previamente. No obstante, debe mencionarse que aunque existió una significación estadística, el número de sujetos con dicho polimorfismo en estado homocigoto fue bajo, por lo que se debe extremar cautela en la interpretación y extrapolación de este resultado. En pacientes con esquizofrenia se ha reportado que los portadores del polimorfismo –141C Del de DRD2 muestran un tiempo de latencia mayor para alcanzar una respuesta sostenida al tratamiento antipsicótico27. En el caso de la EP, es plausible la hipótesis de un efecto similar que conduzca a fluctuaciones en la respuesta motora, a pesar de tratarse de modelos antagónicos en relación con el estado dopaminérgico.
Las limitaciones del presente estudio incluyen un tamaño de muestra relativamente pequeño para un estudio con variables genéticas. Sin embargo, el número de sujetos incluidos en este estudio es comparable con otros estudios que reportan la frecuencia de los polimorfismos de DRD2/ANKK1 en la EP y su relación con las complicaciones derivadas del tratamiento con levodopa. Otra limitación es la evaluación de discinesias de manera categórica (ausencia/presencia). El uso de escalas específicas para la evaluación de discinesias en pacientes con EP es deseable para futuros estudios. Finalmente, este estudio se realizó en un centro de referencia, por lo cual los resultados aquí obtenidos podrían no ser generalizables.
Por otra parte, el conocimiento actual indica que el riesgo para el desarrollo de complicaciones es multifactorial e involucra factores clínicos y genéticos. Un estudio reciente no encontró relación entre polimorfismos de DRD2 y el tiempo de latencia del inicio de levodopa al desarrollo de discinesias; sin embargo, sí se reportó una asociación con un polimorfismo del gen del transportador de dopamina SLC6A328. Más aún, se ha reportado que ciertos polimorfismos en DRD2 parecen tener un papel protector en hombres pero no en mujeres29. Al igual que en los estudios genéticos de riesgo para EP, se requieren de estudios mayores, idealmente del tipo de asociación del genoma completo, para identificar el mayor número de factores involucrados en el desarrollo de complicaciones motoras.
En conclusión, la presencia del polimorfismo Del/Del en –141C parece estar asociado al desarrollo de fluctuaciones motoras secundarias al tratamiento con levodopa en sujetos con EP. Se requiere de una muestra mayor de pacientes para confirmar dicha asociación, así como de una validación en una población independiente antes de afirmar la existencia de un papel entre la variación genética estudiada y el desarrollo de complicaciones motoras.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.