La enfermedad por COVID-19 se ha extendido por el mundo desde diciembre de 2019. Los síntomas neurológicos forman parte de su espectro clínico.
ObjetivoConocer las manifestaciones neurológicas en pacientes infectados por COVID-19 en Argentina.
MétodosEstudio multicéntrico realizado en adultos, desde mayo de 2020 a enero de 2021, con COVID-19 confirmado y síntomas neurológicos. Se consignaron variables demográficas, existencia de comorbilidades sistémicas o neurológicas, la forma de comienzo de la infección, alteración en estudios complementarios y el grado de severidad de los síntomas neurológicos.
ResultadosSe incluyeron 817 pacientes de todo el país, 52% varones, edad promedio 38 años. La mayoría sin comorbilidades ni patología neurológica previa. El primer síntoma de la infección fue neurológico en 56,2% de los casos, predominando la cefalea (69%), luego anosmia/ageusia (66%). También se reportaron mialgias (52%), alodinia/hiperalgesia (18%), astenia (6%). Un 3,2% mostró compromiso difuso del SNC como encefalopatía o convulsiones. Un 1,7% tuvo complicaciones cerebrovasculares. Los trastornos del sueño se observaron en 3,2%. Se reportaron seis pacientes con síndrome de Guillain-Barré (GBS), neuropatía periférica (3,4%), parestesias en lengua (0,6%), hipoacusia (0,4%), plexopatía (0,3%). La severidad de síntomas neurológicos se correlacionó con la edad y la existencia de comorbilidades.
ConclusionesNuestros resultados, similares a los de otros países, muestran dos tipos de síntomas neurológicos asociados a COVID-19: algunos potencialmente incapacitantes o mortales como el GBS o la encefalitis, y otros menos devastadores, pero más frecuentes, como cefalea o anosmia que demandan en forma creciente atención a largo plazo.
COVID-19 disease has spread around the world since December 2019. Neurological symptoms are part of its clinical spectrum.
ObjectiveTo know the neurological manifestations in patients infected by COVID-19 in Argentina.
MethodsMulticenter study conducted in adults, from May 2020 to January 2021, with confirmed COVID-19 and neurological symptoms. Demographic variables, existence of systemic or neurological comorbidities, the form of onset of the infection, alteration in complementary studies and the degree of severity of neurological symptoms were recorded.
Results817 patients from all over the country were included, 52% male, mean age 38 years, most of them without comorbidities or previous neurological pathology. The first symptom of the infection was neurological in 56.2% of the cases, predominantly headache (69%), then anosmia/ageusia (66%). Myalgias (52%), allodynia/hyperalgesia (18%), and asthenia (6%) were also reported. 3.2% showed diffuse CNS involvement such as encephalopathy or seizures. 1.7% had cerebrovascular complications. Sleep disorders were observed in 3.2%. 6 patients were reported with Guillain Barré (GBS), peripheral neuropathy (3.4%), tongue paresthesia (0.6%), hearing loss (0.4%), plexopathy (0.3%). The severity of neurological symptoms was correlated with age and the existence of comorbidities.
ConclusionsOur results, similar to those of other countries, show two types of neurological symptoms associated with COVID-19: some potentially disabling or fatal such as GBS or encephalitis, and others less devastating, but more frequent such as headache or anosmia that demand increasingly long-term care.
A fines de 2019 un nuevo coronavirus, SARS-CoV-2, se extendió rápidamente por toda China y desde enero de 2020 fue considerada una pandemia por la Organización Mundial de la Salud (OMS)1. Poco más de un año después, se han reportado más de 100 millones de casos y dos millones de muertos en todo el mundo; en Argentina, más de dos millones de casos y casi 50.000 muertes2. Es la mayor y más severa pandemia desde la gripe de 19183.
Clínicamente, se caracteriza por un compromiso principalmente respiratorio de severidad variable, fundamentalmente en sujetos con edades avanzadas y enfermedades preexistentes. Varía desde una enfermedad leve y autolimitada hasta un síndrome de distrés respiratorio agudo (SDRA), complicación con alta mortalidad. A medida que la pandemia progresa, los reportes de manifestaciones neurológicas asociadas son cada vez más frecuentes. Las tasas varían según la metodología del estudio y las características de los pacientes, pero parecen ocurrir en aproximadamente 1/3 de los casos, que en la escala de esta pandemia significa una gran cantidad de personas.
Prácticamente cualquier parte del neuroeje parece ser susceptible de lesionarse con el SARS-CoV-2. Al igual que en otras infecciones virales, el compromiso podría producirse por los efectos directos del virus, por la respuesta sistémica a la infección, por una combinación de complicaciones de enfermedades sistémicas, por inflamación para o postinfecciosa, o tardíamente en forma de lesiones desmielinizantes4. Es probable que la hipoxemia, en pacientes con COVID-19 grave, desempeñe un papel en el desarrollo de encefalopatía, al igual que los trastornos metabólicos debidos a insuficiencia orgánica única o múltiple y efectos de la medicación. Una serie de casos neuropatológicos de pacientes encefalopáticos con COVID-19 reveló daño isquémico hipóxico agudo en todos5. En otras series, los hallazgos de neuroimagen eran compatibles con leucoencefalopatía posthipóxica avanzada, similares a los descritos en pacientes con SDRA por otras causas6,7.
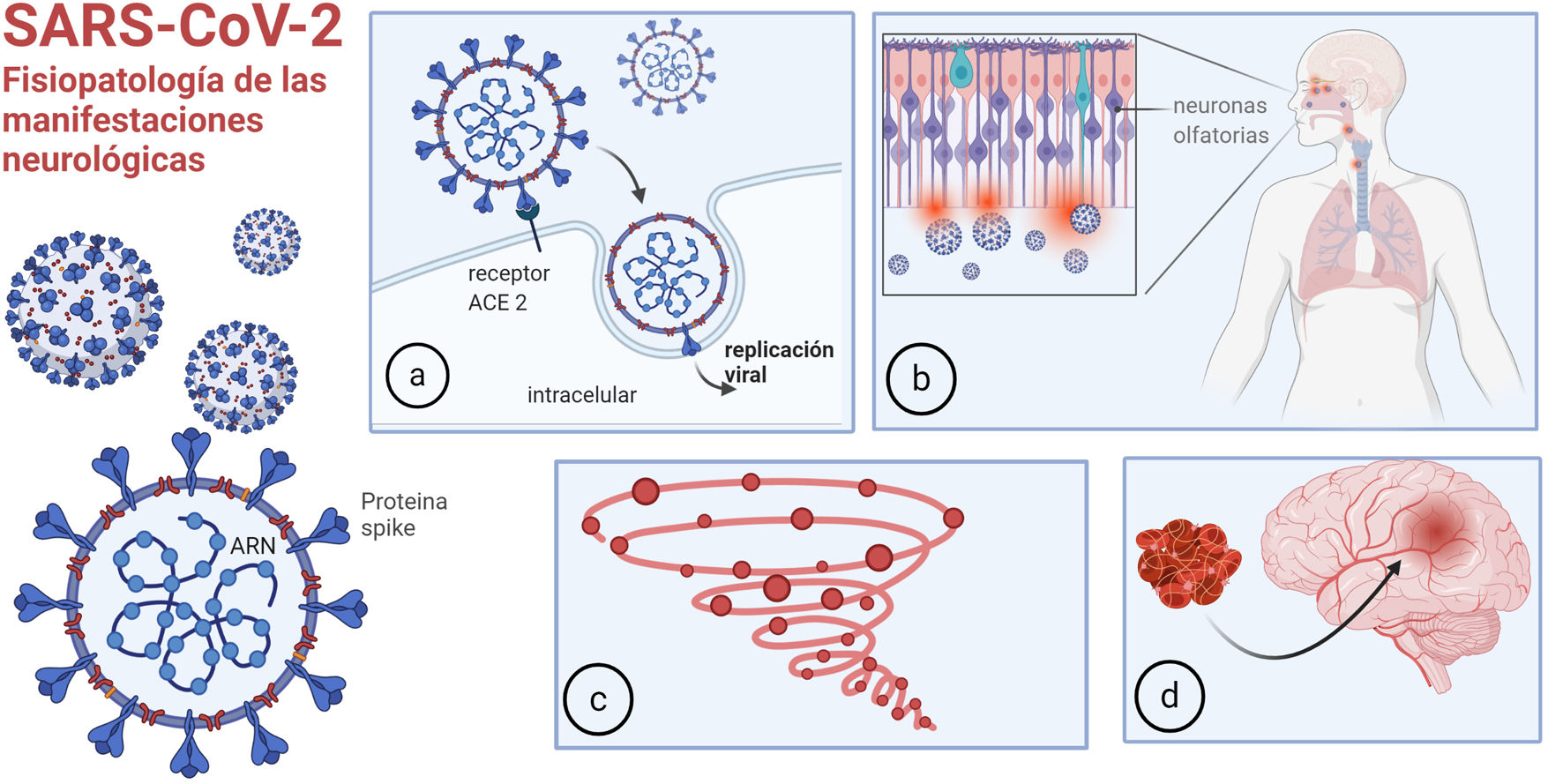
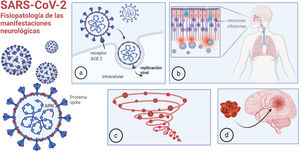
La disfunción del sistema renina-angiotensina es otro mecanismo fisiopatológico de la infección por COVID-19. El SARS-CoV-2 utiliza la enzima convertidora de angiotensina 2 (ACE2) para ingresar a las células (fig. 1a). La ACE2 convierte la angiotensina (AT) II en AT, que tiene propiedades vasodilatadoras, antiproliferativas y antifibróticas. Mediante su unión a la ACE2, el virus produce disfunción de este sistema, con consecuencias cardio y cerebrovasculares.
Fisiopatología de las manifestaciones neurológicas: a) unión de la COVID-19 a la ACE2 para ingresar en las células; b) entrada a través de la mucosa olfatoria; c) respuesta inmune desregulada, tormenta de citoquinas; d) trombofilia.
Imagen realizada por Mariana Bendersky con biorender.com.
El SARS-CoV-2 puede invadir el cerebro a través del epitelio olfatorio y la interfaz neural-mucosa (fig. 1b), y esto causa anosmia en un elevado porcentaje de pacientes, siendo muchas veces el síntoma inicial. Posteriormente, parece propagarse por transporte axonal y/o invasión de vasos vecinos, pudiendo llegar hasta los centros respiratorios en el bulbo raquídeo, provocando la falla respiratoria irreversible de la COVID-19 severa, típicamente caracterizada por falta de disnea8. Algunos informes proporcionan evidencia de invasión viral directa del sistema nervioso: en una serie de casos post mortem, se detectó SARS-CoV-2 en el 53% de las muestras cerebrales9.
Existe además una respuesta inmune sistémica desregulada al virus10. Los pacientes críticamente enfermos con COVID-19, a menudo desarrollan signos de inflamación sistémica severa similares al síndrome de tormenta de citoquinas (fig. 1c) con fiebre persistente y marcadores inflamatorios elevados. Esto puede causar alteración del estado de conciencia per se, y puede asociarse con trombofilia11, aumentando el riesgo de accidente cerebrovascular (ACV) y otros eventos trombóticos (fig. 1d). La activación del complemento también puede provocar una lesión microvascular trombótica en pacientes con COVID-19 grave.
Por último, el virus puede desencadenar fenómenos para y postinfecciosos, como síndrome de Guillain Barré (GBS)12 o desmielinización del sistema nervioso central (SNC).
No existen estudios que hayan focalizado en los pacientes con manifestaciones neurológicas de forma exclusiva, consecutiva y prospectiva en nuestra región. Desde la Sociedad Neurológica Argentina se puso en marcha este registro, con el fin de conocer las manifestaciones neurológicas en pacientes infectados por COVID-19 en Argentina, y de recolectar datos epidemiológicos y clínicos que pudieran correlacionarse con su aparición.
Sujetos y métodosEstudio multicéntrico, analítico, transversal, realizado en pacientes adultos en Argentina, desde mayo de 2020 a enero de 2021. Se invitó a participar a todos los neurólogos del país, que debían completar un formulario online. El protocolo fue evaluado por los comités de ética en investigación de cada unidad participante. Para asegurar el anonimato de los pacientes y evitar registros duplicados, se asignó a cada uno un código alfanumérico. Los signos y síntomas neurológicos fueron consignados por neurólogos entrenados.
Se incluyeron sujetos mayores de 16 años, consecutivos, que consultaron tanto en forma presencial como virtual, con algún síntoma neurológico, y criterios de caso confirmado de COVID-19. Se utilizaron las definiciones efectuadas por el Ministerio de Salud de la nación (https://www.argentina.gob.ar/salud/coronavirus-COVID-19/definicion-de-caso). Se excluyeron pacientes con infecciones respiratorias graves con otra etiología demostrada.
Se consideraron las siguientes variables:
Primarias: COVID-19 confirmado. Presencia de signos o síntomas neurológicos y/o exacerbación de síntomas neurológicos preexistentes. Secundarias: a) demográficas: edad, sexo, lugar de residencia; b) comorbilidades sistémicas; c) enfermedad neurológica previa; d) si el signo o síntoma neurológico fue la forma de comienzo de la infección por COVID-19; e) alteración en datos de laboratorio; f) alteración en estudios neurológicos complementarios; g) grado de severidad de los síntomas neurológicos.
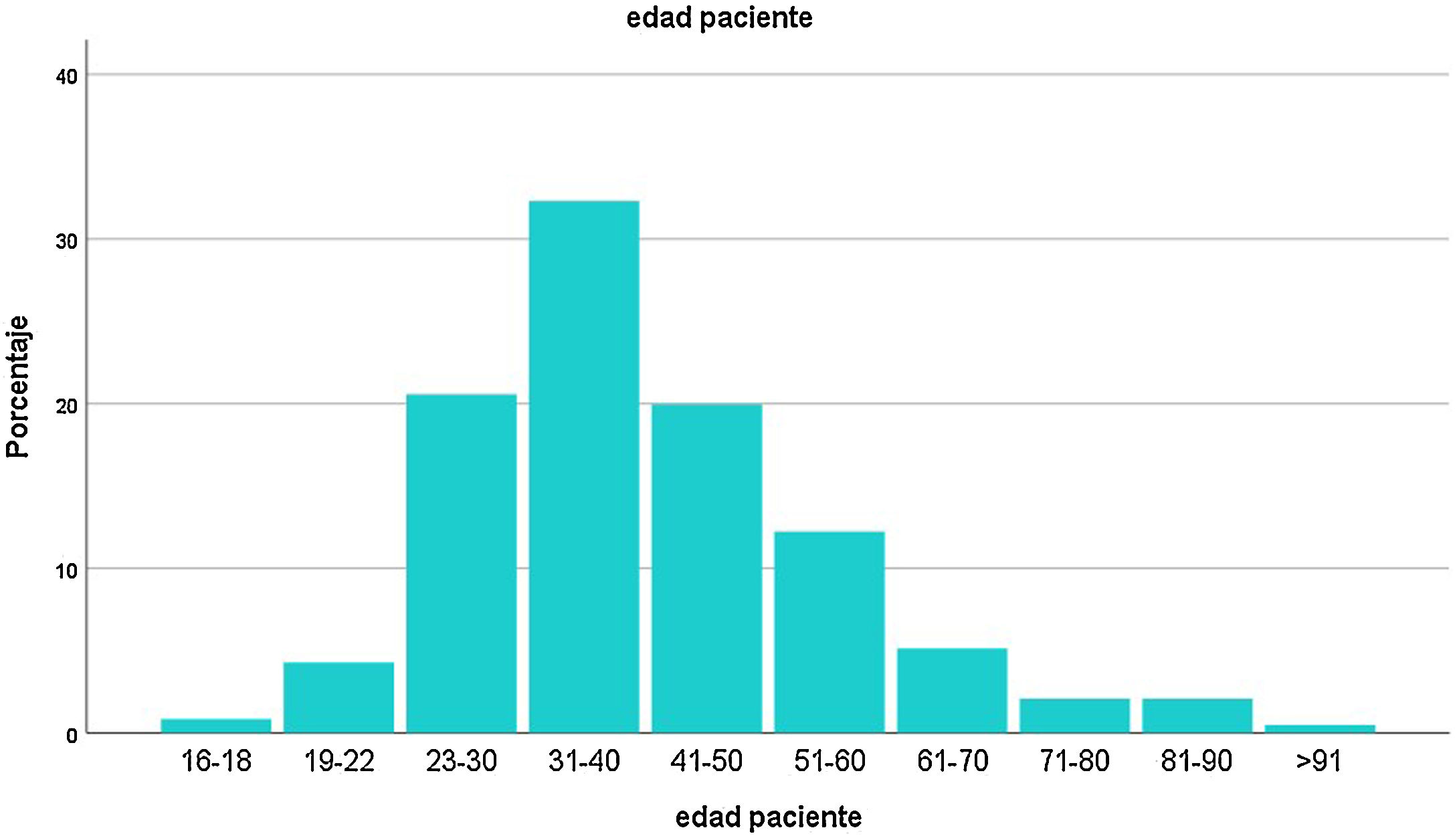
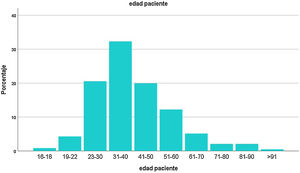
Las variables continuas se expresaron como medias y desvío estándar, o mediana con rangos de valores intercuartiles (IQR). Los datos categóricos se expresaron como valor absoluto y porcentual. La distribución de las edades se repartió en subgrupos (fig. 2). Las proporciones de las variables categóricas se compararon usando la prueba χ2. Para correlacionar variables se utilizaron las pruebas de Pearson, de Spearman o de Mann-Whitney, según el caso. Se consideró un valor de p ≤ 0,05 como significativo.
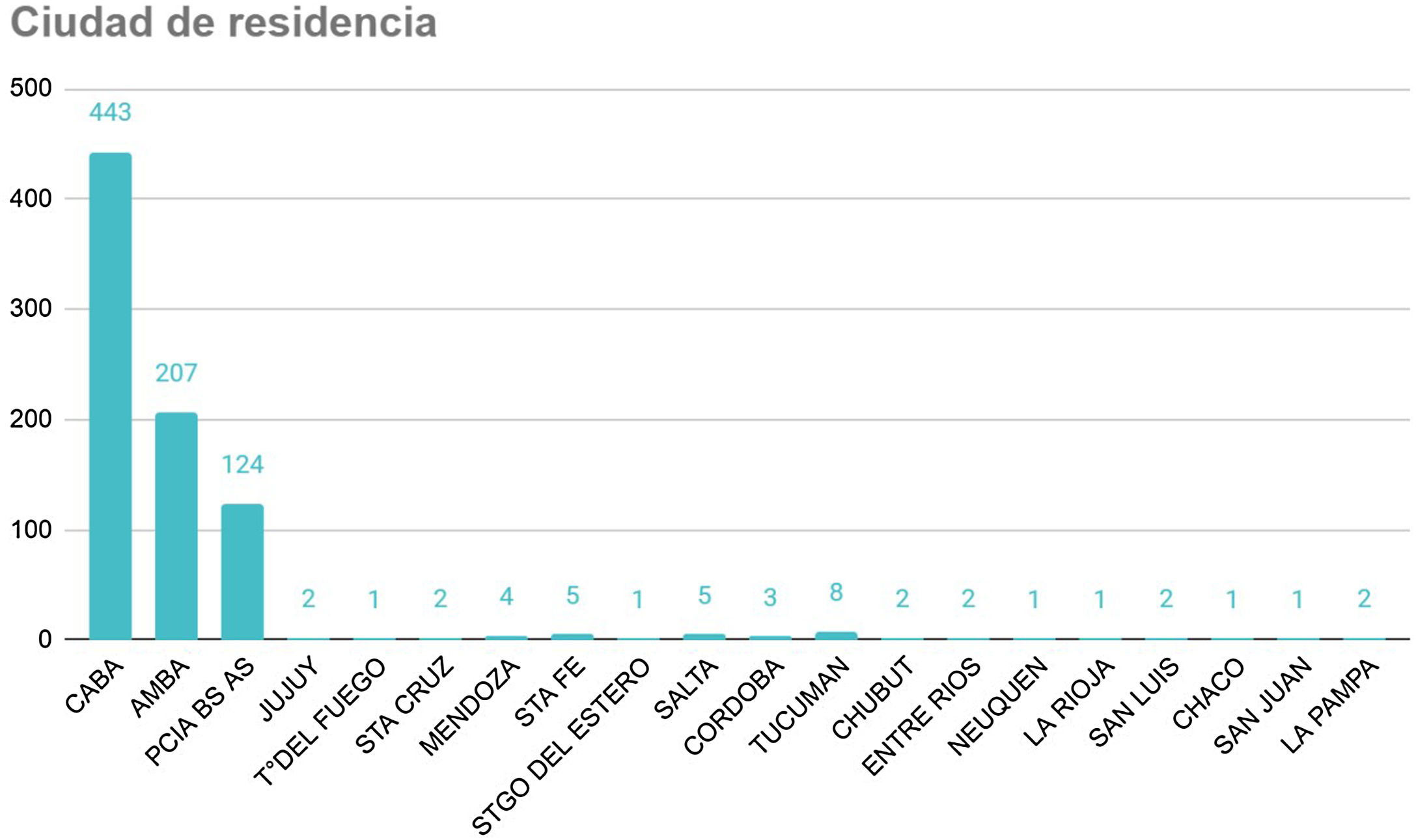
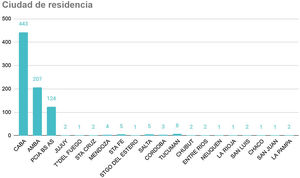
ResultadosEl registro cuenta con 817 pacientes con manifestaciones neurológicas provenientes de diferentes regiones del país, 52% varones, 48% mujeres, de 16 a 98 años, promedio 38 (IQR 30-48) (fig. 2). Si bien se incluyeron pacientes internados y ambulatorios, no contamos con el porcentaje exacto de cada uno. La mayoría residentes de Ciudad Autónoma de Buenos Aires (CABA) y Área Metropolitana de Buenos Aires (AMBA), en tercer lugar, Provincia de Buenos Aires, luego el resto del país, coincidiendo con la distribución de casos en Argentina (fig. 3).
Lugar de residencia de los pacientes.
CABA: Ciudad Autónoma de Buenos Aires; AMBA (excluyendo CABA) incluye los 40 municipios que rodean CABA, se extiende desde Campana hasta La Plata, con límite físico en el Río de la Plata e imaginario en la Ruta Provincial 6; Provincia de Buenos Aires: el resto de la provincia que no es CABA ni AMBA.
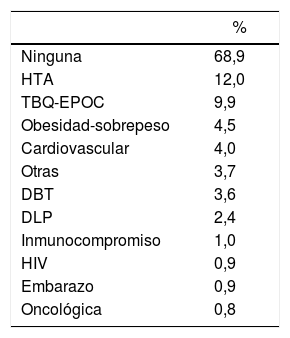
El 69% de los sujetos no tenía ninguna comorbilidad, en el resto, la más frecuente fue la hipertensión arterial (HTA), seguida del tabaquismo o enfermedad pulmonar obstructiva crónica (EPOC) (tabla 1). Algunos reportaban más de una comorbilidad (promedio 1,12). La mayoría (93,2%) no tenía patología neurológica previa (tabla 2). Este registro se compone mayormente de trabajadores esenciales, debido a las medidas de Aislamiento Social Preventivo y Obligatorio vigentes durante el período considerado. Los pacientes con enfermedades neurológicas moderadas o severas estuvieron en general aislados y particularmente atentos a las medidas de prevención de la COVID-19, por lo que la prevalencia de patología neurológica preexistente severa fue baja.
Comorbilidades
| % | |
|---|---|
| Ninguna | 68,9 |
| HTA | 12,0 |
| TBQ-EPOC | 9,9 |
| Obesidad-sobrepeso | 4,5 |
| Cardiovascular | 4,0 |
| Otras | 3,7 |
| DBT | 3,6 |
| DLP | 2,4 |
| Inmunocompromiso | 1,0 |
| HIV | 0,9 |
| Embarazo | 0,9 |
| Oncológica | 0,8 |
HTA: hipertensión; TBQ-EPOC: tabaquismo-enfermedad pulmonar obstructiva crónica; DBT: diabetes mellitus; DLP: dislipidemia; HIV: virus de inmunodeficiencia humana.
En cuanto a las manifestaciones neurológicas (tabla 3), la más frecuente fue la cefalea (69%), con fotofobia (2,4%), dolor retroocular (3,1%) o signos meníngeos (0,9%). En segundo lugar, anosmia/ageusia (66%). También se reportaron mialgias (52%), y otras manifestaciones dolorosas como alodinia o hiperalgesia (18%). El 6% refirió astenia. Un 3,2% mostró signos de compromiso difuso del SNC, como encefalopatía (2%), agitación (1%), convulsiones (0,4%), signos piramidales (0,2%), síndrome disejecutivo (0,5%), mioclonías (0,3%) o síncope (0,4%). Un 1,7% tuvo complicaciones cerebrovasculares: ACV isquémico (1,3%) o hemorrágico (0,4%). Los trastornos del sueño se observaron en 3,2%: insomnio (2,8%), o parasomnias (0,4%). Dentro de las complicaciones del sistema nervioso periférico (SNP) (además de la anosmia), se reportaron seis pacientes con GBS (0,8%), uno con parálisis facial (0,1%), hipoacusia (0,4%), plexopatía (0,3%), neuropatía periférica (3,4%), parestesias en lengua (0,6%). En promedio, cada uno refirió 2,35 síntomas.
Signos y síntomas neurológicos, agrupados por categorías (ver porcentajes detallados en el texto)
| Signos y síntomas | n (%) |
|---|---|
| Cefalea, síndrome meníngeo (fotofobia, dolor retroocular, signos meníngeos) | 556 (71%) |
| Anosmia/ageusia | 519 (66%) |
| Síndromes dolorosos (mialgias, alodinia, hiperestesia, neuralgia) | 430 (55%) |
| Compromiso SNP (GBS, poli o mononeuropatía, miopatía, hipoacusia) | 72 (9.2%) |
| Compromiso SNC difuso (encefalopatía, convulsiones, agitación, mioclonías, síndrome disejecutivo, trastornos visuales) | 25 (3.2%) |
| Trastornos del sueño | 25 (3.2%) |
| Empeoramiento de patología previa | 16 (2%) |
| ACV | 13 (1,7%) |
SNP: sistema nervioso periférico; GBS: síndrome de Guillain-Barré; SNC: sistema nervioso central; ACV: accidente cerebrovascular.
En comparación con los hombres, las mujeres refirieron mayor proporción de cefalea (p = 0,0036), vértigo (p = 0,0217), parestesias linguales (p = 0,0211) y empeoramiento de enfermedades neurológicas previas (p = 0,005). El resto de las manifestaciones neurológicas no mostró diferencias por sexo.
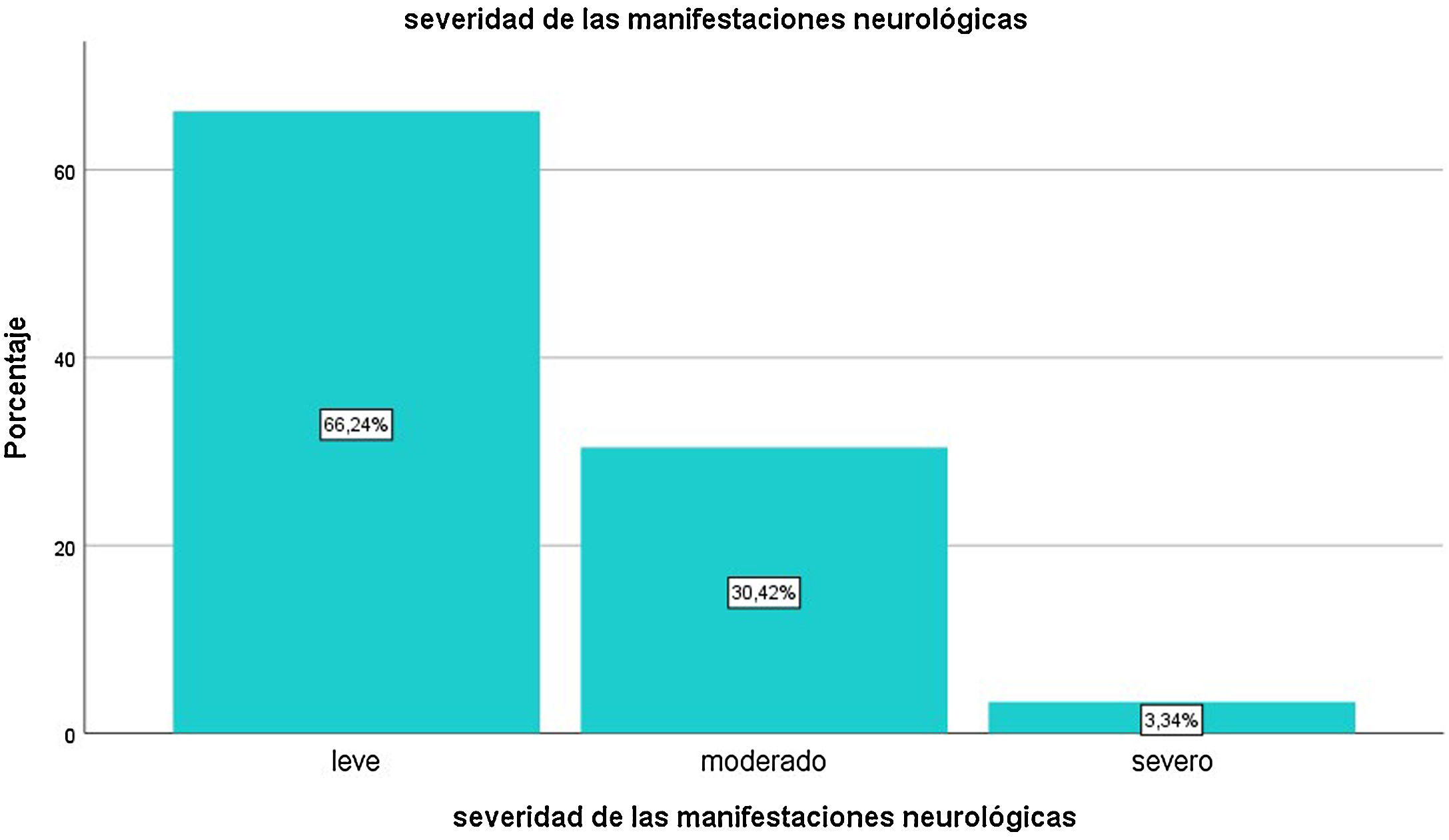
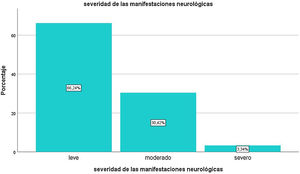
El primer síntoma de la infección fue neurológico en 56,2% de los casos. En su mayoría (66,24%) fueron de intensidad leve, un 30,42% de intensidad moderada, y el resto, severas (fig. 4). Los individuos con manifestaciones graves presentaban edades mayores que aquellos con manifestaciones leves o moderadas (50,5 ± 15,53 vs. 40,52 ± 14,9 años; p = 0,0009). La severidad de síntomas neurológicos correlacionó positivamente con la existencia de comorbilidades (Rho = 0,879, p = 0,004). Las mujeres presentaron una proporción mayor de síntomas clasificados como graves respecto de los hombres (5,94 vs. 2,56%, p = 0,0214).
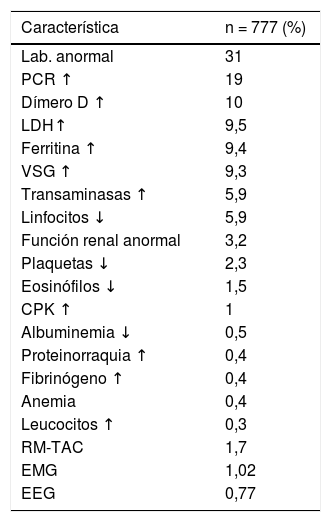
Los estudios complementarios no fueron realizados en todos los casos, ya que la muestra incluyó pacientes de la comunidad con aislamiento domiciliario, y en los internados solo se indicaron los estudios neurológicos indispensables. Un 31% de los pacientes tuvo algún hallazgo anormal: proteína C reactiva (19%), dímero D (10%), ferritina (9,4%), eritrosedimentación (VSG) (9,3%), deshidrogenasa láctica (LDH) (9,5%), neuroimágenes (1,7%), electromiograma (EMG) (1,02%), electroencefalograma (EEG) (0,77%), entre otros (tabla 4).
Estudios complementarios alterados
| Característica | n = 777 (%) |
|---|---|
| Lab. anormal | 31 |
| PCR ↑ | 19 |
| Dímero D ↑ | 10 |
| LDH↑ | 9,5 |
| Ferritina ↑ | 9,4 |
| VSG ↑ | 9,3 |
| Transaminasas ↑ | 5,9 |
| Linfocitos ↓ | 5,9 |
| Función renal anormal | 3,2 |
| Plaquetas ↓ | 2,3 |
| Eosinófilos ↓ | 1,5 |
| CPK ↑ | 1 |
| Albuminemia ↓ | 0,5 |
| Proteinorraquia ↑ | 0,4 |
| Fibrinógeno ↑ | 0,4 |
| Anemia | 0,4 |
| Leucocitos ↑ | 0,3 |
| RM-TAC | 1,7 |
| EMG | 1,02 |
| EEG | 0,77 |
PCR: proteína C reactiva; LDH: deshidrogenasa láctica; VSG: eritrosedimentación; CPK: creatina fosfoquinasa; RM-TAC: resonancia magnética-tomografía computarizada; EMG: electromiograma; EEG: electroencefalograma..
El primer estudio que describió manifestaciones neurológicas de SARS-CoV-2 fue realizado en Wuhan, y comunicó compromiso neurológico en 36,4% de los pacientes, con afección del SNC, SNP y de músculo esquelético13. Sus resultados fueron similares a los nuestros: predominaron cefalea, hiposmia e hipogeusia. La mayor severidad se correlacionó con edades avanzadas y enfermedades preexistentes, mayormente HTA. Los pacientes con SARS-CoV-2 grave presentaron mayor incidencia de ACV, encefalopatía y lesión muscular. En este subgrupo se observó neutrofilia con linfo y plaquetopenia y otros marcadores inflamatorios, como proteína C reactiva y dímero-D. Posteriormente, aparecieron más reportes de manifestaciones neurológicas en otros países14–23 (material suplementario). El registro español incluyó 841 pacientes hospitalizados con COVID-19, con un promedio de edad bastante superior al de nuestra población, de los cuales, el 57,4% desarrolló algún síntoma neurológico. Las complicaciones neurológicas fueron la principal causa de muerte en el 4,1% de todos los fallecidos del estudio18. Un estudio americano encontró que los factores de riesgo independientes para desarrollar cualquier manifestación neurológica fueron COVID-19 grave y una edad más joven. El 71,1% de los pacientes tuvo un resultado funcional favorable al alta. Sin embargo, la encefalopatía se asoció de forma independiente con un peor resultado funcional y una mayor mortalidad dentro de los 30 días de la hospitalización17.
La llegada tardía de la pandemia a nuestra región permitió registrar datos desde el inicio y tener datos locales, diferentes a los de poblaciones con otros contextos sociales y epidemiológicos. Por ejemplo, la mayoría de los pacientes en esta muestra tuvo una media de edad inferior a la de la población europea, y ninguna comorbilidad; aun así, las manifestaciones neurológicas fueron frecuentes. Encontramos una frecuencia y severidad mayor de cefaleas y anosmia a las reportadas en otros estudios, siendo muchas veces el síntoma inicial; por el contrario, la prevalencia de ACV asociado a COVID-19 fue menor a la reportada en otros países, aunque pudiera haber sesgo en esta muestra al no incluir pacientes graves, no manejados por neurólogos. Encontramos también un síntoma frecuente, como la hiperalgesia/alodinia, reportado pocas veces en otras series de pacientes.
Respecto a algunos síntomas reportadosCefalea: Es un síntoma principal de la infección aguda por SARS-CoV-2 y puede convertirse en una queja persistente de la enfermedad prolongada, incluso en casos leves. Durante la fase aguda, el dolor es pulsátil u opresivo, empeora al inclinarse, y puede asociar foto y fonofobia. Puede ubicarse en cualquier parte de la cabeza, pero mayormente es occipital y retroocular. Ding et al.24 describen cefalea en 40% de los pacientes, de intensidad leve, pero en nuestra serie el porcentaje fue mayor, en muchos casos de intensidad moderada a severa y con gran repercusión funcional.
Las características similares a las de la migraña pueden reflejar una activación del sistema trigémino-vascular por inflamación o participación directa del virus. Se ha reportado que la cefalea puede ser más común en pacientes con síntomas gastrointestinales, y que la pérdida de peso rápida con reducción del apetito son características de la cefalea por COVID-1925. En la fase crónica, los dolores pueden hacerse constantes. Esta cefalea crónica posviral fue reconocida como síndrome distintivo en 198626. La pandemia de 1890, conocida como la «gripe rusa o asiática», que mató a un millón de personas, tiene una amplia documentación sobre las secuelas neurológicas que se presentaron meses o años pospandemia27, entre ellas, el síndrome de «neurastenia»: cefalea, letargo e insomnio28, lo que ahora conocemos como una posible rama del síndrome de fatiga crónica/encefalomielitis miálgica y/o fibromialgia, pero algunos de estos casos parecen ser cefaleas diarias nuevas persistentes postinfecciosas. El mismo complejo de síntomas se observa ahora en pacientes con la variante de enfermedad prolongada del SARS-CoV-2.
Anosmia/ageusia: A veces síntoma inicial, otras veces reportada durante la primera semana de infección, la anosmia súbita sin rinorrea es una manifestación llamativa y característica del SARS-CoV2. La abundancia de notificaciones de anosmia por COVID-19 no se da en otras enfermedades virales. Muchos también tienen disgeusia o ageusia (alteración o pérdida del gusto, respectivamente), o cambios en la quimioestesia (la capacidad para percibir las sustancias irritantes).
Se ha demostrado la presencia de ARN y proteína del virus en regiones anatómicamente distintas de la nasofaringe y el cerebro9. El SARS-CoV-2 puede ingresar al SNC cruzando la interfaz neural-mucosa en la mucosa olfatoria, aprovechando la vecindad cercana del tejido endotelial y las terminaciones nerviosas olfativas y trigeminales. Se describieron anomalías en la señal de resonancia magnética (RM) en los bulbos olfatorios de pacientes con COVID-19, que resolvieron en el seguimiento29,30. En dos casos de autopsia, se encontró infiltrado inflamatorio y lesión axonal en los tractos olfatorios, pero no se pudo determinar si el daño viral directo fue responsable16. En un estudio realizado en hámsteres sugieren que la anosmia por COVID-19 estaría relacionada con una descamación masiva y rápida del epitelio olfatorio. Observaron que dos días después de la inoculación directa del virus, la mitad de las células sustentaculares estaban infectadas, pero no las neuronas olfativas31. El epitelio olfativo estaba totalmente descamado y los cilios habían desaparecido, con restauración parcial 14 días después. En humanos, la recuperación de los pacientes que presentaron anosmia es progresiva, pasando de anosmia total, que dura en promedio una semana, a una hiposmia que se resuelve en aproximadamente dos semanas en la mayoría de los casos32.
El mecanismo por el que el virus provoca la pérdida del gusto no se ha explicado del todo. Los receptores de los sabores detectan las sustancias químicas en la saliva y envían la señal al cerebro, pero no contienen ACE2, por lo que es poco probable que se infecten con COVID-19. El sentido del gusto es transmitido por los nervios glosofaríngeo, facial y vago, y solo identifica sabores básicos (dulce, salado, ácido, amargo y umami); sin embargo, para reconocer sabores más complejos (los matices de lo que se está consumiendo), es necesaria la intervención del nervio olfatorio. Aunque parezca que el gusto desaparece con la anosmia debido a esto último, muchas personas con SARS-CoV-2 desarrollan una ageusia verdadera y persistente. Además, refieren pérdida de la percepción de las sustancias químicas. Estas sensaciones no son sabores, sino que su detección la transmite el nervio trigémino, que no expresa ACE2. Los pacientes que se recuperaron del trastorno del gusto identificaron en primera instancia sabores básicos, siendo el salado el más reportado, luego dulce, ácido y amargo32. Adicionalmente, la mayoría de los pacientes manifestaron una recuperación independiente del olfato, más rápida y total. Todo ello podría indicar la existencia de una fisiopatología independiente que afecta a diferentes vías nerviosas.
Mialgias: Las mialgias, especialmente de miembros inferiores y dorso, son comunes en infecciones virales. Estos malestares ocurren inmediatamente antes o al inicio de las manifestaciones respiratorias. Algunos especulan que puede tratarse de una miositis viral, pero faltan pruebas concluyentes de esto33. En Wuhan, el 11% de los pacientes tenían evidencia de lesión muscular con creatina quinasa (CK) elevada13, por el contrario, la mialgia con CK normal fue un síntoma común en casi todas las series de pacientes. Tres informes de casos han descrito rabdomiólisis con CK > 12.000 U/L, en un caso, la biopsia de músculo en un paciente con COVID-19 y miopatía mostró inflamación perivascular y depósito de proteína A resistente al mixovirus, una proteína inducible por interferón de tipo I34.
Alodinia, hiperestesia y otras manifestaciones dolorosas: Un síntoma interesante, probablemente subdiagnosticado, reportado en 16,9% de los pacientes, es la presencia de alodinia35 (dolor ante estímulos no nociceptivos) o hiperestesia cutánea (mayor sensibilidad a los estímulos36. Un 0,8% adicional reportó parestesias, sin neuropatía. Fisiopatológicamente, queda claro que la infección por SARS-CoV-2 se caracteriza por la aparición de una tormenta de citoquinas que conduce a la activación de macrófagos37. Las citoquinas son importantes en el desarrollo de alodinia e hiperalgesia en diversas afecciones patológicas de dolor, el cebado hiperalgésico. Otra hipótesis apunta a que la neuroinvasión afectaría a neuronas y microglia de la médula espinal que expresan ACE2. Dado que la unión de la proteína spike a ACE2 causa una disminución en sus niveles en ambos tipos celulares, aumentarían los niveles de angiotensina 2, que tiene efectos proinflamatorios y proalgésicos. La infección por SARS-CoV-2 podría también conducir a un estado de hiperestimulación que resulte en autoinmunidad, disfunción mitocondrial y neuroinflamación, que podría resultar en el desarrollo de neuropatía de fibras finas. Por otra parte, muchos pacientes que se recuperan de la infección por SARS-CoV-2 muestran signos de polineuropatía de pacientes críticos. Por último, la administración prolongada de opioides en La Unidad de Cuidados Intensivos puede inducir un estado de mayor sensibilización al dolor, lo que produce alodinia e hiperalgesia junto con mialgias y dolor abdominal (hiperalgesia inducida por opioides). Por lo tanto, hay varias razones por las que los pacientes con COVID-19 son propensos al desarrollo de dolor neuropático37.
Complicaciones neuromusculares: En nuestro país se reportaron seis casos de síndrome de Guillain-Barré (GBS), que parece ser una complicación poco frecuente. Entre aproximadamente 1.200 pacientes con COVID-19 ingresados durante un mes en tres hospitales de Italia, se identificaron solo cinco casos de GBS38. El intervalo entre el inicio de la enfermedad viral y el desarrollo de debilidad muscular es de cinco a 10 días, similar al observado para otras infecciones virales asociadas con GBS. Algunos informes sugieren que los síntomas parecen progresar más rápidamente y ser más severos de lo que es típico del GBS; en una serie, tres de cada cinco pacientes requirieron ventilación mecánica, sin embargo, fue difícil distinguir la insuficiencia respiratoria debida al GBS de la debida a la enfermedad pulmonar por COVID-19. En ninguna de las series se observaron características disautonómicas.
Accidentes cerebrovasculares: El ACV parece ser relativamente poco frecuente en el contexto de COVID-19. Las tasas de eventos cerebrovasculares asociados con COVID-19 se basan en gran medida en estudios de cohortes observacionales en pacientes con COVID-19 en diferentes epicentros de todo el mundo10,13,15,18–23,39–43, que reflejan poblaciones variables en términos de gravedad de la enfermedad, comorbilidades y períodos de seguimiento, esto explica la variabilidad en la tasa de eventos. El riesgo de ACV puede variar de < 1% en pacientes con SARS-CoV-2 leve hasta el 6% en pacientes en Cuidados Intensivos. La incidencia en este registro fue de 0,6% de ACV hemorrágico y 1% de ACV isquémico.
En general, el ACV ocurre de una a tres semanas después del inicio de los síntomas de COVID-19. Puede ser isquémico, hemorrágico o presentarse como trombosis venosa. Las isquemias también pueden manifestarse como déficits no focales, como encefalopatía, y afectar a múltiples territorios vasculares. Suelen ser criptogénicos, pero también pueden atribuirse a trombosis de grandes vasos, que puede ser simultánea en diferentes territorios arteriales, embolia cardiogénica o disección arterial44. En pacientes menores de 50 años, se ha observado un cuadro neurológico inicial más severo, en contexto de un SDRA severo. La mortalidad del ACV en pacientes con COVID-19 es mayor a la habitual y, generalmente, esto está determinado por la enfermedad subyacente. Se ha sugerido que SARS-CoV-2 se asocia con un estado de hipercoagulabilidad. Esto se refleja en los niveles elevados de dímero D (marcador del recambio de trombos), observados en muchos pacientes durante las primeras semanas de la enfermedad, en particular en los más gravemente afectados39,44. Estos niveles elevados de dímero D también están presentes en algunos pacientes con ACV isquémico. Se reportaron casos inusuales de trombosis agresivas aórticas, carotídeas y basilares42,43,45. También puede haber una mayor tasa de reoclusión arterial temprana después de la trombectomía mecánica46. SARS-CoV-2 se ha asociado además con varias manifestaciones cardíacas, como arritmia, insuficiencia cardíaca e infarto de miocardio, muchas de las cuales pueden predisponer a un ACV cardioembólico. Esta heterogeneidad sugiere que los mecanismos del ACV en COVID-19 son múltiples y pueden incluir tanto características fisiopatológicas específicas del virus como efectos inespecíficos de inflamación y disfunción de la coagulación, superpuestos a los factores de riesgo preexistentes.
Encefalopatía/agitación/convulsiones: La encefalopatía es común en pacientes críticos con COVID-19. En una serie de 58 pacientes con SDRA relacionado con COVID-19, la encefalopatía estaba presente en 2/3 de los pacientes23. En un estudio de 509 pacientes hospitalizados con COVID-19, el 31,8% tenía encefalopatía, y esos pacientes eran mayores que los que no la tenían, tenían un tiempo más corto desde el inicio de los síntomas hasta la hospitalización, eran más probablemente varones y tenían más probabilidades de tener comorbilidades17. El deterioro del sensorio puede ser el síntoma principal de COVID-19. En un estudio de 817 pacientes mayores (edad media de 78 años) evaluados en el servicio de urgencias a los que se les diagnosticó infección por COVID-19, la encefalopatía estaba presente en el 28%. Entre esos pacientes, el 37% carecía de los síntomas típicos de COVID-19, como fiebre o disnea47.
La etiología de la encefalopatía en estos pacientes suele ser multifactorial. Los pacientes críticamente enfermos con COVID-19 están sujetos a las mismas causas de encefalopatía tóxico-metabólica que otros pacientes críticos. Los signos piramidales son frecuentes, pueden presentarse convulsiones, generalmente no tienen evidencia de inflamación cerebral en RM ni en el análisis del LCR. El EEG muestra hallazgos inespecíficos (enlentecimiento bifrontal difuso). Se ha reportado hipoperfusión frontotemporal bilateral en algunos pacientes encefalopáticos con SARS-CoV-2, el 33% de los sobrevivientes presentó un síndrome disejecutivo, o alteraciones de la atención, orientación y praxia ideomotora, sugestivos de afectación del lóbulo frontal23.
En nuestro registro, el 1,5% de los pacientes estaba encefalopático, un 1% restante consultó por agitación y 0,5% tuvo convulsiones. Solo un paciente presentó síndrome disejecutivo. Esta baja prevalencia puede deberse a las edades significativamente menores de nuestros pacientes, la mayoría sin comorbilidades, y al probable subregistro de pacientes críticos, atendidos por intensivistas, sin intervención de nuestra especialidad.
Se deben considerar varias limitaciones inherentes a los resultados de este trabajo. En primer lugar, existió subregistro de casos, ya que muchos pacientes no llegaron a la consulta neurológica, tanto en las formas leves de SARS-CoV-2 (vistos por médicos no neurólogos de atención primaria) como los más graves, manejados por médicos intensivistas. Además, los síntomas neurológicos leves pueden pasar desapercibidos en pacientes con trastornos muy graves. Si bien se incluyeron pacientes ambulatorios e internados, por el método de recolección de los datos no hay precisiones respecto al grado de severidad de la infección en esta muestra, ni el porcentaje de pacientes internados o fallecidos. En segundo lugar, no podemos conocer qué porcentaje del total de pacientes infectados por COVID-19 desarrolló alguna de estas manifestaciones. Con base en los datos del Sistema Nacional de Vigilancia de la Salud48, el Ministerio de Salud de la nación informó que los síntomas neurológicos se presentaron en el 47,2% del total de los casos. En general, la proporción de pacientes con manifestaciones neurológicas es pequeña, en comparación con la de la enfermedad respiratoria. Sin embargo, la pandemia continúa, con nuevas y más contagiosas mutaciones del virus. Las proyecciones de que entre el 50 y el 80% de la población mundial podrá estar infectada antes de que se desarrolle la inmunidad colectiva sugieren que el número total de pacientes con enfermedades neurológicas podría aumentar.
ConclusionesEste trabajo busca concientizar a la comunidad neurológica sobre las diferentes manifestaciones neurológicas de la COVID-19, a fin de monitorizarlas estrechamente y evitar diagnósticos tardíos o erróneos. Nuestros resultados, similares a los de otros países, muestran que COVID-19 exhibe dos tipos de síntomas neurológicos: algunos potencialmente incapacitantes o mortales como el GBS, las complicaciones cerebrovasculares o la encefalitis, y otros menos devastadores como cefalea, anosmia, y mialgia. Estos llamados síntomas menores, en algunos casos continúan durante ≥ 12 semanas y han sido etiquetados como COVID-19 prolongado («long COVID») o síndrome post-COVID-1949. Las evaluaciones neurológicas longitudinales después de la recuperación serán cruciales para comprender la historia natural del SARS-CoV-2 en el sistema nervioso y monitorear las posibles secuelas.
El compromiso neurológico por COVID-19 es un tema de gran importancia que requiere un esfuerzo global para obtener los datos epidemiológicos y clínicos necesarios para cuantificar la magnitud del problema, definir la gama completa de la enfermedad neurológica y fomentar la investigación neuropatológica, fisiopatológica y terapéutica41. Las complicaciones neurológicas, tanto las más severas, que causan una discapacidad de por vida, como otras más leves, pero mucho más frecuentes, demandan y demandarán en forma creciente atención a largo plazo, con costos sanitarios, sociales y económicos que deberán considerarse dentro de futuros planes y políticas de salud.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo fue realizado gracias a la valiosa colaboración de colegas e instituciones de todo el territorio nacional, esperamos que sirva como inspiración para la realización de más estudios multicéntricos federales.