Las alteraciones práxicas en pacientes con demencia tipo Alzheimer son comúnmente exploradas y reportadas (Rapcsak et al, 1989; Ochipa et al, 1992), mientras que la presencia de apraxia no ha sido estudiada sistemáticamente en la demencia frontotemporal variante frontal.
ObjetivoLos objetivos de este trabajo son buscar evidencia de apraxia en demencia frontotemporal variante frontal e identificar si existen distintos patrones de rendimiento práxico en pacientes con demencia tipo Alzheimer y demencia frontotemporal variante frontal.
Pacientes y métodosSe evaluó a 50 pacientes con diagnóstico de demencia tipo Alzheimer probable y a 40 pacientes con diagnóstico de demencia frontotemporal variante frontal con la batería de evaluación cognitiva de praxias (Politis, 2003).
ResultadosEl 90% de ambos grupos de pacientes mostró alteraciones en al menos una prueba de la batería de praxias. La prueba U de Mann-Whitney comprobó la existencia de diferencias estadísticamente significativas en el rendimiento práxico en la prueba de imitación de gestos no familiares, con peor rendimiento del grupo demencia tipo Alzheimer.
ConclusionesEstos hallazgos son consistentes con el reporte de un marcado déficit en la imitación de gestos no familiares en población con demencia tipo Alzheimer (Ska et al, 1990; Mozaz et al, 1999). La codificación del movimiento subyacente a la repetición de una acción activaría fundamentalmente áreas parietales. Las diferencias en el rendimiento en la prueba de imitación de gestos no familiares en los grupos demencia tipo Alzheimer y demencia frontotemporal variante frontal se explicaría a partir de un compromiso diferencial de áreas parietales.
Apraxia in Alzheimer's dementia patients is commonly explored and reported (Rapcsak et al, 1989; Ochipa et al, 1992), while the presence of apraxia has not been systematically studied in frontal variant of frontotemporal dementia.
ObjectiveThe objectives of this work are search for evidence of apraxia in frontal variant of frontotemporal dementia, and identify if there are different praxis performance patterns in Alzheimer's dementia and frontal variant of frontotemporal dementia patients.
Patients and methods50 patients diagnosed with Alzheimer's dementia and 40 patients diagnosed with frontal variant of frontotemporal dementia, evaluated with the cognitive praxis assessment battery (Politis, 2003).
Results90% of both groups of patients showed alterations in at least one test of praxis battery. The Mann-Whitney test, confirm the existence of statistically significant differences in performance on imitation of unfamiliar gestures, with the worst performance on Alzheimer's dementia group.
ConclusionsThese findings are consistent with the report of a marked deficit in the imitation of unfamiliar gestures in Alzheimer's dementia (Ska et al, 1990; Mozaz et al, 1999). The coding of motion underlying to the repetition of an action, primarily activated parietal areas. The differences in performance on the imitation of unfamiliar gestures could be explained from a differential in parietal area's deficit.
La apraxia se describe como uno de los dominios susceptibles de alterarse en un cuadro demencial1. Ha sido asociada a demencia tipo Alzheimer (DTA), incluso en etapas tempranas de la enfermedad2,3. Tanto la apraxia ideomotora4 como la apraxia conceptual5 pueden estar presentes en DTA. Los pacientes con DTA no sólo pierden la habilidad para ejecutar gestos, sino que también muestran un déficit en el reconocimiento de los mismos3 y en el conocimiento conceptual de las herramientas6. Por otra parte, la presencia de apraxia grave temprana se considera criterio de exclusión para demencia frontotemporal (DFT)6,7. En contraste con las numerosas descripciones clínicas sobre cambios comportamentales en la DFT variante frontal (DFTvf), muchos estudios han sido incapaces de mostrar un patrón específico de alteraciones cognitivas que distinga pacientes con DFT y DTA8,9. A pesar de que la apraxia ha sido descrita en asociación con DFT10, y que tempranamente se enfatizó el rol de los lóbulos frontales en el control del sistema de praxias11,12, la presencia de apraxia no ha sido estudiada sistemáticamente en DFTvf. Los objetivos de este trabajo son buscar evidencia de apraxia en DFTvf e identificar si existen distintos patrones de rendimiento práxico en pacientes con DTA y DFTvf.
Pacientes y métodosPacientesSe reclutaron 90 pacientes del Servicio de Neurología del HIGA Eva Perón, 50 de ellos con diagnóstico de DTA probable (NIN-CDS-ADRDA)13 y 40 con diagnóstico de DFTvf (Lund & Manchester)6,7. Ambos grupos fueron evaluados con un examen neurológico, estudios de neuroimágenes y una extensa batería neuropsicológica que incluye la evaluación de la memoria verbal y visual, el lenguaje, la atención, la visuoconstrucción y las funciones ejecutivas. La evaluación incluyó las siguientes pruebas: California Verbal Learning Test, Memoria Lógica, Dígitos Directos e Inversos y Fluencia Verbal Fonológica de la Batería Neuropsicológica Española14; Figura Compleja de Rey15,16; Test de denominación por confrontación visual de Boston17,18; Fluencia verbal semántica19; Trail Maiking Test A y B20; subescalas de Analogía, Matrices, Vocabulario y Cubos de la Escala de Inteligencia para Adultos, WAIS III21 y ADAS Cognitivo22.
InstrumentosEn ambos grupos fue administrada la batería de evaluación cognitiva de praxias23. La batería de evaluación de praxias comprende las siguientes pruebas: a) ejecución de gestos a la orden verbal; b) ejecución de gestos a la vista de las herramientas; c) uso de herramientas; d) discriminación gestual; e) decisión gestual; f) imitación de gestos familiares; g) apareamiento objeto-herramienta; h) denominación por función; i) evaluación del conocimiento de una función por identificación y j) imitación de gestos no familiares. Llamamos gestos no familiares o gestos sin significado a aquellos movimientos que no tienen un valor simbólico o pragmático en un contexto determinado24. La mitad de estos se tomó del lenguaje de señas y la otra mitad se compuso a partir de la desfiguración temporal y/o espacial de un gesto familiar. Cada ítem o gesto fue puntuado como correcto (0) o incorrecto (1). En cada prueba el desempeño del paciente fue valorado como alterado o conservado de acuerdo con la puntuación de corte de cada subescala de la batería.
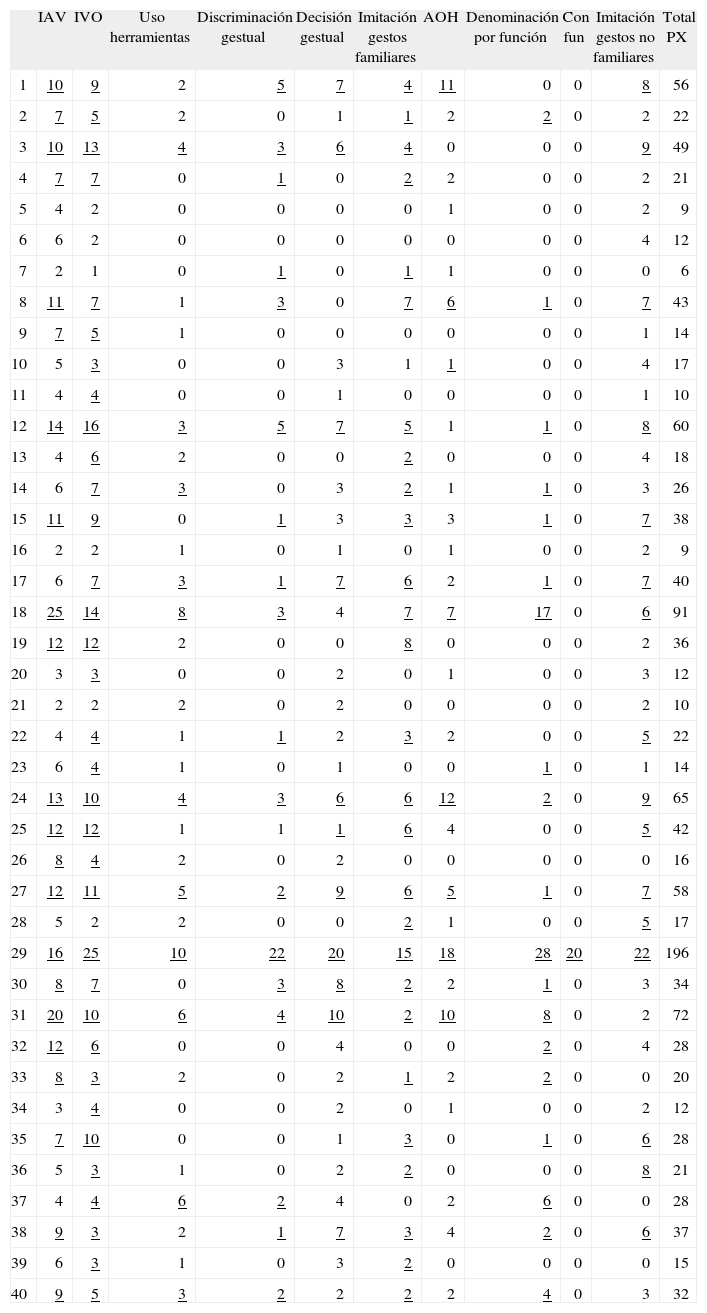
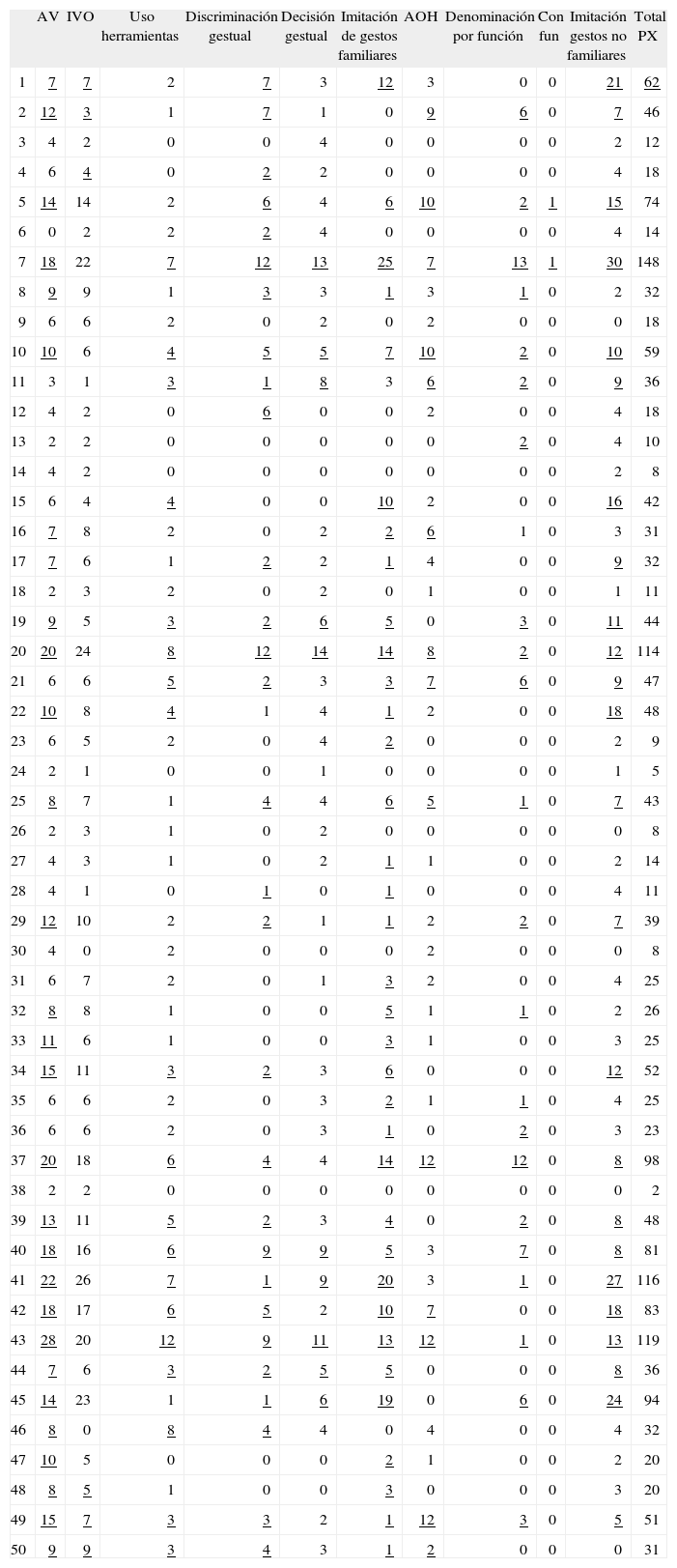
ResultadosEl 90% (45 casos) de los pacientes con DTA y el 90% (36 casos) de los sujetos con DFTvf mostraron alteraciones en al menos una prueba de la batería de praxias. Las tablas 1 y 2 resumen los resultados obtenidos en el rendimiento práxico del grupo DFTvf y DTA, respectivamente. En ambos grupos las pruebas más frecuentemente alteradas fueron la ejecución de pantomimas a la vista de los objetos y la imitación de gestos familiares. Las pruebas relativamente conservadas también coincidieron en ambos grupos: menos del 40% de los pacientes presentó un déficit en el uso de herramientas, decisión gestual, asociación objeto-herramienta y evaluación del conocimiento de una función por identificación. La tabla 3 señala el porcentaje de pacientes que presentan alteraciones en cada una de las pruebas de la batería de praxias, en la población DTA y DFTvf.
– Resumen del rendimiento en la batería de praxias del grupo de pacientes con demencia frontotemporal variante frontal
| IAV | IVO | Uso herramientas | Discriminación gestual | Decisión gestual | Imitación gestos familiares | AOH | Denominación por función | Con fun | Imitación gestos no familiares | Total PX | |
| 1 | 10 | 9 | 2 | 5 | 7 | 4 | 11 | 0 | 0 | 8 | 56 |
| 2 | 7 | 5 | 2 | 0 | 1 | 1 | 2 | 2 | 0 | 2 | 22 |
| 3 | 10 | 13 | 4 | 3 | 6 | 4 | 0 | 0 | 0 | 9 | 49 |
| 4 | 7 | 7 | 0 | 1 | 0 | 2 | 2 | 0 | 0 | 2 | 21 |
| 5 | 4 | 2 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 2 | 9 |
| 6 | 6 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 4 | 12 |
| 7 | 2 | 1 | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 6 |
| 8 | 11 | 7 | 1 | 3 | 0 | 7 | 6 | 1 | 0 | 7 | 43 |
| 9 | 7 | 5 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 14 |
| 10 | 5 | 3 | 0 | 0 | 3 | 1 | 1 | 0 | 0 | 4 | 17 |
| 11 | 4 | 4 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 10 |
| 12 | 14 | 16 | 3 | 5 | 7 | 5 | 1 | 1 | 0 | 8 | 60 |
| 13 | 4 | 6 | 2 | 0 | 0 | 2 | 0 | 0 | 0 | 4 | 18 |
| 14 | 6 | 7 | 3 | 0 | 3 | 2 | 1 | 1 | 0 | 3 | 26 |
| 15 | 11 | 9 | 0 | 1 | 3 | 3 | 3 | 1 | 0 | 7 | 38 |
| 16 | 2 | 2 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 2 | 9 |
| 17 | 6 | 7 | 3 | 1 | 7 | 6 | 2 | 1 | 0 | 7 | 40 |
| 18 | 25 | 14 | 8 | 3 | 4 | 7 | 7 | 17 | 0 | 6 | 91 |
| 19 | 12 | 12 | 2 | 0 | 0 | 8 | 0 | 0 | 0 | 2 | 36 |
| 20 | 3 | 3 | 0 | 0 | 2 | 0 | 1 | 0 | 0 | 3 | 12 |
| 21 | 2 | 2 | 2 | 0 | 2 | 0 | 0 | 0 | 0 | 2 | 10 |
| 22 | 4 | 4 | 1 | 1 | 2 | 3 | 2 | 0 | 0 | 5 | 22 |
| 23 | 6 | 4 | 1 | 0 | 1 | 0 | 0 | 1 | 0 | 1 | 14 |
| 24 | 13 | 10 | 4 | 3 | 6 | 6 | 12 | 2 | 0 | 9 | 65 |
| 25 | 12 | 12 | 1 | 1 | 1 | 6 | 4 | 0 | 0 | 5 | 42 |
| 26 | 8 | 4 | 2 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 16 |
| 27 | 12 | 11 | 5 | 2 | 9 | 6 | 5 | 1 | 0 | 7 | 58 |
| 28 | 5 | 2 | 2 | 0 | 0 | 2 | 1 | 0 | 0 | 5 | 17 |
| 29 | 16 | 25 | 10 | 22 | 20 | 15 | 18 | 28 | 20 | 22 | 196 |
| 30 | 8 | 7 | 0 | 3 | 8 | 2 | 2 | 1 | 0 | 3 | 34 |
| 31 | 20 | 10 | 6 | 4 | 10 | 2 | 10 | 8 | 0 | 2 | 72 |
| 32 | 12 | 6 | 0 | 0 | 4 | 0 | 0 | 2 | 0 | 4 | 28 |
| 33 | 8 | 3 | 2 | 0 | 2 | 1 | 2 | 2 | 0 | 0 | 20 |
| 34 | 3 | 4 | 0 | 0 | 2 | 0 | 1 | 0 | 0 | 2 | 12 |
| 35 | 7 | 10 | 0 | 0 | 1 | 3 | 0 | 1 | 0 | 6 | 28 |
| 36 | 5 | 3 | 1 | 0 | 2 | 2 | 0 | 0 | 0 | 8 | 21 |
| 37 | 4 | 4 | 6 | 2 | 4 | 0 | 2 | 6 | 0 | 0 | 28 |
| 38 | 9 | 3 | 2 | 1 | 7 | 3 | 4 | 2 | 0 | 6 | 37 |
| 39 | 6 | 3 | 1 | 0 | 3 | 2 | 0 | 0 | 0 | 0 | 15 |
| 40 | 9 | 5 | 3 | 2 | 2 | 2 | 2 | 4 | 0 | 3 | 32 |
El subrayado corresponde a las pruebas significativamente alteradas. AOH: Asociación objeto-herramienta; Con fun: evaluación del conocimiento de una función por identificación; IAV: ejecución de gestos a la orden verbal; IVO: ejecución de gestos a la vista de las herramientas; total PX: suma de las puntuaciones parciales de todas las pruebas.
– Resumen del rendimiento en la batería de praxias del grupo pacientes con demencia tipo Alzheimer
| AV | IVO | Uso herramientas | Discriminación gestual | Decisión gestual | Imitación de gestos familiares | AOH | Denominación por función | Con fun | Imitación gestos no familiares | Total PX | |
| 1 | 7 | 7 | 2 | 7 | 3 | 12 | 3 | 0 | 0 | 21 | 62 |
| 2 | 12 | 3 | 1 | 7 | 1 | 0 | 9 | 6 | 0 | 7 | 46 |
| 3 | 4 | 2 | 0 | 0 | 4 | 0 | 0 | 0 | 0 | 2 | 12 |
| 4 | 6 | 4 | 0 | 2 | 2 | 0 | 0 | 0 | 0 | 4 | 18 |
| 5 | 14 | 14 | 2 | 6 | 4 | 6 | 10 | 2 | 1 | 15 | 74 |
| 6 | 0 | 2 | 2 | 2 | 4 | 0 | 0 | 0 | 0 | 4 | 14 |
| 7 | 18 | 22 | 7 | 12 | 13 | 25 | 7 | 13 | 1 | 30 | 148 |
| 8 | 9 | 9 | 1 | 3 | 3 | 1 | 3 | 1 | 0 | 2 | 32 |
| 9 | 6 | 6 | 2 | 0 | 2 | 0 | 2 | 0 | 0 | 0 | 18 |
| 10 | 10 | 6 | 4 | 5 | 5 | 7 | 10 | 2 | 0 | 10 | 59 |
| 11 | 3 | 1 | 3 | 1 | 8 | 3 | 6 | 2 | 0 | 9 | 36 |
| 12 | 4 | 2 | 0 | 6 | 0 | 0 | 2 | 0 | 0 | 4 | 18 |
| 13 | 2 | 2 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 4 | 10 |
| 14 | 4 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 8 |
| 15 | 6 | 4 | 4 | 0 | 0 | 10 | 2 | 0 | 0 | 16 | 42 |
| 16 | 7 | 8 | 2 | 0 | 2 | 2 | 6 | 1 | 0 | 3 | 31 |
| 17 | 7 | 6 | 1 | 2 | 2 | 1 | 4 | 0 | 0 | 9 | 32 |
| 18 | 2 | 3 | 2 | 0 | 2 | 0 | 1 | 0 | 0 | 1 | 11 |
| 19 | 9 | 5 | 3 | 2 | 6 | 5 | 0 | 3 | 0 | 11 | 44 |
| 20 | 20 | 24 | 8 | 12 | 14 | 14 | 8 | 2 | 0 | 12 | 114 |
| 21 | 6 | 6 | 5 | 2 | 3 | 3 | 7 | 6 | 0 | 9 | 47 |
| 22 | 10 | 8 | 4 | 1 | 4 | 1 | 2 | 0 | 0 | 18 | 48 |
| 23 | 6 | 5 | 2 | 0 | 4 | 2 | 0 | 0 | 0 | 2 | 9 |
| 24 | 2 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 5 |
| 25 | 8 | 7 | 1 | 4 | 4 | 6 | 5 | 1 | 0 | 7 | 43 |
| 26 | 2 | 3 | 1 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 8 |
| 27 | 4 | 3 | 1 | 0 | 2 | 1 | 1 | 0 | 0 | 2 | 14 |
| 28 | 4 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 4 | 11 |
| 29 | 12 | 10 | 2 | 2 | 1 | 1 | 2 | 2 | 0 | 7 | 39 |
| 30 | 4 | 0 | 2 | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 8 |
| 31 | 6 | 7 | 2 | 0 | 1 | 3 | 2 | 0 | 0 | 4 | 25 |
| 32 | 8 | 8 | 1 | 0 | 0 | 5 | 1 | 1 | 0 | 2 | 26 |
| 33 | 11 | 6 | 1 | 0 | 0 | 3 | 1 | 0 | 0 | 3 | 25 |
| 34 | 15 | 11 | 3 | 2 | 3 | 6 | 0 | 0 | 0 | 12 | 52 |
| 35 | 6 | 6 | 2 | 0 | 3 | 2 | 1 | 1 | 0 | 4 | 25 |
| 36 | 6 | 6 | 2 | 0 | 3 | 1 | 0 | 2 | 0 | 3 | 23 |
| 37 | 20 | 18 | 6 | 4 | 4 | 14 | 12 | 12 | 0 | 8 | 98 |
| 38 | 2 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 |
| 39 | 13 | 11 | 5 | 2 | 3 | 4 | 0 | 2 | 0 | 8 | 48 |
| 40 | 18 | 16 | 6 | 9 | 9 | 5 | 3 | 7 | 0 | 8 | 81 |
| 41 | 22 | 26 | 7 | 1 | 9 | 20 | 3 | 1 | 0 | 27 | 116 |
| 42 | 18 | 17 | 6 | 5 | 2 | 10 | 7 | 0 | 0 | 18 | 83 |
| 43 | 28 | 20 | 12 | 9 | 11 | 13 | 12 | 1 | 0 | 13 | 119 |
| 44 | 7 | 6 | 3 | 2 | 5 | 5 | 0 | 0 | 0 | 8 | 36 |
| 45 | 14 | 23 | 1 | 1 | 6 | 19 | 0 | 6 | 0 | 24 | 94 |
| 46 | 8 | 0 | 8 | 4 | 4 | 0 | 4 | 0 | 0 | 4 | 32 |
| 47 | 10 | 5 | 0 | 0 | 0 | 2 | 1 | 0 | 0 | 2 | 20 |
| 48 | 8 | 5 | 1 | 0 | 0 | 3 | 0 | 0 | 0 | 3 | 20 |
| 49 | 15 | 7 | 3 | 3 | 2 | 1 | 12 | 3 | 0 | 5 | 51 |
| 50 | 9 | 9 | 3 | 4 | 3 | 1 | 2 | 0 | 0 | 0 | 31 |
El subrayado corresponde a las pruebas significativamente alteradas. AOH: asociación objeto-herramienta; Con fun: evaluación del conocimiento de una función por identificación; IAV: ejecución de gestos a la orden verbal; IVO: ejecución de gestos a la vista de las herramientas; total PX: suma de las puntuaciones parciales de todas las pruebas.
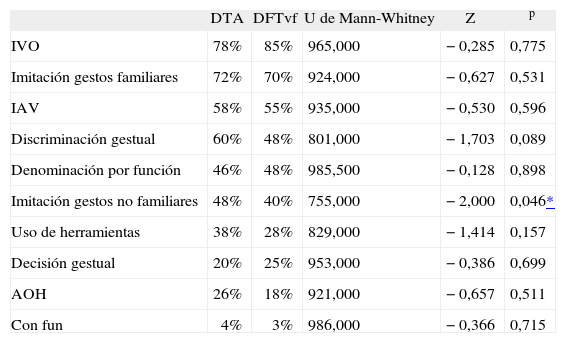
– Porcentaje de pacientes con alteraciones en las pruebas de praxias en población de pacientes con demencia tipo Alzheimer (DTA) y con demencia frontotemporal variante frontal (DFTvf) y diferencias en el rendimiento en la batería de praxias entre ambos grupos
| DTA | DFTvf | U de Mann-Whitney | Z | p | |
| IVO | 78% | 85% | 965,000 | −0,285 | 0,775 |
| Imitación gestos familiares | 72% | 70% | 924,000 | −0,627 | 0,531 |
| IAV | 58% | 55% | 935,000 | −0,530 | 0,596 |
| Discriminación gestual | 60% | 48% | 801,000 | −1,703 | 0,089 |
| Denominación por función | 46% | 48% | 985,500 | −0,128 | 0,898 |
| Imitación gestos no familiares | 48% | 40% | 755,000 | −2,000 | 0,046* |
| Uso de herramientas | 38% | 28% | 829,000 | −1,414 | 0,157 |
| Decisión gestual | 20% | 25% | 953,000 | −0,386 | 0,699 |
| AOH | 26% | 18% | 921,000 | −0,657 | 0,511 |
| Con fun | 4% | 3% | 986,000 | −0,366 | 0,715 |
En el contexto de un desempeño general similar de ambas poblaciones en la batería cognitiva de praxias se hallaron diferencias estadísticamente significativas en la cantidad de errores en la prueba de imitación de gestos no familiares, con peor rendimiento del grupo DTA. La tabla 3 muestra esta diferencia.
DiscusiónSe halló una alta frecuencia de pacientes apráxicos en el grupo DFTvf. Pese a reportes aislados de apraxia en DFT25–27, no se han encontrado estudios previos que examinen sistemáticamente las praxias en la DFTvf. Mozaz et al (2006)3 sostienen que en ocasiones no se identifica el deterioro práxico porque la exploración de este dominio se realiza durante las entrevistas cínicas de forma incompleta por jueces sin experiencia.
Las pruebas más afectadas en esta población fueron la ejecución de gestos a la vista de las herramientas, la imitación de gestos familiares y la ejecución de gestos a la orden verbal. El patrón de rendimiento que presentan los pacientes de este estudio fue hallado previamente: peor desempeño en la imitación28 y en la evocación de un gesto a partir de la presentación visual de un objeto29–31 respecto de la ejecución a la orden verbal, así como uso de objetos32,33 y comprensión de gestos34 relativamente conservados. Justamente, la apraxia se ha caracterizado a partir de estas tres pruebas, entendiendo clínicamente el déficit apráxico como alteraciones en la producción de gestos a la orden verbal, a la imitación y a la vista de los objetos35.
El grupo DTA mostró una alteración significativamente mayor que el grupo DFTvf en la prueba de imitación de gestos no familiares; esta alteración fue encontrada por varios autores33,36–38. Mozaz et al (1999)39 evaluaron la imitación de gestos familiares y no familiares en pacientes con DTA y hallaron que las puntuaciones más bajas se observaron en la imitación de movimientos sin significado, siendo esta la dificultad práxica más precoz en pacientes con DTA. En el mismo sentido, Ska et al (1990)40 sugirieron que la imitación de movimientos sin significado es especialmente sensible a la presencia de DTA. De esta manera, la prueba de imitación de gestos no familiares podría funcionar como un marcador precoz de DTA.
Los resultados en sujetos normales12,41,42 y en poblaciones clínicas37,43,44 señalan que las regiones frontales y parietales son críticas en la imitación de gestos. Fue propuesto que la influencia en la imitación varía en función de la tarea planteada: la imitación en términos de objetivos implicaría mayor activación de áreas frontales inferiores izquierdas (área 44 de Brodmann), mientras que existe un mayor compromiso de áreas parietales rostrales superiores derechas y del opérculo parietal derecho (área 43 de Brodmann) en la codificación detallada del movimiento necesaria para la repetición exacta de una acción41. En este sentido, la correcta imitación de los gestos no familiares dependería especialmente de áreas parietales.
Si bien hay reportes de alteraciones a nivel parietal en pacientes con DFT25, son mayoritariamente los lóbulos frontales y temporales anteriores los que presentan anormalidades funcionales o estructurales en la DFT6,45, mientras que la DTA presenta un patrón de alteración temporoparietal46,47. En este sentido, el compromiso diferencial de áreas parietales en ambos grupos de pacientes explicaría la afectación diferencial en la prueba de imitación de gestos no familiares.
Asimismo, Buxbaum et al (2000)33 y Goldenberg (2001)48 proponen que la imitación de gestos no familiares depende del lóbulo parietal izquierdo y requiere de la codificación de los movimientos en relación con el esquema corporal, entendido como la codificación dinámica de la posición de las partes del cuerpo33.
Si bien ambas poblaciones clínicas muestran alteraciones en la imitación de gestos no familiares, la presencia de diferencias significativas en ambos grupos de pacientes señala la importancia de evaluar sistemáticamente con fines teóricos y diagnósticos la imitación de ambos tipos de gestos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo fue realizado en el marco de los subsidios UBA-CyT P037 y CONICET PIP 112-200801-00633.
Este trabajo fue realizado en el marco de los subsidios UBACyT P037 y CONICET PIP 112-200801-00633.