La esclerosis múltiple es una enfermedad con componente autoinmune, y un número significativo de pacientes se encuentra bajo tratamiento inmunomodulador e inmunosupresor. Frecuentemente los médicos tratantes se preguntan si la vacunación podrá tener un impacto en el desarrollo de la enfermedad, y si existen indicaciones o contraindicaciones para la vacunación de acuerdo a las terapias indicadas.
ObjetivoElaborar una guía de referencia sobre indicaciones y contraindicaciones de vacunación para neurólogos que participan en el manejo de pacientes con esclerosis múltiple con o sin terapias modificadoras de la enfermedad.
Desarrollo Se conformó un equipo de elaboración de las guías entre los miembros del Grupo de Trabajo de Enfermedades Desmielinizantes de la Sociedad Neurológica Argentina (SNA). La metodología implementada fue de acuerdo a recomendaciones establecidas por la SNA, basadas en evidencia, con clasificación de la misma y elaboración de las recomendaciones según el formato GRADE.
ConclusionesSe detallan las vacunas disponibles en Argentina, el impacto potencial que podrían tener en el curso de la enfermedad, las indicaciones de vacunación previas al inicio de cada tratamiento y las contraindicaciones para cada vacuna de acuerdo a la terapia indicada.
Multiple sclerosis is a pathology with an autoimmune component, and a significant number of patients are under immunomodulatory and immunosuppressive treatment. Often, treating physicians wonder whether vaccination may have an impact on the development of the disease, and whether there are indications or contraindications for vaccination according to the indicated therapies.
ObjectiveTo develop a reference guide on vaccination indications and contraindications for neurologists involved in the management of multiple sclerosis patients with or without disease-modifying therapies.
Development A team was created to prepare the guidelines among members of the Demyelinating Diseases Working Group of the Argentine Neurological Society (SNA). The implemented methodology was according to the recommendations established by the SNA, based on evidence, with its classification and preparation of the recommendations according to the GRADE format.
ConclusionsThe vaccines available in Argentina are detailed, the potential impact that they could have in the course of the disease, the vaccination indications prior to the start of each treatment, and the contraindications for each vaccine according to the indicated therapy.
La esclerosis múltiple (EM) es una enfermedad inflamatoria y neurodegenerativa del sistema nervioso central que involucra un mecanismo autoinmune, y en la que la mayoría de los pacientes afectados requieren tratamientos inmunosupresores o inmunomoduladores a largo plazo. No es una enfermedad que genere un estado de inmunosupresión por sí misma, pero se puede ver aumentado el riesgo de infecciones en forma indirecta mediante 2 mecanismos principales: secundario a las terapias modificadoras de la enfermedad (TME), y como consecuencia alteraciones propias de la enfermedad, por ejemplo, los pacientes con trastornos urinarios por lesión medular presentan mayor riesgo de infecciones del tracto urinario (ITU), y los pacientes con trastornos deglutorios padecen mayor riesgo de infecciones pulmonares por broncoaspiración1–3.
En la actualidad no se cuenta con datos poblacionales en Argentina respecto al riesgo de infecciones en pacientes con EM en tratamientos con medicamentos inmunosupresores, pero sí existen datos provenientes de enfermedades reumatológicas, donde el uso de terapias inmunosupresoras es frecuente, que nos permiten aproximarnos a la frecuencia y a la epidemiología de las infecciones en nuestro medio4. De acuerdo a los reportes de la Sociedad Argentina de Reumatología, los pacientes tratados con terapias biológicas tienen un mayor riesgo de infecciones, siendo las más frecuentes la neumonía bacteriana, el virus de la varicela zóster (VZV, por sus siglas en inglés), las infecciones cutáneas y la tuberculosis5.
Las principales infecciones a considerar en pacientes con EM tratados con TME son infecciones de vías aéreas, infecciones urinarias, infecciones herpéticas (virus de herpes simple [HSV, por sus siglas en inglés] y VZV, principalmente en pacientes tratados con fingolimod, cladribina, natalizumab o alemtuzumab), infecciones oportunistas como la leucoencefalopatía multifocal progresiva (con mayor frecuencia en pacientes tratados con natalizumab, pero también en pacientes tratados con fingolimod, dimetilfumarato, alemtuzumab, rituximab y ocrelizumab), criptococosis (principalmente asociada a fingolimod, pero también en natalizumab)6, infecciones por Listeria (alemtuzumab), reactivación de tuberculosis latente (cladribina, alemtuzumab, teriflunomida), reactivación o infección por virus de la hepatitis B o C (ocrelizumab, rituximab)6–9. También se han reportado otras infecciones oportunistas poco frecuentes en relación con alemtuzumab (nocardiosis cerebral, candidiasis esofágica, infecciones por Pasteurella, reactivación sistémica de citomegalovirus (CMV), neumonía atípica, toxoplasmosis cerebral, aspergilosis invasiva)9–11, fingolimod12–15 y natalizumab (paracoccidioidomicosis, toxoplasmosis)16,17, entre otras.
En Argentina es importante destacar que existe un grupo de enfermedades erradicadas o eliminadas como el sarampión, la polio a virus salvaje, o en vías de eliminación como el paludismo, como consecuencia de la incorporación de vacunas al calendario nacional y de acciones de vigilancia y control desde los sistemas de salud. La epidemiología de gran parte de las infecciones difiere en distintas regiones de América Latina, y en particular en Argentina comparado a Europa o América del Norte. Por dicho motivo, es de gran relevancia considerar el riesgo de infecciones endémicas o con mayor prevalencia en nuestro medio a pesar de la ausencia de registros sobre dichas infecciones en pacientes con EM en Argentina. Entre otras, se deben considerar la tuberculosis, las parasitosis intestinales (estrongiloidiasis), la micosis endémicas y las infecciones por arbovirus (entre ellas dengue, fiebre amarilla y Zika).
Razones para elaborar la siguiente guía- •
Frecuentemente se suscita la pregunta acerca de si el paciente con EM tiene indicación de vacunaciones previas o durante el tratamiento, o si existen vacunas contraindicadas.
- •
Los tipos de vacunas, el calendario de vacunación y las campañas de vacunación se actualizan con el paso del tiempo, por lo que se requiere revisión periódica del tema.
- •
Si bien existen revisiones y guías de práctica sobre el tema en otros países, se requiere la elaboración de un documento desde la Sociedad Neurológica Argentina (SNA) para los neurólogos argentinos, como referencia para responder a esta pregunta, considerando el calendario propio y la epidemiología regional.
Elaborar una guía de referencia sobre indicaciones y contraindicaciones de vacunación para neurólogos de Argentina que participan en el manejo de pacientes con EM con o sin tratamiento inmunomodulador/inmunosupresor.
MétodosLos pasos seguidos para la elaboración de la guía fueron realizados de acuerdo a las recomendaciones publicadas por la SNA en 201018 (tabla 1).
Pasos en la elaboración de la guía
| 1. Aprobación por parte del Grupo de Trabajo de Enfermedades Desmielinizantes de la SNA |
| 2. Delimitación del alcance y de los objetivos |
| 3. Creación del grupo elaborador de la guía |
| 4. Formulación de las preguntas clínicas (PICO) |
| 5. Búsqueda de la evidencia |
| 6. Evaluación y síntesis de la literatura |
| 7. Formulación de recomendaciones |
| 8. Revisión interna por autores |
| 9. Revisión externa por no autores (neurólogos, infectólogos, asociaciones de pacientes) |
| 10. Edición |
SNA: Sociedad Neurológica Argentina.
Se conformó un equipo de trabajo con miembros del Grupo de Trabajo de Enfermedades Desmielinizantes de la SNA, quienes divididos en equipos realizaron una revisión crítica de la literatura publicada en función de preguntas preestablecidas. De esta manera, se identificaron todas las vacunas disponibles en Argentina, tanto las del calendario oficial, como de campañas oficiales, y las de fuera del calendario. Se identificó mediante revisión bibliográfica el impacto de cada vacuna en el curso de la enfermedad, y las recomendaciones de vacunación y contraindicaciones en cada una de las TME en Argentina.
Búsqueda de la evidenciaSe realizó en 3 fases sucesivas: En primer lugar, el equipo de especialistas en EM estipularon una serie de preguntas clínicas específicas que cubría los problemas identificados por el alcance del proyecto. Las preguntas clínicas se realizaron según el paradigma PICO (problema, intervención, comparación, desenlace a evaluar o «outcome»). El grupo se reunió para debatir, perfeccionar y aprobar estas preguntas como adecuadas para la identificación de las correspondientes pruebas dentro de la publicación en la literatura. En segundo lugar, con esas preguntas, se desarrolló una estrategia de búsqueda para identificar la evidencia de cada pregunta. Los títulos y los resúmenes identificados fueron revisados para el acuerdo sobre los documentos completos a obtener según el caso para responder a cada pregunta. Sobre los trabajos completos se evaluaron inclusión de acuerdo a criterios predefinidos. Finalmente, los trabajos completos se evaluaron críticamente y los datos relevantes fueron incorporados en las tablas de evidencia para posteriormente ser analizadas por el grupo de expertos como la base sobre la cual evaluar las recomendaciones.
Síntesis de la evidenciaEn cada trabajo se evaluó la calidad metodológica considerando los criterios predefinidos, informe de ensayos clínicos aleatorizados y revisiones sistemáticas (RS), calidad metodológica de guías internacionales y la herramienta de diagnóstico para la precisión de estudios (los detalles completos están disponibles a petición). La calidad de los estudios evaluados fue determinada a través de la herramienta de evaluación de calidad para estudios y RS GRADE19 (tabla 2). La calidad de las guías fue evaluada a través del instrumento AGREE20.
Calidad de la evidencia
| Diseño del estudio | Calidad inicial de la evidencia | Reducir | Aumentar | Calidad de la evidencia |
|---|---|---|---|---|
| Ensayos aleatorizadosEstudios observacionales | AltaBaja | Riesgo de sesgo:−1 serio−2 muy serioInconsistencia:−1 serio−2 muy serioDatos indirectos:−1 serio−2 muy serioSesgo de publicación:−1 probable−2 muy probable | Gran efecto:+1 grande+2 muy grandeDosis respuesta:+1 evidencia de gradienteTodos los posibles confundidores residuales:+1 Reducirían el efecto demostrado+1 Sugerirían un efecto espurio si no se observara efecto | AltaaModeradabBajacMuy bajad |
La evidencia para cada intervención en una condición determinada se extrajo en tablas para su análisis. Luego de evaluar la evidencia, la calidad de la misma, el balance entre los efectos deseables y los no deseables, y los valores y las preferencias se utilizaron las evidencias para formular las recomendaciones de acuerdo al sistema GRADE (tabla 3). El abordaje de recomendaciones según costo-efectividad o análisis económico no será tratado en la presente guía por no disponerse de material publicado en la Argentina. El grupo de expertos examinó las recomendaciones y su clasificación en sus reuniones y llegó a una opinión consensuada. Las recomendaciones se relacionaron de forma explícita a la evidencia que las apoya.
Fuerza de Recomendación GRADE
| Factores considerados |
| Balance entre efectos deseables e indeseables- Cuanto mayor sea la diferencia entre efectos deseables e indeseables, mayor será la probabilidad de justificar una recomendación fuerte. Cuanto menor sea la diferencia, mayor será la probabilidad de justificar una recomendación débil |
| Calidad de la evidencia- Cuanto mayor sea la calidad de la evidencia mayor será la probabilidad de justificar una recomendación fuerte |
| Valores y preferencias- Cuanto más varíen los valores y preferencias o mayor sea la incertidumbre en los valores y preferencias, mayor será la probabilidad de justificar una recomendación débil |
| Costos- Cuanto mayor sean los costos de una intervención, esto es, a mayores recursos consumidos, menor será la probabilidad de justificar una recomendación fuerte |
| Recomendaciones |
| - Recomendación fuerte para el uso de una intervención- Recomendación débil para el uso de una intervención- Recomendación débil contra el uso de una intervención- Recomendación fuerte contra el uso de una intervención |
Después de que la revisión de la evidencia había terminado y cuando un primer borrador de la guía estaba disponible se envió a todos los miembros de ambos grupos de trabajo una grilla con los puntos planteados en la guía pidiendo que expresaran su acuerdo o desacuerdo con cada uno de los puntos consignados con base en la siguiente escala:
- 1.
Aceptado completamente
- 2.
Aceptado parcialmente
- 3.
Rechazado parcialmente
- 4.
Rechazado totalmente
Se discutieron y consensuaron los puntos en controversia en una reunión plenaria con los grupos de expertos, y se llegó a las modificaciones necesarias hasta que el grupo alcanzó, luego de una segunda reunión plenaria, un consenso, definido este como una aceptación de los participantes, igual o mayor al 80% en cada punto.
Redacción de la guíaLa guía ha sido elaborada por el equipo de especialistas de conformidad con las decisiones del grupo de trabajo involucrado en el desarrollo de la guía. El proyecto de directrices se distribuyó a los interesados y la redacción de la misma fue completada siguiendo una sistemática establecida de trabajo.
RecomendacionesCalendario argentino de vacunaciónEn Argentina, la Constitución Nacional vigente de 1994 ha incluido el derecho a la salud la declaración del Helsinki y el pacto de San José de Costa Rica. Es decir, la vacunación es parte de los derechos de los habitantes de Argentina y son de acceso gratuito21. El calendario oficial vigente se puede consultar en https://www.argentina.gob.ar/salud/vacunas22.
Tipos de vacunas incluidas en el Calendario Nacional de Argentina en la actualidad21- •
Vacunas con microorganismos vivos atenuados: vacunas bacilo Calmette-Guerin (BCG), sarampión, rubéola, parotiditis, varicela, rotavirus, antipoliomielítica oral Sabin, fiebre amarilla, fiebre hemorrágica argentina.
- •
Vacunas con microorganismos inactivados: vacuna pertussis de células enteras y acelular, antipoliomielítica inyectable inactivada (poliovirus 1, 2 y 3: IPV, Salk), hepatitis A, antigripal.
- •
Toxoide o anatoxina: diftérica, tetánica, pertussis.
- •
Vacunas conjugadas: haemophilus, vacunas conjugadas antineumocócicas 7 valente, 10 valente y 13 valente; antimeningocócicas C y A+C+Y+W135; anti-Haemophilus influenzae b.
- •
Vacunas de parcelas antigénicas: vacuna pertussis acelular, vacuna contra la hepatitis B, vacuna contra el virus del papiloma humano (VPH).
- •
Las vacunas para la fiebre amarilla y la fiebre hemorragica argentina se aplican en zonas endémicas.
Las recomendaciones de inmunización fuera del caledario para viajeros deben estar basadas en principios de gestión de riesgo. Las estrategias e invervenciones médicas deben estar basadas en el itinerario, condiciones de salud preexistentes y conductas propias de cada viajero23.
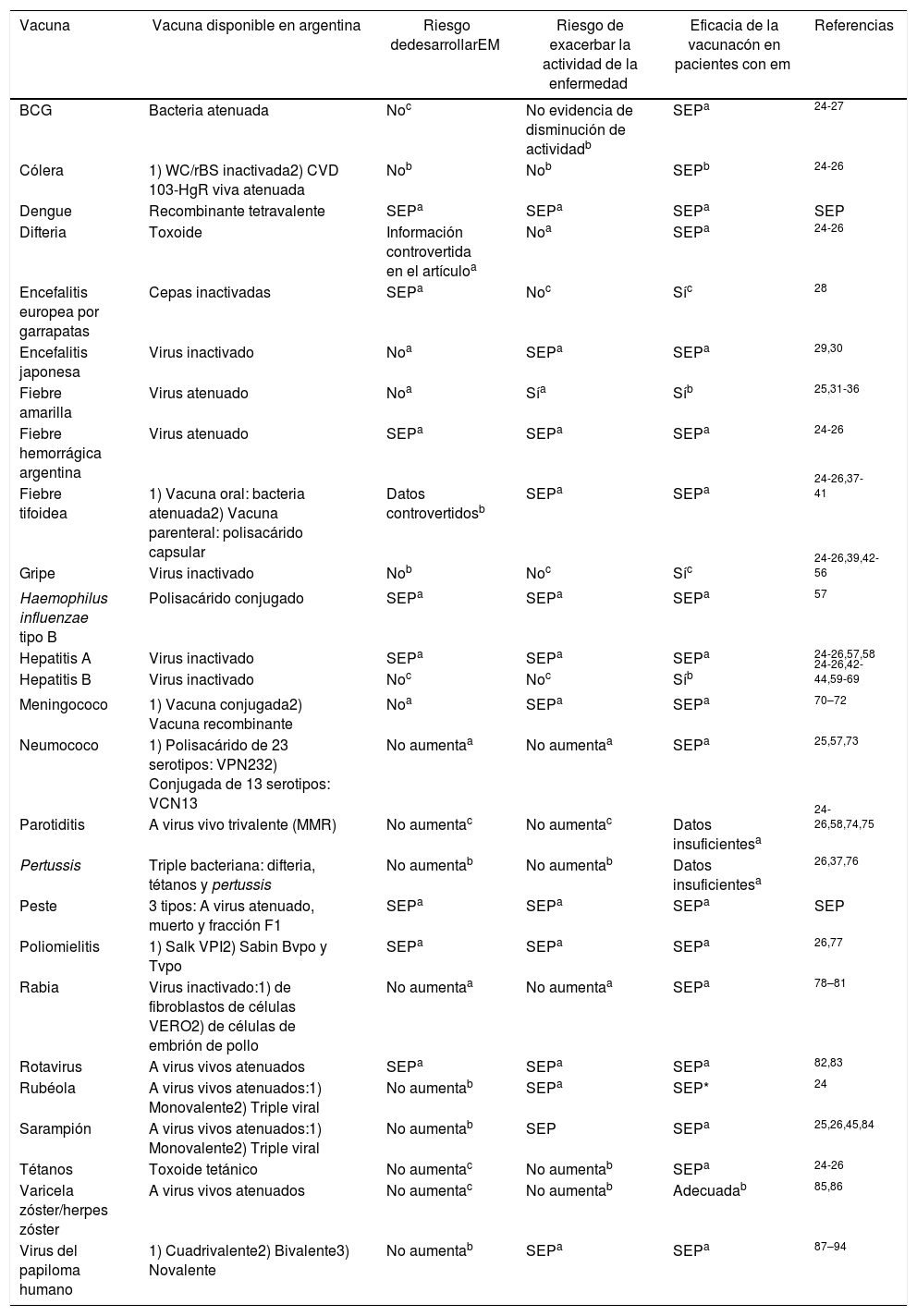
Recomendaciones por vacunas (tabla 4)Preguntas PICO¿Puede lavacunación específica incrementar el riesgo de desarrollo de EM o de exacerbar la actividad de la enfermedad?
Recomendaciones por vacunas
| Vacuna | Vacuna disponible en argentina | Riesgo dedesarrollarEM | Riesgo de exacerbar la actividad de la enfermedad | Eficacia de la vacunacón en pacientes con em | Referencias |
|---|---|---|---|---|---|
| BCG | Bacteria atenuada | Noc | No evidencia de disminución de actividadb | SEPa | 24-27 |
| Cólera | 1) WC/rBS inactivada2) CVD 103-HgR viva atenuada | Nob | Nob | SEPb | 24-26 |
| Dengue | Recombinante tetravalente | SEPa | SEPa | SEPa | SEP |
| Difteria | Toxoide | Información controvertida en el artículoa | Noa | SEPa | 24-26 |
| Encefalitis europea por garrapatas | Cepas inactivadas | SEPa | Noc | Síc | 28 |
| Encefalitis japonesa | Virus inactivado | Noa | SEPa | SEPa | 29,30 |
| Fiebre amarilla | Virus atenuado | Noa | Sía | Síb | 25,31-36 |
| Fiebre hemorrágica argentina | Virus atenuado | SEPa | SEPa | SEPa | 24-26 |
| Fiebre tifoidea | 1) Vacuna oral: bacteria atenuada2) Vacuna parenteral: polisacárido capsular | Datos controvertidosb | SEPa | SEPa | 24-26,37-41 |
| Gripe | Virus inactivado | Nob | Noc | Síc | 24-26,39,42-56 |
| Haemophilus influenzae tipo B | Polisacárido conjugado | SEPa | SEPa | SEPa | 57 |
| Hepatitis A | Virus inactivado | SEPa | SEPa | SEPa | 24-26,57,58 |
| Hepatitis B | Virus inactivado | Noc | Noc | Síb | 24-26,42-44,59-69 |
| Meningococo | 1) Vacuna conjugada2) Vacuna recombinante | Noa | SEPa | SEPa | 70–72 |
| Neumococo | 1) Polisacárido de 23 serotipos: VPN232) Conjugada de 13 serotipos: VCN13 | No aumentaa | No aumentaa | SEPa | 25,57,73 |
| Parotiditis | A virus vivo trivalente (MMR) | No aumentac | No aumentac | Datos insuficientesa | 24-26,58,74,75 |
| Pertussis | Triple bacteriana: difteria, tétanos y pertussis | No aumentab | No aumentab | Datos insuficientesa | 26,37,76 |
| Peste | 3 tipos: A virus atenuado, muerto y fracción F1 | SEPa | SEPa | SEPa | SEP |
| Poliomielitis | 1) Salk VPI2) Sabin Bvpo y Tvpo | SEPa | SEPa | SEPa | 26,77 |
| Rabia | Virus inactivado:1) de fibroblastos de células VERO2) de células de embrión de pollo | No aumentaa | No aumentaa | SEPa | 78–81 |
| Rotavirus | A virus vivos atenuados | SEPa | SEPa | SEPa | 82,83 |
| Rubéola | A virus vivos atenuados:1) Monovalente2) Triple viral | No aumentab | SEPa | SEP* | 24 |
| Sarampión | A virus vivos atenuados:1) Monovalente2) Triple viral | No aumentab | SEP | SEPa | 25,26,45,84 |
| Tétanos | Toxoide tetánico | No aumentac | No aumentab | SEPa | 24-26 |
| Varicela zóster/herpes zóster | A virus vivos atenuados | No aumentac | No aumentab | Adecuadab | 85,86 |
| Virus del papiloma humano | 1) Cuadrivalente2) Bivalente3) Novalente | No aumentab | SEPa | SEPa | 87–94 |
EM: esclerosis múltiple; MMR: vacuna contra sarampión, parotiditis y rubéola; SEP: sin evidencia publicada.
Calidad de evidencia
¿Puede el paciente con EM mostrar menor inmunogenicidad el ser expuesto a vacunas específicas?
Síntesis de recomendaciones GRADEBalance entre beneficios y riesgos. Tanto las vacunas del calendario oficial como aquellas no incluidas en el mismo parecen no incrementar el riesgo de desarrollar EM, o de exacerbación de la actividad de la enfermedad. Si bien para algunas vacunas existen reportes de casos aislados de nuevos casos o exacerbación de enfermedades desmielinizantes, en estudios a gran escala no se ha demostrado una asociación lo suficientemente significativa como para realizar recomendaciones. En el caso de la fiebre amarilla, con base en evidencia de moderada calidad, se deja a consideración del médico tratante la indicación de la vacuna.
Calidad de la evidencia. La calidad de la evidencia es moderada, con ausencia de estudios controlados, pero avalada por extensas series de casos de vigilancia epidemiológica.
Valores y preferencias de los pacientes. Los valores y las preferencias de los pacientes no son probablemente distintos para los desenlaces clave considerados. En el caso particular de la vacunación contra la fiebre amarilla, debería discutirse con el paciente la evidencia publicada y tomar una decisión informada.
Costes y uso de recursos. No se realizaron consideraciones de costos frente a estas recomendaciones.
Recomendación. En la población general pueden utilizarse las vacunas del calendario oficial y las que no forman parte del calendario, sin considerar que estas incrementarán significativamente el riesgo de desarrollar una EM, y los pacientes con EM no presentarán riesgo de empeoramiento de su enfermedad por recibir estas vacunas (recomendación fuerte, calidad de evidencia moderada).
Recomendaciones por terapias (tabla 5).Preguntas PICO¿Enel paciente con EM está indicada la realización de serologías previas o durante el tratamiento para cada terapia disponible, con el fin de identificar necesidad de vacunación?
Recomendaciones por terapia: serologías previas al inicio de tratamiento para determinar la necesidad de vacunación, las indicaciones de vacunación pretratamiento e intratratamiento y los efectos de cada terapia en la respuesta inmunogénica
| Terapia | Serologías previas e intra-tratamiento | Vacunación pre-tratamiento | Vacunación Intra-tamiento | Efectos en la respuesta inmunogénica |
|---|---|---|---|---|
| Interferón (interferón ß-1a, interferón ß-1b) | Ningunab | Según calendario oficialb | Sin restricciones | La respuesta a la vacuna de la influenza no está disminuida25,26La respuesta a las vacunas antimeningocócica, antineumocócica y doble adultos tampoco parece estar afectada95No hay estudios de respuesta inmunogénica con otras vacunasc |
| Acetato de glatiramer | Ningunaa | Según calendario oficialc | Sin restricciones | La respuesta a la vacuna antiinfluenza podría estar disminuida Hay 2 estudios con resultados conflictivos52,53b |
| Teriflunomide | Ningunab | Según calendario oficialc | Evitar vacunas a virus vivos durante el tratamiento y hasta 6 meses después de la discontinuaciónb | Se demostró una respuesta inmune efectiva luego de la vacunación para influenza, aunque ligeramente menor que los pacientes tratados con interferón96Virus de la rabia: sujetos sanos tratados por un mes con teriflunomida fueron capaces de desarrollar una respuesta inmune adecuada, aunque con niveles de anticuerpos más bajos comparados con el grupo placebo97. Este estudio no incluyó a pacientes con EMd |
| Dimetilfumarato | Ningunac | Según calendario oficialc | No se recomiendan vacunas a virus atenuadosb | La respuesta a las vacunas antitetánica, toxoide difteria, antineumocócica o antimeningocócica parece ser similar en pacientes tratados con dimetilfumarato o interferón98cNo hay datos acerca de otras vacunas |
| Fingolimod | Serología varicelaSerología HBVb | Vacunación contra VZV en pacientes con serología negativa 4-6 semanas previas al inicio del tratamientoVacunación contra HPVVacunación contra HVB en pacientes con serología negativa26Vacunación antineumocócicac | Las vacunas con organismos vivos atenuados están contraindicadas hasta 2 meses después de suspendido ested | Es probable que los pacientes tengan menor respuesta inmunológica frente a la vacunación para el virus de influenza estacional y el refuerzo de antitetánica. Resultados semejantes se observaron posteriormente a la vacunación antineumocócica con vacuna polisacárida99d |
| Cladribine | Serología VZVSerología HBVb | Vacunación contra VZV en pacientes con serología negativa 4-6 semanas previas al inicio del tratamientob | Evitar vacunas a virus vivos durante el tratamiento hasta la recuperacion de la linfopeniab | No hay datos sobre la eficacia de la vacunación. Se sospecha que hay reducción en la inmunogenicidad asociada a depleción de células B, por lo tanto, la respuesta a la vacunación debe ser verificada con dosaje de anticuerpos (si están disponibles) para confirmar la inmunoprotecciónb |
| Rituximab/ocrelizumab y otros anti-CD20 | Serología VZVSerología HBVb | Esquema vacunación local completo antes de las 4 semanas. Vacuna antineumocócica (VPP23 y VPC13).Vacuna HPV (adultos jóvenes no vacunados previamente).En pacientes no inmunizados vacuna contra la HVB y el VZVb | No se recomienda aplicar vacunas a virus vivos o atenuados. Podrían indicarse luego de la repoblación de linfocitos B (aprox. 72 semanas)100.Las vacunas inactivadas, si bien son seguras, el porcentaje de respuesta puede ser menor. Se recomienda la vacunación anual contra la influenza estacional101b | Los anticuerpos anti-CD20 pueden disminuir las respuestas inmunes óptimas a ciertas vacunas2,7,101,102Existe evidencia sobre el efecto de rituximab sobre la disminución de la respuesta humoral a la vacuna contra la influenza y el neumococo101Se ha reportado una respuesta humoral disminuida en sujetos tratados con ocrelizumab en comparación con controles (sin tratamiento o bajo interferón) frente al toxoide tetánico, al polisacárido neumocócico de 23 serotipos (con o sin vacunación de refuerzo), al neoantígeno de hemocianina de lapa californiana y a vacunas de la influenza estacional102b |
| Natalizumab | Podría considerarse la serología para VZV previo al inicio del tratamientob | Vacunación contra el VZV en pacientes con serología negativa 4 semanas previas al inicio del tratamientob | No existen recomendaciones específicas de vacunación intra-tratamiento | No afecta las respuestas a inmunización primaria o secundaria en una forma significativa con relación a memoria antigénica (toxoide tetánico [TT]) y para neoantígenos en pacientes con EM103La potencial inmunogenicidad para el virus de influenza en pacientes tratados con natalizumab ha sido similar para H1N1 en tratados y no tratados, y se ha evidenciado una menor respuesta para la cepa H3N253,104,105d |
| Alemtuzumab | Serologías para HBV y VZV9,106,107b | Completar los requisitos de inmunización local al menos 6 semanas antes de iniciar el tratamiento6,7Los pacientes sin historia de varicela y con serología negativa deben ser inmunizados contra VZV antes de iniciar el tratamiento y también posponer el inicio por 6 semanas108b | No existen recomendaciones específicas de vacunación intra-tratamiento. La vacunación para Influenza puede realizarse 6 meses después de las infusiones de alemtuzumab9,106b | Un pequeño estudio piloto demostró que no deteriora la memoria inmunológica humoral con respecto a la capacidad de generar anticuerpos contra los virus comunes, la respuesta de memoria de antígenos, o la capacidad de generar una respuesta inmune humoral contra un antígeno nuevoDemostró la persistencia protectora de las siguientes vacunas: difteria, tétanos, Haemophilus influenzae tipo b, meningococo grupo C (vacuna conjugada) y neumococo (polisacárida)107,109Las respuestas inmunes contra las vacunas de virus vivos no han sido evaluadas y las recomendaciones actuales establecen que los pacientes que iniciaron recientemente tratamiento con alemtuzumab no deben recibirlas, no existen datos de seguridad y eficacia de las mismas9,106,107c |
EM: esclerosis múltiple; HPV: virus del papiloma humano; VHB: vacuna contra la hepatitis B; VZV: virus de la varicela zóster.
Calidad de evidencia
¿En el paciente con EM está indicada la vacunación previa o durante el tratamiento para cada opción disponible, con el fin de reducir el desarrollo de infecciones oportunistas?
¿En el paciente con EM con TME, puede afectarse la respuesta inmunogénica ante la vacunación?
Síntesis de recomendaciones GRADEBalance entre beneficios y riesgos. Se recomienda mantener el calendario de vacunación actualizado en todos los pacientes, independientemente de la terapia a recibir. Se recomienda solicitar serologías previas y vacunación pre e intratratamiento según la tabla 5. Se recomienda valorar los potenciales efectos de la terapia sobre la respuesta inmunogénica de acuerdo a la tabla 5.
Calidad global de la evidencia. La calidad de la evidencia fue variable para las distintas terapias y desenlaces estudiados, y se resumen en la tabla 5.
Valores y preferencias de los pacientes. Los valores y las preferencias de los pacientes no son probablemente distintos para los desenlaces clave considerados.
Costes y uso de recursos. No se realizaron consideraciones de costos frente a estas recomendaciones.
Recomendación. En los pacientes con EM bajo tratamiento debe considerarse la solicitud de serologías y vacunaciones previas e intratratamiento de acuerdo a lo consignado en la tabla 5.
Estatus inmunitario a revisar al diagnosticar a un paciente con esclerosis múltipleLas personas no inmunizadas tienen un mayor riesgo de contraer infecciones prevenibles a través de la vacunación. Aunque no hay evidencia de que la EM aumente per se el riesgo de contraer una infección evitable, los pacientes con EM tienen al menos el mismo riesgo que las personas sanas no vacunadas26. Teniendo en cuenta los riesgos de infección asociados con algunos tratamientos y que se requieren entre 4 y 6 semanas luego de la vacunación para poder comenzar con el mismo, se recomienda que el neurólogo verifique el calendario vigente y el estatus de vacunación en los pacientes con EM al momento del diagnóstico y antes del inicio de la TME, independientemente de cuál sea la terapia a seguir25,26. Los neurólogos pueden discutir las ventajas de la vacunación con los pacientes luego del diagnóstico de EM, independientemente del plan terapéutico a seguir, para prevenir retrasos futuros en el inicio de las TME26.
ConclusionesEsta guía se desarrolló con el objetivo de actuar como documento de consulta para los neurólogos de Argentina acerca del uso de vacunas en EM considerando el calendario propio y la epidemiología regional. En el mismo, se detallan las vacunas disponibles en Argentina y se revisa la evidencia acerca del impacto potencial que su uso podría tener en el curso de la enfermedad. Asimismo, se mencionan las indicaciones de vacunación previas al inicio de cada TME, y las contraindicaciones para cada vacuna de acuerdo a la terapia indicada. Estas guías podrán ser actualizadas en el caso de que surja nueva evidencia y/o se incorporen diferentes vacunas o nuevas TME.
FinanciaciónEsta revisión no recibió apoyos ni financiación para su realización.
Conflicto de interesesNo declaran conflicto de intereses: ADM, CM, CP, EC, GZ, JM, LMC, MPM, MLM, RP y LN. AGB: Ha recibido retribución económica para el desarrollo de actividades educativas, científicas y becas de viajes a congresos de las siguientes compañías farmacéuticas: Biogen, Novartis, Merck, Sanofi, Teva, Tuteur, Roche, Synthon-Bagó, Raffo y Gador. BAS: Ha recibido retribución económica para el desarrollo de actividades educativas, científicas y becas de viajes a congresos de las siguientes compañías farmacéuticas: Biogen, Novartis, Merck, Genzyme, Teva, Bayer, Tuteur y Roche. CAV: Biosidus, Synthon Bago, Genzyme, Novartis, Bayer, Merck y Biogen. DT: Ha recibido retribución económica por el desarrollo de actividades educativas, científicas, asesoría, ensayos clínicos y becas de viajes a congresos de las siguientes compañías farmacéuticas: Bayer, Biogen, Genzyme, Merck Serono, Novartis, Roche, Teva y Tuteur. ECC: Ha recibido retribución económica por el desarrollo de actividades educativas, científicas, asesoría, ensayos clínicos y becas de viajes a congresos de las siguientes compañías farmacéuticas: Biogen, Bayer, Genzyme, Merck, Novartis, Raffo (área eculizumab), Teva y Roche. JIR: Ha recibido honorarios en concepto de disertaciones por parte de Biogen, Genzyme, Merck, Novartis y Roche. También ha recibido apoyo para la investigación por parte de Biogen, Merck, Novartis y Roche. FPG: Ha recibido retribución económica para el desarrollo de actividades educativas, científicas y becas de viajes a congresos de las siguientes compañías farmacéuticas: Biogen, Novartis, Merck, Raffo, Roche, Tuteur, Synthon-Bagó, Gador y Biosidus. SL: Ha recibido retribución económica para el desarrollo de actividades educativas, científicas y becas de viajes a congresos de las siguientes compañías farmacéuticas: Biogen, Novartis, Merck, Sanofi, Teva, Synthon-Bagó y Raffo. LP: Ha recibido retribución económica por el desarrollo de actividades educativas, científicas, asesoría, ensayos clínicos y becas de viaje a congresos de las siguientes compañías farmacéuticas: Bayer, Biogen, Genzyme, Merck, Novartis y Roche. MCY: Ha recibido honorarios por presentaciones educativas y/o ayuda para asistencia a congresos por parte de Merck, Biogen, Genzyme, Bayer Inc, Novartis y Roche Argentin. MIG: recibió remuneración por desarrollar presentaciones educacionales para Merck Serono Argentina, Biogen Argentina, Sanofi-Genzyme Argentina, Bayer Inc Argentina, Roche Argentina y Novartis Argentina. También fue becada para viajar a congresos internacionales por Merck Argentina, Biogen Argentina, Roche Argentina, Novartis Argentina y TEVA Argentina. ND: Advisory boards para Bayer Argentina, Bayer Latinoamerica, Bayer Global, Merck Serono Argentina, Merck Serono Global, Genzyme Argentina, Genzyme Latinoamerica, Genzyme Global y Sanofi Global. Ha recibido apoyo para viajes por congresos de Schering, Bayer, Serono, Merck Serono, Novartis, Biogen Idec, Teva-Tuteur, Teva y Roche. También ha recibido honorarios por investigacion de Bayer Argentina, Biogen Idec Argentina, Genzyme Argentina, Novartis Argentina, Roche Argentina, Teva Argentina y Sanofi Argentina. Además, ha recibido honorarios por cursos de enseñanza de Bayer Argentina, Merck Serono Argentina y Genzyme Argentina. MJ: Merck, Biogen, Novartis, Roche, Gador, Raffo y Sanofi. RRE: Ha recibido reembolsos para desarrollo de presentaciones educacionales, fondos para investigaciones clínicas de G. Uriach, Servier, Astra Zéneca, Schering Arg., Schering Ploug, Bayer Schering Pharma, Serono Arg. Worldwide Clinical Trials (Nottingham, Reino Unido) y subsidios por asesoramiento científico y asistencia a eventos de Schering Arg. Bayer Schering Pharma Teva Tuteur, Bayer, Serono Arg. y Merck Serono. SB: Colaboración para congresos y lornadas científicas de Biogen, Merck, Genzyme, Roche y Novartis. ST: Ha recibido apoyo y ha realizado actividades remuneradas para los laboratorios Biogen, Novartis, Merck, Genzyme y Roche. VS: Ha colaborado en asesorías, recibido grants de investigación, becas de viajes a congresos y honorarios por asesoría y como disertante de parte de Bago, Bayer, Biogen, Biosidus, Gador, Genzyme, Merck, Novartis, Raffo, Teva y Tuteur. VAT: Ha recibido retribución económia por el desarrollo de actividades educativas, científicas, asesoría, ensayos clínicos y becas de viajes a congresos de Biogen, Roche, Merck Teva, Sanofi, Novartis, Bayer y Raffo.
Revisores externos: Dr. Jorge Correale, Dr. Mauricio Farez. Revisores asociaciones de pacientes: Lic. Johana Bauer (EMA), Sra. Susana Giachello (ALCEM).
Nota: La presente Guía fue elaborada por miembros del Grupo de Trabajo de Enfermedades Desmielinizantes de la Sociedad Neurológica Argentina, con aprobación para su realización en Acta N.° 284 del 22 de octubre de 2019. Participaron en la elaboración de la misma aquellos miembros que voluntariamente se ofrecieron luego de una llamada formal. La versión a publicar fue enviada a todos los miembros para su lectura, sin objeciones ni discrepancias recibidas a la fecha del envío de la version final el 11 de agosto de 2020 (se consignará en Acta N.° 291). Participaron en la coordinación general de la guía AGB, búsqueda de la literatura publicada: VS, BAS, JIR, MCY, ECC, LN, DT, ND, ST, MIG, GL, LP, ADM, MPM, JH, RA, SB, LMC, EC, MJ, SL, PAL, CM, MLM, JM, FPC, CP, RP, RRE, JS, VAT, CAV y GZ; clasificación de la calidad de evidencia AGB: VS, JIR y BAS; redacción de la guía AGB: VS, ECC, MCY, DT, ND y LN; revisión de validez interna: ST, GL, LP, MPP, ADM y MIG.
Grupo de Trabajo Enfermedades Desmielinizantes. Sociedad Neurológica Argentina.