El presente artículo resume la guía de práctica clínica (GPC) para el diagnóstico y tratamiento de pacientes con síndrome de Guillain-Barré (SGB) en el Perú.
ObjetivoProveer recomendaciones clínicas basadas en evidencia para el manejo de pacientes con SGB en Perú.
MétodosSe conformó un grupo elaborador local constituido por médicos especialistas y metodólogos. Se formularon 6 preguntas clínicas a ser respondidas por la presente GPC. Durante 2018 se buscaron y seleccionaron GPC de SGB publicadas a partir de 2008, que respondieran a las preguntas planteadas y obtuvieran un puntaje mayor al 60% en los dominios 1 y 3 del instrumento Appraisal of Guidelines for Research and Evaluation II (AGREE-II), y se realizaron búsquedas bibliográficas en Pubmed, para actualizar 6 preguntas clínicas de las GPC preseleccionadas, y para responder una pregunta de novo. La calidad de la evidencia fue evaluada usando la metodología Grading of Recommendations Assessment, Development, and Evaluation (GRADE). En reuniones de trabajo periódicas, se revisó la evidencia y se formuló las recomendaciones, los puntos de buenas prácticas clínicas y el flujograma de evaluación y manejo, usando la metodología GRADE.
ResultadosLa presente GPC abordó 6 preguntas clínicas, divididas en 3 temas: diagnóstico, tratamiento específico y tratamiento de soporte y rehabilitación. En base a dichas preguntas se formularon 6 recomendaciones (5 recomendaciones fuertes y una recomendación débil), 21 puntos de buena práctica clínica y 2 flujogramas.
ConclusiónEl presente artículo es el resumen de la GPC para el diagnóstico y manejo del SGB en el Perú, en la cual se valoró la evidencia científica disponible y su aplicación a nuestro contexto.
This article summarizes the clinical practice guide (CPG) for the diagnosis and treatment of patients with Guillain-Barre syndrome (GBS) in Peru.
ObjectiveTo provide clinical recommendations based on evidence for the management of patients with GBS in Peru.
MethodsA local elaboration group was formed conformed by medical specialists and methodologists. The local elaboration group formulated 6 clinical questions to be answered by this CPG. During 2018, GBS CPGs published since 2008 were searched and selected, which answered the questions posed and obtained a score higher than 60% in domains 1 and 3 of the Appraisal of Guidelines for Research and Evaluation II (AGREE- II), and bibliographic searches were conducted in Pubmed, to update 6 clinical questions of the preselected CPGs, and to answer one de novo question. The quality of the evidence was evaluated using the Grading of Recommendations Assessment, Development, and Evaluation (GRADE) methodology. In regular work meetings, the local elaboration group reviewed the evidence and formulated the recommendations, points of good clinical practice and the flowchart of evaluation and management, using the GRADE methodology.
ResultsThis CPG addressed 6 clinical questions, divided into 3 topics: diagnosis, specific treatment and support and rehabilitation treatment. Based on these questions, 6 recommendations were formulated (5 strong recommendations and one weak recommendations), 21 points of good clinical practice, and 2 flow charts.
ConclusionThis article is the summary of the CPG for the diagnosis and management of GBS in Peru, in which the available scientific evidence and its application to our context was assessed.
El síndrome de Guillain-Barré (SGB) es una neuritis autoinmune inflamatoria aguda cuyo tipo más común es la polineuropatía desmielinizante inflamatoria aguda, aproximadamente en el 90% de los casos 1. No se ha hallado el agente desencadenante para esta entidad, a diferencia de la neuropatía axonal motora aguda de la cual se sabe que es dependiente de una repuesta celular mediada por células T2.
La mayoría de los estudios epidemiológicos que estiman la incidencia del SGB han sido realizados en Estados Unidos de América3. Esta representa la causa más frecuente de parálisis flácida aguda y subaguda en esta región, con una incidencia anual de 0,38-2,66/100.000 personas año. Usualmente la incidencia se incrementa con la edad hasta los 80 años, luego de lo cual se produce una disminución de los casos4.
El antecedente de enfermedad infecciosa está presente en un porcentaje de los pacientes con SGB, siendo los síntomas más frecuentes los gastrointestinales o los respiratorios. Si bien diferentes infecciones han sido identificadas en casos de SGB, los estudios caso-control han revelado asociaciones solo con pocos patógenos. Entre las infecciones con las que se ha reportado asociación se incluyen por Campylobacter jejuni5,6, citomegalovirus7, virus Epstein Barr8, influenza A9, Mycoplasma pneumoniae10, Haemophilus influenzae11, hepatitis (A, B y E)12,13, enterovirus D681, y virus Zika5,6,14,15.
En el Perú durante la primera mitad del año 2018 se presentó un incremento inesperado de número de casos, sobre todo en la región norte, activando una alarma epidemiológica16. Esta situación generó preocupación en la población y autoridades sanitarias por lo cual el Instituto Nacional de Ciencias Neurológicas (INCN) del Ministerio de Salud decidió elaborar una guía de práctica clínica (GPC) de diagnóstico y tratamiento del SGB haciendo uso de la metodología Grading of Recommendations Assessment, Development, and Evaluation (GRADE) para contar con recomendaciones basadas en la mejor evidencia disponible y hacer más eficiente el uso de recursos para la atención de los pacientes con esta condición.
MetodologíaEl procedimiento seguido para la elaboración de la presente GPC está detallado en su versión en extenso, la cual puede descargarse de la página web del INCN (http://www.incn.gob.pe/index.php/menu-guia/90-guias). En resumen, se aplicó la siguiente metodología:
Conformación del grupo elaborador de la guía LocalLa Dirección del INCN conformó un grupo elaborador de la guía local (GEG-Local), que incluyó metodólogos y médicos especialistas en neurología, epidemiología, medicina interna, y medicina física y rehabilitación.
Planteamiento de preguntas clínicas y desenlacesEn concordancia con los objetivos y alcances de esta GPC, el GEG-Local formuló 6 preguntas clínicas (tabla 1) y definió los desenlaces críticos e importantes para cada pregunta clínica.
Preguntas clínicas abordadas
| Temas | N.o | Preguntas |
|---|---|---|
| Diagnóstico | Pregunta 1 | En pacientes con sospecha de síndrome de Guillain-Barré, ¿Cuáles son los criterios válidos para el diagnóstico? |
| Tratamiento específico | Pregunta 2 | En pacientes con síndrome de Guillain-Barré, ¿Es eficaz y seguro el tratamiento con plasmaféresis? |
| Pregunta 3 | En pacientes con síndrome de Guillain-Barré, ¿Debería usarse inmunoglobulina intravenosa en vez de plasmaféresis como manejo modificador de la enfermedad? | |
| Pregunta 4 | En pacientes con síndrome de Guillain-Barré, ¿Es eficaz y seguro el tratamiento con corticoides? | |
| Tratamiento de soporte y rehabilitación | Pregunta 5 | En pacientes con síndrome de Guillain-Barré, ¿Es eficaz y seguro el monitoreo continuo y los cuidados críticos? |
| Pregunta 6 | En pacientes con síndrome de Guillain-Barré, ¿Es eficaz y seguro el tratamiento multidisciplinario y de rehabilitación? |
Se buscaron GPC de SGB que respondieran a alguna de las preguntas planteadas. Se evaluaron 2 guías que hayan realizado revisiones sistemáticas para al menos una de las preguntas formuladas por el GEG-Local, y que cumpla con las siguientes características: Especifica en qué bases de datos se realizó la revisión sistemática, especifica los términos de búsqueda utilizados y especifica los criterios de inclusión de los estudios encontrados. Se buscó seleccionar las GPC que tuvieron puntajes mayores al 60% en los dominios 1 y 3 del instrumento Appraisal of Guidelines for Research and Evaluation II (AGREE-II). Ninguna GPC alcanzó estos criterios. Finalmente se decidió hacer una GPC de novo, utilizando como principal referencia las 2 GPC evaluadas: Diagnóstico y tratamiento del síndrome de Guillain-Barré en el segundo y tercer nivel de atención, del «Instituto Mexicano del Seguro Social» 201617 y la GPC Assessment and management of Guillain-Barré syndrome in the context of Zika virus infection: Interim guidance update de la «Organización Mundial de la Salud» 201618.
Identificación de la evidenciaPara las 6 preguntas clínicas planteadas abordadas se realizó una búsqueda sistemática de novo de documentos. Las búsquedas bibliográficas fueron realizadas en las bases de datos Pubmed y CENTRAL durante mayo de 2018 (Material adicional 1 y 2).
Graduación de la calidad de la evidenciaPara graduar la calidad de la evidencia se siguió la metodología GRADE19. El significado de los 4 niveles de calidad de la evidencia se detalla en la tabla 2.
Significado de los niveles de calidad de la evidencia y de la fuerza de la recomendación
| Calidad de la evidencia | Significado |
|---|---|
| (⊕⊕⊕⊕) Alta | Es muy probable que el verdadero efecto sea similar al efecto estimado |
| (⊕⊕⊕○) Moderada | Es moderadamente probable que el verdadero efecto sea similar al efecto estimado, pero es posible que sea sustancialmente diferente |
| (⊕⊕○○) Baja | Nuestra confianza en el efecto es limitada. El verdadero efecto podría ser sustancialmente diferente al efecto estimado |
| (⊕○○○) Muy baja | Nuestra confianza en el efecto es pequeña. El verdadero efecto probablemente sea sustancialmente diferente al efecto estimado |
| Fuerza de la recomendación | Significado |
|---|---|
| Recomendación fuerte (a favor o en contra) | El GEG-Local cree que todos o casi todos los profesionales que revisan la evidencia disponible seguirían esta recomendación. En la formulación de la recomendación se usa la frase «se recomienda» |
| Recomendación condicional (a favor o en contra) | El GEG-Local cree que la mayoría de los profesionales que revisan la evidencia disponible seguirían esta recomendación, pero un grupo de profesionales podrían no seguirla. En la formulación de la recomendación se usa la frase «se sugiere» |
El GEG-Local revisó la evidencia recolectada para cada una de las preguntas clínicas en reuniones periódicas, y formuló las recomendaciones, otorgándole una fuerza a cada recomendación (tabla 2) usando la metodología GRADE20. Se tuvo en consideración: 1) Beneficios y daños de las opciones, 2) Valores y preferencias de los pacientes, 3) Aceptabilidad por parte de los profesionales de salud, 4) Factibilidad de las opciones en los establecimientos de salud a nivel del territorio peruano, y 5) Uso de recursos. Para la formulación de recomendaciones, estos criterios fueron presentados y discutidos para cada pregunta, y se procuró llegar a un consenso; de no hacerlo, se tomó la decisión por mayoría simple en una votación. Asimismo, se formularon puntos de buenas prácticas clínicas, que fueron emitidos por el GEG-Local sin una evaluación formal de la evidencia, y mayormente en base a su experiencia clínica u otras fuentes.
Revisión por expertos externosLa presente GPC fue revisada en reuniones con médicos especialistas representantes de otras instituciones y tomadores de decisiones. Además, fue enviada por vía electrónica para su revisión por un experto externo que es mencionado en la sección de agradecimientos, con el objetivo de evaluar la calidad metodológica y la congruencia de las recomendaciones planteadas. El GEG-Local tuvo en cuenta los resultados de estas revisiones para modificar las recomendaciones finales.
Actualización de la guía de práctica clínicaLa presente GPC tiene una validez de 3 años. Al acercarse al fin de este periodo, se procederá a realizar una revisión sistemática de la literatura para su actualización, luego de la cual se decidirá si se actualiza la presente GPC o se procede a realizar una nueva versión.
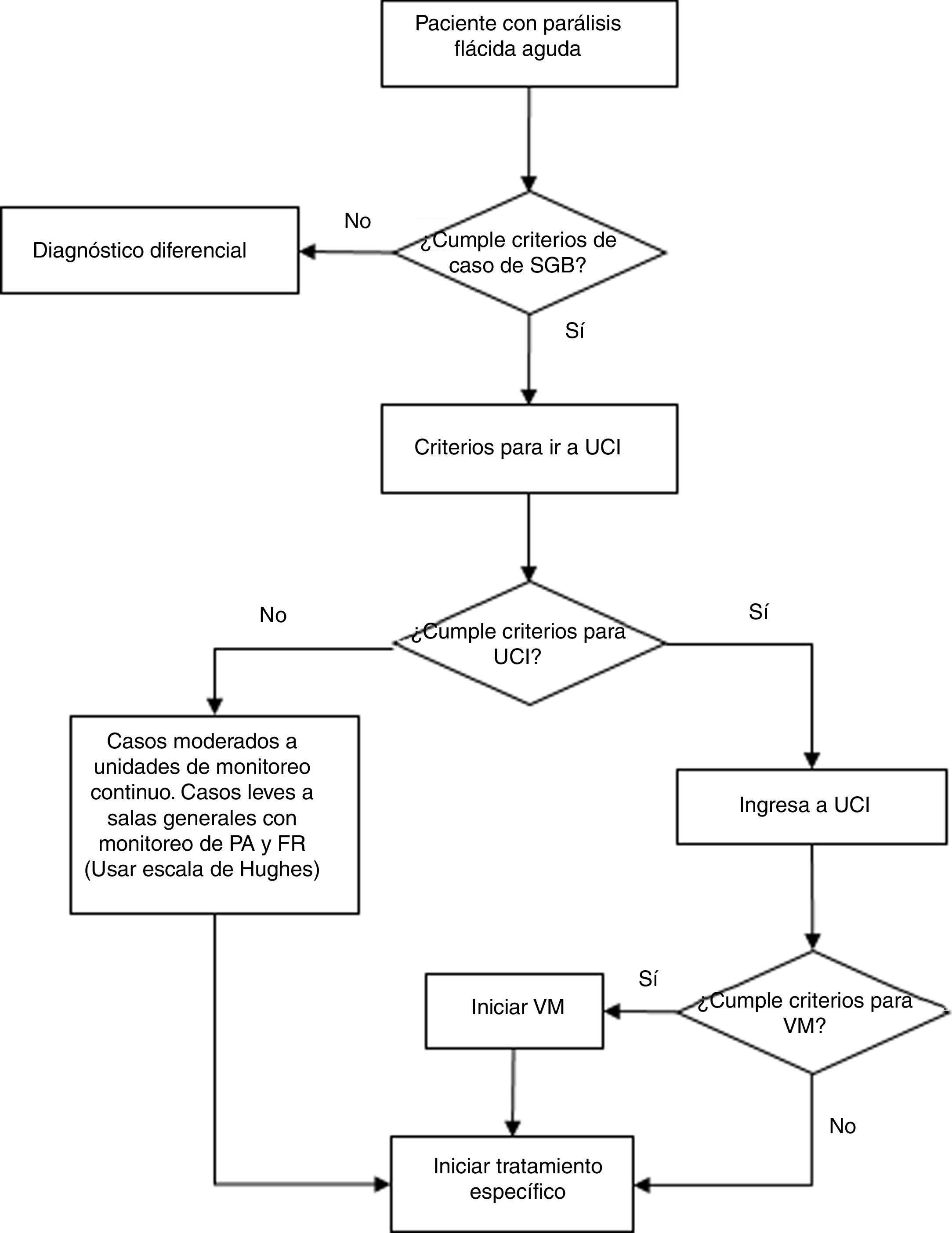
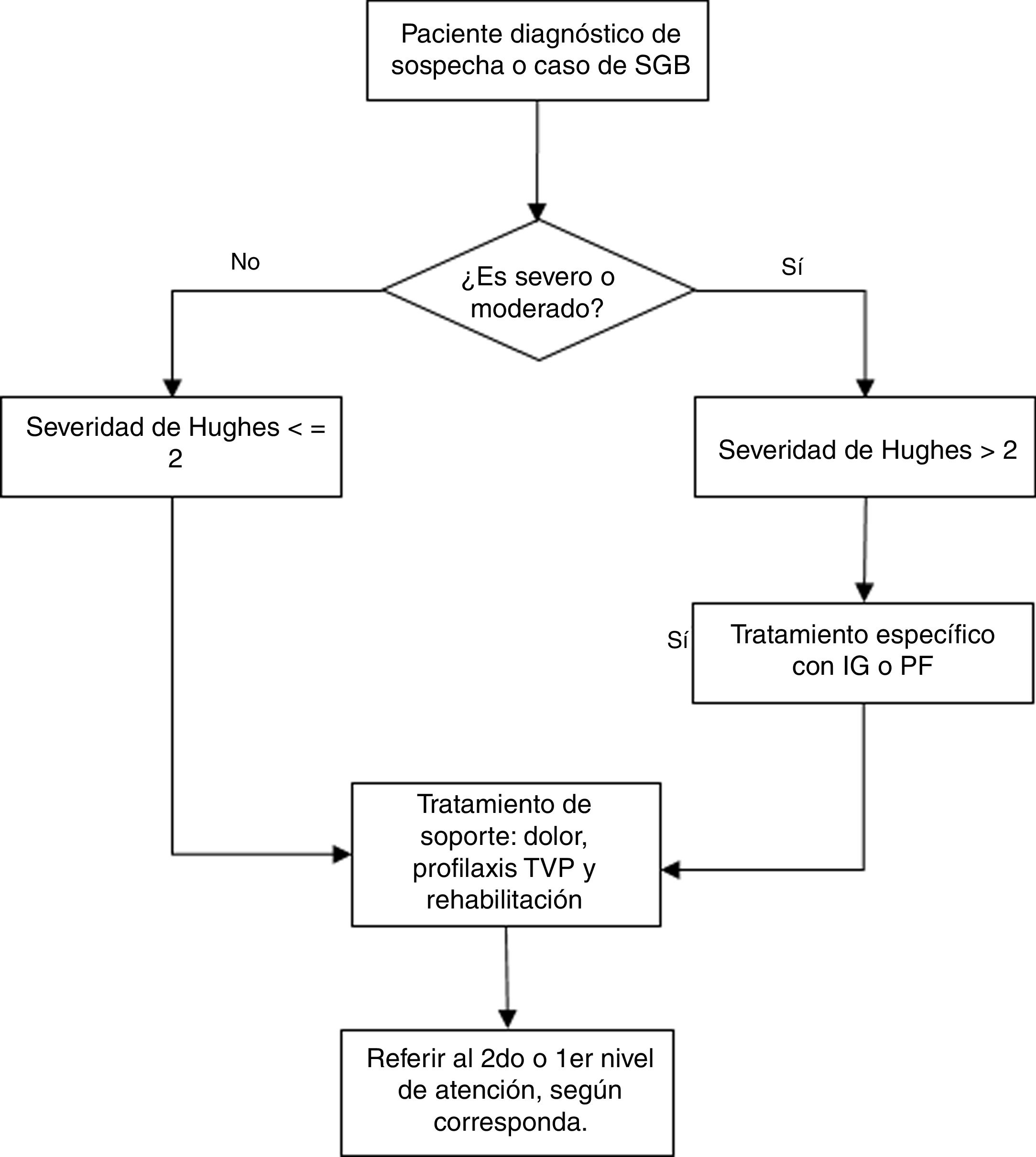
RecomendacionesLa presente GPC abordó 6 preguntas clínicas, divididas en 3 temas: diagnóstico, tratamiento específico, y tratamiento de soporte y rehabilitación de pacientes con SGB. En base a dichas preguntas se formularon 6 recomendaciones (5 recomendaciones fuertes y 1 recomendación débil), 21 puntos de buena práctica clínica y 2 flujogramas.
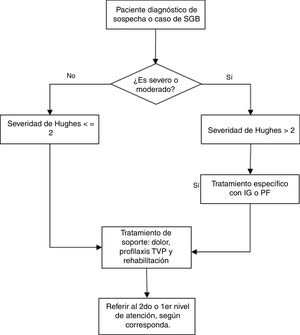
Las recomendaciones se exponen en la tabla 3, y el flujograma de manejo en las figuras. 1 y 2. A continuación, se expondrán las recomendaciones para cada pregunta, así como un resumen del razonamiento seguido para llegar a cada recomendación en base a la evidencia. Las tablas de perfiles de evidencias de GRADE de cada pregunta se encuentran disponibles en el material adicional 3.
Lista de recomendaciones y puntos de buena práctica clínica
| N.o pregunta | Recomendaciones o puntos de buena práctica clínica | Tipo | Fuerza y dirección | Calidad de la evidencia |
|---|---|---|---|---|
| Diagnóstico | ||||
| 1. En pacientes con sospecha de síndrome de Guillain-Barré, ¿Cuáles son los criterios válidos para el diagnóstico? | Se recomienda usar los criterios de Brighton para realizar el diagnóstico de caso confirmado de síndrome de Guillain-Barre que consisten en que toda persona presente los siguientes signos y síntomas (tabla 4):1) Debilidad muscular bilateral y flácida de las extremidades; e2) Hiporreflexia o arreflexia en las extremidades con debilidad; y3) Patrón de enfermedad monofásica,4) Intervalo de 12h a 28 días, entre el inicio y la máxima debilidad con meseta clínica posterior; y5) Ausencia de diagnóstico alternativo para la debilidad.Con cumplimiento de los siguientes criterios: 1) Disociación albúmino-citológica en LCR (nivel de proteínas mayor del normal de laboratorio y <50células/μl);2) Hallazgos electrofisiológicos compatibles con SGB. | R | Fuerte a favor | Muy baja (⊕⊖⊖⊖) |
| Se recomienda realizar el diagnóstico de caso sospechoso de SGB (nivel 2 o 3 de Brighton) evaluados por un profesional de la salud con experiencia en el examen neurológico (tabla 4). | PBP | |||
| Un caso descartado de SGB es un caso sospechoso en el que durante la investigación se identifica otra patología (diagnóstico diferencial, tabla 5). | PBP | |||
| En los pacientes con diagnósticos de sospecha de SGB se sugiere realizar punción lumbar basal para el diagnóstico diferencial o evaluar si existe disociación albúmino-citológica en el LCR o; si el estudio de LCR se realizó en la primera semana de inicio de la enfermedad, para detectar disociación albúmino-citológica se podría repetir el estudio a partir de la segunda semana. | PBP | |||
| Donde y cuando sea posible realizar pruebas de electrofisiología a partir de la segunda semana de inicio de la enfermedad para establecer el diagnóstico de mayor certeza (nivel 1 o 2 de Brighton), tipificar el subtipo y el pronóstico. | PBP | |||
| Para evaluar la severidad se utilizará la escala de Hughes. | PBP | |||
| En un paciente con sospecha de SGB y criterio de severidad (Hughes>2) se debería iniciar tratamiento específico y los resultados del estudio del LCR y electrofisiología no deberían retrasarlo. | PBP | |||
| Tratamiento específico | ||||
| 2. En pacientes con síndrome de Guillain-Barré, ¿Es eficaz y seguro el tratamiento con plasmaféresis? | En pacientes con síndrome de Guillain-Barré de severidad moderada en adelante, se recomienda el tratamiento con plasmaféresis, según disponibilidad y ausencia de contraindicaciones. | R | Fuerte a favor | Moderada (⊕⊕⊕⊖) |
| El tratamiento con plasmaféresis se podría realizar en pacientes con SGB con un tiempo de inicio de los síntomas menor a 4 semanas, preferiblemente dentro de las 2 semanas con enfermedad rápidamente progresiva, quienes no pueden caminar sin ayuda (escala de severidad de Hughes>2) o aquellos que desarrollan debilidad progresiva en musculatura orofaríngea y ventilatoria. | PBP | |||
| En estos casos se podría realizar 4 sesiones de plasmaféresis de manera interdiaria en un periodo de 8 a 10 días. Y de acuerdo a la evolución del paciente y ante falla o refractariedad podría ampliarse el número de sesiones. | PBP | |||
| La plasmaféresis en pacientes con SGB leve (escala de severidad de Hughes≤2) no ha demostrado generar beneficios a largo plazo. | PBP | |||
| La plasmaféresis se podría realizar tanto con albúmina humana al 5% como con plasma fresco congelado. Si se cuenta con ambas alternativas preferir el uso de albúmina humana al 5%. | PBP | |||
| Se requiere personal entrenado para la administración apropiada de plasmaféresis. | PBP | |||
| El volumen de plasma recambiado se debe calcular mediante la siguiente fórmula: Volumen de plasma estimado (litros)=0,07×peso (kg)×(1−hematocrito). | PBP | |||
| 3. 3. En pacientes con síndrome de Guillain-Barré, ¿Debería usarse inmunoglobulina intravenosa en vez de plasmaféresis como manejo modificador de la enfermedad? | En pacientes con síndrome de Guillain-Barré de severidad moderada en adelante, se recomienda el tratamiento con plasmaféresis o inmunoglobulina intravenosa, según disponibilidad y ausencia de contraindicaciones. | R | Fuerte a favor | Moderada (⊕⊕⊕⊖) |
| El tratamiento con inmunoglobulina intravenosa debería realizarse en pacientes con SGB con inicio de los síntomas de menos de 4 semanas, preferiblemente dentro de las 2 semanas, con enfermedad rápidamente progresiva, que no pueden caminar sin ayuda (escala de gravedad de SGB>2) o aquellos que desarrollan debilidad progresiva en musculatura orofaríngea y ventilatoria. | PBP | |||
| En niñas/os y personas adultas: administrar inmunoglobulina intravenosa a dosis total de 2g/kg en infusión continua. Dividida en: 1g/kg/día por 2 días o 0,4g/kg/día por 5 días. Elegir el esquema de acuerdo con las condiciones clínicas y comorbilidades del paciente. | PBP | |||
| La administración de inmunoglobulina intravenosa posterior a la plasmaféresis no ofrece mayor beneficio en los pacientes con síndrome de Guillain-Barré por lo que se debe evitar el uso de ambas terapias en el mismo paciente. | PBP | |||
| En casos de pacientes con fluctuaciones relacionadas con el tratamiento (con mejoría inicial), ya sea con inmunoglobulina intravenosa o plasmaféresis, podría considerarse una nueva administración de inmunoglobulina intravenosa (2g/kg en 2 a 5 días). | PBP | |||
| La inmunoglobulina intravenosa es preferible a la plasmaféresis en personas adultas mayores, por ser más fácil de administrar, mejor tolerada, y ser igualmente eficaz y segura. | PBP | |||
| 4. En pacientes con síndrome de Guillain-Barré, ¿Es eficaz y seguro el tratamiento con corticoides? | En pacientes con síndrome de Guillain-Barré no se recomienda el tratamiento con corticoides. | R | Fuerte en contra | Moderada (⊕⊕⊕⊖) |
| Tratamiento de soporte y rehabilitación | ||||
| 5. En pacientes con Síndrome de Guillain-Barré, ¿Es eficaz y seguro el monitoreo continuo y los cuidados críticos? | Recomendación: | |||
| En pacientes con SGB se recomienda monitorizar e identificar criterios de necesidad de ingreso a UCI o ventilación mecánica. | R | Fuerte a favor | Muy baja (⊕⊖⊖⊖) | |
| El paciente con SGB que se encuentra en UCI debería recibir evaluaciones neurológicas como parte de evaluación y manejo. | PBP | |||
| Al paciente con SGB se recomienda monitorizar la función respiratoria y valorar si cumple criterios o presenta predictores para iniciar ventilación mecánica. | PBP | |||
| 6. En pacientes con síndrome de Guillain-Barré, ¿Es eficaz y seguro el tratamiento multidisciplinario y de rehabilitación? | En pacientes con síndrome de Guillain-Barré se recomienda el tratamiento preventivo y rehabilitador de las discapacidades, de forma precoz, bajo un enfoque multidisciplinario e integral, con la frecuencia necesaria de acuerdo a las características clínicas y necesidad de cada paciente. | R | Condicional a favor | Muy baja (⊕⊖⊖⊖) |
| Para el manejo del dolor el tratamiento rehabilitador multidisciplinario podría ser beneficioso. Sin embargo, el paciente con SGB debería recibir tratamiento de dolor según su necesidad y de acuerdo a los protocolos locales. | PBP | |||
| Para prevenir el desarrollo de UPP el tratamiento rehabilitador multidisciplinario podría ser beneficioso. Sin embargo al paciente con SGB se le debería prevenir o tratar las UPP según su necesidad y de acuerdo a los protocolos locales | PBP | |||
| Para prevenir la TVP el tratamiento rehabilitador multidisciplinario podría ser beneficioso. Sin embargo al paciente con SGB se le debería prevenir el desarrollo de TVP mediante tratamiento profiláctico según su necesidad y de acuerdo a los protocolos locales. | PBP | |||
LCR: líquido cefalorraquídeo; PBP: punto de buena práctica clínica; R: recomendación; SGB: síndrome de Guillain-Barré; TVP: trombosis venosa profunda; UCI: unidad de cuidados intensivos; UPP: úlceras por presión.
En adultos con sospecha de SGB, se recomienda usar los criterios de Brighton para realizar el diagnóstico de caso confirmado de SGB que consisten en que toda persona presente los siguientes signos y síntomas (tabla 4): a) Debilidad muscular bilateral y flácida de las extremidades; b) Hiporreflexia o arreflexia en las extremidades con debilidad; c) Patrón de enfermedad monofásica; d) Intervalo de 12h a 28 días, entre el inicio y la máxima debilidad con meseta clínica posterior y e) Ausencia de diagnóstico alternativo para la debilidad. Con cumplimiento de los siguientes criterios: a) Disociación albúmino-citológica en el líquido cefalorraquídeo (nivel de proteínas mayor del normal de laboratorio y<50células/μl) y b) Hallazgos electrofisiológicos compatibles con SGB. (Recomendación fuerte a favor, calidad de evidencia muy baja ⊕⊖⊖⊖)
Criterios diagnósticos de Brighton
| Ítems que se requieren | Niveles de certeza diagnóstica | ||
|---|---|---|---|
| 1 | 2 | 3 | |
| 1. Debilidad muscular bilateral y flácida en extremidades | + | + | + |
| 2. Hiporreflexia o arreflexia en extremidades débiles | + | + | + |
| 3. Patrón de enfermedad monofásico | + | + | + |
| 4. Inicio a nadir de la debilidad: 12h−28 días+meseta subsecuente | + | + | + |
| 5. Disociación albúmino-citológica en líquido cefalorraquídeo (elevación de proteínas y número de leucocitos<50células/μ) | + | +/- | |
| 6. Hallazgos electrofisiológicos consistentes con síndrome de Guillain-Barré | + | +/- | |
| 7. Ausencia de un diagnóstico alternativo identificado de la debilidad | + | + | + |
Niveles de certeza diagnóstica:
Nivel 1: Es el nivel más alto (el diagnóstico de síndrome de Guillain-Barré es el más probable). Todos los ítems están presents.
Nivel 2: Ítems presentes 1-4, 5 (líquido cefalorraquídeo presente, o cuando el líquido cefalorraquídeo no se colecta/no está disponible), 6 (cambios electromiográficos consistentes con al menos un tipo de síndrome de Guillain-Barré), y 7 (ausencia o diagnóstico alternativo identificado causante de la debilidad) presente.
Nivel 3: Ítems 1-4, y 7 presentes.
Tomado de van Doorn44.
El diagnóstico del SGB es eminentemente clínico; sin embargo, la estandarización de los criterios diagnósticos no ha sido del todo aclarada, generando dificultades diagnósticas en médicos no especialistas en el primer nivel de atención y especialmente en condiciones epidemiológicas adversas. Por lo cual, es importante homogenizar definiciones y ordenar adecuadamente el proceso diagnóstico del SGB.
Se seleccionó el estudio observacional de Mateen et al.21 quienes evaluaron la tasa de detección y la descripción de casos según los criterios de Brighton en pacientes con SGB comparándolo con el diagnóstico confirmado durante el seguimiento y su respuesta al tratamiento.
Se encontró, en pacientes con SGB, una tasa de detección con los criterios diagnósticos de certeza 1 del 62% (IC del 95%: 50,4-72,4), con los criterios diagnósticos de certeza 2 del 83,5% (IC del 95%: 73,5-90,9) y con los criterios diagnósticos de certeza 3 del 86,1% (IC del 95%: 76,5-92,8). Se concluyó que el contar con criterios diagnósticos de Brighton definidos aumenta la tasa de detección. Considerando que el uso de los criterios diagnósticos de Brighton mejora la tasa de detección, se decidió formular una recomendación a favor de su uso. Por otro lado, a pesar de que la calidad en evidencia fue muy baja, la aceptabilidad, valores y preferencias y costos van a favor del uso de los criterios diagnósticos de Brighton, por lo que se decidió realizar una recomendación fuerte al respecto.
Puntos de buenas prácticas clínicas:- 1.
Se recomienda realizar el diagnóstico de caso sospechoso de SGB (nivel 2 o 3 de Brighton) evaluados por un profesional de la salud con experiencia en el examen neurológico (tabla 4).
- 2.
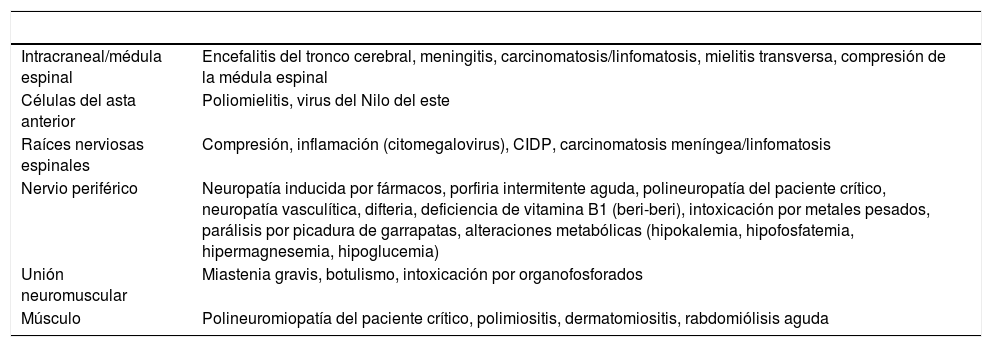
Un caso descartado de SGB es un caso sospechoso en el que durante la investigación se identifica otra patología (diagnóstico diferencial, tabla 5).
Tabla 5.Diagnóstico diferencial del síndrome de Guillain-Barré
Intracraneal/médula espinal Encefalitis del tronco cerebral, meningitis, carcinomatosis/linfomatosis, mielitis transversa, compresión de la médula espinal Células del asta anterior Poliomielitis, virus del Nilo del este Raíces nerviosas espinales Compresión, inflamación (citomegalovirus), CIDP, carcinomatosis meníngea/linfomatosis Nervio periférico Neuropatía inducida por fármacos, porfiria intermitente aguda, polineuropatía del paciente crítico, neuropatía vasculítica, difteria, deficiencia de vitamina B1 (beri-beri), intoxicación por metales pesados, parálisis por picadura de garrapatas, alteraciones metabólicas (hipokalemia, hipofosfatemia, hipermagnesemia, hipoglucemia) Unión neuromuscular Miastenia gravis, botulismo, intoxicación por organofosforados Músculo Polineuromiopatía del paciente crítico, polimiositis, dermatomiositis, rabdomiólisis aguda CIDP: del inglés, polineuropatía crónica desmielinizante inflamatoria.
Tomado de Korinthenberg45.
- 3.
En los pacientes con diagnósticos de sospecha de SGB se sugiere realizar punción lumbar basal para el diagnóstico diferencial o evaluar si existe disociación albúmino-citológica en el líquido cefalorraquídeo o, si el estudio de líquido cefalorraquídeo se realizó en la primera semana de inicio de la enfermedad, para detectar disociación albúmino-citológica se podría repetir el estudio a partir de la segunda semana.
- 4.
Donde y cuando sea posible realizar pruebas de electrofisiología a partir de la segunda semana de inicio de la enfermedad para establecer el diagnóstico de mayor certeza (nivel 1 o 2 de Brighton), tipificar el subtipo (Material adicional 4 y 5) y el pronóstico.
- 5.
Para evaluar la severidad se utilizará la escala de Hughes (Material adicional 6).
En pacientes con SGB de severidad moderada en adelante, se recomienda el tratamiento con plasmaféresis, según disponibilidad y ausencia de contraindicaciones. (Recomendación fuerte a favor. Calidad de evidencia: baja ⊕⊕⊖⊖).
De la evidencia a la decisiónLa plasmaféresis es un procedimiento extracorpóreo mediante el cual se elimina el plasma del paciente para ser sustituido por un líquido de reemplazo (albúmina humana 5% o plasma fresco congelado). Actúa eliminando las sustancias patológicas del compartimento vascular22,23. En el SGB, el tratamiento inmunomodulador mediante plasmaféresis interfiere con la progresión del daño nervioso producido por los autoanticuerpos presentes en el suero del paciente3. Este tratamiento se administra por un equipo multidisciplinario en condiciones hospitalarias siendo el SGB la mayor indicación clínica para su uso en el Perú24. Debido a que es un procedimiento invasivo y se requieren equipos sofisticados para su aplicación25, puede ser un reto optimizar el uso de plasmaféresis en Perú.
Se seleccionó la revisión sistemática de Chevret et al.26 quienes evaluaron la efectividad del tratamiento con plasmaféresis en pacientes diagnosticados con SGB considerando los siguientes desenlaces: mortalidad, infección severa, caminar con ayuda, mejora en un grado de discapacidad, caminar sin ayuda, ventilación mecánica, recuperación completa de la fuerza muscular, secuelas motoras severas y recaídas.
Se encontró que tras el tratamiento con plasmaféresis se incrementó la capacidad de caminar con ayuda después de 4 semanas (RR 1,60; IC del 95%: 1,19-2,15), la capacidad de caminar sin ayuda después de 4 semanas (RR 1,72; IC del 95%: 1,06-2,79), la recuperación completa de la fuerza muscular luego de un año (RR 1,24; IC del 95%: 1,07-1,45), se mejoró en un grado de la escala de Hughes la discapacidad después de 4 semanas (RR 1,64; IC del 95%: 1,37-1,96), se redujo el empleo de ventilación mecánica después de 4 semanas (RR 0,53; IC del 95%: 0,39-0,74) y la presencia de secuelas motoras severas luego de un año (RR 0,65; IC del 95%: 0,44-0,96); sin embargo se incrementó el número de recaídas luego de un año de seguimiento (RR 2,89; IC del 95%: 1,05-7,93). Concluyendo que hay mayores beneficios que riesgos al realizar plasmaféresis en comparación a placebo o tratamiento estándar; por lo que, se consideró emitir una recomendación a favor. Por otro lado, a pesar de que la calidad de la evidencia fue mayormente baja y requiere inversión económica en recursos, el tratamiento con plasmaféresis resulta ser una alternativa modificadora del curso de la enfermedad que sin tratamiento generaría secuelas incapacitantes, por lo que se decidió realizar una recomendación fuerte al respecto.
Puntos de buena práctica clínica- 1.
El tratamiento con plasmaféresis se podría realizar en pacientes con SGB con un tiempo de inicio de los síntomas menor a 4 semanas, preferiblemente dentro de las 2 semanas con enfermedad rápidamente progresiva, quienes no pueden caminar sin ayuda (escala de severidad de Hughes>2) o aquellos que desarrollan debilidad progresiva en musculatura orofaríngea y ventilatoria.
- 2.
En estos casos se podría realizar 4 sesiones de plasmaféresis de manera interdiaria en un periodo de 8 a 10 días. De acuerdo a la evolución del paciente y ante falla o refractariedad podría ampliarse el número de sesiones.
- 3.
La plasmaféresis en pacientes con SGB leve (escala de severidad de Hughes≤2) no ha demostrado generar beneficios a largo plazo.
- 4.
La plasmaféresis se podría realizar tanto con albúmina humana al 5% como con plasma fresco congelado. Si se cuenta con ambas alternativas, preferir el uso de albúmina humana al 5%.
- 5.
Se requiere personal entrenado para la administración apropiada de plasmaféresis.
- 6.
El volumen de plasma recambiado se debe calcular mediante la siguiente fórmula: Volumen de plasma estimado (litros)=0,07×peso (kg)×(1−hematocrito).
En pacientes con SGB de severidad moderada en adelante, se recomienda el tratamiento con plasmaféresis o inmunoglobulina intravenosa, según disponibilidad y ausencia de contraindicaciones. (Recomendación fuerte a favor, calidad de evidencia: moderada ⊕⊕⊕⊖)
De la evidencia a la decisiónEn el SGB, el tratamiento con inmunoglobulina intravenosa interfiere en la progresión del daño nervioso producido por los autoanticuerpos presentes en el suero, por lo cual es una alternativa en el tratamiento de estos pacientes. Su uso es recomendado, al igual que la plasmaféresis27. Su eficacia y seguridad se ha comparado en múltiples estudios frente a la plasmaféresis que resultó ser el estándar de cuidado18.
Se seleccionó la revisión sistemática de Hughes et al.28 donde se evaluó la eficacia y seguridad del tratamiento con inmunoglobulina intravenosa en pacientes diagnosticados con SGB considerando los siguientes desenlaces: mortalidad después de un año, cambios en discapacidad a las 4 semanas, mejora en uno o más grados de discapacidad a las 4 semanas, muerte o discapacidad a los 12 meses, recaída o fluctuación relacionada con el tratamiento, interrupción de tratamiento y eventos adversos atribuidos al tratamiento.
Solo se halló que, luego del tratamiento con inmunoglobulina intravenosa, existe un menor número de pacientes en los que se interrumpió su tratamiento (RR 0,14; IC del 95%: 0,05-0,36). Se concluye que no hay diferencias entre inmunoglobulina intravenosa y plasmaféresis con respecto a los beneficios y riesgos críticos, por lo que se decidió formular una recomendación a favor de ambas intervenciones. Por otro lado, debido a que la evidencia fue de calidad moderada, la aceptabilidad, valores y preferencias van a favor del uso de ambas intervenciones, el GEG-Local decidió realizar una recomendación fuerte al respecto. El GEG-Local consideró que la factibilidad y costos estarían justificados por los beneficios a largo plazo en los pacientes tratados, evitando en ellos el desarrollo de discapacidad con un mayor costo social que esto conllevaría.
Puntos de buena práctica clínica- 1.
El tratamiento con inmunoglobulina intravenosa debería realizarse en pacientes con SGB con inicio de los síntomas de menos de 4 semanas, preferiblemente dentro de las 2 semanas, con enfermedad rápidamente progresiva, que no pueden caminar sin ayuda (escala de gravedad de GBS>2) o aquellos que desarrollan debilidad progresiva en musculatura orofaríngea y ventilatoria.
- 2.
En niñas/os y personas adultas: administrar inmunoglobulina intravenosa a dosis total de 2g/kg en infusión continua. Dividida en: 1g/kg/día por 2 días o 0,4g/kg/día por 5 días. Elegir el esquema de acuerdo con las condiciones clínicas y comorbilidades del paciente.
- 3.
La administración de inmunoglobulina intravenosa posterior a la plasmaféresis no ofrece mayor beneficio en los pacientes con SGB por lo que se debe evitar el uso de ambas terapias en el mismo paciente.
- 4.
En casos de pacientes con fluctuaciones relacionadas con el tratamiento (con mejoría inicial), ya sea con inmunoglobulina intravenosa o plasmaféresis, podría considerarse una nueva administración de inmunoglobulina intravenosa (2g/kg en 2 a 5 días).
- 5.
La inmunoglobulina intravenosa es preferible a la plasmaféresis en personas adultas mayores, por ser más fácil de administrar, mejor tolerada, y ser igualmente eficaz y segura.
En pacientes con SGB no se recomienda el tratamiento con corticoides. (Recomendación fuerte en contra, calidad de evidencia: moderada ⊕⊖⊖⊖).
De la evidencia a la decisiónLos corticoides poseen efectos antiinflamatorios e inmunosupresores. Su acción inmunomoduladora estaría determinada por la acción directa o indirecta de los receptores de glucocorticoides ligados a coactivadores, los cuales se unen al ADN de células del sistema inmunitario (principalmente leucocitos) lo que causa su supresión29,30. Por lo tanto, se espera que reduzcan la inflamación y el consecuente daño en las neuropatías, como se evidenció en algunos experimentos en modelos animales31,32. Sin embargo, estudios posteriores han demostrado que el uso de corticoides genera serios efectos adversos33. Por lo tanto, se decidió incluir esta pregunta clínica en la GPC, para evaluar la eficacia y la seguridad de la corticoterapia en el tratamiento de pacientes diagnosticados con SGB.
Se seleccionó la revisión sistemática de Hughes et al.34 donde se evaluó la efectividad del tratamiento con corticoides en comparación con placebo o tratamiento estándar en pacientes diagnosticados con SGB considerando los siguientes desenlaces: Cambio en el grado de discapacidad, mejora en más de un grado de la escala de severidad de SGB, muerte o discapacidad (incapacidad para caminar sin ayuda), muerte, diabetes mellitus que requiere insulina, hipertensión y nueva infección tratada con antibióticos. Se encontró que, en comparación con el uso de placebo, el tratamiento con corticoides generó un pequeño cambio de la discapacidad después de 4 semanas, clínicamente no significativo (0,17 diferencia de medias más alto; IC95%: 0,06-0,39), una mayor frecuencia de diabetes mellitus como efecto adverso (RR 2,21; IC95% 1,19-4,12) y una menor frecuencia de hipertensión arterial (RR 0,15; IC del 95% 0,05-0,41). Se concluye que hay mayor riesgo y ningún beneficio importante en el uso de corticoides tanto por vía oral como intravenosa en comparación a placebo o tratamiento estándar, por lo que se consideró emitir una recomendación en contra. Además, debido a que la calidad de la evidencia fue mayormente moderada a alta para producir eventos adversos, lo cual generaría un posible gasto innecesario, el GEG-Local decidió realizar una recomendación fuerte al respecto.
Tratamiento de soporte y rehabilitaciónPregunta 5: ¿Es eficaz y seguro el monitoreo continuo y los cuidados intensivos para pacientes con síndrome de Guillain-Barré?RecomendaciónEn pacientes con SGB se recomienda monitorizar e identificar criterios de necesidad de ingreso a unidad de cuidados intensivos (UCI) (Material adicional 7) o ventilación mecánica. (Recomendación fuerte a favor, calidad de evidencia: muy baja ⊕⊖⊖⊖)
De la evidencia a la decisiónLos pacientes con SGB pueden presentar alteraciones en el sistema nervioso autonómico o necesidad de apoyo ventilatorio hasta en un 70% y un 30% respectivamente3,35. El cuidado de los pacientes con SGB incluirá el monitoreo constante de funciones vitales y aquellos que tengan un mayor nivel de severidad deberían ser transferidos a UCI.
Se seleccionó el estudio observacional de Damian et al.36, en el que se analizaron retrospectivamente las diferencias en mortalidad de pacientes con SGB en UCI con diferente nivel de complejidad: UCI neurológicas, UCI con atención neurológica y generales. Se encontró un incremento de mortalidad en los pacientes con SGB tratados en UCI generales en comparación con aquellos tratados en UCI neurológicas (OR 1.23; IC95%: 0,81-1,87), al igual que los pacientes con SGB tratados en UCI con atención neurológica en comparación con aquellos tratados en UCI neurológicas (OR 1,44; IC95%: 0,90-2,30), sin embargo, ambas no fueron estadísticamente significativas.
Se concluye que hay iguales beneficios, sin reportar riesgos, en tratar a pacientes con SGB con criterios de necesidad de ingreso a UCI que se manejen en una UCI general; por lo que, se consideró emitir una recomendación a favor. Además, aunque la calidad de la evidencia fue muy baja, el tratamiento de pacientes con SGB en unidades con monitoreo continuo o UCI (generales o neurológica) requeriría un mayor uso de recursos, y la disponibilidad de UCI neurológicas en Perú es muy baja; el GEG-Local consideró que el paciente con SGB con criterios de ingreso a unidades de monitoreo continuo o ingreso a UCI (generales o neurológicas) se beneficiaría en términos de reducir el riesgo de muerte por lo cual decidió realizar una recomendación fuerte.
Puntos de buena práctica clínica- 1.
El paciente con SGB que se encuentra en UCI debería recibir evaluaciones neurológicas como parte de evaluación y manejo.
- 2.
Al paciente con SGB se recomienda monitorizar la función respiratoria y valorar si cumple criterios o presenta predictores para iniciar ventilación mecánica. (Material adicional 8)
En pacientes con SGB se recomienda el tratamiento preventivo y rehabilitador de las discapacidades, de forma precoz, bajo un enfoque multidisciplinario e integral, con la frecuencia necesaria de acuerdo a las características clínicas y necesidad de cada paciente. (Recomendación condicional a favor, calidad de evidencia: muy baja ⊕⊖⊖⊖).
De la evidencia a la decisiónLas principales secuelas en un paciente con SGB son las motoras, disminuyendo así la capacidad laboral en aproximadamente un 20% de los casos a los 2 años del inicio de la enfermedad37. El tratamiento multidisciplinario (cualquier intervención coordinada por medio de 2 o más disciplinas: fisioterapia, cuidados de enfermería, terapia del lenguaje, trabajo social, terapia psicológica y/o neuropsicológica) tiene como fin el limitar los síntomas del paciente, mejorar la independencia funcional y maximizar la participación del paciente en actividades diarias38. Es necesario optimizar las acciones de rehabilitación en pacientes con SGB, quienes frecuentemente superan el cuadro agudo con alguna discapacidad moderada a severa37.
Se seleccionó 2 revisiones sistemáticas sin metaanálisis: Khan et al.39 y Khan y Amatya40. Estas revisaron estudios observacionales que incluyeron a pacientes con SGB, y evaluaron los efectos en aquellos que recibieron una rehabilitación multidisciplinaria de alta intensidad, en comparación con el de baja intensidad, sobre los desenlaces de limitación de la actividad a los 12 meses y calidad de vida. Se encontró una tendencia a la mejoría en la limitación de la actividad física al incrementarse las puntuaciones «Functional Independence Measure» en diferentes estudios como el de Demir y Koseoglu41, el de Meythaler et al.42 y el de Nicholas et al.43. Además, se evidenció una mejoría en la calidad de vida a los 12 meses en el grupo de pacientes con SGB que recibieron tratamiento multidisciplinario, con reducción de 23 a 13 puntos en el puntaje de las escalas «Environmental Status Scale» y de 19 a 10 puntos en la «Handicap Assessment Scale», ambas escalas que miden el nivel de discapacidad.
Se concluye que hay mayores beneficios que riesgos en administrar tratamiento rehabilitador multidisciplinario; el GEG-Local consideró emitir una recomendación a favor. Además, debido a que la calidad de la evidencia fue muy baja y que estas intervenciones podrían incrementar el uso de recursos, la recomendación fue condicional.
Puntos de buena práctica clínica- 1.
Para el manejo del dolor, el tratamiento rehabilitador multidisciplinario podría ser beneficioso. Sin embargo, el paciente con SGB debería recibir tratamiento de dolor según su necesidad y de acuerdo a los protocolos locales.
- 2.
Para prevenir el desarrollo de úlceras por presión, el tratamiento rehabilitador multidisciplinario podría ser beneficioso. Sin embargo, al paciente con SGB se le debería prevenir o tratar las úlceras por presión según su necesidad y de acuerdo a los protocolos locales.
- 3.
Para prevenir la trombosis venosa profunda, el tratamiento rehabilitador multidisciplinario podría ser beneficioso. Sin embargo, al paciente con SGB se le debería prevenir el desarrollo de trombosis venosa profunda mediante tratamiento profiláctico según su necesidad y de acuerdo a los protocolos locales.
Todos los autores participaron en la realización de la guía. CAD, NM, KPB, VVR, ORT, CAHR y CAAR se encargaron de las búsquedas sistemáticas y la evaluación de calidad de los estudios para cada pregunta. Todos los autores participaron en la discusión de los estudios encontrados y la formulación de las recomendaciones y puntos de buenas prácticas clínicas. Todos los autores revisaron y aprobaron la versión final del artículo.
FinanciaciónEl documento técnico de donde se ha elaborado esta versión ha sido financiado por el Instituto Nacional de Ciencias Neurológicas, INCN, Lima, Perú.
Conflicto de interesesLos responsables de la elaboración del presente documento declaran no tener ningún conflicto de interés financiero y no financiero, con relación a los temas descritos en el presente documento.
Expresamos nuestro agradecimiento a Mg. Charles Huamaní Saldaña, médico neurológo, Hospital Nacional Adolfo Guevara Velasco, Essalud, Cusco, Perú, por la revisión que realizó a la presente guía, y a Mg. Josmel Pacheco-Mendoza, Médico veterinario especialista en bibliotecología, Universidad San Ignacio de Loyola por la asesoría en las revisiones sistemáticas.
Los archivos del material suplementario están disponibles a través del pedido al autor corresponsal (CAD).