La forma inflamatoria de angiopatía amiloide cerebral es una presentación recientemente descrita y poco frecuente. Produce deterioro cognitivo, crisis epilépticas, signos neurológicos focales y cefalea.
Caso clínicoMujer de 73 años, con cuadro de 3 meses de evolución consistente en alteración del lenguaje, crisis epiléptica y encefalopatía. La resonancia magnética de encéfalo evidenció una imagen extensa en la región temporooccipital izquierda. Se realizó biopsia cerebral y tratamiento inmunosupresor, con buena respuesta. El estudio anatomopatológico reveló la presencia de angiopatía amiloide cerebral.
ConclusionesEsta enfermedad debe ser incluida en el diagnóstico diferencial ante un cuadro de encefalopatía aguda o subaguda en pacientes de edad avanzada.
The inflammatory form of cerebral amyloid angiopathy is a recently described and not very frequent presentation. It manifests with cognitive decline, seizures, focal neurological signs and headaches.
Clinical caseA 73 year old woman presents in the last 3 months language disorder, seizures and encephalopaty. Cerebral magnetic resonance showed extensive image in left temporo-occipital region. Cerebral biopsy and immunosupresor treatment was done, with good response. The pathologic study showed the presence of cerebral amyloid angiopathy.
ConclusionsThe inflammatory form of cerebral amyloid angiopathy must be included in the deferential diagnosis in cases of acute or subacute encefalopathy in elderly patients.
La angiopatía amiloide cerebral (AAC) esporádica es una enfermedad común que afecta a los vasos de pequeño calibre del cerebro. Se caracteriza por el depósito progresivo de proteína beta-amiloide en la pared de las arterias de mediano y pequeño tamaño, arteriolas y capilares de la corteza cerebral y de las leptomeninges adyacentes1,2. El principal factor de riesgo conocido es la edad avanzada. Según estudios basados en autopsias, la prevalencia en pacientes de edad avanzada sin demencia es del 20-40%, y en pacientes con demencia, del 50-60%1. Los alelos de apolipoproteína E son el único factor de riesgo genético conocido para la AAC esporádica1. La manifestación clínica más frecuente es la hemorragia intracerebral espontánea1,2. Recientemente, se ha descrito una forma de presentación inflamatoria de la angiopatía amiloide cerebral (I-AAC)3, en la cual se produce una respuesta autoinmune, con inflamación vascular o perivascular de los vasos sanguíneos que contienen depósitos de beta-amiloide1,3,4. Solo existen series de casos reportados, con aproximadamente 70 casos descritos en la bibliografía5. Clínicamente se puede manifestar como un cuadro de inicio agudo o subagudo con deterioro cognitivo, crisis epilépticas, déficit neurológico focal o cefalea1,2,4,5. El genotipo épsilon 4-épsilon 4 de la apolipoproteína E se presenta con más frecuencia asociado a esta forma de presentación de AAC2,4. En la resonancia magnética (RM) de cerebro se presenta con múltiples imágenes hiperintensas en secuencias T2 y FLAIR, parcheadas o confluentes, con distribución asimétrica, localizadas en la sustancia blanca subcortical y con menos frecuencia comprometiendo la región cortical adyacente, en uno o más territorios lobares (frontal, parietal, temporal y occipital), con microhemorragias en la región corticosubcortical en secuencia eco de gradiente (T2*-GRE), sin restricción en difusión en secuencia ADC, consistente con edema vasogénico, pudiendo presentarse con o sin realce con gadolinio3–6. En el líquido cefalorraquídeo pueden encontrarse hallazgos inespecíficos, como pleocitosis y/o hiperproteinorraquia3,5. Chung et al. propusieron unos criterios diagnósticos en el año 2011 para el diagnóstico de I-AAC (tabla 1)5. El diagnóstico de I-AAC definitiva se realiza mediante biopsia de cerebro y leptomeninges, donde se observa el depósito de amiloide vascular acompañado de cambios inflamatorios perivasculares, intramurales o transmurales, con o sin formación de granulomas, con o sin células gigantes multinucleadas2,3,5. El diagnóstico de I-AAC probable se realiza sin necesidad de la biopsia cerebral, con base en el cuadro clínico y los hallazgos radiológicos característicos en las imágenes de RM de cerebro5. Presenta, en general, buena respuesta al tratamiento inmunosupresor, el cual se lleva a cabo con corticoides u otro inmunosupresor (ciclofosfamida, metotrexato, micofenolato de mofetilo), con mejoría clínica y radiológica en la mayoría de los casos (70-75%) luego de 1-3 semanas del inicio del tratamiento, de forma completa o parcial2–5. La duración óptima del tratamiento aún debe ser determinada, pero debe basarse en la respuesta clínica y radiológica5. El pronóstico es, en general, favorable, con un curso evolutivo monofásico una vez realizado el tratamiento, aunque en algunos casos se presentan recidivas luego de la suspensión del tratamiento inmunosupresor4,5.
Criterios diagnósticos propuestos para inflamación asociada a angiopatía amiloide cerebral
| I-AAC probableTodos los siguientes:1. Inicio agudo o subagudo de los síntomas2. Edad igual o mayor a 40 años3. Al menos uno de los siguientes hallazgos clínicos: cefalea, cambios en el estado mental o en la conducta, signos neurológicos focales y crisis epilépticas4. RM de cerebro con imágenes parcheadas o confluentes hiperintensas en secuencias T2 y FLAIR, que son:a. Usualmente asimétricasb. Con o sin efecto de masac. Con o sin realce con contraste en parénquima o leptomeninges5. Evidencia de ACC preexistente en secuencia SWI de RM:a. Hemorragias o microhemorragias corticales y subcorticales múltiples y/ob. Hemorragia lobar reciente o pasada6. Ausencia de neoplasia, infección u otra causa |
| I-AAC definitivaTodos los anteriores más confirmación histopatológica con:1. Inflamación perivascular, transmural y/o intramural2. Depósito de amiloide en los vasos en la corteza y las leptomeninges del área afectada |
I-ACC: inflamación asociada a angiopatía amiloide cerebral; RM: resonancia magnética.
Criterios diagnósticos propuestos por Chung et al. en el año 2011.
Paciente de sexo femenino, de 73 años de edad, con antecedentes de poliquistosis renal severa, insuficiencia renal crónica sin requerimiento de hemodiálisis, anemia crónica e hipertensión arterial, en tratamiento con enalapril 10mg/día y eritropoyetina humana (aplicaciones cada 5-10 días).
Presentó cuadro de aproximadamente 3 meses de evolución, de curso progresivo, inicialmente con alteración del lenguaje (anomias) y bradipsiquia, con dificultad creciente para realizar sus actividades habituales, temblor leve en ambas manos y trastorno de ansiedad, sin otros cambios conductuales. En el interrogatorio dirigido no refirió cuadro infeccioso o vacunación reciente. Tampoco presentó registros febriles, cefalea o vómitos.
En el examen neurológico se evidenció la presencia de anomias (sin parafasias), ligera inestabilidad en la prueba de Romberg, temblor postural y cinético leve y simétrico en los miembros superiores, sin otros hallazgos de relevancia. Obtuvo 26/30 puntos en el Mini-Examen del Estado Mental y 10/10 puntos en el test del reloj.
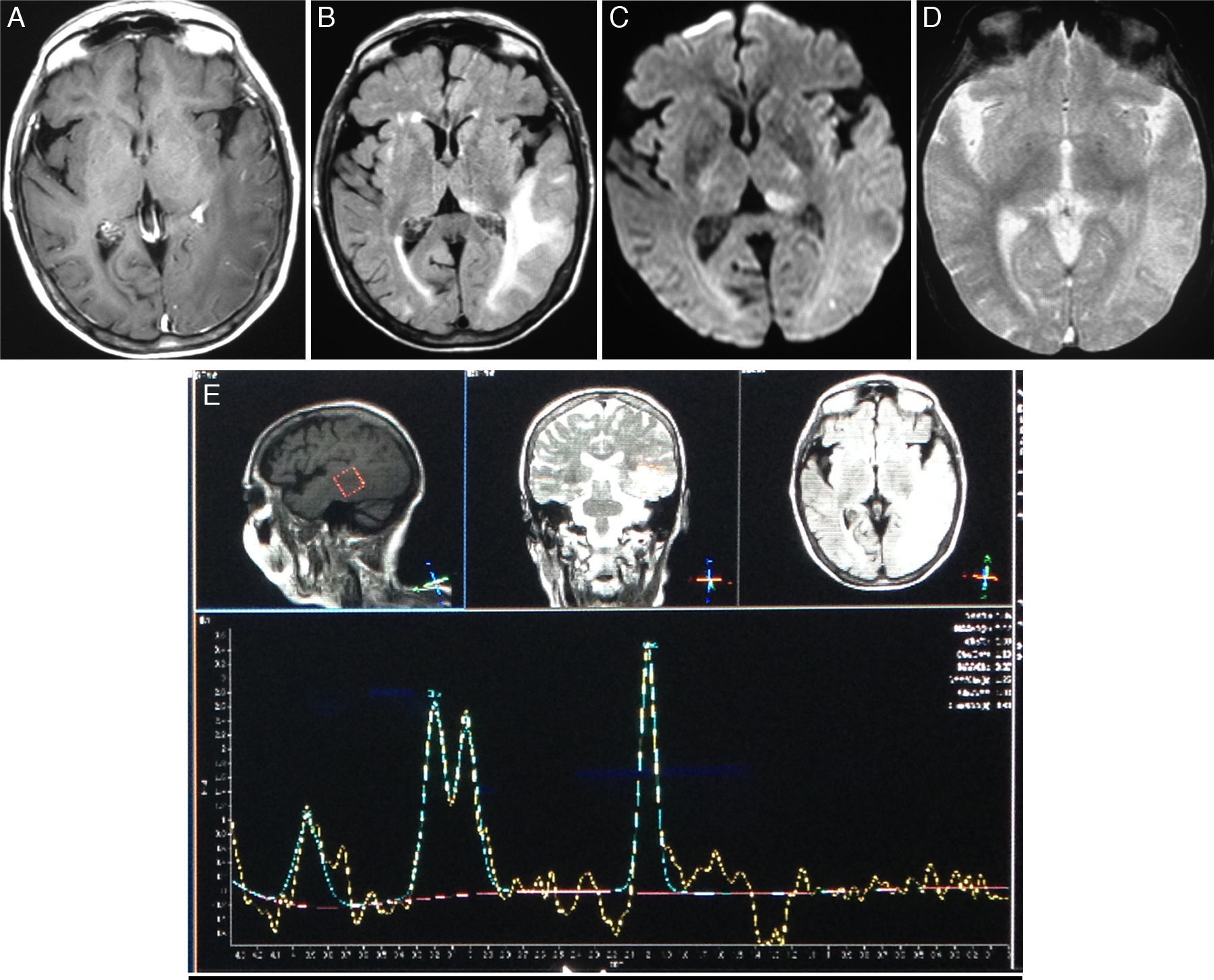
En la RM de encéfalo (fig. 1) se evidenció una imagen extensa a nivel subcortical temporooccipital izquierdo, hiperintensa en secuencias T2 y FLAIR e hipointensa en secuencia T1, con leve refuerzo leptomeníngeo con el gadolinio, aisladas áreas focales de restricción y ligero efecto de masa por compresión de los espacios subaracnoideos corticales y el atrio ventricular adyacentes. No se hallaron imágenes compatibles con microhemorragias en secuencia eco de gradiente (T2*-GRE). En secuencia de angiorresonancia de vasos intracraneales se observó una imagen nodular compatible con aneurisma sacular de 10mm a nivel de la bifurcación de la arteria cerebral media izquierda, y otra imagen de similares características compatible con aneurisma de 3mm en la bifurcación de la arteria cerebral media derecha.
Resonancia magnética de cerebro.
Cortes axiales en secuencias T1 con gadolinio (A), FLAIR (B), DWI (C), T2-GRE (D) y espectroscopía monovoxel con TE de 136ms (E).
Se observa una extensa lesión subcortical temporooccipital izquierda con señal hipointensa en T1 e hiperintensa en FLAIR asociada a un aumento del refuerzo leptomeníngeo con el contraste y efecto de masa por colapso de los surcos corticales adyacentes. Además, se aprecian múltiples señales puntiformes hiperintensas en FLAIR en la sustancia blanca subcortical y lobular frontal bilateralmente y occipital derecha.
En la secuencia de difusión solo existen áreas focales de restricción en el lóbulo occipital y el pulvinar a izquierda.
No se observan microhemorragias en la secuencia T2*-GRE.
En la curva espectroscópica se observa un descenso de la relación N-acetil-aspartato/creatina, sin cambios significativos en la relación colina/creatina. Es evidente un doblete negativo en 1,3ppm compatible con lactato.
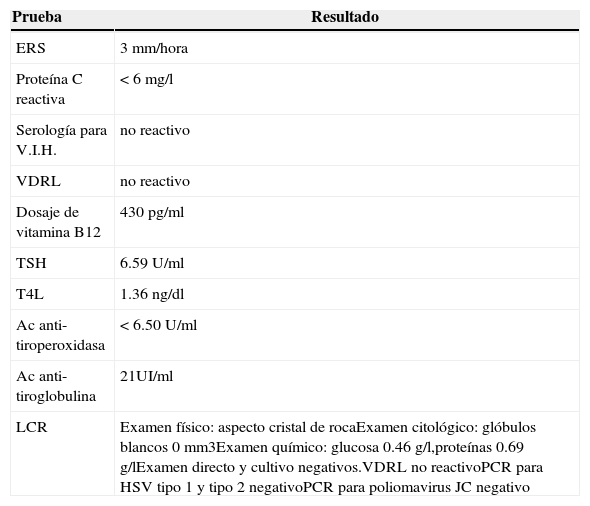
Los exámenes de laboratorio (en sangre y en líquido cefalorraquídeo) realizados se muestran en la tabla 2.
Exámenes de laboratorio
| Prueba | Resultado |
|---|---|
| ERS | 3 mm/hora |
| Proteína C reactiva | < 6 mg/l |
| Serología para V.I.H. | no reactivo |
| VDRL | no reactivo |
| Dosaje de vitamina B12 | 430 pg/ml |
| TSH | 6.59 U/ml |
| T4L | 1.36 ng/dl |
| Ac anti-tiroperoxidasa | < 6.50 U/ml |
| Ac anti-tiroglobulina | 21UI/ml |
| LCR | Examen físico: aspecto cristal de rocaExamen citológico: glóbulos blancos 0 mm3Examen químico: glucosa 0.46 g/l,proteínas 0.69 g/lExamen directo y cultivo negativos.VDRL no reactivoPCR para HSV tipo 1 y tipo 2 negativoPCR para poliomavirus JC negativo |
ERS: Eritrosedimentación; V.I.H.: virus de la inmunodeficiencia humana; VDRL: Venereal Disease Research Laboratory; TSH: tirotrofina; T4L: Tiroxina libre; LCR: Líquido cefalorraquídeo; PCR: reacción en cadena de la polimerasa; HSV: virus Herpes Simple.
Presentó un episodio compatible con crisis epiléptica (crisis parcial compleja secundariamente generalizada), que cedió con diazepam por vía intravenosa. Se inició tratamiento con fenitoína (100mg/8h). En las 48h siguientes el cuadro progresó con afasia mixta severa y, posteriormente, nivel de conciencia fluctuante, con períodos durante los cuales presentaba apertura ocular al estímulo verbal, respuesta verbal con emisión de sonidos incomprensibles y respuesta motora de localización al estímulo doloroso, con episodios de excitación psicomotriz, por lo que ingresó en la Unidad de Terapia Intensiva.
Se realizó tomografía axial computarizada de tórax, abdomen y pelvis con doble contraste, sin hallarse imagen compatible con neoplasia.
Se realizó una RM de encéfalo con espectroscopía (fig. 1), en la que se evidenció un descenso del pico de N-acetil-aspartato y de la relación N-acetil-aspartato/creatina, con presencia de lactato. No se observan cambios significativos en el pico de colina.
Se realizó una biopsia de cerebro y meninges, y se inició tratamiento empírico con pulso de corticoides en altas dosis por vía intravenosa (metilprednisolona 1g/día durante 5 días), luego de lo cual se continuó con un descenso progresivo de los corticoides con meprednisona por vía oral. La paciente presentó una mejoría del cuadro de forma gradual.
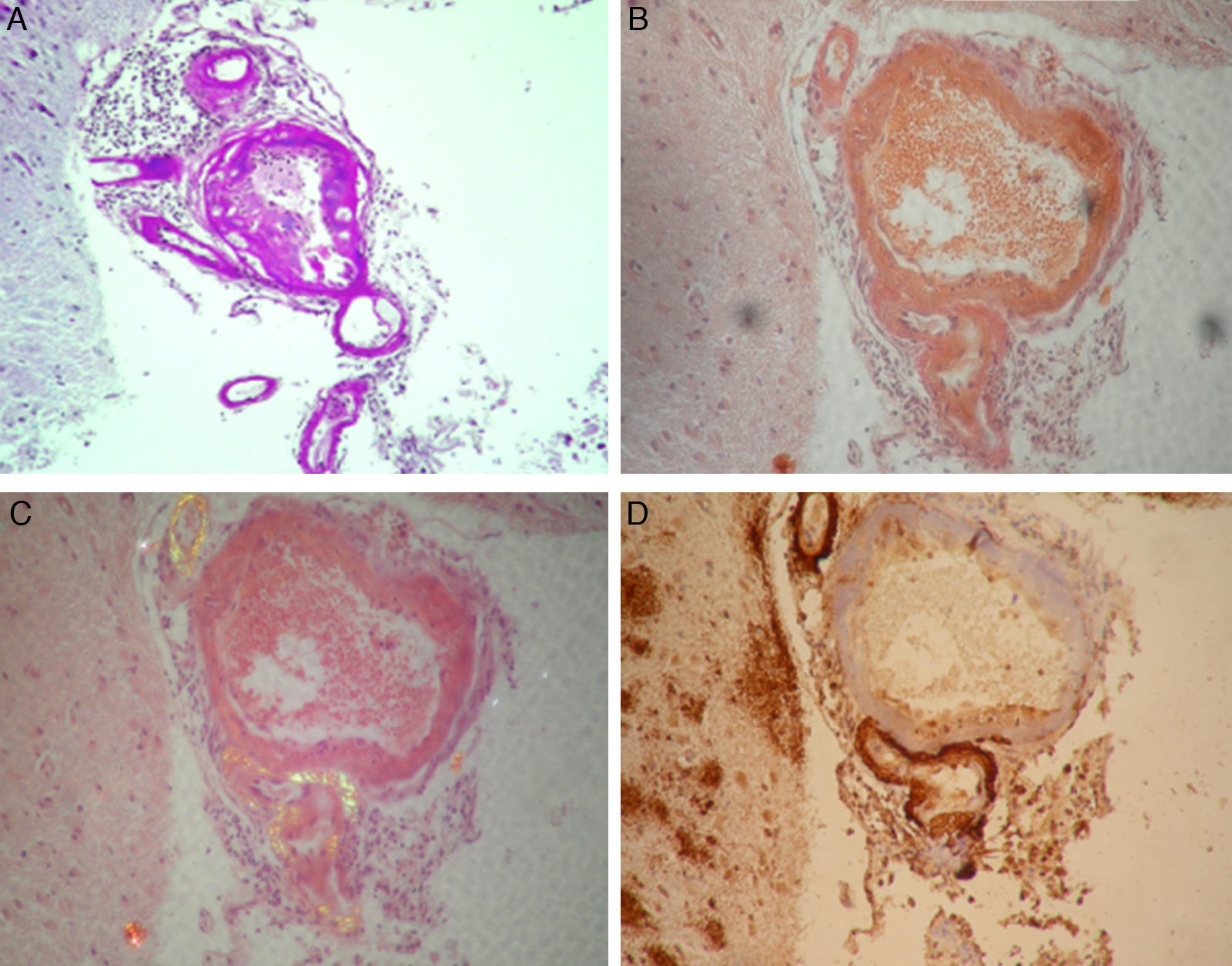
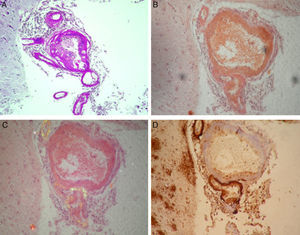
En el estudio anatomopatológico (fig. 2) se encontraron hallazgos compatibles con AAC, con algunos vasos trombosados e inflamación agregada, y un extenso depósito de beta-amiloide vascular y en placas a nivel cortical.
Anatomía Patológica. A. Vasos leptomeníngeos con infiltrado inflamatorio perivascular y de pared vascular (PAS, ×100). B. Vasos leptomeníngeos con infiltrado inflamatorio perivascular y de pared vascular (Rojo Congo, ×200). C. Vasos leptomeníngeos con infiltrado inflamatorio perivascular y de pared vascular (Rojo Congo polarizado, áreas con polarización amarillo verdosa, ×200). D. Vasos leptomeníngeos con infiltrado inflamatorio perivascular y de pared vascular, con placas de beta-amiloide en la corteza cerebral (inmunomarcación beta-amiloide, ×200).
En la RM de cerebro de control realizada se observó la resolución completa de la lesión extensa localizada en el lóbulo temporooccipital izquierdo previamente descrita.
El diagnóstico final fue de I-AAC. La paciente fue dada de alta luego de un mes de internación, con afasia de expresión moderada, y no se repitieron las crisis epilépticas.
ComentariosSe ha expuesto el caso de una paciente con I-AAC, la cual es una forma de presentación infrecuente de una enfermedad relativamente habitual. Consideramos que ante un cuadro de encefalopatía de evolución aguda o subaguda en un/a paciente de edad avanzada, esta enfermedad debe ser incluida entre los diagnósticos diferenciales, aun si no se observan microhemorragias en la secuencia T2*-GRE en la RM de cerebro, ya que es una de las causas potencialmente tratables de deterioro cognitivo rápidamente progresivo7. Tanto en el artículo publicado por Kinnecom et al. como en el de Chung et al. se propone la posibilidad de realizar el diagnóstico de I-AAC sin efectuar la biopsia cerebral, basándose en el cuadro clínico típico y en las imágenes de RM de cerebro características, e iniciar tratamiento inmunosupresor empírico con corticoides en altas dosis, reconsiderando la necesidad de biopsia cerebral si hubiera una falla de respuesta dentro de las 3 semanas del inicio del mismo4,5. En esta paciente, al igual que en el caso descrito por Sakaguchi et al.8, no se observaron imágenes compatibles con microhemorragias en la secuencia eco de gradiente (T2*-GRE) de RM de cerebro, por lo que no se podrían aplicar los criterios diagnósticos propuestos para el diagnóstico de I-AAC probable. Esto demuestra que en algunos casos es imprescindible la realización de una biopsia cerebral.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener conflicto de intereses relacionado con el contenido de esta publicación.
Se agradece la colaboración al Dr. Sergio Gonorazky y al Dr. Matías Landi.