La mano afectada en un accidente cerebrovascular es de muy difícil recuperación. Muy pocos pacientes logran un uso independiente.
ObjetivoExaminar los efectos de la movilización activa-pasiva bilateral en la mano hemipléjica de forma previa al tratamiento de reeducación, para condicionar los hemisferios cerebrales a una mejor respuesta.
Materiales y métodosCatorce pacientes con más de 6 meses de evolución del accidente cerebro vascular (promedio 36 meses) fueron sometidos a un tratamiento convencional de reeducación de la mano durante un mes. Seguidamente, durante otro mes, al mismo grupo se los trató durante 15 min, 3 veces por semana con automovilización activa-pasiva bilateral, previo al mismo tratamiento de reeducación usando un instrumental diseñado para ese propósito. Se los volvió a evaluar luego de la intervención y a los 2 meses de finalizada la terapia, para estudiar la retención.
ResultadoLas escalas utilizadas pre y post intervención mostraron una significativa mejoría. Fugl Mayer Assessment (FMA) miembro superior (p<0.001). Wolf Motor Function Test tiempo (WMFTT) (p<0.003), Wolf Motor Function Test calidad (WMFTC) (p<0.000). La Stroke Impact Scale (SIS) no mostró cambios significativos (p<0.084) Escala Visual Analógica (EVA) (p<0.000).y La Fuerza de Prensión (FP) mostró: (p<0,038).
ConclusionesTodos los pacientes mejoraron con el tratamiento convencional preintervención. La mejoría fue mayor postintervención y esta se mantuvo luego de 2 meses (retención).
Recovering the affected hand in stroke patients is very difficult, and few patients attain an independent use of it.
ObjectiveTo assess whether the conditioning of cerebral hemispheres through active-passive automobilization of the affected hand leads to better results in the subsequent conventional rehabilitation treatment.
Material and methodsA group of 14 patients with stroke underwent conventional hand re-education therapy for a month at least six months before admission (average 36 months). Later on, the same group was treated for 15minutes three times a week for another month with active-passive bilateral automobilization using a purpose-built instrument, prior to the same conventional reeducation treatment. Then each patient was reevaluated after two months without treatment in order to assess retention. To assess changes after the intervention, we used the following scales: Fugl Mayer Assessment upper limb, Wolf Motor Function Test time, Wolf Motor Function Test Quality, Visual Analog Scale, Stroke Impact Scale.
ResultsPre- and post-intervention scale values showed significant improvement: Fugl Mayer Assessment upper limb, P<0.001; Wolf Motor Function Test time, P<0.003; Wolf MotorFunction Test Quality, P<0.000; Visual Analog Scale, P<0.000. Stroke Impact Scale (SIS) showed no significant changes P<0.084, and grip strength showed P<.0.038.
ConclusionsAll patients improved with conventional treatment pre-intervention. The improvement was greater post-intervention and it was maintained for 2 months (retention).
La recuperación de la función de la mano luego de un accidente cerebro vascular (ACV) es incompleta y el 66% de los pacientes, con tratamiento convencional, no logran una aceptable función de la misma luego de 6 meses1,2. En el adulto sano, las cortezas motoras primarias de ambos hemisferios están balanceadas3. La activación de la corteza de un hemisferio inhibe la corteza contra lateral vía cuerpo calloso y así previene los movimientos en espejo3 En el paciente con ACV disminuye la excitabilidad del lado lesionado y aumenta la del lado sano4, lo cual produce una aumento del déficit de la función de la mano. Se han ensayado distintas técnicas de tratamiento que conducen a balancear la excitabilidad de ambas cortezas. Parecería que aquellas que conducen a aumentar la excitabilidad del lado lesionado han resultado más eficaces5. Una revisión sistemática6 demuestra que el entrenamiento intensivo en una tarea específica produce los mejores resultados.
Por otro lado, está muy cuestionado el término «meseta» que significa que el paciente con ACV crónico llegó a un punto en su tratamiento que no se beneficia más con los ejercicios7,8. Muchas investigaciones sugieren que otras técnicas innovadoras, con nuevos parámetros y modalidades distintas de las convencionales, producen una mejoría funcional en pacientes con ACV de más de 6 meses de evolución8,9.
Algunas de las estrategias de tratamiento ensayadas para balancear la excitabilidad interhemisférica y recrear circuitos neuronales ocultos son: la robótica10, los entornos virtuales11, la estimulación eléctrica o magnética transcraneal12, la estimulación eléctrica sensitivo-motora13, la restricción del miembro sano14 y la neurofarmacología15. Numerosas investigaciones demostraron que el cerebro humano posee la capacidad de activar distintas regiones durante la recuperación luego de una lesión16. Todas estas estrategias de rehabilitación pretenden explotar estos mecanismos para llevarlos a la práctica clínica y mejorar la funcionalidad de los pacientes.
En este ensayo se trata de evaluar los resultados de la movilización activa-pasiva bilateral en pacientes hemipléjicos adultos por ACV, con marcado déficit en el uso de la mano. Se pretende influir en el balance de las cortezas motoras como preacondicionamiento (neuromodulación) cerebral, antes de realizar una reeducación con actividades específicas, influyendo sobre la reorganización de redes neuronales17,18.
Consiste en efectuar una automovilización bilateral en flexoextensión de la muñeca, con dedos en extensión (en espejo) durante 15 min, previo a realizar un entrenamiento unilateral con actividades funcionales3. En estudios previos, ha sido demostrada la influencia de la flexoextensión pasiva de muñeca en la modulación de la excitabilidad de las cortezas motoras mediante vías supraespinales19,20.
Material y métodoDiseño experimental no aleatorizado, pre-post.
MuestraFueron seleccionados 25 pacientes con un único episodio de ACV y con déficit importante de la función de la mano. Todos habían completado el programa de rehabilitación convencional; 7 pacientes no cumplieron los criterios de inclusión y 4 no completaron la totalidad del ensayo. Total: 14 pacientes.
Los criterios de inclusión fueron: a) pacientes con más de 6 meses de evolución; b) espasticidad ≤ 2 de la escala Ashworth modificada (AM); c) algunos movimientos voluntarios antigravitacionales en hombro y/o extensores de muñeca o dedos; d) sin retracciones fijas; e) sensibilidad conservada o disminuida, evaluada con ítems de sensibilidad de la escala Fugl Mayer Assessment (FMA), y f) buena capacidad de entendimiento.
Los criterios de exclusión fueron: a) inestabilidad clínica; b) dolor en mano o brazo afectado; c) implantes metálicos; d) antecedentes de fracturas previas en miembros superiores, y e) alteraciones emocionales importantes.
Protocolo aprobado por el Comité de Ética e investigación del Centro de Educación Médica e Investigaciones Clínicas (CEMIC) el 14 de junio del 2012.
Mediciones: luego de aceptar el consentimiento informado, adherido a la Declaración de Helsinki y posteriores enmiendas, en todos los pacientes se aplicaron las siguientes escalas de medición:
- 1.
FMA21 abreviada para miembro superior (21 ítems) que incluyen muñeca, mano, coordinación y sensibilidad, y su confiabilidad fue demostrada22-24. Esta escala fue seleccionada porque mide deficiencias25. Máximo puntaje motor = 30, máximo puntaje sensitivo = 12. Puntaje total = 42. Puntaje más alto indica menor discapacidad.
- 2.
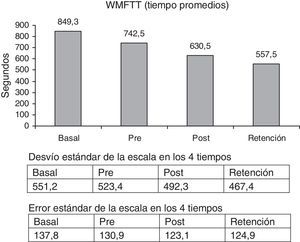
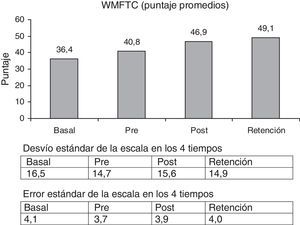
Wolf Motor Function Test (WMFT)26. Esta escala fue seleccionada porque mide la capacidad funcional y parece ser más precisa que otras27. Consta de 15 ítems. Presenta 2 secciones: a) medición del tiempo de ejecución para cada actividad (WMFTT) total normal 29 s, a menor puntaje, mejor función, y b) mide la calidad del movimiento (WMFTC) (puntaje total normal = 75); a mayor puntaje, mejor función.
- 3.
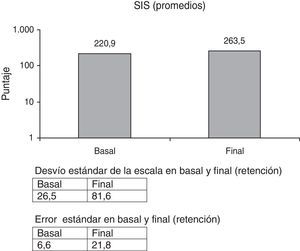
Stroke Impact Scale (SIS) cuestionario autoadministrado, que mide el impacto de la afección en las actividades básicas cotidianas, también validada28.
- 4.
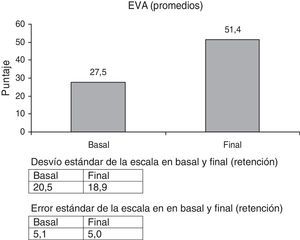
Escala visual analógica (EVA) sobre la percepción por el paciente del estado funcional de la mano.
- 5.
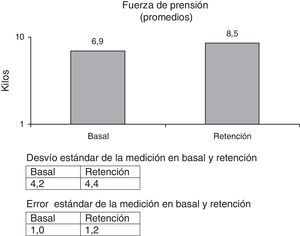
Fuerza de prensión (FP). Medida con dinamómetro digital CAMRY, previamente calibrado.
Se eligieron estas escalas porque son ampliamente difundidas y la confiabilidad interobservador y su validez han sido demostradas.
IntervenciónPrimera etapa: luego de realizadas las mediciones de las escalas de evaluación mencionadas en el rubro «Mediciones», todos los pacientes concurrieron al Servicio de Terapia Ocupacional (TO) 3 veces por semana, durante 45 min, donde practicaban una serie de actividades manuales, preestablecidas, que debían repetir en su hogar durante media hora 2 veces por día. La forma de hacerlo fue enseñada por la terapista ocupacional según un instructivo estándar (véase el anexo). La TO controló la correcta ejecución de estas actividades y guio el progreso según la complejidad.
Segunda etapa: a las 4 semanas se reevaluaron con las escalas FMA y WMFT, para detectar si hubo cambios. Seguidamente, se continuó otras 4 semanas el mismo plan pero agregando, previo a las actividades de TO 15 min de automovilización activa-pasiva de muñeca con dedos en extensión, movimientos rítmicos, a velocidad constante, de manera que no haya fatiga (intervención). A tal efecto, se diseñó un aparato especial (fig. 1), en el cual se colocan las 2 manos (afectada y sana) en posición neutra, con dedos extendidos, y permite que el movimiento de la mano sana (flexo-extensión de muñeca), efectuado por el mismo paciente, se transmita, mediante un sistema de acoplamiento, a la mano enferma en forma de espejo. El paciente se encuentra sentado con los antebrazos apoyados en una mesa. Los pacientes decidieron la velocidad adecuada con la cual se sentían cómodos. Durante las primeras 2 semanas se lo instruyó para que con su mano sana movilice la afectada. Las últimas 2 semanas se trató de que con la mano afectada movilice la sana.
Al terminar el mes se realizó nueva evaluación con las escalas antedichas, de manera que la duración total de la prueba fue de 2 meses.
Tercera etapa: durante los 2 meses siguientes, sin intervención, el paciente siguió con sus tareas o tratamientos habituales, pidiéndosele que incremente el uso de su mano.
Cuarta etapa: luego de transcurridos los 2 meses se realizó una nueva medición con las mismas escalas, para investigar la retención de lo ganado.
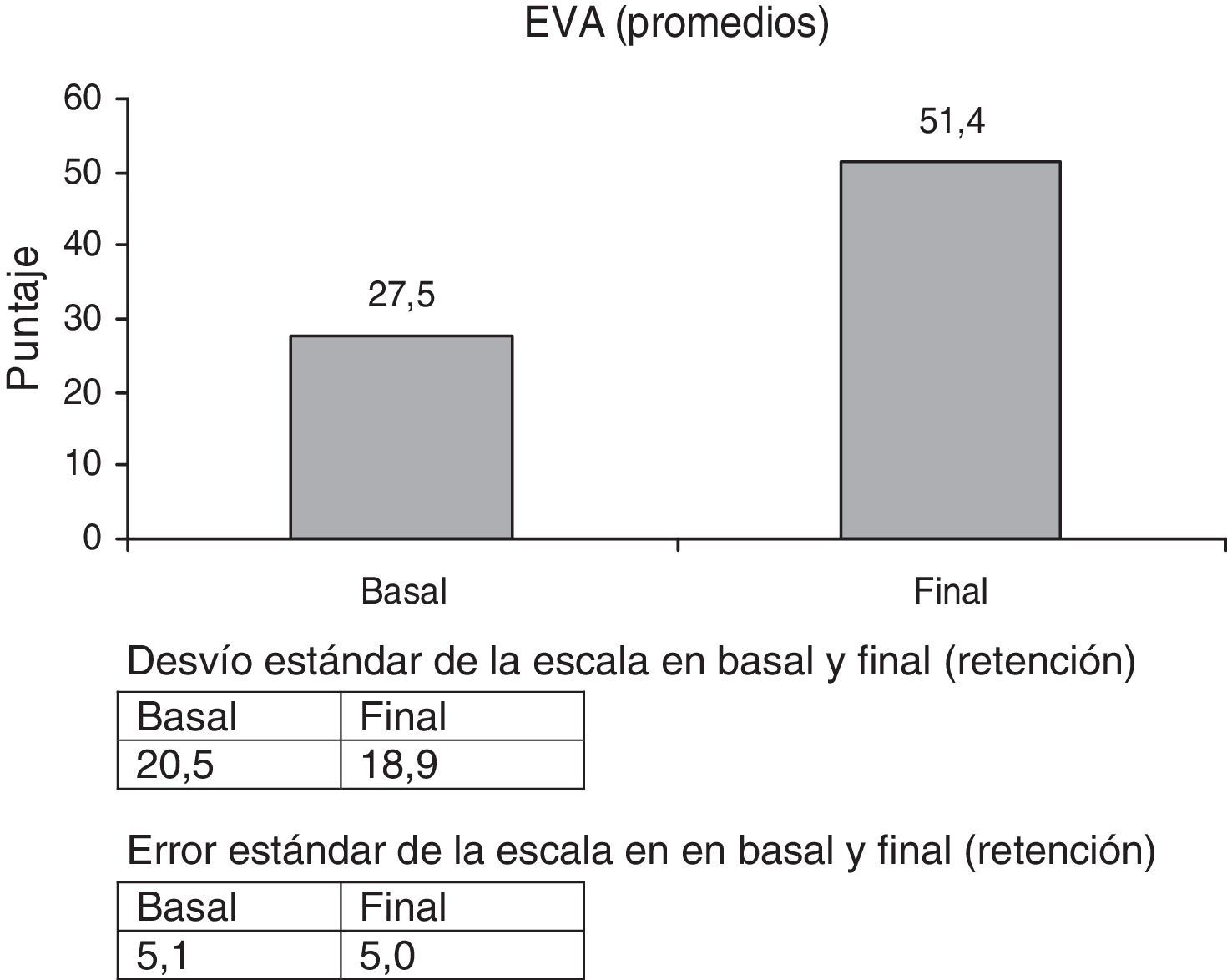
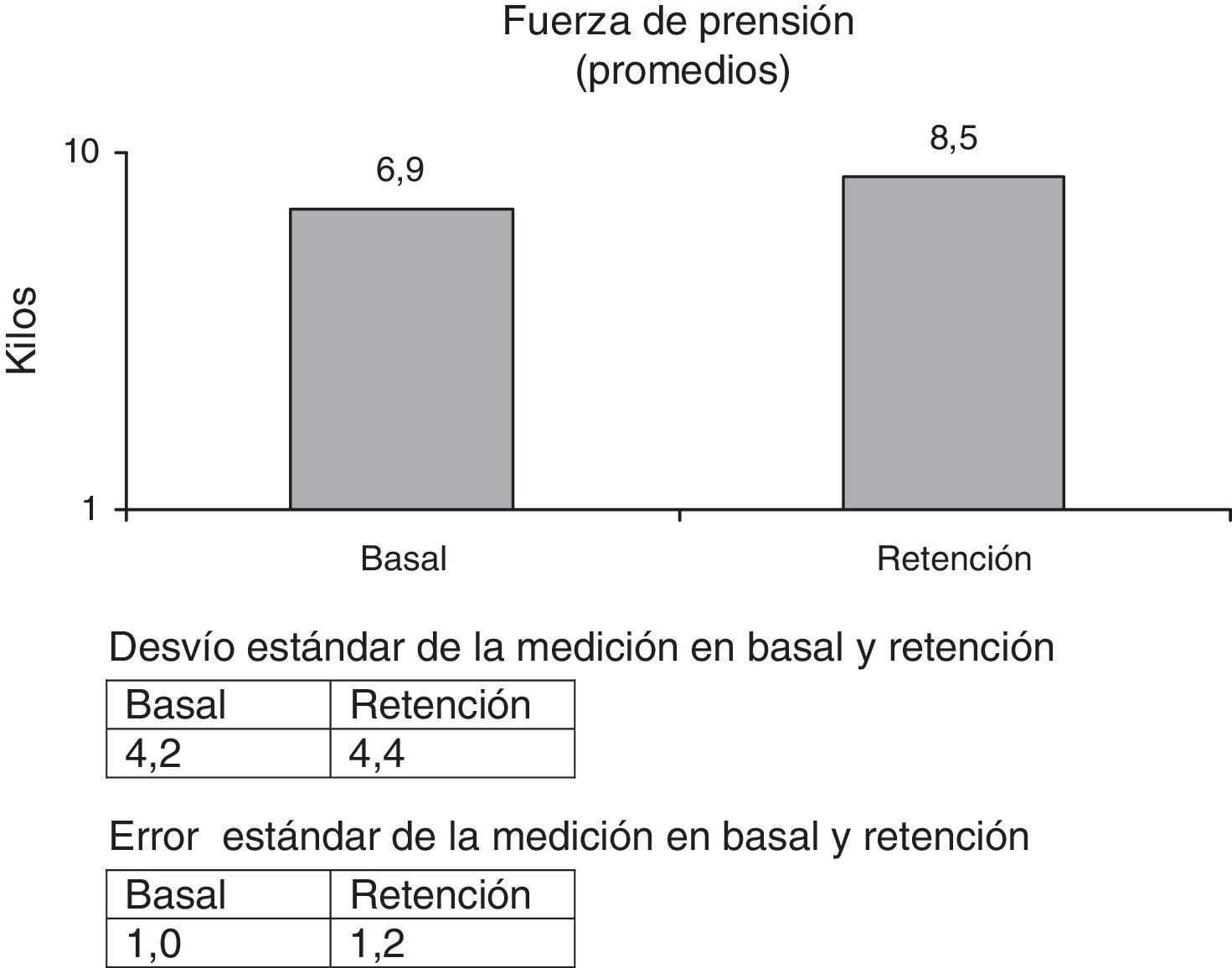
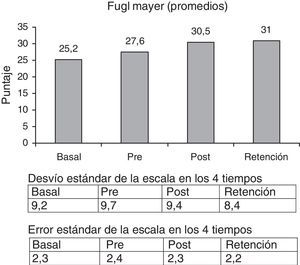
Las escalas fueron tomadas al inicio de la primera etapa (basal), al inicio de la segunda (pre), al término de la segunda (post) y luego de 8 semanas sin intervención (retención), a excepción de EVA, SIS y FP, que se tomaron en basal y retención.
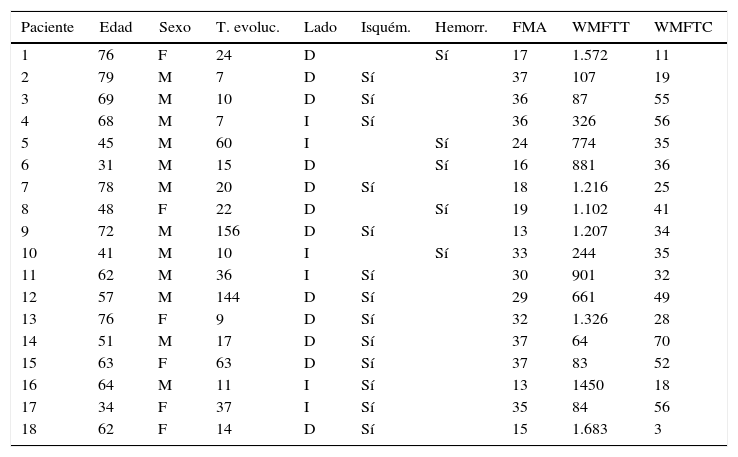
En la tabla 1 se muestran las características de los pacientes.
Puntaje basal de escalas
| Paciente | Edad | Sexo | T. evoluc. | Lado | Isquém. | Hemorr. | FMA | WMFTT | WMFTC |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 76 | F | 24 | D | Sí | 17 | 1.572 | 11 | |
| 2 | 79 | M | 7 | D | Sí | 37 | 107 | 19 | |
| 3 | 69 | M | 10 | D | Sí | 36 | 87 | 55 | |
| 4 | 68 | M | 7 | I | Sí | 36 | 326 | 56 | |
| 5 | 45 | M | 60 | I | Sí | 24 | 774 | 35 | |
| 6 | 31 | M | 15 | D | Sí | 16 | 881 | 36 | |
| 7 | 78 | M | 20 | D | Sí | 18 | 1.216 | 25 | |
| 8 | 48 | F | 22 | D | Sí | 19 | 1.102 | 41 | |
| 9 | 72 | M | 156 | D | Sí | 13 | 1.207 | 34 | |
| 10 | 41 | M | 10 | I | Sí | 33 | 244 | 35 | |
| 11 | 62 | M | 36 | I | Sí | 30 | 901 | 32 | |
| 12 | 57 | M | 144 | D | Sí | 29 | 661 | 49 | |
| 13 | 76 | F | 9 | D | Sí | 32 | 1.326 | 28 | |
| 14 | 51 | M | 17 | D | Sí | 37 | 64 | 70 | |
| 15 | 63 | F | 63 | D | Sí | 37 | 83 | 52 | |
| 16 | 64 | M | 11 | I | Sí | 13 | 1450 | 18 | |
| 17 | 34 | F | 37 | I | Sí | 35 | 84 | 56 | |
| 18 | 62 | F | 14 | D | Sí | 15 | 1.683 | 3 |
T. evoluc.: tiempo de evolución en meses.
Los pacientes N.° 2 y 14: no completaron tratamiento.
Los pacientes N.° 15 y 16: completaron las 3 primeras etapas.
Se obtuvieron promedios ± desviación estándar para describir las variables continuas analizadas. El efecto se examinó a través de un modelo de regresión que evalúa si la escala cambia en función del tiempo (variable predictiva).
ResultadosLos resultados de las escalas en basal, pre, post y retención se muestran en las figuras 2–7.
Uno de los pacientes fue eliminado del ensayo por incumplimiento en la asistencia (pacienten.° 2). Un paciente (n.° 14) no completó la 2.ª etapa (intervención). Dos pacientes completaron la etapa de intervención, pero no concurrieron a los 2 meses para evaluar retención por enfermedad intercurrente (pacientesn.° 15 y 16).
Durante la evaluación basal 13 pacientes tenían algún movimiento voluntario antigravitacional en flexoabducción de hombro y 7 en extensores de muñeca.
Comparados con la evaluación inicial, todos los pacientes mejoraron su funcionalidad y discapacidad, como queda demostrado por los resultados del FMA, WMFT, EVA y FP efectuadas postintervención y a los 2 meses. La única escala que no mostró cambios significativos fue la SIS.
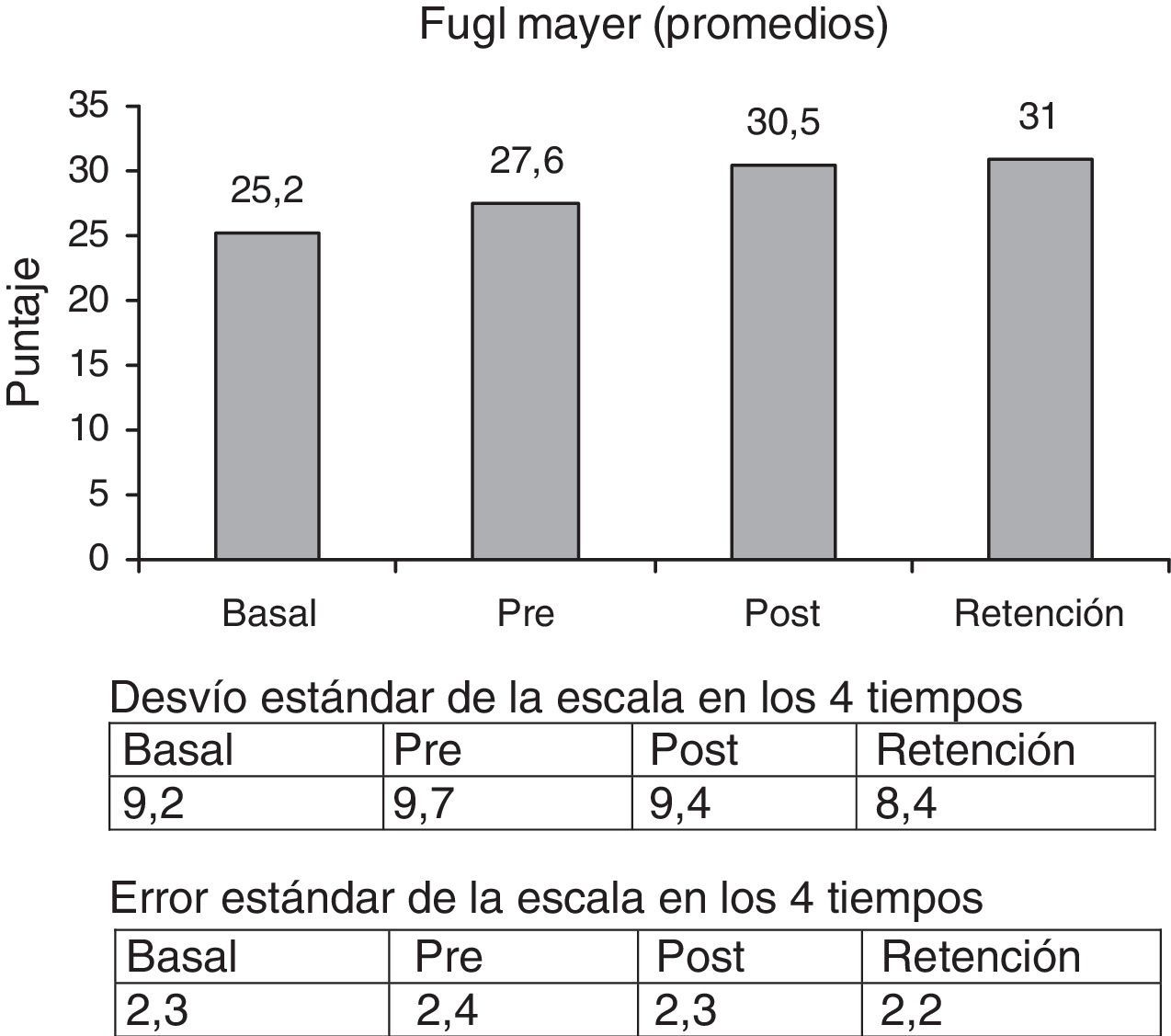
La escala FMA se incrementó un 23% comparando la medición basal y la retención (p<0,001) (fig. 2).
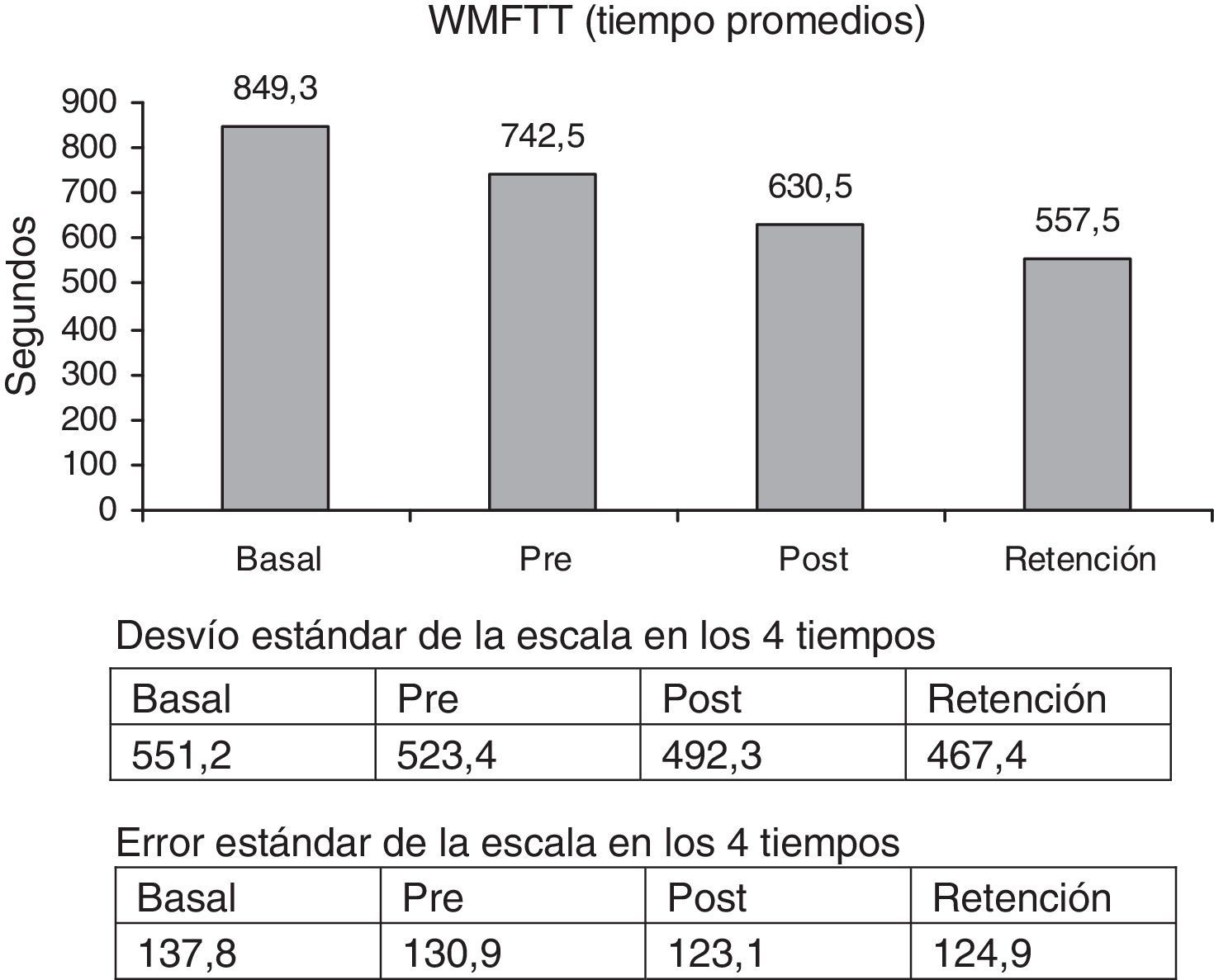
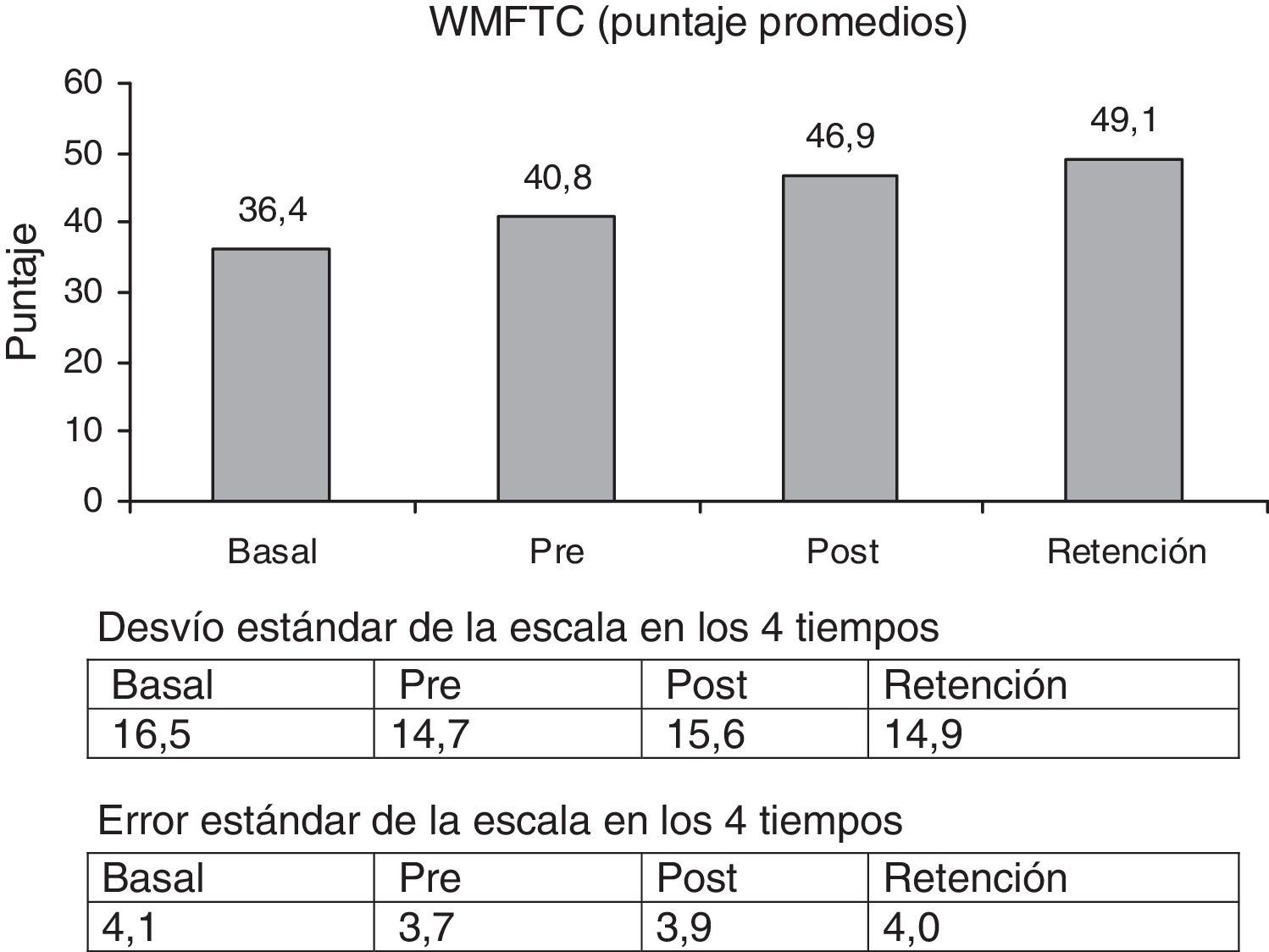
La escala WMFTT mostró una significante mejoría entre la medición basal y la retención, 52,4% (p<0,003). La escala WMFTC mostró un 34,8% de mejoría (figs. 3 y 4) (p<0,000).
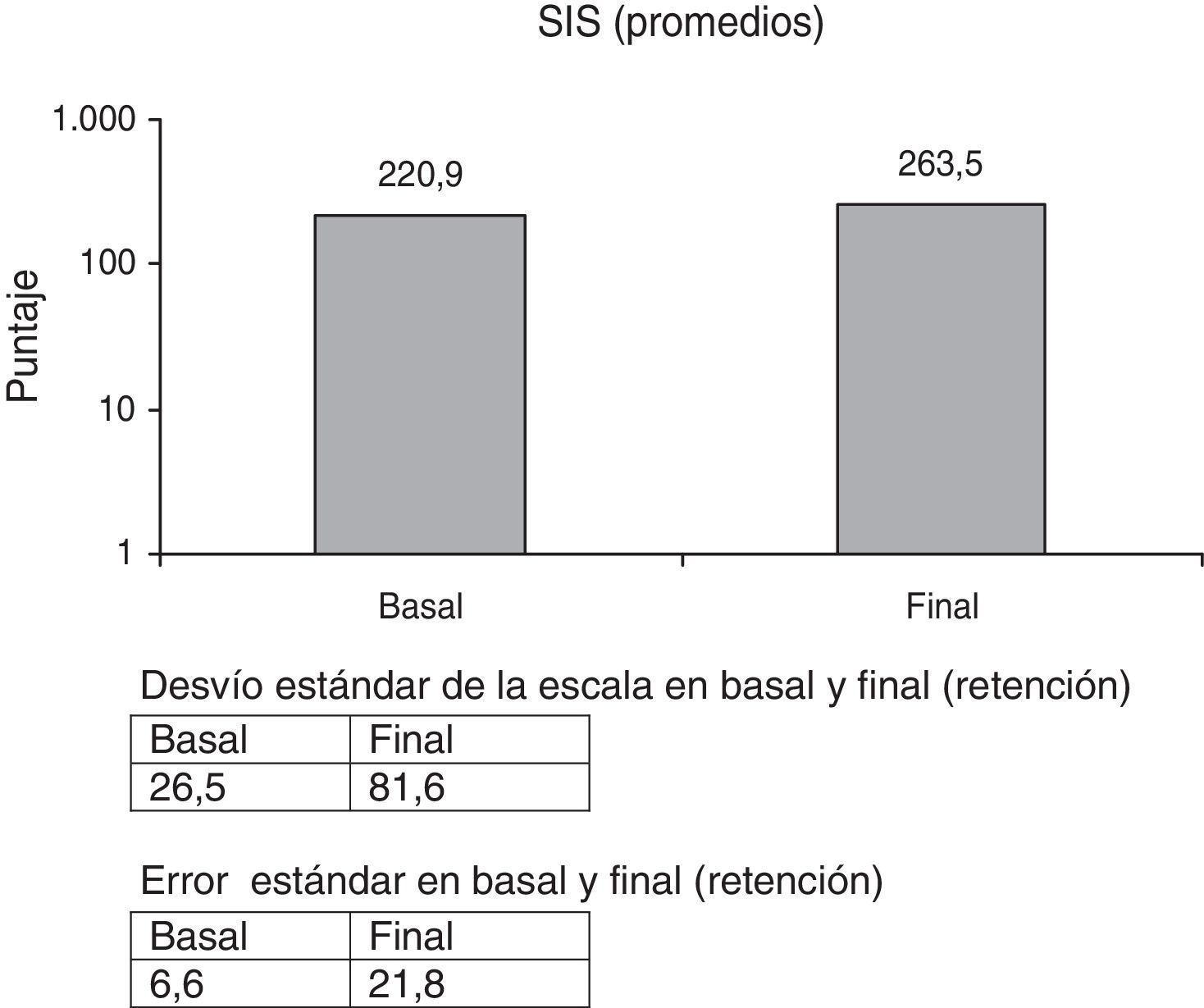
En la escala SIS (fig. 5), cuyos ítems son muy subjetivos, no hubo cambios significativos, 19,3% (p<0,084). Iguales resultados reflejan otros trabajos32.
La percepción del paciente sobre el uso de la mano, escala EVA, evidenció un valor muy alto de mejoría, 86,9%. (p<0,000) (fig. 6). Fue notable la expresión de los pacientes: «ahora puedo agarrar más cosas», «me resulta más fácil el uso de la mano para muchas actividades».
La FP se incrementó en un 23,2%, siendo el valor de p<0,038.
Comparando los porcentaje de aumento de las escalas pre y retención, las cifras fueron las siguientes: FM = 12,3% (p<0,001); WMFTT = 33,2% (p < 0,003) y WMFTC = 22,5% (p<0,000).
Se estudió la posible influencia de la edad en los resultados de las diferentes escalas, dividiendo a los pacientes entre mayores y menores de 60 años. Se calcularon los porcentajes entre la medición basal y la final (retención) y también entre la medición preintervención y la retención. Los resultados se muestran en la tabla 2.
Porcentaje de mejoría según las edades en diferentes escalas
| Escala de FM | ||
|---|---|---|
| Basal-retención | Pre-retención | |
| Más de 60 años | 25 | 11 |
| Menos de 60 años | 15,3 | 7 |
| Escala WMFTT | ||
|---|---|---|
| Basal-retención | Pre-retención | |
| Más de 60 | 41 | 26,2 |
| Menos de 60 | 67 | 37,3 |
| Escala WMFTC | ||
|---|---|---|
| Basal-retención | Pre-retención | |
| Más de 60 | 57 | 18,9 |
| Menos de 60 | 26 | 23,9 |
También se calculó el porcentaje de mejoría en pacientes más deteriorados (puntaje FM menor de 20) y los menos deteriorados (puntaje FM mayor de 20), mostrando los resultados en la tabla 3.
En todos los pacientes reclutados la mano dominante fue la derecha.
DiscusiónLa reeducación repetitiva intensiva con tareas específicas puede mejorar la función de la mano en paciente con ACV crónico29. Este estudio examina el efecto de la movilización activa-pasiva bilateral en espejo de la mano, previo a realizar con la misma una tarea específica de utilización con el objetivo de influir en la corteza motora, balanceando la excitabilidad. En nuestro ensayo, de los 14 pacientes, 7 tenían puntaje de escala FM menor de 20, lo cual significa una importante discapacidad. Los mismos presentaron un promedio de mejoría, de la movilidad de la mano, del 44%, contra 15,6% del resto (puntaje FM mayor a 20). Esto concuerda con las investigaciones de otros autores que encontraron que los pacientes más deteriorados mejoraron más que los menos deteriorados en los movimientos de la mano30. Esta discrepancia se explica porque un puntaje bajo de FM (pacientes más deteriorados), al ganar pocos puntos, en porcentaje puede ser alto, comparado con los menos deteriorados. El resultados de esta investigación es coincidente, pero la función de la mano mejoró más en los menos deteriorados, como lo demuestra el resultado de las escalas WMFTT y WMFTC (mejor movilidad no equivale a mejor función)31,32.
En la escala WMFTT los pacientes con escala FM mayor de 20 mejoraron en un promedio de 152% contra 50% del resto. Esto se interpreta que la velocidad de ejecución de una tarea mejoró mucho más en pacientes menos lesionados (FM mayor de 20).
En la escala de WMFTC los pacientes con FM menor a 20 mejoraron un 23% contra el 33% del resto.
Es de destacar que el promedio del tiempo de evolución de los pacientes fue de 36 meses (3 años), lo cual significa que presentaban una lesión ya estabilizada.
La escala SIS aumentó, pero no significativamente comparada con los valores basales (fig. 5).
Fue notable la mejoría en la percepción de los pacientes del uso de la mano (escala EVA) (fig. 6).
Los pacientes realizaban siempre la misma tarea en las etapas basal-pre y pre-post, con el agregado de que en esta última eran precedidas por la automovilización activa-pasiva durante 15 min. La terapista elegía la tarea según la complejidad y las posibilidades del uso de la mano y progresando a tareas más complejas (véase el anexo).
Según la edad, el porcentaje de mejoría en la escala FM fue mayor en pacientes por encima de 60 años que en los de menos de 60 (tabla 2). Lo mismo ocurrió en los que presentaban un FM menor de 20 (más deteriorados) (tabla 3). En las escalas WMFTT y WMFTC el porcentaje de mejoría fue mayor en pacientes más jóvenes y menos deteriorados (menores de 60 años y FM mayor de 20) (tablas 2 y 3).
Todos los pacientes, en distintas proporciones, mejoraron en la etapa inicial preintervención, con la práctica de las tareas específicas, lo cual significa que tenían un potencial remanente para estimular. La mejoría fue mayor luego de la intervención (figs. 2-4).
Este estudio mostró que la automovilización activa-pasiva, previa a una terapia de reeducación específica, puede mejorar el uso de la mano en pacientes hemipléjicos y debería tenerse en cuenta, como tratamiento, en casos subagudos y crónicos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener conflictos de intereses.
Juan Gili, estadígrafo del Instituto de Investigaciones del CEMIC, por su valiosa colaboración.
El paciente debe estar sentado cómodamente frente a una mesa en una silla sin apoyabrazos. Es conveniente que un familiar presencie la sesión para que lo pueda asistir en su hogar. En todas las actividades que el paciente realice parcialmente la TO o familiar podrá asistirlo.
- 1.
Llevar el brazo a la mesa y empujar un objeto de un lado a otro con y sin visión.
- 2.
Mover un objeto colocado en la mano por la TO sobre la mesa.
- 3.
Lo mismo pero moviendo el brazo en el espacio.
- 4.
Colocar una toalla enrollada en la mano del paciente y traccionar hacia un lado y pedirle que la suelte.
- 5.
Tomar y soltar un cilindro parado sobre su base.
- 6.
Mantener un frasco en la mano y desenroscar la tapa con la sana.
- 7.
Mantener un objeto en la mano y mover pulgar hacia arriba y abajo.
- 8.
Pasar objetos de una mano a otra (diferentes tamaños y consistencia).
- 9.
Agarrar y elevar una bolsa de (arroz, porotos, maíz, etc.) desde la mesa.
- 10.
Agarrar la toalla enrollada elevarla algo y soltarla.
- 11.
Juego del pescador.
- 12.
Tomar y soltar una caja de fósforos.
- 13.
Rotar la caja de fósforos en la mano.
- 14.
Abrir y cerrar un alfiler de gancho grande (8cm).