El Comité de Anemia de la SLANH fue creado en 2007 con el objetivo primario de promover el adecuado tratamiento de la anemia en el paciente con ERC en LA, pretendiendo así reducir la morbimortalidad y mejorar la calidad de vida de estos enfermos. Para ello se consideró necesario unificar los criterios diagnósticos y de tratamiento a través de la elaboración y difusión de una guía latinoamericana para el tratamiento de la anemia en pacientes con ERC. Así es como se publicaron en 2009 las «Recomendaciones de práctica clínica de la Sociedad Latinoamericana de Nefrología e Hipertensión (SLANH) para el tratamiento de la anemia en el paciente con ERC. Ese documento surgió de la revisión, por un grupo de expertos de diversos países de nuestro continente, de los trabajos científicos publicados hasta ese momento, así como de las GPC regionales e internacionales vigentes. Se procuró que el compendio de esa información resultara de fácil lectura, con sugerencias prácticas sobre el diagnóstico y el tratamiento de la anemia del paciente con ERC que pudieran ser aplicables en los países de LA.
La nueva actualización de 2017 fue creada, de manera similar a la publicación anterior, por un grupo de expertos nefrólogos en anemia de diversos países del nuestro continente. Esta nueva publicación presenta a los nefrólogos y médicos de LA que asisten pacientes con ERC un documento de apoyo igualmente práctico pero suficientemente actualizado que ofrece recomendaciones sobre el diagnóstico y los tratamientos más efectivos para los pacientes adultos portadores de ERC con anemia en cualquier etapa evolutiva de la enfermedad. No son considerados aspectos específicos relacionados al manejo de la anemia en niños, en pacientes embarazadas ni en portadores de un trasplante renal funcionante, así como no pretende asumir situaciones clínicas complejas o no habituales.
The Anaemia Committee of the SLANH was created in 2007 with the primary objective of promoting the adequate treatment of anaemia in the patient with chronic kidney (CKD) disease in Latin America, aiming to support the reduction of the morbidity, mortality and also improve the quality of life of these patients. Therefore, it was considered necessary to unify the diagnostic and treatment criteria through the preparation of a guideline for the treatment of anaemia, which led to the “Clinical Practice Recommendations of the Latin American Society of Nephrology and Hypertension (SLANH) for the treatment of anaemia in patients with chronic kidney disease” that was published in 2009.
The new 2017 upgrade “Recommendations for the study and treatment of anaemia in patients with chronic kidney disease” was developed by a group of anaemia experts from different countries of our continent. This guideline offers a supporting and easy reading document to nephrologists and physicians who attend CKD patients. It also contains practical suggestions of the latest recommendations on diagnosis and the more effective new treatments for adult patients with anaemia at any stage in the progression of the CKD. Specific aspects related to the management of anaemia in children and pregnant patients, or patients with a functioning renal transplant are not considered, nor is it intended to include complex or unusual clinical situations.
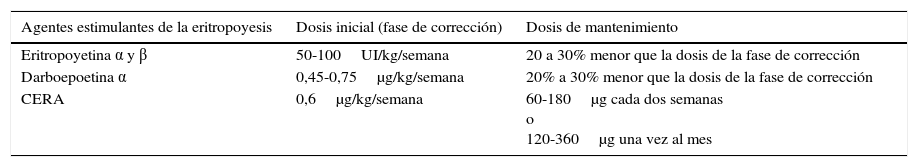
agentes estimuladores de la eritropoyesis
Appraisal of Guidelines for Research and Evaluation
aplasia pura de células rojas
accidente vascular encefálico
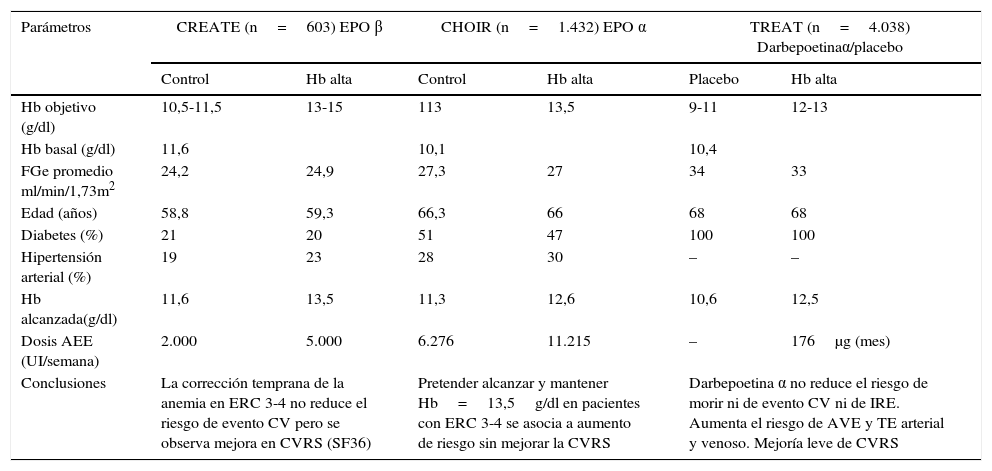
Correction of Hemoglobin and Outcomes in Renal Insufficiency
calidad de vida relacionada con la salud
diálisis peritoneal
eritropoyetina recombinante humana
European Renal Best Practice
enfermedad renal crónica
enfermedad renal crónica que no está en diálisis
Food and Drug Administration
filtrado glomerular estimado
guías de buena práctica clínica
Grading of Recommendations, Assessment, Development and Evaluations
hemoglobina
hemodiálisis
hipertensión arterial
intravenoso
Kidney Disease Improving Global Outcomes
Kidney Disease Outcomes Quality Iniciative
Latinoamérica
no diálisis
National Institute for Health and Care Excellence
subcutáneo
Sociedad Latinoamericana de Nefrología e Hipertensión
sobre el nivel del mar
tratamiento renal sustitutivo
porcentaje de saturación de transferrina
Trial to Reduce Cardiovascular Events with Aranesp Therapy
vía oral