Desde la introducción de la terapia antirretroviral de gran actividad en 1996, la historia natural de la infección por el VIH ha cambiado por completo. Hasta entonces, la prescripción de medicación para la prevención de infecciones oportunistas y de antivirales en mono o biterapia permitió retrasar pero no evitar el desenlace fatal al que estaban abocados los pacientes infectados por el VIH. Sin embargo, la recuperación inmunológica propiciada por la terapia triple es de tal grado que ha transformado la infección por el VIH en un proceso crónico, comparable de algún modo al del diabético que recibe insulina. En ambos casos (sida y diabetes), las manifestaciones clínicas no se hacen aparentes en tanto en cuanto el paciente tome escrupulosamente la medicación prescrita. De todos modos, dada la gran variabilidad genética del VIH, el control de la replicación viral se reduce con el tiempo y nuevas combinaciones de fármacos deben sustituir a las previas, con el fin de mantener el beneficio terapéutico.
La potencia antiviral de la medicación es directamente proporcional al grado de exposición de los viriones en los diferentes compartimientos del organismo. Allí donde las dosis de los fármacos sean insuficientes habrá escape viral y selección de virus resistentes que, de forma progresiva, tenderán a reemplazar a la población viral original. Se comprende así que la monitorización de las dosis de fármacos en la circulación y las pruebas de resistencias1,2 constituyan un requerimiento creciente en el manejo de los pacientes infectados por VIH.
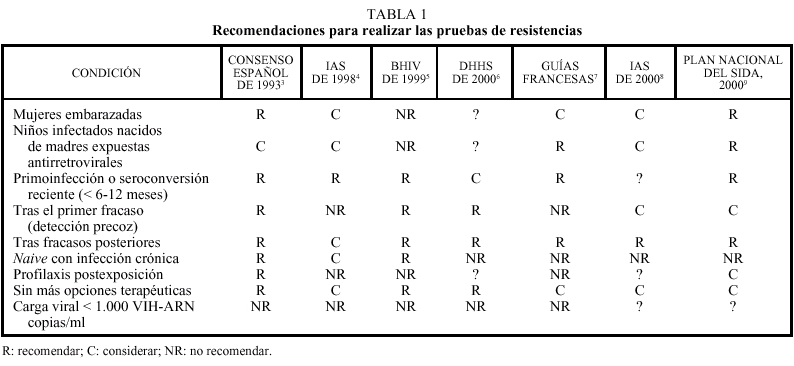
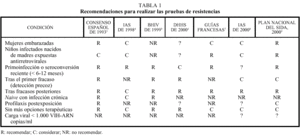
En marzo de 2000 tuvo lugar en Madrid una reunión de expertos para debatir las diferentes situaciones clínicas en las cuales las pruebas de resistencias pueden ser de utilidad. Esta reunión fue precedida de otra similar el año anterior3 y de otras realizadas por diferentes grupos de expertos en otros países (tabla 1)4-9. La prioridad de recomendar los tests de resistencias se estableció para 5 situaciones, mientras que en otras la conveniencia de estas pruebas fue considerada como relativa o, en algunos casos, contraindicada (tabla 2)10. A continuación
se discuten en detalle cada una de estas situaciones clínicas.
Mujeres gestantes VIH+
La administración de antirretrovirales durante la gestación, y sobre todo en el momento del parto y las primeras semanas de vida del bebé, ha reducido drásticamente la transmisión vertical del VIH. Una máxima supresión de la carga viral en el momento del nacimiento parece ser el principal determinante de este efecto protectivo del tratamiento. Aunque los estudios prospectivos y aleatorizados que han demostrado este beneficio se limitan a zidovudina y nevirapina, es probable que sea igualmente aplicable a todos los antirretrovirales. Si se reconocen resistencias a los fármacos utilizados durante la gestación, es de esperar que ocurra un rebrote en la carga viral y que se exponga al bebé a un mayor riesgo de infección por el VIH. La transmisión de virus resistentes a los recién nacidos de madres infectadas está bien documentada10. Puesto que un manejo apropiado de la mujer embarazada permite reducir al máximo la transmisión maternofetal del VIH, el panel consideró que las pruebas de resistencias deben realizarse a todas las gestantes VIH + con carga viral detectable. La recomendación se extiende no sólo a aquellas mujeres que toman medicación sino también a las que son naive y deben iniciarla. La justificación del test en esta última situación se basa en el reconocimiento de tasas de resistencias primarias del 5 al 15% en muchos países desarrollados, entre ellos España11-13. El riesgo de una respuesta insuficiente tras prescribir tratamiento empíricamente no es aceptable en el contexto de la prevención de la transmisión vertical.
Niños nacidos (e infectados) de madres VIH+
El número de recién nacidos de madres VIH+ que adquieren la infección se ha reducido a cifras inferiores al 1-3% en los países desarrollados. Sin embargo, en los pocos que se infectan a partir de madres expuestas a medicación antirretroviral durante la gestación, el riesgo de transmisión de virus resistentes es más elevado10. El tratamiento antirretroviral es prescrito precozmente a los recién nacidos que son diagnosticados de infección por el VIH, dado que la progresión a sida es rápida en muchos de ellos. Por tanto, el éxito de la primera combinación terapéutica es realmente crucial para el pronóstico de estos niños infectados. El panel consideró que los tests de resistencias deben realizarse a todos los recién nacidos que adquieren la infección VIH por vía vertical. Como ocurría con las madres VIH+, la recomendación se extiende también a los bebés cuyas madres no habían sido expuestas a medicación antirretroviral, puesto que la tasa de resistencias en la población naive es relativamente elevada en nuestro entorno14-21.
Primoinfección o seroconversión reciente
La transmisión de virus con resistencia a ZDV fue descrita por vez primera en 1992, en un sujeto con una primoinfección por el VIH tras una relación homosexual de riesgo. Desde entonces, la transmisión de virus resistentes ha sido bien documentada por diferentes vías de transmisión y se ha extendido a otros fármacos distintos de la ZDV, como lamivudina, nevirapina y los inhibidores de la proteasa. Recientemente, se han comunicado casos de transmisión de virus multirresistentes, lo cual supone un grave problema de salud pública.
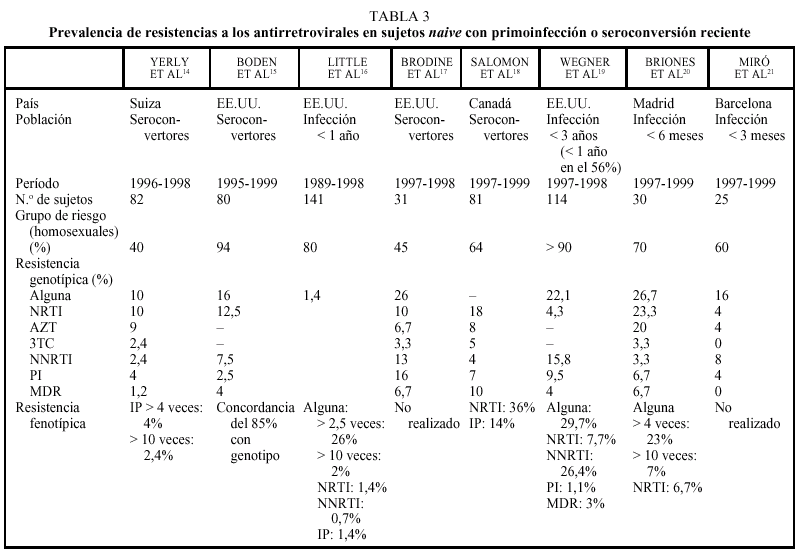
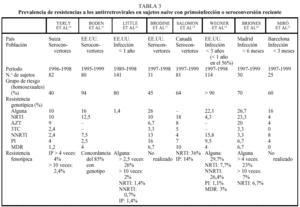
Las resistencias a ZDV y, con menor frecuencia, a 3TC son las más frecuentemente reconocidas en sujetos naive. En aquellos que presentan una primoinfección por VIH o han seroconvertido recientemente (p. ej., en los últimos 6-12 meses), la tasa promedio de resistencias primarias es del 10-20% para ZDV y del 5-10% para 3TC en los EE.UU. y Europa occidental (tabla 3)13-21. Estos dos fármacos han sido los más ampliamente utilizados y presentan una baja barrera genética, sobre todo el 3TC1.
La respuesta al primer régimen antirretroviral parece ser menor en los sujetos con resistencias primarias22, aunque el uso de fármacos en combinación puede dificultar el reconocimiento de esta circunstancia, al menos a corto plazo. En el estudio multicéntrico italiano ICONA, una respuesta virológica inferior a la primera combinación terapéutica fue reconocida en los sujetos con resistencias genotípicas basales22. De forma parecida, en el ACTG 343, un estudio de inducción-mantenimiento, los sujetos con resistencia basal a ZDV presentaron con mayor frecuencia un rebrote de la carga viral en la fase de mantenimiento23.
Las mutaciones de resistencia tienden a desaparecer del plasma en unas pocas semanas o meses si no hay presión farmacológica24. De este modo, la población viral resistente que se transmite de un sujeto tratado a un nuevo individuo que resulta infectado tiende a revertir si no se introduce terapia antirretroviral1. En realidad no hay tal reversión, sino que los virus mutantes suelen tener una menor capacidad replicativa y quedan ocultos por el sobrecrecimiento de las variantes sensibles (wild type), que presentan un mayor fitness1. Por esto, el reconocimiento de resistencias primarias es tanto más difícil cuanto más tiempo ha transcurrido desde la primoinfección por el VIH. Esta circunstancia explica que las tasas de resistencias primarias sean mayores en sujetos con primoinfección o seroconversión reciente respecto a los sujetos con infección crónica por el VIH. En cualquier caso, los genotipos resistentes persisten como población viral minoritaria en plasma o en forma de ADN proviral en células crónicamente infectadas, y pueden reaparecer rápidamente si el sujeto es de nuevo expuesto al fármaco implicado.
Fracaso terapéutico precoz
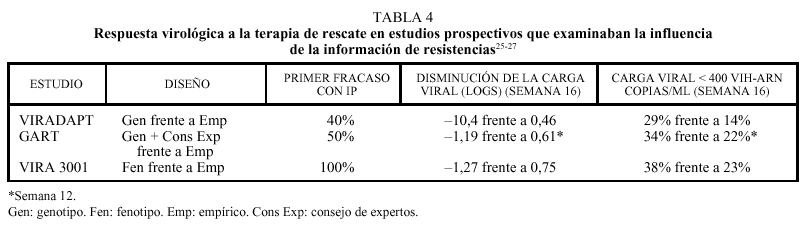
Varios estudios retrospectivos han demostrado que tanto el genotipo como el fenotipo predicen la respuesta a la terapia de rescate en los sujetos que presentan un fracaso virológico. Tres estudios prospectivos han confirmado que la utilización de los tests de resistencias permite diseñar terapias de rescate más eficaces25-27, aunque el beneficio virológico no pasa de ser moderado (0,5 logs de promedio) (tabla 4). De todos modos, el beneficio clínico producido por pequeñas variaciones en la carga viral demostró ser importante en la época de la mono/biterapia y no deben ser menospreciados.
En otros dos estudios prospectivos28,29, la información de los tests de resistencias no demostró conferir una mejor respuesta virológica respecto al diseño empírico del tratamiento de rescate. Sin embargo, en esos dos estudios los pacientes incluidos eran multitratados y probablemente la ayuda que pudieran aportar los tests de resistencias se vio comprometida por la ausencia de fármacos potencialmente útiles.
La mayoría de guías para el uso de los tests de resistencias han discernido entre primeros, segundos y subsecuentes fracasos de tratamiento, para establecer una prioridad en el uso de los tests de resistencias (tabla 1)3-9. Generalmente, la ayuda de estas pruebas es mayor en los sujetos con menor exposición a los antirretrovirales que en los multitratados, en los que la presencia de resistencias cruzadas reduce la eficacia de la mayoría de fármacos disponibles actualmente. Sin embargo, si los tests de resistencias pueden ser de utilidad en las terapias de rescate es sobre todo porque pueden permitir el reconocimiento de los fármacos afectados por resistencias en un régimen que fracasa y, de este modo, permitir su sustitución selectiva en lugar de modificar toda la pauta terapéutica. Generalmente, las resistencias aparecen antes frente a los fármacos con barrera genética más baja, como 3TC y nevirapina1,2. Los fracasos virológicos precoces a menudo sólo demuestran resistencias a estas moléculas, y no hay evidencia de pérdida de actividad antiviral para el resto que, de este modo, pueden mantenerse en la nueva combinación de rescate. Es más, si el fracaso virológico precoz ocurre sin evidencia de mutaciones de resistencia para los fármacos en uso, puede defenderse la opción de la intensificación, sumando un nuevo compuesto a la terapia en uso30. Por todo ello, el panel recomendó que los tests de resistencias deben hacerse precozmente cuando se asiste a un fracaso virológico. Si hay una demora importante debe presumirse que se habrán acumulado mutaciones de resistencia para todos los fármacos de la combinación en uso y, por tanto, será más apropiado reemplazar todos ellos.
Fracaso virológico en multitratados
La probabilidad de alcanzar carga viral indetectable en respuesta a la terapia de rescate en personas expuestas a casi todos los antirretrovirales es muy reducida1,2. En estos sujetos se han acumulado a lo largo del tiempo múltiples mutaciones de resistencia, que comprometen la eficacia antiviral de los fármacos disponibles. Sin embargo, en esta población se ha observado un beneficio clínico e inmunológico prolongado, a pesar del fracaso virológico, en la medida en que continúan tomando medicación y no la suspenden. Es como si el tratamiento antirretroviral produjera un beneficio mayor del que conlleva la reducción en la carga viral31. Una menor capacidad replicativa de los virus mutantes que se seleccionan bajo presión farmacológica podría explicar esta observación. De este modo, puede defenderse que es mejor mantener el tratamiento que suspenderlo en los pacientes que no alcanzan una supresión viral completa. El papel de los tests de resistencias en este contexto no es sólo el de ayudar a reconocer qué fármacos pueden ser los más útiles en el rescate, sino sobre todo informar sobre aquellos de los que puede prescindirse porque no tendrán actividad antiviral y, sin embargo, pueden ser causa de toxicidad.
Sujetos naive con infección crónica por el VIH
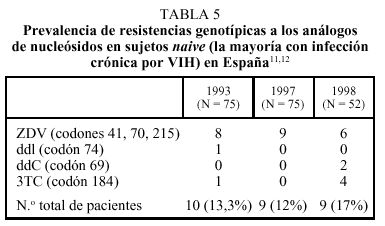
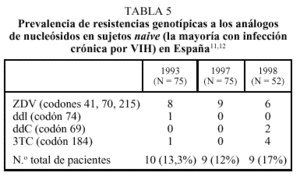
Las personas naive para tratamiento antiviral que se conocen infectadas durante largo tiempo o con una duración imprecisa de la infección por el VIH presentan virus resistentes con menor frecuencia que los individuos que han adquirido esta infección recientemente. Esto obedece a dos factores. Por un lado, el arsenal terapéutico actual es de reciente introducción, de modo que las personas infectadas antes de 1996 sólo pudieron haber seleccionado virus resistentes frente a unos pocos nucleósidos, como ZDV, ddI y ddC. Además, la proporción de pacientes tratados fue reducida hasta la introducción de los inhibidores de la proteasa, de modo que la probabilidad de adquirir la infección a partir de sujetos pretratados y con virus resistentes sólo sería remota. En segundo lugar, si la transmisión de virus resistentes ocurrió, es muy improbable que tras varios años sin tratamiento persistan como población dominante los genotipos resistentes iniciales. Todas estas circunstancias explican que la tasa de resistencias primarias en sujetos naive difiera según se trate de seroconvertores recientes o sujetos con infección crónica por el VIH. Así, en los estudios ERASE 1 y 211,12, la tasa de resistencias primarias fue inferior al 10% (tabla 5), mientras que es superior al 20% en seroconvertores recientes de Madrid y Barcelona20,21.
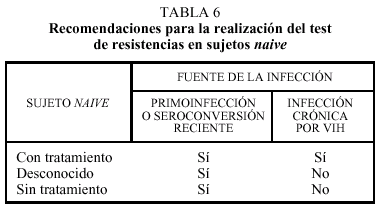
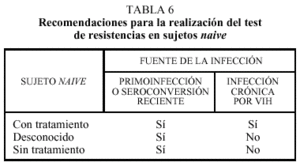
El panel consideró que los tests de resistencias no deben realizarse en sujetos naive con infección crónica por el VIH, aunque ocasionalmente pueden ser de utilidad (tabla 6). Así ocurre cuando se conoce el sujeto transmisor que había sido expuesto a fármacos antirretrovirales.
Profilaxis postexposición
El riesgo de adquirir la infección por el VIH tras una exposición accidental a sangre o un producto contaminado es del 0,3% de promedio32. El personal sanitario (p. ej., enfermeras) que sufre una inoculación accidental con agujas recientemente utilizadas para la venopunción en pacientes VIH+ puede exponerse a virus resistentes. En esta situación, la administración precoz (en las primeras horas) de medicación antirretroviral parece reducir el riesgo de infección32. La utilización de no nucleósidos o inhibidores de la proteasa parece ser la mejor opción para prevenir la infección de las células expuestas al inóculo. Estos compuestos actúan directamente sobre sus enzima diana en los viriones y no requieren fosforilización previa, como ocurre con los análogos de nucleósidos. En cualquier caso, la elección de los fármacos debe ser pronta y empírica, excluyendo aquellos que haya utilizado el paciente fuente de la exposición accidental al virus. Por otro lado, debe favorecerse la administración de fármacos bien tolerados, puesto que de otro modo, la medicación deja de tomarse con frecuencia. La utilidad de los tests de resistencias es limitada en este contexto; se justificarían para examinar al paciente fuente de la infección y adaptar convenientemente la pauta preventiva con posterioridad en la persona accidentada si se considera necesario.
Ausencia de opciones terapéuticas
Los pacientes que presentan un fracaso virológico, tras haber sido expuestos a múltiples fármacos antirretrovirales de forma secuencial, o que han desarrollado toxicidad frente a los mismos, constituyen un grupo creciente de enfermos con escasas opciones de tratamiento eficaz. A menudo, la mejor oferta terapéutica para ellos consiste en prevenir las infecciones oportunistas. El conocimiento del perfil de resistencias en estos casos es de interés académico. Como se ha comentado antes al examinar a los sujetos multitratados, la utilidad de los tests de resistencias en este contexto sólo es defendible para excluir la medicación frente a la que hay resistencias, que no tendrá actividad antiviral y, sin embargo, puede ser causa de toxicidad.
Carga viral indetectable
Los métodos utilizados para la genotipificación o el examen fenotípico requieren un mínimo grado de viremia en el plasma de la persona estudiada, en el rango de 1.000 copias de VIH-ARN por ml. Ya se ha comentado antes que la detección precoz de virus resistentes puede permitir realizar un cambio de medicación antes de que se acumulen múltiples mutaciones de resistencia. Es bien conocido que cuantas más mutaciones, mayor nivel de resistencia específica y cruzada con otros compuestos de la misma familia1. Puesto que las técnicas de cuantificación de la carga viral permiten reconocer valores de viremia del orden de 20 a 50 copias de VIH-ARN por ml, muchos expertos consideran que los tests de resistencia deben mejorar su sensibilidad para poder examinar muestras de plasma con valores de viremia por debajo de las 1.000 copias de VIH-ARN por ml. Sin embargo, una limitación importante de esta medida se refiere al menor grado de reproducibilidad de los resultados obtenidos cuando se examinan muestras con carga viral baja. Tanto la genotipificación como la fenotipificación con virus recombinantes precisan la reacción en cadena de la polimerasa, la cual puede amplificar genomas que no son los mayoritarios en un sujeto. El riesgo de sesgo es tanto mayor cuanto menor es el número de copias de VIH-ARN en la muestra examinada. De forma ideal, las pruebas de resistencias en estos casos debería repetirse antes de informar un resultado como definitivo.
Consideraciones para una utilización adecuada de los tests de resistencias
Los métodos actualmente disponibles para analizar las resistencias a los antirretrovirales son complejos y la reproducibilidad está lejos de ser óptima, sobre todo en muestras con carga viral baja y/o presencia de poblaciones virales mixtas (wild type y mutantes). En este sentido, los laboratorios que analizan resistencias deben gozar de acreditaciones externas y controles periódicos de calidad que aseguren la fiabilidad de sus resultados. Por otro lado, el rendimiento de estos tests en muestras de sujetos infectados con subtipos no B del VIH-1 puede ser inferior y es bien conocido el creciente número de sujetos infectados por estas variantes. Deben realizarse análisis de coste-efectividad que midan el alcance real de la introducción de estas técnicas en el manejo terapéutico de los sujetos VIH+. Los valores plasmáticos de los fármacos antirretrovirales y la IC50 de cada uno de ellos deben ser integrados en los algoritmos de interpretación de resistencias, si se quiere utilizar de forma clínicamente válida la información de estos tests. La búsqueda de nuevos genotipos que ocasionen fenotipos de resistencia debe continuar e identificarse las situaciones precisas en las que los tests de resistencias son de particular utilidad, como recientemente se ha descrito con el fracaso precoz con nevirapina33 o nelfinavir34.
Fe de errores
En el artículo "Un paciente con pérdida de memoria" (Med Integral 2001; 37: 145-153), correspondiente a le segunda semana del mes de febrero, de A. Miralles Martínez y A. Frank García, la figura 1 no corresponde a ese trabajo, por lo que reproducimos la citada figura tal como debía haber sido publicada.