Las bronquiectasias son dilataciones anormales e irreversibles de los bronquios. La alteración estructural de la pared bronquial se asocia a una alteración de los mecanismos de defensa local que facilitan la colonización bacteriana y la génesis de un proceso inflamatorio crónico, perpetuando un círculo vicioso de colonización-inflamación.
Las bronquiectasias son una enfermedad bronquial crónica que tienen un impacto significativo en la utilización de los servicios de salud en todo el mundo. Desde la primera descripción de la enfermedad por Laennec, en 1819, se han sucedido importantes cambios en su tratamiento clínico, así como en su morbilidad y mortalidad. Los programas de vacunación en la infancia y el tratamiento antibiótico temprano de las infecciones pulmonares han cambiado el contexto epidemiológico de esta enfermedad. En países en vías de desarrollo, las infecciones siguen siendo la primera causa de bronquiectasias, mientras que en los países desarrollados se ha producido un descenso significativo de las etiologías infecciosas y un incremento relativo de otras causas como las inmunodeficiencias primarias o la fibrosis quística. El desarrollo de nuevas tecnologías permitirá que en un futuro no muy lejano la terapia génica y nuevas modalidades de tratamiento dirigidas específicamente contra determinados mediadores inflamatorios mejoren el manejo terapéutico de las bronquiectasias.
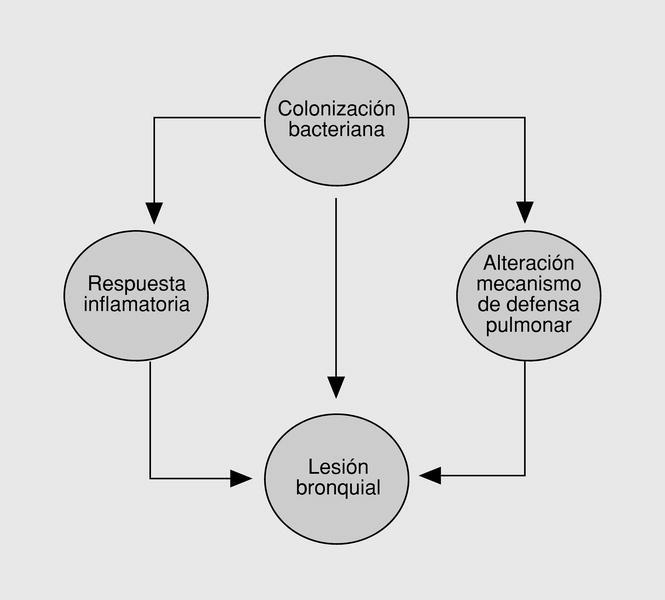
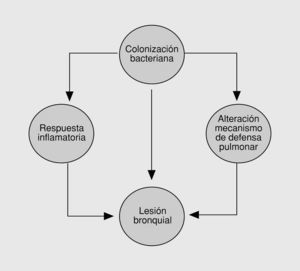
Fig. 1. Círculo vicioso de infección inflamación en las bronquiectasias.
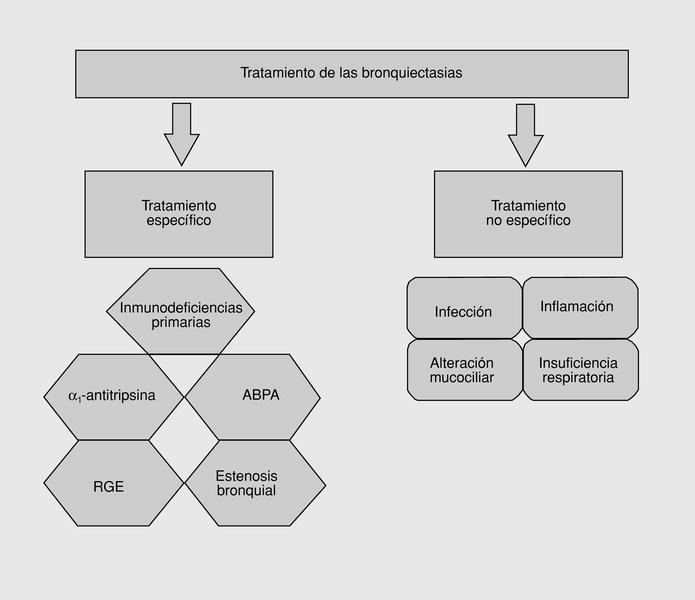
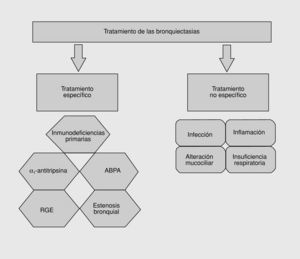
Fig. 2. Tratamiento de las bronquiectasias.
Fig. 3. Sistema de nebulización de antibióticos
Patogenia
La teoría sobre el círculo vicioso de las bronquiectasias formulada por Cole postula que el daño inicial sobre la pared bronquial comprometería los mecanismos de defensa pulmonar permitiendo la colonización bacteriana del árbol traqueobronquial1. En un intento de eliminar estos microorganismos, el huésped respondería con un proceso inflamatorio que, incapaz de eliminar la flora bacteriana colonizante, se vuelve crónico, pobremente controlado, generando daño bronquial, un mayor compromiso de los mecanismos de defensa local y susceptibilidad a la invasión bacteriana. La base biológica de la respuesta inflamatoria bronquial se ha estudiado en los últimos años, y se ha objetivado una infiltración tisular por neutrófilos, células mononucleares y linfocitos CD42. El reclutamiento de neutrófilos está mediado por citocinas proinflamatorias IL-1 beta, IL-8, factor de necrosis tumoral (TNF)-alfa3 y leucotrieno B44. La interacción de los neutrófilos con el endotelio vascular está mediada por moléculas de adhesión. En recientes trabajos se ha observado que los pacientes con bronquiectasias presentan una sobreexpresión de la endotelina 1 (ET-1) que incrementaría la expresión de las moléculas de adhesión (CD18 y CD11b) en la superficie de los neutrófilos, favoreciendo el contacto con la superficie endotelial y la posterior infiltración de la pared bronquial5. Los neutrófilos activados liberarían una serie de metabolitos intracelulares en las vías aéreas, entre los que se encuentran la elatasa neutrófila y los radicales oxígeno, causando una alteración en el batido mucociliar, hipersecreción de las glándulas mucosas y daño en el epitelio respiratorio6.
Bacteriología
Los pacientes con bronquiectasias presentan, habitualmente, sus vías aéreas colonizadas por gérmenes potencialmente patógenos, alcanzando cifras de colonización entre un 60-80% en situaciones de estabilidad clínica. Los microorganismos aislados con más frecuencia son H. influenzae y Pseudomonas spp.; estos microorganismos son los que causan las exacerbaciones infecciosas7,8. De especial interés es la colonización bronquial por Pseudomonas aeruginosa. Diversos estudios han demostrado que los pacientes colonizados por Pseudomonas spp. tienen una mayor afección radiológica en la tomografía axial computarizada (TAC) torácica de alta resolución y deterioro en la función pulmonar9-11, así como una respuesta inflamatoria pulmonar más intensa12.
En ocasiones, se produce colonización bronquial por microorganismos que requerirán tratamiento específico y un mayor control clínico: Nocardia asteroides, Aspergillus spp., Alcaligenes xylosoxidans y Mycobacterium spp8.
Más controvertido es el significado clínico del aislamiento de gérmenes potencialmente no patógenos como Neisseria spp. o Corynebacterium spp. en las vías aéreas de los pacientes con bronquiectasias. En 2 estudios recientes de nuestro grupo, en pacientes con enfermedad pulmonar obstructiva crónica (EPOC)13 y en pacientes con bronquiectasias14, encontramos que los pacientes colonizados por gérmenes potencialmente patógenos (como H. influenzae, S. pneumoniae, Pseudomonas spp.) tenían una respuesta inflamatoria sistémica y pulmonar en comparación con los pacientes colonizados por gérmenes no patógenos. Este hallazgo indicaría que el potencial daño pulmonar es mayor en los pacientes colonizados por patógenos respiratorios en sus vías aéreas.
Tratamiento
Dado que las bronquiectasias son una alteración irreversible del bronquio, deben establecerse las medidas específicas para evitar su aparición. El adecuado control y prevención de las enfermedades infecciosas como los programas de vacunación temprana en la niñez, la vigilancia epidemiológica, el diagnóstico precoz y el tratamiento de la tuberculosis pulmonar, y otras infecciones pulmonares, así como el diagnóstico y tratamiento adecuado de enfermedades que predisponen a la aparición de bronquiectasias como el tratamiento sustitutivo con inmunoglobulinas en los pacientes con inmunodeficiencias primarias o con alfa-1 antitripsina en el caso de pacientes con deficiencia de alfa-1 antitripsina, sin duda influirán en el declive de la prevalencia de las bronquiectasias en nuestra sociedad.
El único tratamiento definitivo para las bronquiectasias es la cirugía, pero las indicaciones para la cirugía están limitadas actualmente a unos pocos casos. En la mayoría de casos se basará en el tratamiento médico de las exacerbaciones y el control del daño tisular y la inflamación.
Tratamiento quirúrgico
Hay sólo dos indicaciones mayores para el tratamiento quirúrgico de las bronquiectasias. Los pacientes con bronquiectasias localizadas pueden ser candidatos a una resección pulmonar limitada, en el caso de pacientes con exacerbaciones infecciosas frecuentes, a pesar de una tratamiento médico adecuado, y sin factores predisponentes que favorezcan la reaparición de las bronquiectasias. Un segundo grupo de candidatos potenciales son aquellos pacientes con complicaciones graves secundarias a las bronquiectasias, como las complicaciones infecciosas (abscesificación pulmonar) o hemoptisis masiva que no responde al tratamiento médico o a la embolización bronquial15,16. El trasplante pulmonar debe considerarse como una alternativa en pacientes en estadios finales de su enfermedad con una supervivencia de vida esperada de menos de 2 años. De los 6.126 trasplantes pulmonares recogidos en el St. Louis International Lung Transplant Registry desde enero de 1997, 932 pacientes tenían fibrosis quistica17 y 129 bronquiectasias sin fibrosis quística18.
Tratamiento médico
Los objetivos del tratamiento médico son tratar la infección y la inflamación bronquial resultante, así como mejorar el aclaramiento mucociliar19.
Tratamiento antibiótico
Exacerbación aguda. Una exacerbación es reconocida clínicamente por un incremento de la producción o cambio de las características macroscópicas del esputo (cambio de mucoso a mucopurulento o purulento). El planteamiento inicial sería que la flora bacteriana que habitualmente coloniza las vías aéreas de estos pacientes sería la causante de la exacerbación. Hay algunos principios importantes a tener en cuenta al planear el tratamiento antimicrobiano en los pacientes con bronquiectasias20,21. En primer lugar, la flora bacteriana que coloniza el árbol bronquial es diversa y potencialmente patógena, y es indispensable identificar los microorganismos potencialmente patógenos que colonizan cada paciente. En segundo lugar, un conocimiento apropiado de la absorción de los diferentes antibióticos y la cinética de penetración bronquial. En tercer lugar, los pacientes con bronquiectasias producen secreciones espesas que actúan como una barrera física para la difusión del antibiótico en el lugar de la infección. Además, estas secreciones de la vía aérea contienen enzimas como las beta-lactamasas, capaces de inactivar las penicilinas. Basándose en estas consideraciones, la política más apropiada sería usar antibióticos activos contra H. influenzae como tratamiento de primera línea, ajustando el tratamiento antibiótico según los resultados microbiológicos. Los antibióticos de elección serían penicilinas (amoxicilina más ácido clavulánico) y las cefalosporinas, macrólidos, carbapenems22 y quinolonas. Las fluroroquinolonas recientemente comercializadas (levofloxacino, moxifloxacino, gatifloxacino) pueden significar una alternativa terapéutica en el tratamiento de los episodios de agudización en los pacientes con bronquiectasias23. Una pauta de 10 a 14 días de antibiótico por vía oral será suficiente en la mayoría de pacientes. La administración parenteral se reservará para aquellos pacientes con deterioro grave de la función pulmonar o el fracaso respiratorio agudo, así como en aquellos con sepsis bronquial crónica. Siempre deben ajustarse los antibióticos basándose en los resultados de los cultivos microbiológicos. Los pacientes crónicamente infectados por P. aeruginosa se beneficiarían de una tanda de 15 días de tratamiento antibiótico administrado vía parenteral de dos agentes antimicrobianos antipseudomónicos si requieren ingreso hospitalario, o tratamiento oral con ciprofloxacino en casos de agudizaciones que se puedan tratar en domicilio. Existen pacientes con frecuentes episodios de exacerbación infecciosa y supuración bronquial crónica, con recaídas tempranas tras el tratamiento que se beneficiarían de pautas de tratamiento oral mantenido de varias semanas o incluso meses con el fin de evitar la recaída temprana. En estos casos, el objetivo más que conseguir la eliminación microbiológica, que en muchos casos no será posible, perseguiría el reducir los contajes bacterianos y mantener el paciente en un período más prolongado de estabilidad clínica.
Colonización bronquial crónica. Así como nadie discute la utilidad del tratamiento antibiótico en las agudizaciones, más controvertido es el tratamiento de la colonización bronquial crónica. Sobre la base de que la infección desempeña un papel importante en perpetuar el daño bronquial, reduciendo la carga microbiana, podríamos alterar el curso clínico de la enfermedad al modificar la respuesta inflamatoria. Podemos plantearnos tratar a los pacientes con sepsis bronquial crónica y frecuentes episodios de exacerbación continuamente o con tandas de tratamiento antibiótico regulares con el objetivo de reducir la respuesta inflamatoria debida a la persistencia de microorganismos en las vías aéreas. Diversos trabajos han evidenciado que la administración de antibióticos en estos pacientes mejora los síntomas clínicos, reduce la purulencia del esputo y disminuye los valores de enzimas proteolíticas24. En los pacientes con persistencia de la sintomatología a pesar del tratamiento antibiótico por vía oral o con marcados efectos secundarios con altas dosis mantenidas de antibióticos por vía oral puede plantearse la administración del antibiótico nebulizado. Numerosos estudios han demostrado una mejoría de la función pulmonar y reducción en el número de ingresos hospitalarios tanto en pacientes con bronquiectasias no secundarias a fibrosis quística como secundarias a fibrosis quística. Aunque eficaz, se trata de una técnica de mayor coste económico, que exige una mayor dedicación de personal sanitario por lo que su indicación ha de quedar restringida a unos casos muy concretos. Un reciente trabajo publicado en la bibliografía ha demostrado la utilidad de la administración de antibióticos mediante un sistema de inhalación de polvo seco; futuros trabajos habrán de corroborar la utilidad de la administración de antibióticos mediante este sistema25.
Tratamiento de la inflamación bronquial. Hiperreactividad bronquial
Aunque se ha demostrado que el tratamiento con corticoides orales reduce la morbilidad en los pacientes con fibrosis quística26, los efectos secundarios del tratamiento corticoide crónico no justifican su uso generalizado en los pacientes con bronquiectasias. Un reciente estudio investigó la utilidad de la fluticasona inhalada para tratar la hiperreactividad bronquial de estos pacientes. El tratamiento inhalado (sistema de polvo seco) con fluticasona (500 mg) durante 4 semanas reducía de forma significativa la respuesta inflamatoria (recuento leucocitario, IL-1 beta, IL-8 y LTB4)27. En este contexto la utilización de corticoides inhalados estaría justificado en el tratamiento de los pacientes con hiperreactividad bronquial evidenciada mediante un estudio funcional respiratorio. En pacientes sin hiperreactividad bronquial podría plantearse su uso basándose en los hallazgos del trabajo anteriormente citado, aunque futuros estudios en una amplia población de pacientes con bronquiectasias deberán evaluar este aspecto.
Otra línea de investigación actual es el uso de antiinflamatorios no esteroides Hay datos preliminares que sugieren que el tratamiento con estos fármacos puede alterar la progresión del daño pulmonar en los pacientes con fibrosis quística28. La indometacina inhalada se ensayó en 25 pacientes con expectoración crónica (ocho tenían bronquiectasias) demostrando una reducción en la producción del esputo y una mejoría de la disnea comparada con el placebo29. La indometacina también se ha administrado por vía oral a una dosis de 25 mg en 4 tomas diarias durante 4 semanas en 9 pacientes con bronquiectasias, observándose una disminución en la actividad inflamatoria mediada por neutrófilos30. Nuevos trabajos habrán de evaluar su utilidad en los pacientes con bronquiectasias.
Mejorar el aclaramiento mucociliar
El objetivo de los agentes mucolíticos es tratar la hipersecreción cambiando las características fisicoquímicas de las secreciones respiratorias producidas por las vías aéreas anormales, favoreciendo el drenaje traqueobronquial defectuoso. Hay poca evidencia científica que apoye en estos momentos el uso rutinario de mucolíticos en las bronquiectasias. El tratamiento con bromhexina a dosis altas durante más de 7 días en pacientes exacerbados se ha observado que producía mejoría en la producción de esputo y el aclaramiento mucociliar, hecho que deberá ser analizado en futuros estudios aleatorizados. Se ha sugerido que la digestión del ADN liberado por los neutrófilos en el lugar de la infección, por una enzima específica como la rhDNasa podría hacer el esputo menos viscoso y más fácil de expectorar. Su eficacia clínica se ha demostrado en el tratamiento de los pacientes con fibrosis quística31,32, pero los estudios que han evaluado su uso en los pacientes con bronquiectasias sin fibrosis quística no apoyan su uso en estos pacientes.
Tratamiento de las complicaciones
Hemoptisis
Los episodios de exacerbación infecciosa de las bronquiectasias pueden acompañarse de una hemoptisis menor, en cuyo caso el tratamiento de la exacerbación se acompañaría de una remisión del episodio de sangrado. En el caso de hemoptisis masiva o persistente el tratamiento de elección sería la embolización arterial. En un reciente estudio de Osaki et al realizado en 22 pacientes que requirieron embolización bronquial (nueve de ellos con bronquiectasias) se produjo resangrado en el 50% de los pacientes que fueron embolizados, siendo las bronquiectasias un factor de riesgo de recurrencia de las hemoptisis. El tratamiento quirúrgico deberá considerarse en pacientes con hemoptisis masiva de riesgo vital que no responde a la embolización arterial, y en pacientes con reserva pulmonar adecuada y hemoptisis persistente que no responde a la embolización arterial, aunque deberá reservarse a casos muy seleccionados dado el alto porcentaje de mortalidad postoperatoria y morbilidad34.
Insuficiencia respiratoria crónica
Los pacientes con bronquiectasias en fase terminal de su enfermedad pueden requerir oxigenoterapia cuando presentan insuficiencia respiratoria, o cor pulmonale; siendo los criterios de administración de oxígeno los mismos que para los pacientes con EPOC.