La enfermedad pulmonar obstructiva crónica (EPOC) se caracteriza por una limitación crónica y progresiva al flujo aéreo. Ésta es sólo parcialmente reversible y se asocia a una respuesta inflamatoria secundaria a la exposición pulmonar a partículas nocivas y/o gases1. Según datos de la Organización Mundial de la Salud (OMS), se prevé que en el año 2020 la EPOC constituirá la quinta enfermedad más prevalente y la tercera causa de muerte de la humanidad2.
Un reciente estudio realizado en España para conocer la prevalencia de esta enfermedad en nuestro país (estudio IBERPOC) puso de manifiesto que, en la población con edades comprendidas entre 40-69 años, existía una prevalencia de un 9%3. Este porcentaje probablemente se habría incrementado si se hubiese incluido a las personas mayores de 70 años, dado que esta afección aumenta claramente con la edad y la duración del hábito tabáquico. Otro dato relevante del estudio IBERPOC fue que el 78,2% de los enfermos no estaba previamente diagnosticado de EPOC. Estos resultados deben ser motivo de reflexión. Resulta necesario mejorar nuestros conocimientos acerca de esta dolencia, particularmente entre los profesionales de atención primaria, con el objetivo de conseguir un diagnóstico mucho más temprano en una enfermedad tan prevalente.
El diagnóstico de EPOC siempre debe considerarse en cualquier sujeto que presente síntomas de tos, producción de esputo o disnea y/o historia de exposición a cualquier factor de riesgo de desarrollar esta afección. El diagnóstico se confirma mediante una espirometría que demostrará un volumen espiratorio máximo en el primer segundo (FEV1) posbroncodilatador inferior al 80% del valor predicho, junto con un cociente FEV1/capacidad vital forzada (FVC) menor del 70%. Es preciso tener en cuenta que la tos y la expectoración pueden preceder en muchos años a la instauración de obstrucción bronquial. Por otra parte, no todos los individuos que tosen y expectoran van a desarrollar EPOC.
De forma reciente, y ante la magnitud del problema, los Institutos Nacionales de Salud de Estados Unidos (US National Heart, Lung and Blood Institute) y la OMS han puesto en marcha el programa GOLD (Global Initiative for Chronic Obstructive Lung Disease). Los objetivos del tratamiento de la EPOC, recogidos recientemente en un documento elaborado por el panel de expertos de la iniciativa GOLD, son los siguientes1: prevenir la progresión de la enfermedad, aliviar los síntomas, aumentar la tolerancia al ejercicio, mejorar la calidad de vida relacionada con la salud, prevenir y tratar las complicaciones y exacerbaciones y, por último, reducir la mortalidad.
Es obvio que el arsenal terapéutico disponible en la actualidad para el tratamiento de la EPOC no ha podido cumplir estos objetivos. Estudios recientes, si bien todavía preliminares, con un nuevo anticolinérgico selectivo, tiotropio, nos sugieren que la terapia de mantenimiento con este fármaco podría ayudarnos a conseguir una buena parte de los propósitos planteados en la iniciativa GOLD4.
Sistema colinérgico
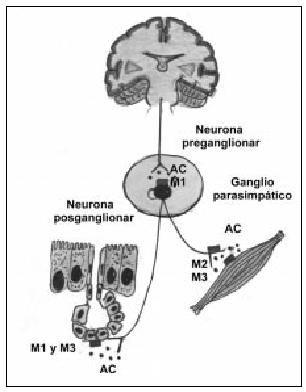
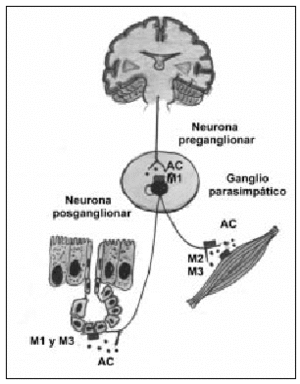
El sistema colinérgico es el principal componente en la obstrucción de las vías aéreas en la EPOC y es la causa de la broncoconstricción y de la hipersecreción mucosa característica en la enfermedad. Además, es potencialmente reversible. Las fibras colinérgicas presinápticas parten del tronco cerebral y, a través del nervio vago, llegan a los ganglios parasimpáticos. Aquí es donde se produce la sinapsis neural, y surgen las fibras posganglionares que inervarán la musculatura lisa o las glándulas mucosas (fig. 1). La estimulación del nervio vago provoca la liberación de acetilcolina (AC), que actúa al activar los diferentes receptores muscarínicos5. Se han clonado cinco genes diferentes de receptores muscarínicos en estudios de hibridación molecular. De éstos, sólo se han tipificado farmacológicamente tres, los receptores M1, M2 y M3, los cuales han demostrado poseer funciones fisiológicas distintas, tal como se ha comprobado en estudios realizados con antagonistas selectivos. Los receptores M1, localizados en los ganglios parasimpáticos, paredes alveolares y glándulas mucosas, actúan como facilitadores de la neurotransmisión. Los receptores M3 están presentes en el músculo liso y las glándulas submucosas y son los causantes de la broncoconstricción y la secreción glandular. Por último, los receptores M2 se encuentran en las terminaciones nerviosas colinérgicas e inhiben la liberación local de AC, ejerciendo un feed-back negativo en la acción vagal (autorreceptor)6. Por todo ello, la selectividad de un compuesto inhibidor de los receptores M1 y M3 presentaría ventajas farmacológicas con importantes implicaciones terapéuticas.
Fig. 1. Inervación colinérgica con la localización de los receptores muscarínicos en las vías respiratorias. Del sistema nervioso central parten las neuronas preganglionares hasta los ganglios parasimpáticos, donde realizan la sinapsis con las neuronas posganglionares. Los receptores M1 aumentan la transmisión colinérgica; los receptores M2 o autorreceptores producen una retroalimentación negativa en la transmisión neural y facilitan la recaptación de AC; los receptores M3, localizados en músculo liso y glándulas, provocan broncoconstricción y secreción mucosa al ser estimulados. AC: acetilcolina.
Tiotropio
Farmacología
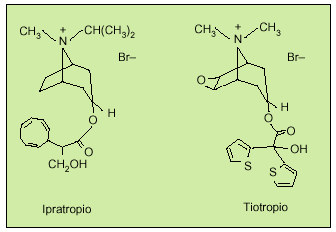
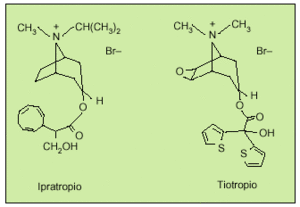
El descubrimiento de un nuevo fármaco de acción prolongada y selectiva sobre los subtipos de receptores (bromuro de tiotropio) ha supuesto un gran avance en la farmacología de los compuestos antimuscarínicos7. Como el bromuro de ipratropio, el tiotropio se diferencia químicamente de la atropina por una estructura de amonio cuaternario cargado positivamente, responsable de la limitada absorción intestinal, evitando los posibles efectos secundarios que puedan derivarse de su difusión sistémica. La presencia de grupos tiofeno en la molécula de tiotropio le confieren lipofilia (fig. 2).
Fig. 2. Estructura química del bromuro de ipratropio y del bromuro de tiotropio.
Estudios clínicos preliminares
Los estudios iniciales, en que se comparaba la cinética de disociación del tiotropio y otros antagonistas muscarínicos sobre los receptores, fueron esperanzadores. Las diferencias comenzaron a apreciarse al valorar la velocidad de disociación de los compuestos de sus receptores (el tiotropio se disociaba unas 100 veces más lentamente que el ipratropio de los receptores), además de la mayor afinidad de unión sobre los receptores M1 y M3, no observada sobre los M2. Nos encontramos, pues, ante un compuesto con afinidad selectiva sobre los receptores muscarínicos y con el perfil farmacológico adecuado, lo que le otorga unas prometedoras cualidades como agente terapéutico8-10.
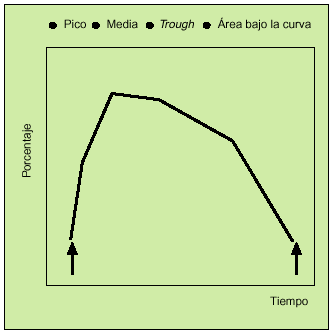
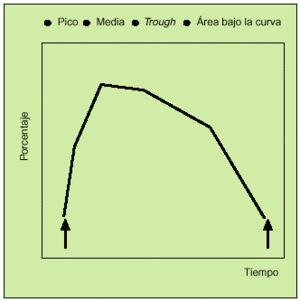
Antes de comenzar a detallar los recientes estudios realizados con este nuevo compuesto, es preciso aclarar una serie de conceptos que aparecerán a lo largo de este artículo o en las gráficas incluidas en él. Tras la administración de las dosis correspondientes de un fármaco, se realiza una serie de espirometrías que permiten construir una curva denominada curva tiempo-respuesta (fig. 3). En estas gráficas se puede analizar los siguientes parámetros:
Fig. 3. Parámetros curva tiempo-respuesta.
La respuesta máxima o pico. Constituye el máximo grado de broncodilatación detectado. Puede determinarse el tiempo que tarda en producirse.
Media de las determinaciones efectuadas en las horas siguientes (3-6 h) a la administración del fármaco. Informa no sólo de la rapidez con la que se obtiene la respuesta broncodilatadora, sino de su consistencia y persistencia.
Respuesta valle (trough). Se obtiene a partir de una espirometría realizada al finalizar el intervalo terapéutico de una dosis e inmediatamente antes de la administración de la siguiente. Este concepto novedoso es de gran interés, puesto que nos informa sobre la persistencia del efecto broncodilatador antes del inicio de la siguiente dosis.
Hechas estas consideraciones, analizaremos ahora los diferentes ensayos clínicos llevados a cabo en fases I y II.
En los estudios realizados en fase I, con voluntarios sanos, utilizando dosis únicas o múltiples, y variando la dosis de tiotropio, no se observaron efectos sistémicos secundarios relevantes, tales como alteraciones en la frecuencia cardíaca y/o respiratoria, presión arterial, pupilometría o alteración de parámetros analíticos. La sequedad de boca, típico efecto muscarínico, se presentó después de altas dosis (superiores a 80 µg). Se observó, además, una disminución de la resistencia de la vía aérea (Raw) de 72 h de duración11,12.
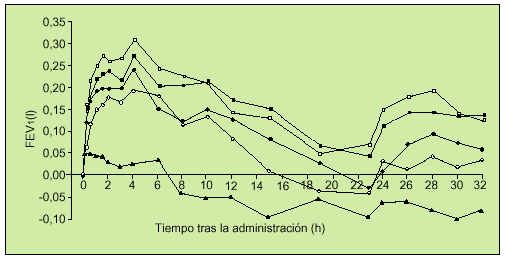
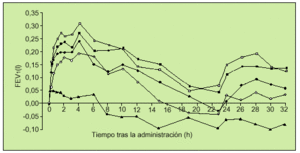
El primer trabajo en fase II de auténtico interés en la EPOC fue realizado por el Grupo Holandés para el Estudio de Tiotropio. Se trata de un estudio aleatorio, doble ciego, controlado y cruzado, en el que cada paciente inhalaba dosis únicas de bromuro de tiotropio de 10 a 80 µg (9-72 µg de tiotropio) y placebo, considerando un período de lavado del fármaco de 72 h entre las diferentes dosis. Los pacientes incluidos en este estudio, al igual que en los que posteriormente describiremos, fueron enfermos diagnosticados de EPOC según criterios de la American Thoracic Society (ATS), edad mayor o igual a 40 años, ser o haber sido fumador de 10 paquetes-año, presentar en la espirometría un FEV1 inferior al 65%, FEV1/FVC menor del 70%, no tener historia de asma, atopia, rinitis alérgica o presentar en la analítica un recuento de eosinófilos mayor de 400/ml. A los 35 pacientes incluidos en el estudio, con FEV1 medio previo del 44%, se les realizaron determinaciones de FEV1 y FVC en intervalos sucesivos hasta 32 h después de la inhalación del fármaco o placebo. Se objetivó mejoría de estos parámetros a todas las dosis utilizadas, con un efecto rápido a los 15 min y con un pico del 19-26% de FEV1 sobre el basal obtenido en el rango de 1 a 4 h. La duración del efecto se extendió hasta las 32 h (fig. 4). En general, el fármaco fue bien tolerado13.
Fig. 4. Incremento ajustado de la mejora media del FEV1 sobre el basal para las siguientes dosis de bromuro de tiotropio: 10µg-s-, 20µg -d-m, 40µg -j-, 80µg -h- y de placebo -m-. (Modificado de la referencia 13.) FEV1: volumen espirado en el primer segundo; h: horas.
Más recientemente, se valoraron los resultados con diferentes dosis de tiotropio (0, 4, 5, 9, 18 y 36 µg), utilizadas una vez al día (al mediodía) durante un período de 4 semanas en un estudio aleatorio, doble ciego, controlado con placebo, con grupos paralelos, en el que se incluyó a 169 pacientes con EPOC y un FEV1 medio del 44%. Durante el período de estudio, se programaron visitas semanales en las que se realizaron medidas espirométricas a diferentes intervalos horarios (8:00, 10:00 y 12:00 h) semanalmente durante el período basal (2 semanas), tratamiento (4 semanas) y postratamiento (3 semanas). Todas las dosis incrementaron el FEV1 tanto al principio como al final del período diario de tratamiento, durante los 29 días de estudio, y se retornó gradualmente a la situación basal cuando se suspendió la administración del fármaco. Se obtuvo en el día 8 el máximo valor de FEV1 trough (valle), que se mantuvo estable hasta el día 29. Estos trabajos permitieron seleccionar la dosis de 18 µg, una vez al día, por su seguridad y eficacia14,15.
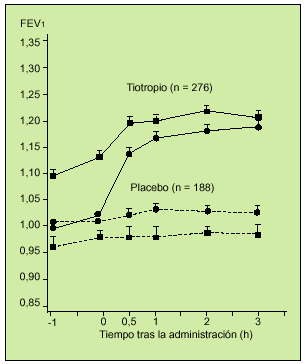
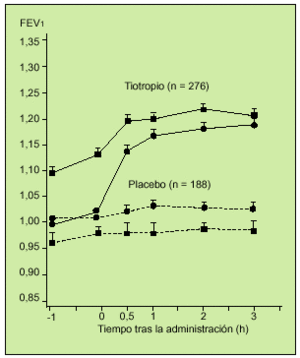
El Grupo de Trabajo de Tiotropio de EE.UU. puso en marcha un estudio multicéntrico, aleatorio, doble ciego, controlado con placebo, en el que se valoró la eficacia espirométrica de 18 µg de tiotropio durante 13 semanas. En el protocolo se incluyó a 470 pacientes con EPOC y un FEV1 medio de 38,6%. A 279 sujetos se les administró tiotropio y a 191 placebo. Se realizaron deteminaciones de FVC y FEV1 en los días 1, 8, 50 y 92. La respuesta media broncodilatadora al tiotropio se observó a las 3 h de administrar el fármaco. Los enfermos que recibieron tiotropio mejoraron su FEV1 en un 16% en el día 8 y en un 20% en el día 92, con respecto a las mediciones basales realizadas antes de iniciar el tratamiento (fig. 5). El tiotropio fue siempre superior al placebo. También lo fue en la medición del flujo espiratorio pico (PEF) y en la reducción del uso de ß2-adrenérgicos de rescate. Asimismo, se objetivó que la mejoría funcional se mantuvo durante las 13 semanas, lo que abunda en la ausencia de taquifilaxia con este fármaco. Este trabajo es el primero que incluye la evaluación de parámetros clínicos como la autoescucha de sibilancias, el grado de disnea, tos y opresión torácica en una puntuación de 0 a 3, siendo 0 ninguno y 3 grave. También se evaluó el estado general global con una escala de 1 a 8, siendo 1 pobre y 8 excelente. Se obtuvo una mejoría en cuanto a las sibilancias y la disnea y en cuanto a la valoración global del estado general con respecto al placebo. El 9,3% de los pacientes presentó con el fármaco sequedad de boca. En definitiva, este estudio demostró la seguridad y eficacia de una dosis diaria de este nuevo anticolinérgico y su potencialidad como posible fármaco de primera línea en el tratamiento de la EPOC16.
Fig. 5. Registro del valor medio de FEV1 tras la inhalación del fármaco o el placebo en el día 1 -d- y en el día 92 -j-. En ambos casos la diferencia resultó estadísticamente significativa (p < 0,001). (Modificado de la referencia 16.)
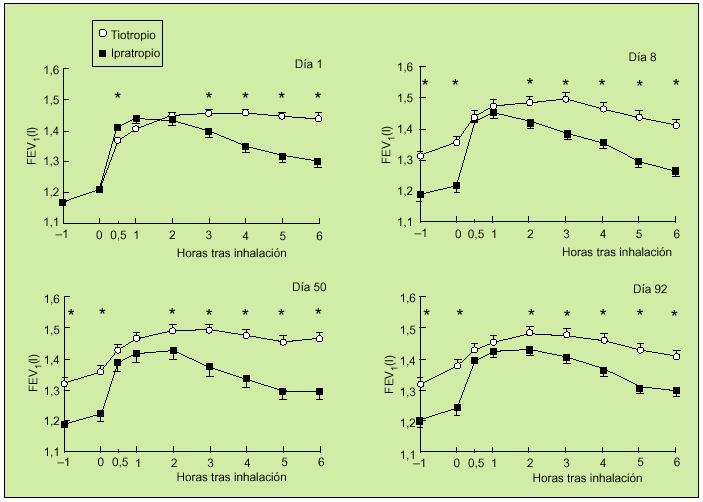
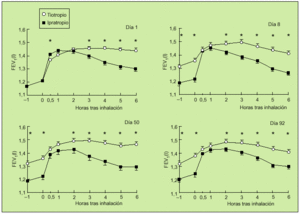
Otro trabajo interesante es el realizado por el grupo holandés, en el que 14 centros participaron en un estudio aleatorio, doble ciego, paralelo, con tiotropio e ipratropio. Incluyeron a 288 pacientes con EPOC con un FEV1 medio del 41%. A 191 pacientes se les administró 18 µg de tiotropio una vez al día y a 97 enfermos 40 µg de ipratropio cuatro veces al día. Se realizó un seguimiento durante 13 semanas. En este período de tiempo se valoraron FEV1 y FVC a las 0,5, 1, 2, 3, 4, 5 y 6 h tras la inhalación de los fármacos en los días 1, 8, 50 y 92. Durante el tratamiento se objetivó una mayor respuesta en el grupo que recibió tiotropio a partir de la tercera hora de su administración (fig. 6), aunque en las mediciones efectuadas tras la primera dosis se observó un comienzo de acción más rápido en el grupo tratado con ipratropio. Igualmente, se observó una mejoría del PEF matutino hasta la décima semana y del PEF nocturno hasta la séptima semana a favor del grupo de pacientes tratados con tiotropio. Es de destacar la mejora significativa que consiguió tiotropio en relación con ipratropio sobre los valores de FEV1trough. Asimismo, en el grupo del nuevo anticolinérgico se observó una reducción significativa en el uso de salbutamol de rescate. En cuanto a efectos adversos, la sequedad de boca fue más frecuente cuando se usó el tiotropio (el 14,7 frente al 10,3%). En ambos casos este síntoma comenzó alrededor de la cuarta semana y persistió en dos tercios de los sujetos, aunque en ningún momento fue motivo de abandono del estudio. A la vista de estos
datos, se pudo concluir que una dosis única de 18 µg de tiotropio es más efectiva que 40 µg de ipratropio cuatro veces al día durante las 13 semanas. Además, ambas pautas son similares en cuanto a perfil de seguridad17.
Fig. 6. Valores medios de FEV1 antes y durante las 6 horas siguientes a la inhalación de tiotropio e ipratropio. *p < 0,05 para tiotropio frente a ipratropio. (Modificado de la referencia 17).
Ensayos clínicos de un año de duración
Recientemente se han presentado los resultados de 4 ensayos clínicos a más largo plazo (1 año). Dos de ellos, realizados en EE.UU., controlados con placebo, mientras que los otros dos llevados a cabo en Europa fueron controlados con bromuro de ipratropio. En los dos primeros, se seleccionó a un total de 921 pacientes, de los que 550 recibieron tiotropio (18 µg/día entre las 8:00 y las 10:00 h) y 371, placebo. Se observó una mejoría en el FEV1 y la FVC (3 h después de la dosis), el FEV1trough (23-24 h después de la última dosis) y el PEF matutino y nocturno, con respecto al placebo. Estas mejorías se han mantenido en el tiempo, a lo largo del año de estudio, no apareciendo taquifilaxia. Un dato muy interesante es que el tiotropio parece reducir la pérdida de FEV1trough a lo largo del tiempo (del día 50 al 344). También se puso de manifiesto que el tiotropio redujo el uso de ß2-adrenérgicos de acción corta y que su tolerancia y perfil de seguridad fue similar al placebo18,19.
Los ensayos europeos, controlados con ipratropio, han seleccionado a un total de 535 enfermos, de los que 356 recibieron tiotropio (18 µg/día) y 179 ipratropio (40 µg/6 h). Estos trabajos también han mostrado una mejoría en la función pulmonar de los pacientes que han recibido tiotropio con respecto a ipratropio. Además, es de destacar que las mediciones del PEF matutino y nocturno fueron superiores en el grupo que recibió tiotropio y que estos resultados se mantuvieron en el tiempo. Asimismo, los enfermos tratados con tiotropio requirieron menos salbutamol de rescate que los pacientes que recibieron ipratropio20.
Otros aspectos que han sido valorados en estos trabajos han sido la disnea, medida con el índice de disnea basal (IDB) y el índice de disnea transicional (IDT), y la calidad de vida relacionada con la salud, evaluada mediante el cuestionario de St. George (SGRQ). El tiotropio ha mejorado de forma significativa la disnea y los parámetros de calidad de vida, y ha sido significativamente superior al placebo o al ipratropio21.
Un aspecto especialmente interesante de estos ensayos ha sido el efecto del tiotropio sobre las exacerbaciones respiratorias frente a placebo e ipratropio. Se ha observado que el tiotropio reduce el número de exacerbaciones y hospitalizaciones por año, retrasa el tiempo hasta la primera exacerbación y reduce el número de días de hospitalización.
Ensayos comparativos de tiotropio con salmeterol
Recientemente, en el Congreso Europeo de Berlín (ERS 2001) se han presentado los resultados de un estudio aleatorio, doble ciego, controlado con placebo y, a su vez, comparativo con salmeterol. En él se ha comparado de una dosis de tiotropio (18 µg) con 2 dosis diarias de salmeterol (50 µg) durante un período de 6 meses. Tanto el tiotropio como el salmeterol mejoraron el FEV1 y la FVC, y ambos fueron, siempre, superiores al placebo, si bien la acción broncodilatadora en el día 169 fue superior con tiotropio, ya que con salmeterol el efecto broncodilatador fue disminuyendo progresivamente. Además el FEV1trough fue superior, día a día, en los pacientes que habían recibido tratamiento con tiotropio frente a los que recibieron salmeterol22. Cuando se analizaron distintos parámetros de calidad de vida (SGRQ), al inicio y transcurridos los 6 meses, el grupo que recibió salmeterol sólo consiguió mejoría en las variables que evaluaban los síntomas, con relación al grupo placebo, mientras que los que se trataron con tiotropio lo hicieron significativamente en la globalidad de las variables medidas con el SGRQ23. Re-
sultados similares se obtuvieron cuando se valoró la disnea24.
Dispositivo de administración del tiotropio
En todos los trabajos reseñados, el tiotropio se administró con un dispositivo de inhalación de polvo seco denominado HandiHaler®. Su mecanismo de acción se basa en la evacuación del polvo contenido en una cápsula, previamente perforada, mediante el flujo inspiratorio del paciente. Estudios in vitro realizados con este dispositivo muestran que flujos inspiratorios de 15 l/min son suficientes para vaciar la cápsula. Estudios realizados con HandiHaler®, en un grupo de 26 enfermos con EPOC con grados diferentes de FEV1 (menor o igual al 27%, entre el 28-45%, y entre el 46 y el 65%), concluyeron que todos los enfermos fueron capaces de generar suficientes flujos inspiratorios para vaciar las cápsulas de tiotropio.
Conclusiones
Tras la comercialización de este nuevo fármaco, será preciso revaluar los protocolos terapéuticos actualmente establecidos1,25-30. Así, los enfermos incluidos en los estadios II y III (pacientes con síntomas continuos y limitados en su actividad física y calidad de vida), según la nueva clasificación de la iniciativa GOLD, podrían beneficiarse de un tratamiento de mantenimiento con tiotropio más el uso a demanda de un ß2-adrenérgico de corta duración. En caso de que la respuesta fuese subóptima, podría asociarse a tiotropio un ß2-adrenérgico de larga duración administrado dos veces al día.
Es preciso señalar que, fuera de todo protocolo terapéutico, el clínico siempre ha de evaluar cuidadosamente la efectividad de la terapia combinada en un paciente concreto y ajustar la respuesta obtenida a los efectos secundarios presentados.
Hasta este momento sólo el abandono del hábito tabáquico y el cumplimiento de la oxigenoterapia crónica domiciliaria han demostrado ser capaces de reducir la mortalidad en la EPOC. Se requieren más estudios que confirmen la hipótesis de que tiotropio, un nuevo anticolinérgico de acción prolongada, seguro y eficaz, es capaz de modificar la historia natural de esta enfermedad crónica y progresiva.