En la práctica, en presencia de una infección bacteriana, el clínico dedica la mayor parte de su esfuerzo a la elección del tipo de antimicrobiano que, atendiendo a los datos epidemiológicos, localización de la infección y edad del paciente, sea activo frente a los microorganismos causales más frecuentes. Sin embargo, en ocasiones se presta un menor interés a otros aspectos del tratamiento, como son la dosis empleada, el intervalo de dosificación o la duración global1. Por otro lado, en muchas situaciones clínicas disponemos de varias opciones terapéuticas con una eficacia similar. La elección concreta en cada paciente suele basarse en varios aspectos, como son la presencia de alergias medicamentosas, la existencia de enfermedades previas (insuficiencia renal, hepatopatía, etc.) o situaciones específicas (embarazo, edad avanzada y coste)1.
En este contexto, el conocimiento de dos aspectos básicos de los antimicrobianos (su farmacocinética y su farmacodinámica) permitirá llevar a cabo un tratamiento más racional (y por tanto más eficaz) en lo que respecta a la elección de la dosis, intervalo y vía de administración, así como contribuir en situaciones concretas a la elección de un determinado antimicrobiano en presencia de opciones múltiples1,2.
En este artículo pretendemos, de forma breve, indicar algunos aspectos farmacocinéticos y farmacodinámicos de uso práctico, y remitimos al lector interesado a completas y excelentes revisiones en profundidad de este tema2-13.
Fases de la administración de un antimicrobiano
Cuando se administra un fármaco antimicrobiano, pueden distinguirse tres fases consecutivas: una fase farmacéutica, en la que el principio activo se libera en el lugar de absorción; una fase farmacocinética, en la que el medicamento llega hasta la localización en la
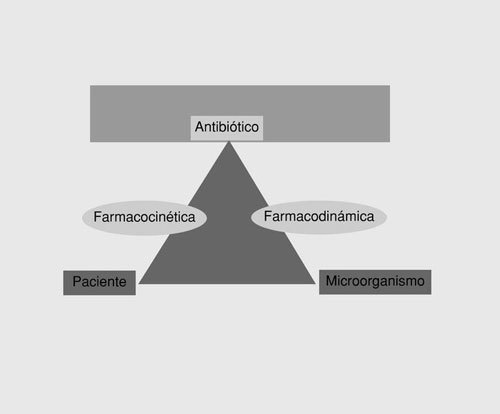
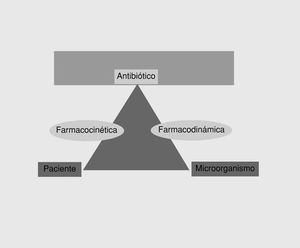
que ejerce sus efectos, y una fase farmacodinámica en la que el fármaco interacciona con el microorganismo responsable. Aunque los aspectos farmacéuticos tienen interés en la práctica (p. ej., la rapidez de liberación del principio activo es diferente en una gragea, una cápsula o un comprimido), en este artículo únicamente señalaremos los aspectos farmacocinéticos o farmacodinámicos. Ambos aspectos miden, respectivamente, dos de los lados del triángulo terapéutico12 (fig. 1), es decir, la farmacocinética evalúa la interacción entre el antimicrobiano y el paciente, mientras que la farmacodinámica evalúa la interacción entre el antimicrobiano y el microorganismo. Por tanto, las medidas que realmente son útiles en la predicción de la eficacia son aquellas en las que se contemplan ambos aspectos.
Fig. 1. El triángulo terapéutico.
Datos farmacocinéticos
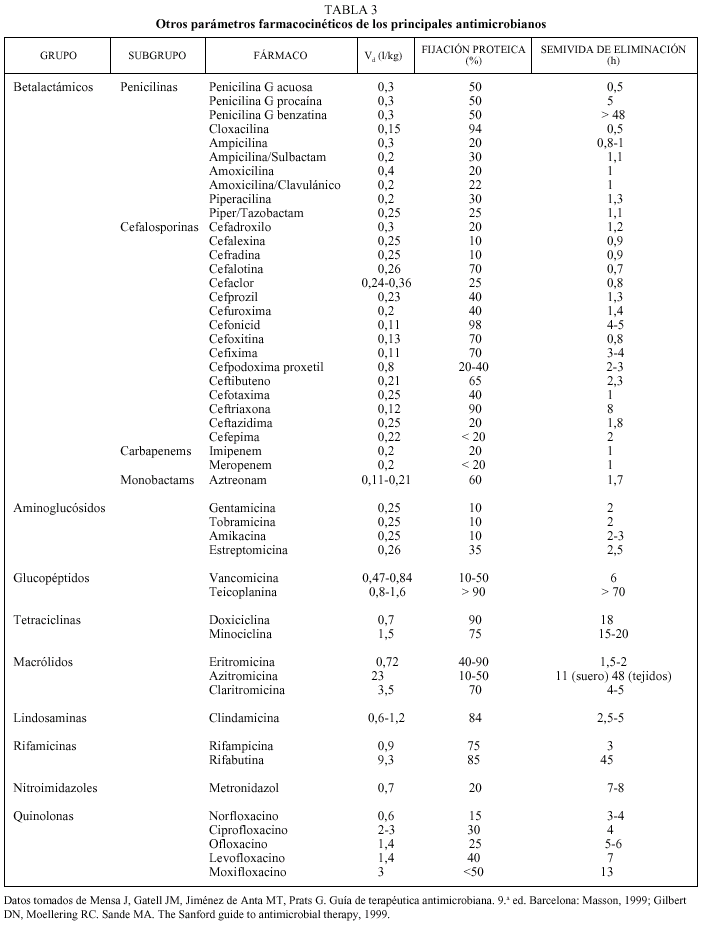
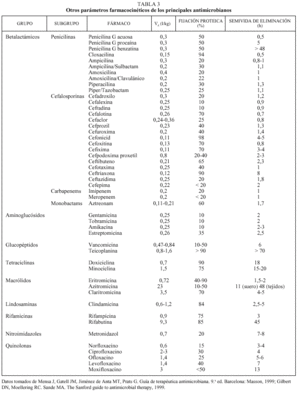
Tradicionalmente, el estudio de la farmacocinética de un determinado antimicrobiano implica la consideración de 4 elementos diferentes: la absorción, la distribución, la metabolización y la excreción. Los 4 procesos, considerados de forma global, conducen a la presencia de una determinada concentración de antimicrobiano en un determinado momento y en un determinado lugar. Las principales magnitudes farmacocinéticas que se utilizan en la práctica son: la concentración sérica máxima (Cmáx), el tiempo máximo (tmáx), el área bajo la curva (ABC0-), la biodisponibilidad, el volumen de distribución (Vd), el grado de unión a las proteínas y la semivida de eliminación (t1/2).
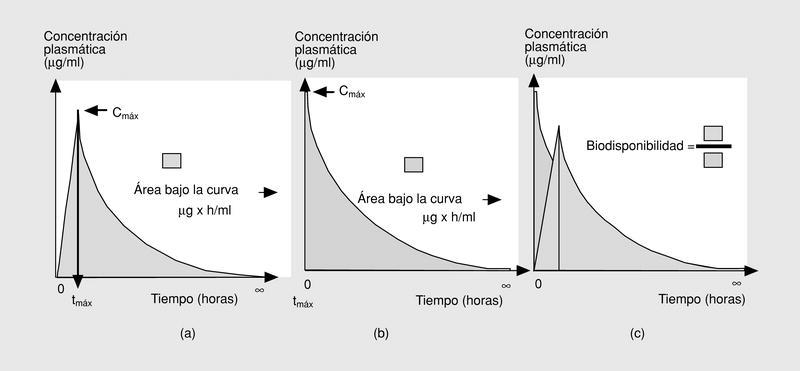
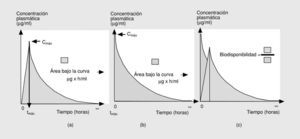
Las tres primeras magnitudes (Cmáx, tmáx y ABC0-) son fácilmente comprensibles si representamos gráficamente lo que sucede tras la administración de una dosis de antimicrobiano por vía oral (fig. 2a)13. En esta situación, el fármaco iniciará su absorción (y, simultáneamente, los otros procesos farmacodinámicos) y alcanzará, en un determinado tiempo (tmáx), una concentración sérica máxima (Cmáx). El área bajo la curva (ABC0-) es la cantidad de antibiótico biodisponible entre el tiempo 0 e infinito, teniendo en cuenta que la con centración plasmática disminuye de forma exponencial. Si consideramos que la Cmáx se mide en µg/ml y el tmáx en horas, el área bajo la curva se mide en µg * h/ml. Es fácil comprender que cuando los fármacos se administran por vía intravenosa, la Cmáx se alcanza en el momento 0 y que el tmáx es, lógicamente, 0 h (fig. 2b).
Fig. 2. Datos farmacológicos.
Íntimamente relacionado con los conceptos anteriores se encuentra el de biodisponibilidad, definido como el cociente entre el ABC0- obtenida con una dosis y el ABC0- tras la administración de la misma dosis por vía intravenosa (fig. 2c). Evidentemente, sólo podremos calcular la biodisponibilidad en aquellos fármacos que se puedan administrar por ambas vías (oral e intravenosa), que por definición será 0 en aquellos fármacos que debido a su extrema hidrosolubilidad sólo pueden administrarse por vía intravenosa (en concreto las cefalosporinas parenterales, los aminoglucósidos y los glucopéptidos) (tabla 1). El conocimiento de esta magnitud puede ayudar en la toma de decisiones terapéuticas. Así, podemos observar que la biodisponibilidad de la eritromicina es baja y, por ello, su administración por vía oral o intravenosa no es equivalente desde el punto de vista farmacocinético. Sin embargo, la biodisponibilidad del levofloxacino es excelente por lo que, si no existen otros factores asociados, su administración por vía oral o intravenosa es prácticamente equivalente. Íntimamente relacionado con este aspecto se encuentra el efecto de la ingesta sobre la absorción oral de los antimicrobianos orales. En la tabla 2 se indica el efecto que ejercen la ingesta de comida sobre la absorción de los principales antimicrobianos orales. Cabe destacar la diferencia existente entre un retraso en la absorción (que disminuye la Cmáx, pero no altera la cantidad de fármaco absorbida) y una disminución de la absorción. De esta forma, el retraso en la absorción sólo tendrá importancia práctica en los antimicrobianos cuyo mecanismo bactericida sea concentración-dependiente (véase más adelante).
Otra magnitud farmacocinética de interés es el volumen de distribución aparente (Vd), que evalúa la relación entre la cantidad de antibiótico presente en el organismo y su concentración plasmática (Vd = dosis/concentración plasmática); se mide en litros o l/kg. La denominación «aparente» deriva de la consideración del organismo como un único compartimiento en el que el fármaco está uniformemente distribuido3. Por otra parte, como inmediatamente después de la administración de un fármaco comienzan los procesos de biotransformación y excreción, en el cálculo de esta magnitud debe extrapolarse la concentración a la existente en el momento 0. Teniendo en cuenta que el agua corporal constituye aproximadamente el 60% del peso corporal y que éste se distribuye en dos tercios correspondientes al líquido intracelular y un tercio correspondiente al líquido extracelular (tres cuartas partes en el líquido intersticial y una cuarta parte en el plasma), el conocimiento del volumen de distribución ayuda a deducir el tipo de distribución del antibiótico. Así, si el Vd es inferior a 0,06 l/kg, el fármaco quedará confinado en el espacio intravascular; los fármacos con Vd entre 0,06 y 0,21 l/kg difundirán al líquido intersticial, y aquellos con un Vd entre 0,21 y 0,6 l/kg penetrarán en el espacio intracelular. Si el Vd de un fármaco es superior a 0,6 l/kg, significará que el fármaco se acumula en el espacio intracelular. En la tabla 3 se indican los volúmenes de distribución aparente de los principales antibióticos. Como puede observarse, los antimicrobianos eficaces en el tratamiento de microorganismos intracelulares deben tener un Vd superior a 0,6 l/kg.
El grado de fijación a las proteínas plasmáticas es otro factor importante en la actividad de un antimicrobiano debido a varios factores8. El dato más evidente es la competencia farmacológica que puedan ejercer sobre otros medicamentos administrados de forma simultánea. En este sentido, tiene interés señalar que no sólo es importante el grado de fijación a las proteínas, sino el tipo de proteínas a las que se unen. Así, los ácidos débiles (p. ej., betalactámicos, quinolonas, tetraciclinas) se unen principalmente a la albúmina, mientras que las bases débiles (macrólidos, aminoglucósidos, clindamicina) se unen principalmente a alfa-1-antitripsina. Por otro lado, el grado de fijación proteica influye directamente en la actividad antimicrobiana, ya que únicamente la fracción libre del antimicrobiano es capaz de ejercer un efecto farmacológico. Por ello, al aumentar la fijación proteica disminuye la concentración libre. En este sentido, se ha señalado que un grado de fijación proteica superior al 80-90% se considera significativo. No obstante, esta interpretación debe ser matizada por el hecho de que al aumentar la fijación proteica aumenta la semivida de eliminación (véase más adelante) en aquellos antimicrobianos eliminados únicamente por filtración glomerular y por lo tanto aumenta el tiempo de contacto entre el fármaco y la bacteria. Por todo ello, el grado de fijación proteica puede ser positivo o negativo, dependiendo principalmente de la relación entre la concentración libre del fármaco y la CIM (véase más adelante) del antibiótico frente a los microorganismos implicados8.
La semivida de eliminación (t1/2) equivale al tiempo que tarda en reducirse a la mitad la concentración de un determinado fármaco. La semivida de eliminación depende fundamentalmente de dos factores: el aclaramiento plasmático y el volumen de distribución según la siguiente expresión:
Volumen de distribución /Aclaramiento plasmático
Por ello, la semivida de eliminación aumenta cuando el volumen de distribución es mayor (tabla 3) o disminuye el aclaramiento del fármaco.
El conocimiento de la semivida de eliminación tiene importancia práctica en la posología, ya que habitualmente se alcanza el estado de meseta (steady state) de las concentraciones máximas y mínimas cuando han transcurrido 4 o 5 vidas medias. De forma similar, cuando ha finalizado la administración de un antibiótico y han transcurrido entre 4 y 5 vidas medias, podemos considerar que su concentración plasmática es 0. También es importante el conocimiento de la semivida de eliminación con vistas a administrar una «dosis de carga» cuando se va a tratar un proceso grave y es preciso alcanzar rápidamente una fase de meseta. Esta dosis de carga debe administrarse cuando la semivida de eliminación es superior a 3 h, y se calcula fácilmente multiplicando la concentración plasmática deseada por el volumen de distribución.
Aunque la mayor parte de los datos farmacocinéticos se obtienen en plasma o suero, la mayor parte de las infecciones tienen lugar en el intersticio de los tejidos. Por ello, es importante señalar que en estudios experimentales se ha observado que ambas concentraciones (suero y líquido intersticial) son similares. Sin embargo, esta afirmación no puede generalizarse a las cavidades (oído medio, senos paranasales) ni a colecciones de líquidos en serosas (pleural, peritoneal). En estas situaciones (efecto cavidades), la baja relación entre la superficie de aporte de antibiótico y el volumen hacen que el antimicrobiano alcance concentraciones locales bajas, pero con una mayor duración del efecto, por lo que es posible que en infecciones situadas en los lugares descritos sean más adecuadamente tratadas con dosis más elevadas a intervalos más espaciados.
Para finalizar este apartado, debemos indicar que la penetración de los antimicrobianos en los diferentes teji dos está sujeta a factores locales. Así, en algunos órganos (p. ej., SNC, próstata o hueso) la penetración de antimicrobianos está limitada, mientras que en otras localizaciones (p. ej., tracto urinario) la concentración local del antimicrobiano es superior a la plasmática. En este sentido, el excelente trabajo de revisión de Nix14 recopila los datos disponibles acerca de las concentraciones de diferentes grupos de antimicrobianos en diferentes compartimientos del aparato respiratorio (mucosa bronquial, líquido epitelial pulmonar o macrófagos alveolares).
Datos farmacodinámicos
La interacción de un antimicrobiano con un microorganismo susceptible puede tener como consecuencia la muerte o la lesión del agente biológico y la liberación de material proinflamatorio.
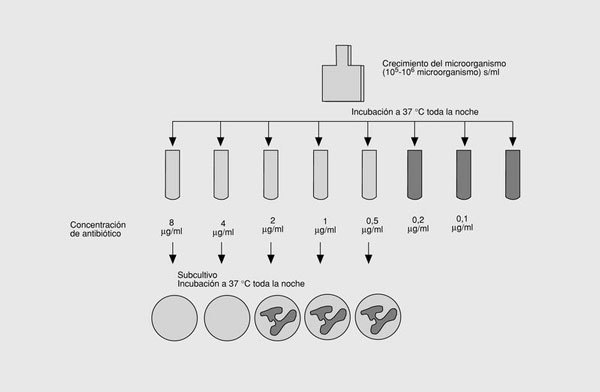
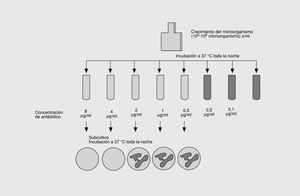
Tradicionalmente, la farmacodinámica ha estudiado el primero de los aspectos, cuya medida característica de interacción es la concentración inhibitoria mínima (CIM), definida como la menor concentración de antimicrobiano que inhibe el crecimiento visible de un inóculo de 105 UFC/ml. Una magnitud muy relacionada con la anterior es la concentración bactericida mínima (CBM), definida como la menor concentración de antimicrobiano que destruye el 99,9% de un inóculo de 105 UFC/ml (fig. 3). Habitualmente, la CBM es la misma o como máximo una o dos diluciones mayor que la CMI. Ambas magnitudes se expresan en µg/ml o mg/l y son específicas para cada antimicrobiano y cada microorganismo. Aunque la utilidad de la CIM como medida principal de la farmacodinámica ha sido criticada por motivos teóricos8, en la actualidad es la única magnitud satisfactoria in vitro de la actividad intrínseca de los antimicrobianos.
Fig. 3. Concentración inhibitoria mínima y concentración bactericida mínima.
La propia técnica de determinación de la CIM y CBM permite definir dos conceptos relacionados: el efecto inóculo y el concepto de tolerancia8. Teniendo en cuenta que las determinaciones de las magnitudes expuestas se basa en el empleo de una cantidad concreta de bacterias, no puede predecirse si la CIM o CBM es idéntica cuando existe una concentración más elevada (como la que puede encontrarse en determinadas situaciones clínicas). En este contexto, se define como efecto inóculo a aquella situación en la que al aumentar el inóculo se incrementa la CIM. Principalmente se ha observado el efecto inóculo en betalactámicos en relación con bacilos gramnegativos. En este sentido, se ha observado un efecto inóculo con las ureidopenicilinas y las cefalosporinas de tercera generación, pero no con las cefalosporinas de segunda generacion o carbapenems15. Otro concepto derivado de la determinación de la CIM/CBM es el de tolerancia. Este término hace referencia a la situación en la cual el valor de la CBM es muy superior al de la CIM16. Se ha descrito la tolerancia bacteriana principalmente en bacterias gramnegativas cuando se emplean betalactámicos en su tratamiento y se ha atribuido este fenómeno a la inhibición de los mecanismos de autólisis. En general, se considera que la tolerancia bacteriana no se asocia a una evolución clínica menos favorable que en las infecciones por cepas no tolerantes8.
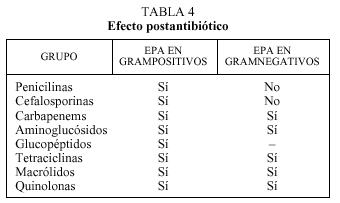
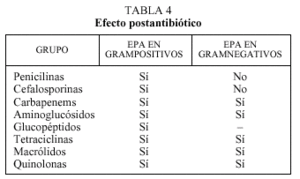
Otro concepto farmacodinámico de interés práctico en la interacción de los antimicrobianos y bacterias es el denominado efecto postantibiótico (EPA)5,7,17. Este fenómeno consiste en la supresión del crecimiento antibacteriano tras la exposición a un antibiótico o, expresado de otra manera, el tiempo que tarda un organismo en recuperarse de los efectos producidos por el antimicrobiano7. El efecto postantibiótico depende del tipo de antimicrobiano y de la especie, tal como se expresa en la tabla 4. La consideración del efecto postantibiótico se ha empleado en la dosificación de la mayor parte de los antimicrobianos (cuya administración teóricamente debería realizarse a intervalos menores si tenemos en cuenta su semivida de eliminación). Sin embargo, en la última década, la aplicación de este concepto a la práctica clínica ha modificado sustancialmente la pauta de administración de los aminoglucósidos, que debe ser en dosis única diaria (en vez de en dosis fragmentada cada 8 h) con lo que aumenta la eficacia y la comodidad de administración, y disminuye, por otro lado, la toxicidad. La única excepción a esta afirmación la constituye la endocarditis enterocócica18.
La liberación de material proinflamatorio es un aspecto menos considerado en el tratamiento antimicrobiano. Sin embargo, cuando en presencia de una infección es posible emplear diversos antimicrobianos con el resto de características similares, la escasa liberación de material proinflamatorio se considera una ventaja terapéutica19.
Índices de eficacia antibiótica (relación farmacocinética/farmacodinámica)
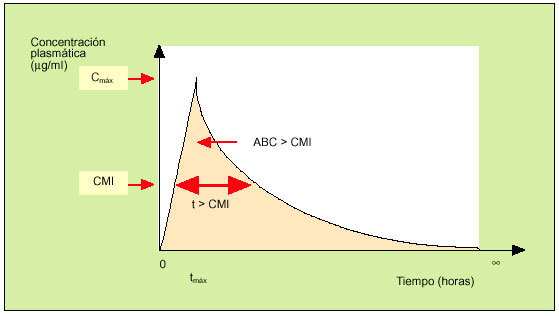
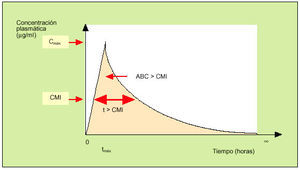
En la práctica, las magnitudes más interesantes para el clínico son aquellas en las que se evalúan de forma conjunta los datos farmacocinéticos y los farmacodinámicos. En este sentido, las tres magnitudes son el cociente Cmáx/CIM, el tiempo que la concentración del antibiótico está por encima de la CIM (t > CIM) y el área bajo la curva por encima de la CIM (ABC > CIM)1. En la figura 4 se representan gráficamente estos conceptos. Sin embargo, cuando se evalúa la eficacia de un determinado antimicrobiano, no todas estas magnitudes son equivalentes. En este sentido, cabe señalar que la «forma de matar» de los antimicrobianos puede habitualmente adscribirse a uno de estos dos patrones: un modelo tiempo-dependiente o un modelo concentración-dependiente1,3.
Fig. 4. Relación farmaco-cinética/farmacodinámica.
En los antimicrobianos que siguen un modelo tiempo-dependiente, la eficacia depende básicamente de la mayor duración de contacto entre el antimicrobiano y la bacteria. Los fármacos que siguen este modelo de actuación se indican en la tabla 5. En este tipo de fármacos, la magnitud que mejor evalúa la eficacia terapéutica es el t > CIM. En concreto, en estudios realizados con betalactámicos se ha comprobado que en presencia de neutropenia (en cuyo contexto la destrucción bacteriana depende exclusivamente del antibiótico), es preciso que los niveles de penicilinas o cefalosporinas superen la CIM entre el 90-100% del intervalo entre las dosis frente a estreptococos o bacilos gramnegativos, mientras que en las infecciones estafilocócicas (en las que existe EPA) únicamente es preciso que la concentración supere la CIM entre el 50-60% del intervalo de la dosis. En ausencia de neutropenia, el intervalo de tiempo que el antibiótico debe de estar por encima de la CIM debe ser entre el 25-30% para las penicilinas, 25-40% para las cefalosporinas y 20% para los carbapenems. En otros grupos de fármacos «tiempo-dependientes» (macrólidos, glucopéptidos, clindamicina) se dispone de menor información acerca del t > CIM preciso para un adecuado efecto terapéutico10. En la práctica, podemos utilizar este concepto aplicando la siguiente fórmula8:
% t > CIM = ln ( Dosis /Vd * CIM ) * t1/2 /0,693 * 100 / Intervalo de dosis
En esta fórmula el Vd se expresa en litros y la CIM en mg/l, mientras que la semivida de eliminación y el intervalo entre dosis se expresa en horas.
En los antimicrobianos que siguen un modelo concentración-dependiente, la eficacia depende básicamente de la presencia de elevadas concentraciones del mismo en contacto con las bacterias. Los fármacos que siguen este modelo de actuación se detallan en la tabla 5. Las magnitudes que evalúan la eficacia terapéutica de este grupo son el cociente Cmáx/CIM y el ABC > CIM. En concreto, en aminoglucósidos se consigue una eficacia superior al 90% cuando la relación entre la Cmáx/CIM es superior a 8-109. En la evaluación de la eficacia terapéutica de las quinolonas se ha comprobado que la eficacia terapéutica se consigue cuando el ABC > CIM es superior a 125 o cuando la relación entre la Cmáx/CIM es mayor de 10-2011.