La enfermedad pulmonar obstructiva crónica (EPOC) es una enfermedad frecuente en nuestro medio, y constituye una de las principales causas de morbimortalidad en la población general que junto al asma o la neumonía, representa la tercera o cuarta causa más frecuente de mortalidad en la Unión Europea. La EPOC se caracteriza por una reducción poco reversible y habitualmente progresiva de los flujos espiratorios atribuible a una afectación de la vía aérea o la presencia de enfisema pulmonar. Las formas más graves suelen presentar una combinación de ambos y se diagnostican de forma tardía, cuando el paciente ya presenta síntomas y una mayor reducción del máximo volumen espirado en el primer segundo (FEV1).
El abandono del tabaco sigue siendo la única medida que ha demostrado detener el progresivo deterioro del FEV1, mientras la oxigenoterapia continua domiciliaria ha permitido ofrecer a estos pacientes una prolongación de la vida cuando cumplen los criterios para realizarla. En los pacientes con una enfermedad avanzada se han intentado otras medidas que incluyen, fundamentalmente, el tratamiento broncodilatador (betamiméticos, anticolinérgicos y teofilinas), corticoides y la rehabilitación pulmonar, capaces de aliviar o mejorar su sintomatología y la calidad de vida en la mayoría de los casos, pero con una repercusión mínima en las pruebas funcionales. A pesar de todos estos avances, un número no despreciable de pacientes con una EPOC avanzada no consiguen una calidad de vida aceptable y asistimos a una progresión de su enfermedad o un riesgo elevado de mortalidad, lo que ha obligado a seguir buscando nuevos tratamientos.
La búsqueda de terapias efectivas para el tratamiento de estos enfermos ha incluido la posibilidad de introducir distintas técnicas quirúrgicas capaces de alterar o sustituir las anomalías fisiopatológicas de la enfermedad, entre las que han destacado la parálisis frénica, la costocondrectomía, la toracoplastia, el neumoperitoneo, la neumectomía parcial, la bullectomía y, en los últimos años, la posibilidad de la cirugía de reducción de volumen pulmonar en el enfisema o el trasplante pulmonar. Los malos resultados iniciales desalentaron a la mayoría de los grupos hasta el desarrollo de las dos últimas, gracias a la mejora de las técnicas utilizadas, la amplia disponibilidad de fármacos inmunosupresores y el reconocimiento de la necesidad de realizar una ajustada selección de todos los casos, cuya revisión actualizada nos proponemos realizar en este artículo.
Bullectomía
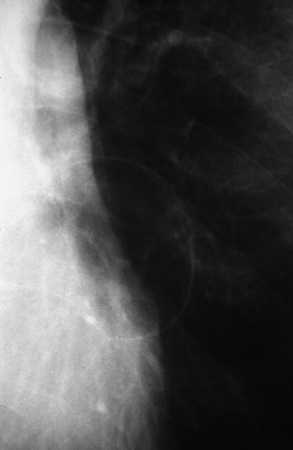
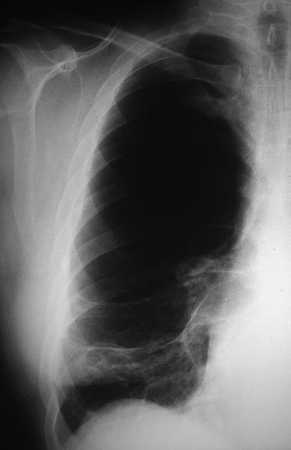
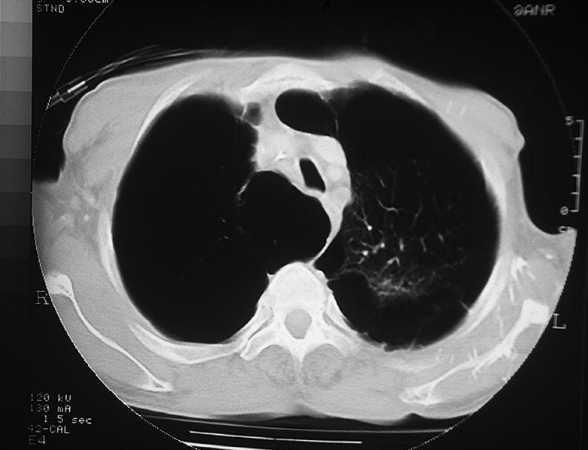
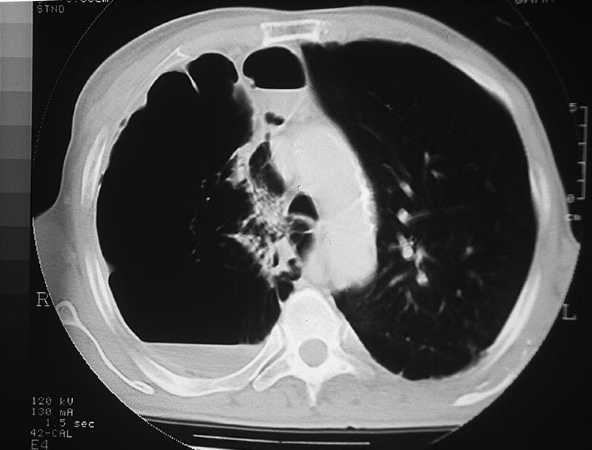
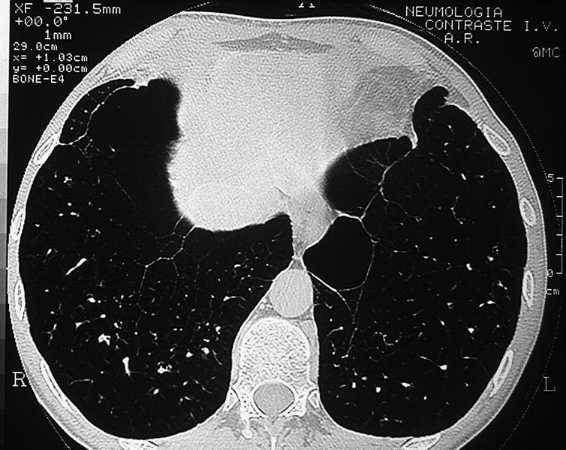
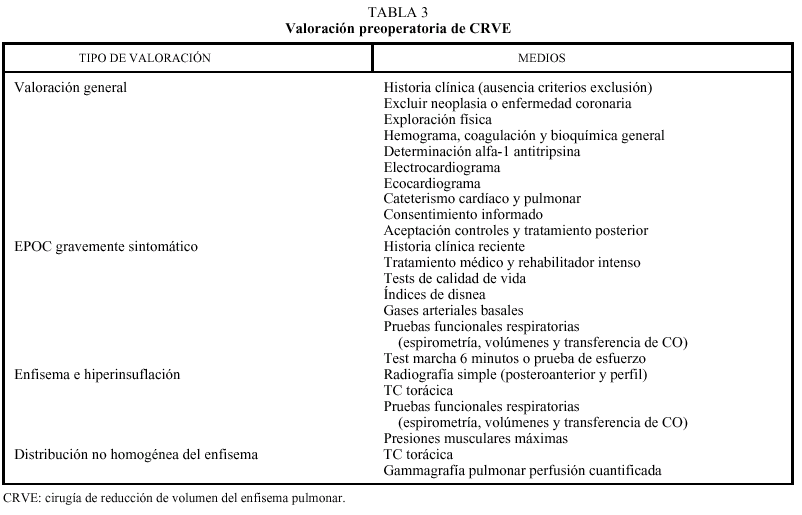
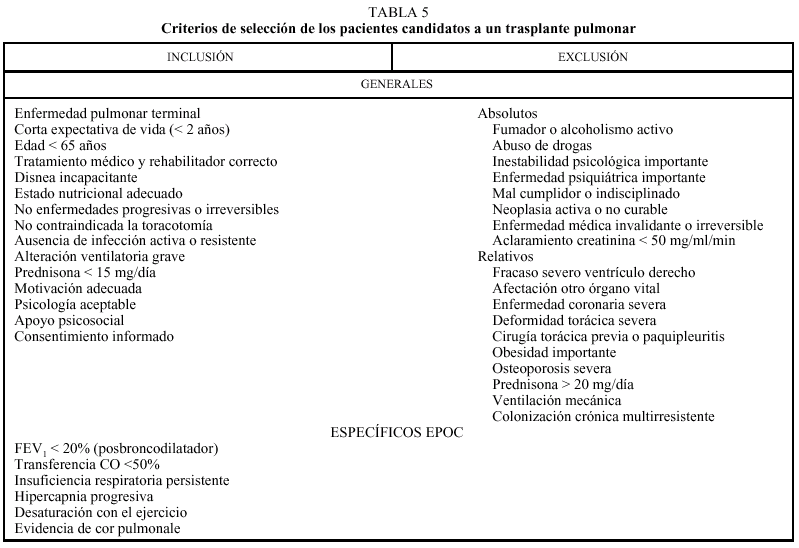
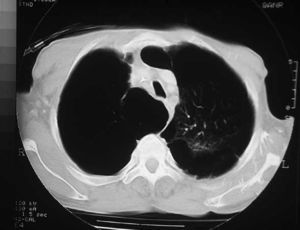
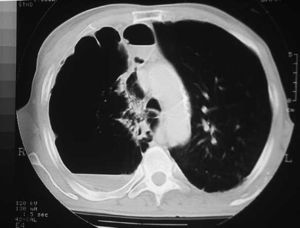
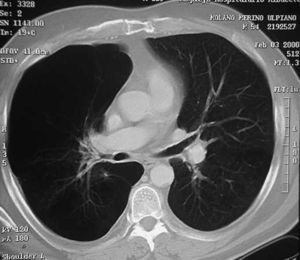
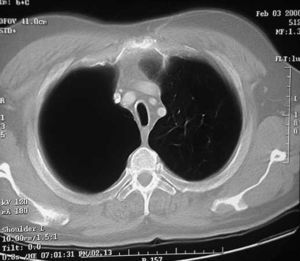
Las bullas son grandes espacios de contenido aéreo dentro del parénquima pulmonar (mayores de 1 cm) que son provocados por la obstrucción, dilatación y confluencia de los espacios aéreos distales a los bronquios terminales, que pueden presentarse de forma aislada o en el contexto de un enfisema bulloso. La mayoría de bullas aisladas suelen ser asintomáticas hasta alcanzar un gran tamaño o afectar a estructuras vecinas, detectándose habitualmente en la radiografía simple o la tomografía computarizada (TC). Hasta en el 15% de los casos, la radiografía pone de manifiesto un espacio aéreo bien delimitado por una pared fina o lineal, sin vascularización en su interior (fig. 1) y que ocasionalmente puede comprimir el mismo parénquima pulmonar homolateral (fig. 2) o al hemitórax contralateral, aunque estos hallazgos suelen ser más evidentes cuan do utilizamos la TC torácica que es la técnica de elección para su diagnóstico (fig. 3). Su evolución es variable y algunas bullas pueden desaparecer de forma e spontánea o tras un proceso infeccioso, mantenerse estables, crecer progresivamente o complicarse por una infección, una hemorragia o un neumotórax (fig. 4).
Fig. 1. Radiografía simple de tórax. Espacio aéreo paracardíaco izquierdo bien delimitado por una pared fina y sin vascularización en su interior compatible con una bulla.
Fig. 2. Radiografía simple de tórax (hemitórax derecho). Bulla gigante en el lóbulo superior derecho que comprime al parénquima de la base pulmonar.
Fig. 3. TC torácica. Bulla gigante en el lóbulo superior derecho que desplaza la línea media mediastínica comprimiendo el hemitórax contralateral.
Fig. 4. TC torácica. Bulla gigante que ocupa el hemitórax derecho con un nivel líquido dorsal secundario a una infección.
La bullectomía o resección quirúrgica de las bullas de gran tamaño permitirá la eliminación de estas zonas anuladas funcionalmente y facilitará la expansión del resto del parénquima pulmonar, consiguiendo mejorar las relaciones de ventilación-perfusión, disminuir el espacio muerto, mejorar la mecánica pulmonar (disminuye la hiperinsuflación y mejora la contracción diafragmática) y aumentar el número de espacios alveolares para el intercambio gaseoso. Dado que no se ha demostrado que sea útil o que produzca una mejoría significativa en todos los casos, es fundamental la elección de los pacientes cuyos criterios antes de plantearla quedan reflejados en la tabla 1, de los que la presencia de complicaciones o progresión con afectación de estructuras vecinas y la ocupación de más de un tercio del hemitórax afectado son los más valorados.
Cirugía de reducción de volumen del enfisema pulmonar
La cirugía de reducción de volumen del enfisema pulmonar (CRVE) es un procedimiento quirúrgico paliati vo utilizado para el tratamiento de un subgrupo de pacientes con un enfisema pulmonar avanzado y consiste en la resección selectiva de las zonas diana o con más enfisema para mejorar la función pulmonar. Los primeros intentos fueron realizados por Brantingan y Mueller en 1957, aunque la técnica ha sido actualizada y modificada por Cooper en 1994, constituyendo una opción de gran interés para algunos pacientes con enfisema terminal que no presentan bullas o que no disponen de un donante para el trasplante.
El enfisema se define en términos histológicos por el agrandamiento anormal de los espacios aéreos distales a los bronquios terminales, acompañado de la destrucción de la pared alveolar y una disminución de la retracción elástica. Este fenómeno justifica una obstrucción o aumento de la resistencia de las vías aéreas, con una posterior hiperinsuflación y atrapamiento aéreo que empeora la mecánica pulmonar, especialmente la contracción diafragmática. Su progresión y las alteraciones marcadas en la relación ventilación-perfusión serían las causantes de la sintomatología y el deterioro de estos pacientes, que teóricamente podría ser evitado con la CRVE. Esta cirugía facilitaría la eliminación de las zonas patológicas y la recuperación de la retracción elástica con la consiguiente disminución de la obstrucción o la hiperinsuflación, optimizando la función diafragmática y aumentando la elasticidad torácica (remodelación de la caja torácica y pulmonar). Además, la elimina-
ción de las zonas no funcionales mejoraría las relaciones ventilación-perfusión y el intercambio gaseoso.
En la actualidad, los estudios disponibles han demostrado un incremento posquirúrgico del FEV1, la capacidad vital forzada (FVC) o los parámetros de la prueba de esfuerzo y una disminución del volumen residual (RV) o la capacidad pulmonar total (TLC) que, junto a la mejora de la disnea y la calidad de vida, ha permitido considerarla como una alternativa válida al trasplante en algunos pacientes, sobre todo si consideramos que presenta un número inferior de complicaciones, evita la demora de la espera de un donante o no precisa de un tratamiento inmunosupresor. Sin embargo, aún existen algunos aspectos poco resueltos o controvertidos que incluyen establecer si los cambios producidos en la función pulmonar se mantienen o asocian a un deterioro más rápido con el tiempo, así como la correcta selección de los candidatos, la confirmación de una buena relación coste-efectividad o la disponibilidad de parámetros más definitivos para medir los resultados.
Técnica quirúrgica
Existen diversas técnicas quirúrgicas para realizar la CRVE, que incluyen un abordaje unilateral o bilateral, utilizando grapadoras quirúrgicas o láser para eliminar las zonas enfisematosas. El procedimiento bilateral con grapadoras parece superior (neumorreducción quirúrgica) y ha demostrado unos mejores resultados en la función pulmonar. No existe consenso sobre si la esternotomía media es superior a la videotoracoscopia, aunque la mayoría de estudios reflejan unos resultados similares y un mejor acceso de la toracotomía a los lóbulos más anteriores o superiores. Aunque la cifra es arbitraria y depende de la valoración intraoperatoria, suele resecarse el 20-30% de las áreas periféricas más afectadas de cada pulmón que no tienen porque seguir una anatomía lobar o segmentaria en bloque si no la afecta de forma global. Las complicaciones más frecuentes de la cirugía son las fugas aéreas persistentes (un 30-54% de los casos), las infecciones (neumonías y empiemas) o la aparición de arritmias, con una mortalidad del 4-10% en los primeros 3 meses.
Selección de los pacientes
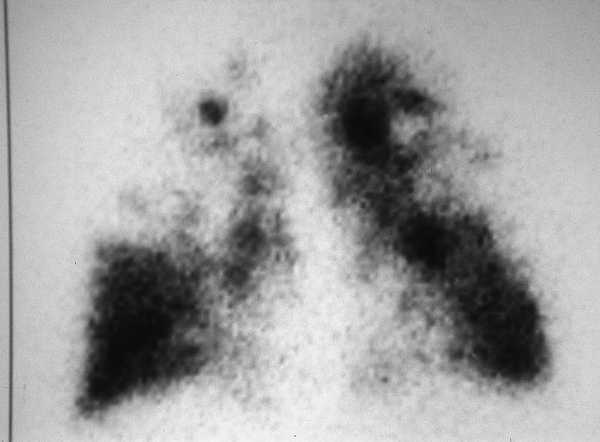
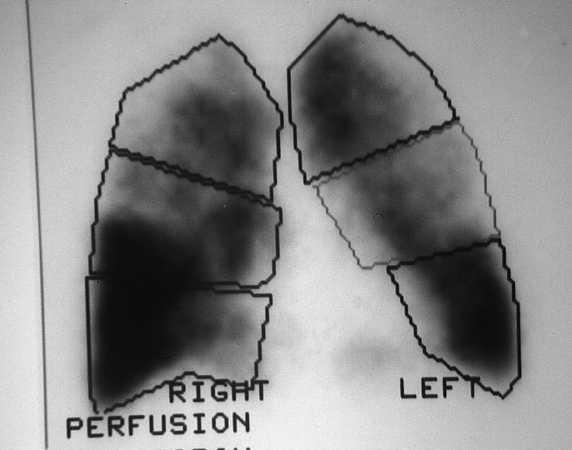
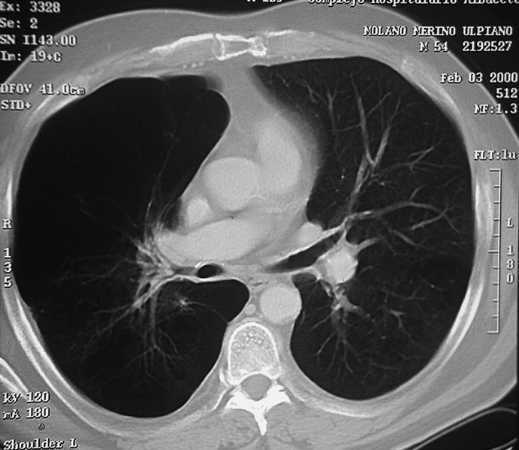
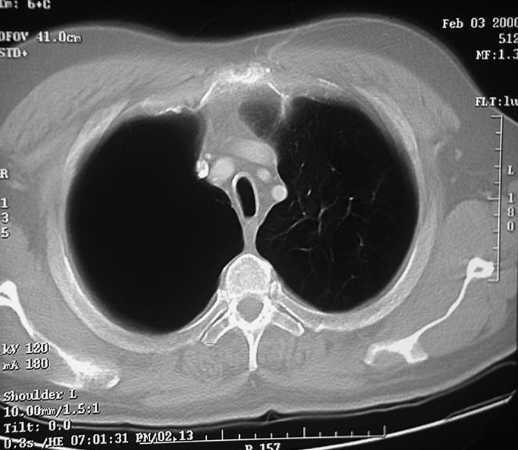
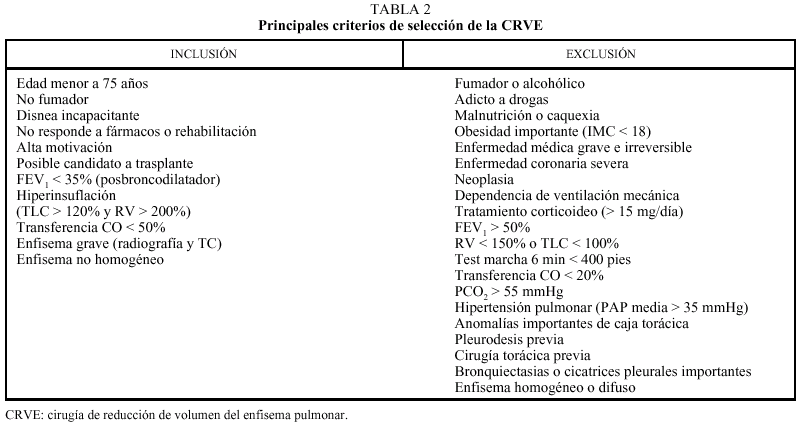
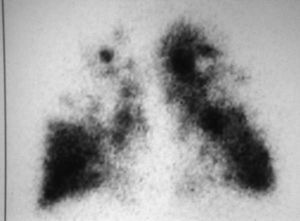
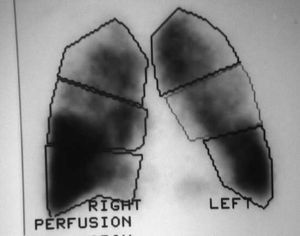
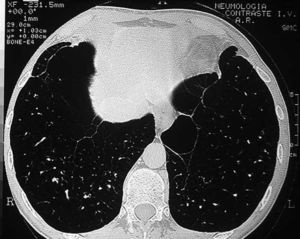
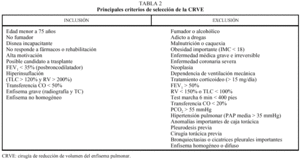
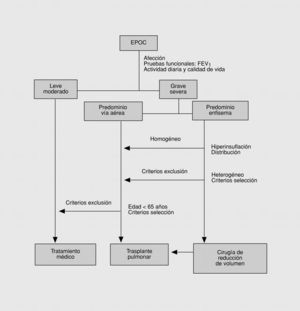
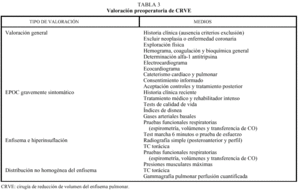
Los pacientes candidatos a la CRVE son enfermos con enfisema terminal que cumplen unos criterios de selección (tabla 2). En la mayoría de las series, los criterios evaluados siguen evolucionando a una mayor restricción con el tiempo y a una correcta selección, que ha sido considerada como fundamental, incluyendo sólo el 20% de los casos con un EPOC avanzada. Todos los pacientes deben someterse a un panel preoperatorio extenso (tabla 3) y los mejores candidatos son los que presentan una buena motivación, no han mejorado con otros tratamientos farmacológicos o un programa intenso de rehabilitación pulmonar, presentan una obstrucción o hiperinsuflación grave debida principalmente al enfisema y están afectados por un enfisema heterogéneo (con zonas diana o más afectadas por el enfisema), de predominio en los lóbulos superiores y cuya valoración debe ser realizada con la gammagrafía pulmonar cuantificada de perfusión (fig. 5) y la TC torácica (figs. 6 y 7), que debe distinguirlos de las formas difusas u homogéneas de enfisema pulmonar (fig. 8). La presencia de una edad más avanzada, una afectación predominante de la vía aérea, la hipercapnia y la hipertensión pulmonar son factores que empeoran los resultados y en algunos grupos son considerados como contraindicaciones relativas para esta cirugía.
Fig. 5 (a y b). Gammagrafía pulmonar de perfusión cuantificada. Las dos imágenes demuestran una distribución heterogénea del marcador, con una menor captación de los lóbulos superiores, especialmente del derecho.
Fig. 6. TC torácica. Enfisema pulmonar de distribución no homogénea y claro predominio derecho. Nótese la ausencia de vascularización o parénquima en el hemitórax derecho.
Fig. 7. TC torácica. Enfisema pulmonar heterogéneo que afecta al hemitórax derecho. Nótese el aspecto característico de la tráquea en desfiladero o con un diámetro anteroposterior aumentado característico de los pacientes con una EPOC.
Fig. 8. TC torácica. Enfisema pulmonar difuso y simétrico sin diferenciar zonas de mayor afectación.
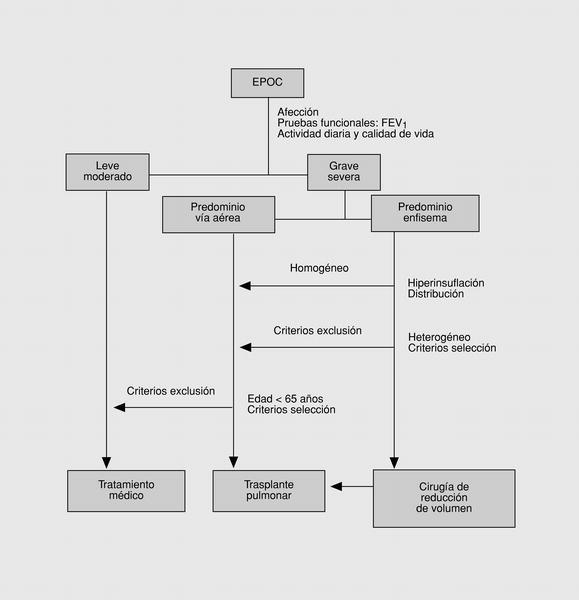
La relación de la CRVE y el trasplante pulmonar es aún controvertida y poco establecida por la falta de controles a largo plazo sobre la primera, así como el desconocimiento del efecto de la CRVE previa al trasplante o de la relación coste-efectividad obtenida de ambas intervenciones. Los estudios disponibles sugieren que la CRVE es una alternativa viable y que no contraindica un futuro trasplante, siendo aconsejada en determinados pacientes como una primera opción aunque los resultados obtenidos sean inferiores a corto plazo en la actualidad (fig. 9).
Fig. 9. Algoritmo de evaluación quirúrgica del paciente con una EPOC.
Trasplante pulmonar
El trasplante o implantación de un órgano ajeno a un individuo receptor es una opción válida en los enfermos con enfermedad pulmonar en fase terminal que no han respondido o han agotado otros tratamientos más con servadores (tabla 4). En la actualidad se han realizado más de 3.000 trasplantes pulmonares en el mundo y los resultados en este tipo de pacientes son favorables, al conseguir una mejoría en la calidad de vida o una supervivencia superior al 70% a los 2 años (un 45-50% a los 5 años). Sin embargo, es una técnica en la que aún existen algunas limitaciones que incluyen principalmente la falta de disponibilidad de donantes (en algunos países la mortalidad en la lista de espera llega al 20%), la preservación del órgano antes de trasplantarlo, las complicaciones propias del trasplante o de la inmunosupresión y la selección de los candidatos.
El primer trasplante pulmonar fue realizado por Hardy en 1963, pero los malos resultados y una supervivencia inferior a los 2 meses desanimó a otros grupos a realizarlo hasta principios de los años ochenta, donde nuevamente las mejoras técnicas, la aparición de mejores inmunosupresores y la mayor selección de los casos ha facilitado su resurgimiento y expansión. En la actualidad, han aumentado el número de enfermedades que pueden beneficiarse de él y, por su elevada prevalencia, la EPOC avanzada es la indicación más frecuente ll egando a casi el 40% de las indicaciones del registro internacional o el 29% en España. Inicialmente sólo se realizó a los pacientes con enfisema terminal primario por déficit de alfa-1 antitripsina, pero posteriormente se ha practicado a otras formas de enfisema o de EPOC que cumplan los criterios establecidos.
El trasplante pulmonar en estos pacientes ha permitido recuperar la mayoría de parámetros funcionales (va lores por encima del 80% cuando es bipulmonar o por encima del 65% cuando es unipulmonar), normalizar la gasometría antes del tercer mes y mejorar la tolerancia al ejercicio o las relaciones de ventilación-per fusión.
Tipos de trasplante pulmonar
Los primeros trasplantes en los pacientes con EPOC fueron cardiopulmonares pero posteriormente, dada la ausencia de una disfunción ventricular significativa en todos los casos y que cuando era limitada se recuperaba tras la intervención, fueron sometidos a un trasplante bipulmonar, consiguiendo unos buenos resultados y una mayor disponibilidad de donantes. En la actualidad, el trasplante unipulmonar o de un solo pulmón se ha generalizado y convertido en la modalidad más usada por la mayoría de grupos, dada la disminución del número de complicaciones, la mayor disponibilidad de órganos y unos resultados funcionales suficientes, con la posibilidad de trasplantar el otro pulmón si se rechaza el previo. Sólo se recomienda el trasplante cardiopulmonar cuando la fracción de eyección del ventrículo izquierdo es inferior al 35% o existe una enfermedad coronaria grave, y el bipulmonar cuando el paciente tiene menos de 50 años, el riesgo es elevado o existe una infección pulmonar.
Selección de los pacientes
La mayoría de grupos establecen sus propios criterios de selección basándose en los universalmente consensuados y su propia experiencia, de entre los que destacan los reflejados en la tabla 5. Existe unanimidad en descartar a aquellos pacientes con una situación desesperada, y los mejores candidatos son los que presentan una enfermedad avanzada sin otra alternativa en el tratamiento o una falta de respuesta a las medidas conservadoras, una edad inferior a los 65 años (60 años para el trasplante bipulmonar) y una corta expectativa de vida (inferior a 2-3 años), considerando como signos de mal pronóstico la presencia de hipercapnia o hipertensión pulmonar. Es imprescindible que la valoración sea individualizada y siempre existe la posibilidad de ser valorado por más de un centro si no existen claras contraindicaciones.
La ausencia de modelos teóricos precisos para determinar el momento de someter a un trasplante a un paciente con EPOC obliga a no demorar su valoración por una unidad especializada de referencia ante la duda, aunque antes deben haberse optimizado los pasos previos y los criterios de selección. En, aproximadamente, un 25% de los pacientes, éstos no han sido utilizados correctamente y son considerados como no aptos en una primera valoración, sobre todo por la ausencia de un programa previo de rehabilitación, la escasa prescripción de la oxigenoterapia domiciliaria o de un tratamiento farmacológico intenso y la excesiva utilización de corticoides acompañados de sus efectos secundarios.
Complicaciones postrasplante pulmonar
El postoperatorio inmediato de estos pacientes es un momento difícil, por la coincidencia de múltiples factores en la recuperación de la función del pulmón trasplantado con la potencial aparición de un edema de reperfusión, una hipertensión pulmonar, un fallo primario de las suturas realizadas (dehiscencia, necrosis, este nosis o fugas), hemorragias, una trombosis venosa pulmonar por fallo del injerto o un rechazo hiperagudo. Además, estos pacientes deberán seguir de forma permanente un tratamiento inmunosupresor para evitar el rechazo del órgano trasplantado y este fenómeno supone un aumento de su susceptibilidad a presentar in fecciones habituales u oportunistas que obligan a un
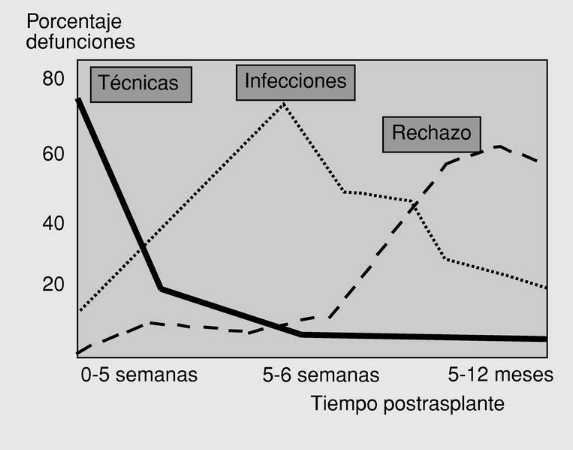
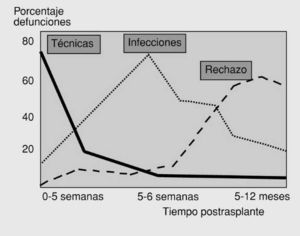
seguimiento exhaustivo por ser la principal causa de morbimortalidad de este procedimiento y tener una cronología característica (fig. 10). En las primeras 2 semanas son más frecuentes las infecciones bacterianas y a partir de la segunda o la tercera, suelen aparecer otros tipos de infecciones oportunistas entre las que destacan la infección por citomegalovirus, herpes, nocardias, toxoplasmas, micobacterias, Pneumocystiis carinii u hongos como Candida y Aspergillus, recomendando su tratamiento o profilaxis rutinaria.
Fig. 10. Cronología de las causas de mortalidad por las complicaciones postrasplante pulmonar.
La mayoría de los episodios de rechazo cursan de forma asintomática o con síntomas que sugieren una infección respiratoria, acompañados de una deterioro funcional (disminución mantenida del 10% o progresiva del FEV1) y la aparición de infiltrados difusos o lesiones inespecíficas en la radiografía que pueden visualizarse mejor con la TC. El rechazo agudo puede aparecer a partir del quinto día del trasplante con una incidencia máxima durante los primeros 2 meses y ante una mínima sospecha es obligada la realización de una broncoscopia con múltiples biopsias pulmonares endoscópicas o transbronquiales para su confirmación y la exclusión de una infección, con la intención de incrementar el tratamiento inmunosupresor. A partir de los 3 meses, en el rechazo crónico es también fundamental el diagnóstico temprano y es característica una disminución inicial de los flujos medios, con una posterior y rápida disminución del FEV1 parecido a otras formas de bronquioli-
tis obliterante que deberá confirmarse con la broncoscopia.
Bibliografía general
Arcasoy SM, Kotloff RM. Lung transplantation. N Engl J Med 1999; 340: 1081-1091.
Barnes PJ. Chronic obstructive pulmonary disease. N Engl J Med 2000; 343: 269-280.
Brenner M, Yusen R, McKenna R, Sciurba F, Gelb AF, Fischel R et al. Lung volume reduction surgery for emphysema. Chest 1996; 110: 205-218.
Cooper JD, Trulock EP, Triantafillou AN, Patterson GA, Pohl MS, Deloney PA et al. Bilateral pneumectomy (volume reduction) for COPD. J Thorac Cardiovasc Surg 1995; 109: 106-119.
Jaurena JR, Varela A, Carreño MC, López A. Trasplante pulmonar. Rev Clin Esp 1994; 194: 218-225.
Jiménez D, Díaz G, Pérez E. Cirugía de reducción de volumen para el enfisema pulmonar. Rev Clín Esp 1999; 199: 449-455.
Montemayor T, Alfajeme I, Escudero C, Morera J, Sánchez Agudo L. Normativa sobre diagnóstico y tratamiento de la enfermedad pulmonar obstructiva crónica. Arch Bronconeumol 1996; 32: 285-301.
Morales P. Trasplante de pulmón y EPOC. Arch Bronconeumol 2000; 36 (Supl 3): 38-44.
Murray JG, McAdams HP, Erasmus JJ, Patz EF, Tapson V. Complications of lung transplantation: radiologic findings. AJR 1996; 166: 1405-1411.
O'Brien GM, Criner GJ. Surgery for severe COPD. Postgrad Med 1998; 103: 179-202.
Payne DK, Markewitz BA, Owens MW. Surgical treatment of chronic obstructive pulmonary disease. Am J Med Sci 1999; 318: 89-95.
Prieto I, Poyo-Guerrero R, Liste D. Tratamiento postoperatorio del trasplante pulmonar. Med Clin (Barc) 2000; 115: 468-476.
Russi EW, Stammberger U, Weder W. Lung volume reduction surgery for emphysema. Eur Respir J 1997; 10: 208-218.
Snider GL. Reduction pneumoplasty for giant bullous emphysema. Chest 1996; 109: 540-548.
Trulock EP. Lung transplantation. Am J Respir Crit Care Med 1997; 155: 789-818.
Weinmann GG, Hyatt R. Evaluation and research in lung volume reduction surgery. Am J Respir Crit Care Med 1996; 154: 1913-1918.