La enfermedad cerebrovascular aguda, conocida también en el argot médico como «ictus» (palabra latina utilizada antiguamente para describir enfermedades con inicio brusco), constituye, junto con la cardiopatía isquémica y las neoplasias, el grupo de las tres enfermedades más importantes causantes de morbilidad y mortalidad en los países desarrollados. En España, la incidencia de ictus oscila entre 150 y 323 casos por 100.000 habitantes. Dado que su frecuencia aumenta con la edad, el ictus afecta principalmente a población geriátrica; así, la prevalencia se sitúa entre 4.012 y 7.100 casos por cada 100.000 habitantes mayores de 64 años de edad1. Más impactantes resultan aún aquellos aspectos cualitativos relacionados con la morbilidad y la discapacidad tras un episodio de enfermedad cerebrovascular aguda.
La enfermedad cerebrovascular es heterogénea y sus síntomas, evolución y pronóstico varían en función del tipo de lesión, su extensión y su localización. Existen dos grandes categorías de ictus: el hemorrágico y el isquémico. Ambos tipos de lesiones, a pesar de ser tan opuestos (exceso de sangre por hemorragia, o bien falta de sangre por isquemia), pueden lesionar de forma irreversible el tejido cerebral. La hemorragia puede causar lesión cerebral. En primer lugar, incrementando la presión intracraneal, hecho que provoca zonas de presión localizadas en áreas focales del cerebro. En segundo lugar, desconectando las vías y los centros nerviosos de las zonas próximas. En tercer lugar, provocando irritación en los vasos adyacentes generando vasoconstricción y en consecuencia isquemia. La isquemia lesiona el tejido cerebral al privarle del aporte sanguíneo necesario para el aporte de oxígeno y otros nutrientes vitales, produciéndose en consecuencia necrosis tisular y muerte neuronal.
Accidente cerebrovascular isquémico
Etiología
Varias enfermedades pueden causar un ictus isquémico; las más frecuentes en los ancianos son la arteriosclerosis de grandes y pequeñas arterias y la cardioembolia. Existe asociación entre factores de riesgo vascular y las causas más frecuentes de ictus isquémico (hipertensión, diabetes, tabaquismo, hipercolesterolemia)2. Otras enfermedades que han demostrado ser factores de riesgo para padecer un accidente cerebrovascular (ACV) son: el hecho de haber padecido accidentes isquémicos transitorios previamente (AIT), la existencia de fibrilación auricular, el infarto de miocardio y otras cardiopatías, como la miocardiopatía dilatada y la valvulopatía mitral.
Clínica del ictus isquémico
Según la duración del déficit neurológico secundario a la isquemia cerebral, clásicamente los ictus isquémicos se clasifican en: AIT (el déficit neurológico desaparece en menos de 24 h); ictus progresivo (el déficit neurológico progresa durante las primeras 24 h); ictus establecido o completo (el déficit neurológico se mantiene más de 3 semanas). Este último varía desde mínimas secuelas a grandes déficit neurológicos discapacitantes. El AIT se caracteriza por un déficit neurológico transitorio, su manifestación clínica depende del territorio vascular afectado, los más frecuentes son en el territorio de la cerebral media, y pueden aparecer episodios de trastornos del habla y debilidad en el brazo o en la mano del lado contralateral. El diagnóstico es totalmente clínico y con frecuencia es difícil de valorar cuando el médico no observa la focalidad neurológica. Esta dificultad es mayor aún en el anciano que puede presentar síntomas diversos e inespecíficos atribuibles a otras enfermedades. En general, si un episodio no tiene un inicio brusco, ni presenta en la anamnesis una focalidad neurológica coherente con un territorio cerebral, es poco probable que sea de origen vascular. En la tabla 1 se detalla una serie de síntomas que no suelen ser sugestivos de AIT. El diagnóstico adecuado de un AIT resulta de vital importancia, pues puede ser el primer síntoma de la ateromatosis carotídea. Asimismo, la presencia de AIT de repetición es indicativa de gran riesgo de desarrollar un ictus establecido.
El ictus establecido o completo presentará la forma clínica correspondiente al territorio cerebral que haya sufrido el infarto. El clásico síndrome de hemiplejía y hemihipoestesia se corresponde con un infarto hemisférico en el territorio contralateral de la arteria cerebral media. Si el hemisferio es el dominante pueden existir alteraciones en el lenguaje (afasia). Menos frecuentemente se afecta el territorio de la arteria cerebral anterior, produciéndose hemiparesia contralateral con mayor afección de la extremidad inferior; además, pueden existir incontinencia y síntomas frontales. La lesión del territorio de la cerebral posterior afecta fundamentalmente a las estructuras del tronco cerebral y del cerebelo, manifestándose como un trastorno grave de la marcha y el equilibrio, y la afección de los pares craneales.
Tratamiento en la fase aguda del ictus isquémico
Durante años se había considerado el ictus como un acontecimiento irremediable y fatal. Este hecho, unido a su alta prevalencia en edades muy avanzadas, fue causa de que durante mucho tiempo en el tratamiento de los ancianos con ictus se impusieran actitudes compasivas en favor de un nihilismo terapéutico. Hoy día está bien demostrado que los cuidados generales en la fase postaguda, la planificación del alta y la utilización adecuada de los distintos niveles asistenciales (media estancia o convalecencia, hospital de día, rehabilitación domiciliaria, etc.) son capaces de mejorar la supervivencia y minimizar las repercusiones de la discapacidad en estos pacientes3. Asimismo, el manejo protocolizado y en equipo interdisciplinario de los principales problemas y síndromes geriátricos que pudieran aparecer ha demostrado ser beneficioso en términos de disminuir la discapacidad y evitar o retrasar la institucionalización de por vida. Por otra parte, la aparición de nuevas posibilidades terapéuticas, como los fármacos neuroprotectores y la trombólisis, abre nuevas vías de tratamiento cuya eficacia ha sido demostrada incluso en edades avanzadas.
Medidas generales de tratamiento y cuidados
Manejo de la vía aérea y oxigenación. El aporte de oxígeno al sistema nervioso central depende tanto del flujo sanguíneo cerebral como del contenido arterial de oxígeno. La hipoxemia en pacientes con ictus isquémico puede empeorar la lesión debido a un aumento del metabolismo anaerobio, por lo que es recomendable la oxigenoterapia cuando la saturación de oxígeno de la sangre sea inferior al 95%4.
Control de la presión arterial. En el momento de presentación del ictus, alrededor del 80% de los pacientes tienen cifras elevadas de presión arterial, como si se tratase de un mecanismo compensatorio para aumentar el flujo cerebral. Así pues, debe evitarse la administración rutinaria de agentes hipotensores, ya que una reducción brusca de la presión arterial puede producir un empeoramiento de la isquemia cerebral, especialmente en el area periinfártica (zona de penumbra isquémica)5. No hay consenso sobre las cifras a partir de las cuales hay que iniciar tratamiento, pero diversos ensayos sugieren que hay que tratar la hipertensión cuando las cifras de presión arterial sistólica son superiores a 220 mmHg o cuando hay clínica de encefalopatía hipertensiva. Los fármacos más utilizados son los de acción corta y fácil manejo, como enalapril o labetalol.
Control de la temperatura. La hipertermia se asocia con un aumento de la mortalidad global en el caso de pacientes con ictus isquémico agudo. Ésta suele ser debida, con frecuencia, a la existencia de un proceso infeccioso intercurrente, aunque también en ocasiones puede ser secundaria a una alteración de la termorregulación por lesión cerebral. En general, se recomienda tratar la hipertermia con antitérmicos, como el paracetamol y los antibióticos, si existe la sospecha de infección, manteniendo la temperatura corporal entre 36 y 37 °C4,5.
Control de la glucemia. Entre el 20 y el 50% de los pacientes tienen hiperglucemia en el momento de la presentación del ictus. Las cifras elevadas de glucemia, tanto en pacientes diabéticos como en no diabéticos, se asocian a una menor supervivencia y a un peor pronóstico funcional, posiblemente debido a que la mayor cantidad de glucosa en el área isquémica favorece una mayor acumulación de metabolitos ácidos al producirse una mayor glucólisis anaerobia y, como consecuencia, una mayor lesión tisular. De forma ideal deben mantenerse unos valores de glucemia dentro de la normalidad, incluso es recomendable la administración de insulina si fuese necesario4.
Hidratación. Con frecuencia los ictus en los pacientes ancianos pueden acompañarse de deshidratación, ya sea por disminución de la ingesta en las últimas horas o por coexistencia de otras enfermedades predisponentes. Así pues, debe evaluarse esta posibilidad, mediante marcadores clínicos y/o analíticos, y corregirla si es necesario mediante la administración de sueroterapia. Cabe recordar también que la deshidratación contribuye a disminuir el flujo cerebral al reducir la volemia circulante, y puede empeorar el área isquémica4. Por otra parte, la deshidratación puede favorecer la aparición de síndrome confusional o delirium.
Tratamiento para mejorar la perfusión del área isquémica
Existen diferentes estrategias terapéuticas para intentar mejorar la reperfusión en el ictus isquémico agudo. Se han ido desarrollando diferentes tratamientos dirigidos a mejorar el flujo sanguíneo cerebral, cuyo mecanismo de acción se basa en conseguir frenar la progresión del trombo (antitrombóticos: anticoagulantes y antiagregantes), o bien su destrucción (trombolíticos). Asimismo, en los últimos años se han desarrollado fármacos que actúan sobre las alteraciones metabólicas y bioquímicas que se activan en la isquemia (neuroprotectores):
Antiagregantes. Los antiagregantes plaquetarios, especialmente la aspirina (ácido acetilsalicílico), se usan generalmente en la prevención secundaria del ictus isquémico; sin embargo, su utilización precoz en la fase aguda es controvertida6,7. Se han realizado diferentes ensayos clínicos con antiagregantes como tratamiento de la fase aguda del infarto cerebral isquémico. El International Stroke Trial (IST) comparaba aspirina y heparina solas y en asociación. En los pacientes que habían recibido aspirina no se halló una reducción de la mortalidad en los primeros 14 días, pero sí que se encontró una asociación significativa con la disminución de la mortalidad y la dependencia a los 6 meses. En el grupo que había recibido aspirina se observó una disminución significativa de nuevos infartos isquémicos, aunque con un ligero incremento no significativo de hemorragias extracraneales6. En otro ensayo, el Chinese Acute Stroke Trial (CAST), se comparó aspirina con placebo, observándose en el grupo tratado con aspirina una reducción significativa de la mortalidad en las primeras 4 semanas y una tendencia a la disminución de la dependencia, aunque con un incremento de episodios hemorrágicos. De estos ensayos se ha concluido que la aspirina en la fase aguda puede aportar un ligero beneficio entre las 4 semanas y los 6 meses. Esto, unido a su bajo coste, hace que algunos autores recomienden su uso precoz en la fase aguda del ictus isquémico a dosis de 300 mg/día, habiendo descartado siempre la existencia de una hemorragia mediante la realización previa de una tomografía computarizada (TC)6,7. Sin embargo, debido al pequeño riesgo de incremento de hemorragias y a que sus beneficios no son muy relevantes, el uso de aspirina en la fase aguda del ictus isquémico no está establecido de un modo generalizado7.
Heparina. La utilización de heparina a dosis anticoagulantes en la fase aguda del ictus isquémico es un tema controvertido. En el ensayo Fraxipaine Ischaemic Stroke Study (FISS) se compararon dosis altas y bajas de una heparina de bajo peso molecular frente a placebo. No se hallaron diferencias significativas en la proporción de pacientes que presentaron transformación hemorrágica del infarto, mortalidad ni presencia de complicaciones entre los tres grupos a los 10 días de inicio del tratamiento. A los 6 meses se observó una mejoría significativa en el grupo tratado con heparina a dosis altas. En el ensayo FISS bis, realizado para comprobar los resultados del estudio FISS, no se encontraron diferencias significativas en la mortalidad ni la dependencia a los 6 meses entre los tres grupos; en cambio, sí hubo una presencia significativamente mayor de complicaciones hemorrágicas en el grupo tratado con heparina a dosis altas. Los resultados del conjunto de ensayos realizados con heparina parecen demostrar que el tratamiento anticoagulante en fases iniciales del ictus isquémico no se asocia con un beneficio a corto ni a largo plazo, por lo que no se aconseja su utilización de manera rutinaria8. La anticoagulación sí es un tratamiento a considerar en todos los pacientes con fibrilación auricular una vez descartada la hemorragia intracraneal con una TC9.
Trombólisis. El tratamiento antitrombótico ha abierto una nueva vía para el tratamiento del ictus isquémico. Su indicación se basa en el hecho de que pueden existir oclusiones arteriales en hasta el 75% de los infartos cerebrales isquémicos en las primeras horas. El único agente trombolítico que ha demostrado ser eficaz es el activador tisular del plasminógeno (rt-PA). Se dispone de una ventana terapéutica muy corta, ya que la capacidad del tejido cerebral para sobrevivir a la isquemia es de 3 h (6 como máximo); por tanto, la utilización de trombolíticos obliga a considerar el ictus isquémico como una emergencia. La mayor complicación del tratamiento con rt-PA es la transformación hemorrágica del ictus y el riesgo de hemorragia.
Se ha intentado definir el grupo de pacientes que más se beneficiarían de recibir tratamiento con rt-PA y aquellos en que este tratamiento no aporta beneficios. En los diferentes ensayos realizados se ha observado que los pacientes con afección de menos del 33% del territorio de la arteria cerebral media o de ganglios basales son los que más se benefician del tratamiento trombolítico, ya que presentan complicaciones en un porcentaje muy bajo y la reducción de la mortalidad y la discapacidad es alrededor del 50%. Los pacientes con déficit poco importantes o con síntomas que mejoran rápidamente no deberían ser tratados ya que obtienen un beneficio mínimo; tampoco deberían recibir tratamiento los pacientes mayores de 80 años, los que tengan un ictus grave, estupor o coma, porque presentan un riesgo de complicaciones hemorrágicas graves muy elevado. La existencia de un estrecho margen entre los beneficios obtenidos del tratamiento trombolítico y las complicaciones, junto con el escaso tiempo de que se dispone para aplicarlo y la necesidad de unidades especializadas, hace que sea difícil realizar recomendaciones para su uso rutinario10.
Neuroprotección. La disminución del flujo sanguíneo cerebral desencadena en el tejido isquémico una serie de alteraciones bioquímicas y metabólicas que conducen a la muerte neuronal. El área cerebral que sufre esta disminución de flujo se denomina «zona de penumbra isquémica» y es potencialmente recuperable si se restablece el flujo sanguíneo. El objetivo de la neuroprotección es interferir con las alteraciones bioquímicas que se producen en la zona de penumbra para evitar la necrosis del tejido cerebral isquémico. La citicolina (500 mg/día, por vía oral) ha demostrado su utilidad en diversos ensayos clínicos; su utilización en las primeras 24 h produce una disminución significativa de la dependencia en ciertos subgrupos de pacientes. Otros fármacos que han demostrado su utilidad son el ebselen, el clometiazol intravenoso, el sulfato de magnesio intravenoso a dosis altas y el piracetam11. La estrecha ventana terapéutica y el escaso margen de beneficios cuestionan todavía su uso rutinario en la clínica diaria.
Complicaciones en la fase aguda del ictus isquémico
Edema cerebral
El edema cerebral es la primera causa de mortalidad en la fase aguda de los ictus isquémicos. Aparece con mayor frecuencia en infartos extensos y dependientes de grandes vasos y su mecanismo suele estar relacionado con la aparición de citotoxicidad en la zona infartada, debido a la acumulación de productos tóxicos como consecuencia de la necrosis y de la isquemia tisular, puede existir también un componente vascular debido a vasodilatación de arterias próximas a la zona infartada. Clínicamente, suele manifestarse en forma de somnolencia y disminución del nivel de conciencia de uno a cinco días tras la presentación del ictus. Aunque clásicamente se han utilizado los corticoides como tratamiento, su eficacia ha sido cuestionada, ya que son efectivos en el edema vasogénico pero no influyen en el componente citotóxico. Asimismo, se ha observado que con frecuencia su utilización no aumenta la supervivencia y, en cambio, se asocia a un aumento de complicaciones, como la hiperglucemia, la hemorragia gastrointestinal y las infecciones12. Otros tratamientos, como el manitol, la hiperventilación e incluso la craneotomía descompresiva, han demostrado ser eficaces para disminuir la presión intracraneal; sin embargo, no parece que hayan conseguido aumentar la supervivencia ni modificar las secuelas neurológicas graves5.
Infecciones
Las infecciones más frecuentes son respiratorias. Los mecanismos más habituales son la aspiración y las neumonías asociadas a intubación que tienen una alta mortalidad, por lo que deben ser tratadas precozmente.
Alteración de la deglución
La disfagia y la ingesta deficitaria son frecuentes tras un ictus. Inicialmente, puede manejarse con fluidos pero debe asegurarse un correcto aporte nutricional lo más precozmente posible, ya que la desnutrición se asocia con un aumento de mortalidad, una mayor estancia hospitalaria y un aumento de complicaciones. En fases muy iniciales no se han demostrado diferencias entre la utilización de sonda nasogástrica o gastrostomía, pero si la necesidad de nutrición enteral se prolonga, se recomienda la gastrostomía4,5.
Úlceras por presión
Las úlceras por presión son una complicación evitable que causa gran malestar al paciente y enlentecen la recuperación. Su prevención se basa en una evaluación inicial del riesgo, los cuidados por parte de un equipo de enfermería experto, los cambios posturales frecuentes y la utilización de colchones y almohadas adecuados.
Trombosis venosa profunda
Diversos estudios han demostrado que la prevalencia de trombosis venosa profunda (TVP) en ictus es cercana al 50%, aunque sólo tiene manifestaciones clínicas menos del 5% de pacientes. Su prevención se basa en la movilización precoz, y en la utilización adecuada de la heparina a dosis profilácticas5,6.
Crisis comiciales
La epilepsia precoz aparece en un 5% de los pacientes, generalmente en aquellos con afección de la corteza cerebral. Su tratamiento no difiere al de la epilepsia de otras causas.
Hemorragia digestiva
Es una complicación poco frecuente que suele ser secundaria al uso de corticoides, antiinflamatorios no esteroideos o anticoagulantes, o también por el estrés provocado por el propio ictus, al igual que puede suceder en cualquier otra enfermedad aguda grave. El sucralfato, la ranitidina y el omeprazol suelen ser utilizados como tratamientos preventivos de hemorragias digestivas, al menos durante las primeras 4-6 semanas desde el ictus5.
Accidente cerebrovascular hemorrágico
Etiología
Los factores de riesgo más importantes para presentar una hemorragia intraparenquimatosa son la edad avanzada y la hipertensión arterial. Otras causas menos frecuentes son las malformaciones vasculares, la rotura de un aneurisma, las alteraciones de la coagulación, el tratamiento con anticoagulantes, la transformación hemorrágica de un ictus isquémico y los tumores14. La hemorragia subaracnoidea es debida, con gran frecuencia, a aneurismas y, en menor proporción, a hipertensión arterial.
Clínica del ictus hemorrágico
La presentación típica de la hemorragia intraparenquimatosa es el inicio brusco de una focalidad neurológica que progresa en un tiempo variable entre minutos y horas, puede ir acompañada de cefalea, náuseas, vómitos, disminución del nivel de conciencia y cifras muy elevadas de presión arterial. El signo clínico más característico de la hemorragia son los vómitos, ya que están presentes en el 49% de los pacientes con hematomas hemisféricos, en el 45% de las hemorragias subaracnoideas y únicamente en el 2% de los pacientes con ictus isquémico. La prueba diagnóstica fundamental es la TC, ya que nos permite diferenciar precozmente entre ictus isquémico y hemorrágico. Además, revela la localización y el tamaño de la hemorragia y puede permitir la visualización de malformaciones y complicaciones como la herniación, la hemorragia intraventricular o la hidrocefalia.
Tratamiento en la fase aguda del ictus hemorrágico
La American Heart Association Stroke Council publicó en 1999 unas directrices para llegar a un consenso sobre el tratamiento13:
Vía aérea y oxigenación
Es recomendable garantizar un buen aporte de oxígeno, por lo que en general a todos los pacientes en quienes se sospecha una hemorragia intraparenquimatosa se les suele indicar oxigenoterapia.
Control de la presión arterial
Se debe realizar un control más estricto que en los ictus isquémicos para disminuir la hemorragia activa y el riesgo de presentar nuevas hemorragias. Lo ideal es mantener la presión arterial media alrededor de 130 mmHg. Se debe evitar la hipotensión por la disminución de flujo sanguíneo cerebral que conlleva. Los fármacos recomendados son: enalapril, nitroprusiato o labetalol en perfusión intravenosa.
Manejo de la hipertensión endocraneal
La hipertensión endocraneal (HTE) es la mayor causa de mortalidad en hemorragias intracerebrales. Clásicamente se han utilizado los corticoides, aunque en la actualidad, debido a su escaso beneficio y a las complicaciones asociadas, es preferible el manitol intravenoso durante un período inferior a 5 días. Por otra parte, además del edema provocado por el propio hematoma, puede producirse hidrocefalia secundaria a la hemorragia en áreas próximas al sistema ventricular, lo que aumenta aún más la HTE. En estos pacientes el tratamiento de elección es el drenaje ventricular mediante la colocación de una válvula.
Crisis comiciales
Como medida general, debe iniciarse tratamiento anticomicial profiláctico, que se irá disminuyendo progresivamente si en el primer mes no se produce ninguna crisis.
Otras medidas generales
Es importante la aplicación de fluidoterapia si es necesaria, con el objetivo de mantener una euvolemia con valores de electrólitos normales. Debe mantenerse una temperatura corporal normal. Asimismo, debe efectuarse el tratamiento precoz de los posibles procesos infecciosos intercurrentes.
El tratamiento quirúrgico del hematoma tiene como objetivo disminuir al máximo el tamaño del hematoma y, si es posible, tratar la causa. Aunque con la cirugía se consigue una disminución rápida de la HTE y una disminución de la hemorragia, el daño cerebral secundario al acto quirúrgico hace que su efectividad sea, en general, más baja de la esperada5. Finalmente, en el caso de la hemorragia subaracnoidea, cabe destacar que las medidas terapéuticas anteriormente recomendadas son también del todo aplicables en este tipo de hemorragia, aunque cuando la hemorragia subaracnoidea es debida a la rotura de un aneurisma, debe plantearse la posibilidad de tratamiento quirúrgico.
Complicaciones en la fase aguda del ictus hemorrágico
Como complicaciones de una hemorragia intracraneal destacan, en primer lugar, el vasospasmo, que puede aparecer en el mismo territorio donde se ha producido la hemorragia. Éste es muy frecuente a partir del cuarto día, y empeora el pronóstico, ya que puede producir una lesión isquémica asociada. Clínicamente, se puede sospechar por la aparición de un empeoramiento del déficit neurológico. El tratamiento de elección es el nimodipino en perfusión intravenosa. En segundo lugar, la otra complicación posible es el resangrado; éste también es un marcador de mal pronóstico. Finalmente, las otras complicaciones que pueden aparecer en la fase aguda son similares a las del ictus isquémico, y se puede aplicar el mismo tratamiento.
Rehabilitación del paciente anciano con ictus
Las técnicas de rehabilitación tienen como objetivo intervenir sobre los déficit motores y sensoriales que causan discapacidad, para conseguir recuperar la independencia. Cuando esto no sea posible, los objetivos se centrarán en optimizar las funciones conservadas, a fin de conseguir una buena adaptación a la discapacidad manteniendo en lo posible el bienestar del paciente.
Rehabilitación en la fase aguda
Actualmente existe un consenso respecto a que la rehabilitación se debe iniciar en la fase más temprana posible, una vez efectuado el diagnóstico y el paciente esté clínicamente estable. El enfermo debe estar en condiciones físicas que le permitan efectuar y/o tolerar la movilización y en condiciones mentales que le capaciten para una mínima comprensión y colaboración. En las situaciones clínicamente inestables (disminución de conciencia, inestabilidad hemodinámica, insuficiencia cardiorrespiratoria, infecciones agudas, etc.), resulta difícil garantizar estas condiciones.
Rehabilitación a medio y largo plazo
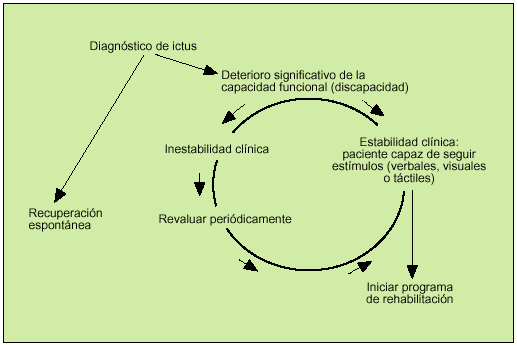
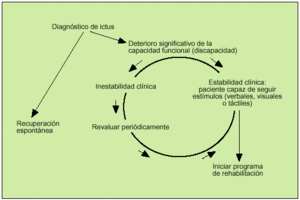
Una vez superada la fase aguda de la enfermedad, si el paciente sigue presentando un déficit motor o sensorial que le ocasione discapacidad, debe plantearse la entrada en un programa de rehabilitación de medio y largo plazo. Se debe tener en cuenta que la rehabilitación es un proceso activo, en el que el anciano debe comprender lo que se le pide que haga y debe integrar lo aprendido y recordarlo. Los ancianos con deterioro en sus capacidades cognitivas, o con problemas de comunicación y comprensión, difícilmente obtendrán beneficios en un programa de fisioterapia. La decisión de incluir o no a un paciente anciano con un ictus en un programa de rehabilitación generalmente corresponde al médico rehabilitador; sin embargo, es responsabilidad de todos los profesionales sanitarios que atienden al anciano conocer los principios básicos en que se basa esta decisión, con tal de detectar los casos potencialmente mejorables, así como conocer aquellos en los que la rehabilitación no va a proporcionar beneficios, evitando así la utilización inadecuada de recursos costosos y la generación de falsas espectativas a pacientes y familiares. En general, se acepta que un anciano con un ictus reciente y con capacidad conservada para detectar y seguir estímulos podría ser candidato para iniciar un programa de rehabilitación (fig. 1)14. Los objetivos de un programa de rehabilitación en ancianos con secuelas de un ACV deberán ir dirigidos, en primer lugar, a obtener una mejora significativa en la capacidad funcional (máxima independencia posible para las actividades cotidianas); cuando esto no sea posible, los objetivos deberán encaminarse a conseguir el mantenimiento de las capacidades conservadas y el bienestar del anciano (tabla 2).
Fig. 1. Criterios para plantear el inicio de un programa de rehabilitación en ancianos con ictus. (Tomado y adaptado de Garrison14.)
Valoración del paciente anciano con un ictus ante el proceso de la rehabilitación
La valoración inicial debe incluir dos aspectos diferenciados: por una parte, la evaluación del déficit neurológico en sí mismo causado por la lesión vascular cerebral y, por otra, la valoración conjunta del anciano y de todos sus problemas de salud. Esta última requiere la recogida de una serie de variables, como la capacidad funcional, el estado mental, la existencia de otras enfermedades (comorbilidad), el estado nutricional, los déficit sensoriales y los aspectos del entorno social y familiar (tabla 3). La recogida sistematizada de estas variables es lo que se conoce en el ámbito de la gerontología como «valoración geriátrica integral». A continuación se exponen los cinco apartados fundamentales de este proceso:
Valoración de la capacidad funcional
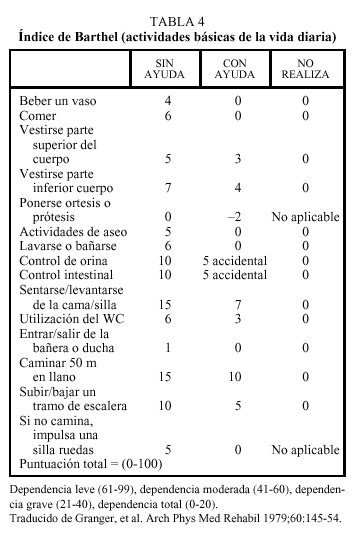
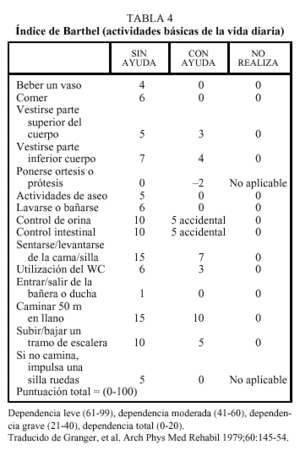
Se entiende por capacidad funcional la posibilidad de llevar a cabo por sí mismo y sin ayuda de otras personas las actividades cotidianas de la vida diaria. La valoración de la capacidad funcional previa al ictus es un factor importante a tener en cuenta, ya que de alguna manera determina la distancia del camino a recorrer para volver a la situación inicial. Aunque el grado de pérdida de capacidad funcional se produce por la gravedad de la lesión neurológica, es evidente que aquellos ancianos cuya capacidad funcional se hallaba previamente deteriorada tendrán un peor pronóstico en cuanto al grado de recuperación. La capacidad funcional se puede evaluar por simple anamnesis o bien mediante escalas de actividades de la vida diaria. Una de las más utilizadas en los pacientes con enfermedad cerebrovascular es el índice de Barthel. Este índice evalúa la capacidad de autocuidado del paciente con una puntuación que va desde 0 (dependencia total) hasta 100 (independencia) (tabla 4), lo que permite cuantificar de manera objetiva la gravedad de la pérdida funcional y monitorizar los progresos durante la rehabilitación. En este sentido, diversos trabajos han demostrado que el índice de Barthel puede tener un valor pronóstico; así, una puntuación inferior a 20 en el momento del ingreso hospitalario tras un ACV se correlaciona con una mayor mortalidad a los 15 días y a los 6 meses. Una puntuación superior a 40 en el momento del ingreso en una unidad de rehabilitación indica una elevada probabilidad de retorno al domicilio, y una puntuación superior a 60 en el momento del alta de una unidad de rehabilitación indica una elevada probabilidad de continuar viviendo en el domicilio a los 6 meses15.
Valoración del estado de salud general del anciano
Antes de iniciar el proceso de rehabilitación, es indispensable evaluar el estado de salud general, con el objetivo de detectar la presencia de enfermedades crónicas y las necesidades que el paciente tendrá de tratamientos y controles. Esta evaluación incluirá una historia clínica completa, haciendo especial hincapié en la presencia de problemas típicamente geriátricos (comorbilidad, polifarmacia, problemas cardiorrespiratorios, deshidratación, desnutrición, etc.). Será de vital importancia mantener estas enfermedades crónicas en estado óptimo de compensación, ya que mínimas descompensaciones y otros procesos intercurrentes influirán negativamente en el rendimiento del paciente durante el programa de rehabilitación. Cabe destacar también la importancia de la evaluación de los órganos de los sentidos (vista y oído), ya que su deterioro (especialmente la vista) influye negativamente en la rehabilitación, impidiendo la adaptación a la discapacidad y empeorando el resultado funcional global.
Valoración de la función cognitiva
La evaluación de la función cognitiva es un elemento clave en la evaluación del paciente anciano con ictus. Ésta se puede llevar a cabo mediante simple anamnesis con el paciente (contrastada con los familiares), o bien mediante cuestionarios estandarizados de cribado (p. ej., el Mini Mental Test de Folstein). La presencia de deterioro cognitivo global, así como de otros déficit cognitivos focales (afasia, agnosia, etc.), interfiere negativamente en los procesos de colaboración, comprensión e integración, que son tan necesarios en la aplicación de las técnicas de rehabilitación. En este sentido, numerosos estudios han demostrado que el deterioro cognitivo se ha asociado a un peor resultado funcional en la rehabilitación, a una menor probabilidad de retorno al domicilio y a un mayor riesgo de institucionalización14. Se deben tener en cuenta todos los aspectos que pueden influir negativamente en el estado mental del anciano; por tanto, se debe evitar el uso de fármacos psicotropos, detectar posibles descompensaciones metabólicas y optimizar el estado de hidratación y nutrición. Asimismo, se debe favorecer las medidas que permitan un entorno tranquilo, facilitando la colaboración y la orientación.
Valoración del estado emocional (depresión)
Al igual que sucedía con el deterioro cognitivo, la depresión y la falta de motivación por parte del paciente pueden interferir negativamente en el cumplimiento y en la colaboración en el proceso rehabilitador. La presencia de depresión es frecuente en pacientes con secuelas de un ACV; sin embargo, su frecuencia es muy variable, oscilando en diferentes estudios entre el 25 y el 79%. Dichas variaciones se explican por los diferentes criterios diagnósticos de depresión utilizados en los distintos estudios, y también por las diferentes poblaciones de pacientes estudiados. Asimismo, resulta difícil establecer el diagnóstico de depresión en pacientes con afasia y otros déficit cognitivos que impiden una correcta anamnesis. Existe una cierta controversia sobre el tipo de trastorno depresivo más frecuente en pacientes ancianos con ictus. Por un lado, se ha sugerido que puede haber una relación entre la localización del ictus y los síntomas depresivos, ya que éstos son más frecuentes en los ictus de localización frontal y en el hemisferio dominante (trastorno depresivo asociado a enfermedad médica según la clasificación del DSM-IV); sin embargo, estos hallazgos han sido cuestionados en otros estudios. Otros autores sugieren que los síntomas depresivos parecen estar más en relación con la discapacidad y todos los cambios de vida que ésta conlleva, y la depresión, la manifestación de un trastorno adaptativo (trastorno adaptativo con ánimo depresivo según la clasificación del DSM-IV). En cualquier caso, el reconocimiento de los síntomas depresivos y el tratamiento precoz de los mismos (apoyo psicoterápico, tratamientos en grupos, educación de los familiares y tratamiento farmacológico), es un aspecto importante de la valoración inicial del anciano ante el proceso de la rehabilitación.
Valoración nutricional
La desnutrición es un problema frecuente en ancianos portadores de enfermedades crónicas. El estado nutricional ha demostrado ser un factor pronóstico, capaz de influir en la recuperación de la capacidad funcional y en la mortalidad de pacientes ancianos. Se ha comprobado que el deterioro de las concentraciones de colesterol y el perímetro muscular del brazo fueron factores predictivos de la aparición de complicaciones médicas intercurrentes en pacientes geriátricos sometidos a un programa de rehabilitación16. Finalmente, el deterioro del estado nutricional retrasa o impide la cicatrización de las úlceras por presión, aumenta el riesgo de infecciones y, globalmente, aumenta el riesgo de complicaciones y de mortalidad.
Valoración del soporte social y familiar
La importancia del entorno social pasa con frecuencia inadvertida por el médico y, a menudo, por la propia familia. Frecuentemente, se olvida que el soporte social y de los familiares puede ejercer una influencia positiva sobre la capacidad funcional y el proceso de adaptación a la discapacidad, permitiendo una mejor autopercepción del estado de salud y una mejoría de la autoestima. El entorno social y familiar es por sí mismo uno de los factores pronósticos especialmente relevantes a tener en cuenta en el momento de predecir el lugar de residencia. Por otra parte, se ha demostrado que el soporte social, entendido como el conjunto de personas que hay alrededor del paciente y que pueden interaccionar con él, puede influir positivamente sobre el pronóstico funcional, contribuyendo a mantener los resultados conseguidos en los programas de rehabilitación.
Pronóstico funcional en el anciano con ictus
El pronóstico funcional depende, por un lado, de las variables relacionadas con el estado general de salud del anciano (comentadas en el apartado anterior) y, por otro, de aquellas directamente relacionadas con la lesión neurológica y su extensión. En el Copenhagen Stroke Study se analizó a 1.197 pacientes no seleccionados que ingresaron de forma consecutiva en una unidad de ictus; la edad media de los mismos fue de 74 años. En dicho estudio se observó que el 95% de los pacientes alcanzaron su mejor nivel funcional a los 3 meses, un 4,3% mejoró entre el tercer y el quinto mes, y únicamente el 0,7% obtuvo mejorías a partir del quinto mes17. A la luz de estos datos, parece razonable pensar que los pacientes con ictus que habiendo efectuado un programa de rehabilitación no hayan mejorado su capacidad funcional a los 3 meses, difícilmente van a obtener más beneficios. Sin embargo, dado que el proceso de recuperación suele ser más lento en ancianos y teniendo en cuenta que con frecuencia la rehabilitación se ve interrumpida por la aparición de procesos intercurrentes, este período podría prolongarse en algunos casos hasta los 6 meses.
En ocasiones, el médico puede encontrarse ante un anciano con secuelas neurológicas establecidas más allá de los 6 meses del ictus, y en el que se plantea la demanda de efectuar un programa de rehabilitación. En estos casos debe asumirse que, probablemente, no será posible mejorar su capacidad funcional de una manera significativa y, por ello, no sería candidato para rehabilitación, evitando así la sobreutilización de recursos innecesarios. Sin embargo, antes de rechazar la posibilidad de un programa de rehabilitación, deberá valorarse cuidadosamente si el anciano había efectuado o no rehabilitación con anterioridad y si ésta se llevó a cabo en las condiciones adecuadas y en el momento adecuado, ya que no es infrecuente encontrar ancianos con discapacidad, en los que la fisioterapia fracasó por haber sido efectuada en un entorno dificultoso para el anciano (hospital de agudos, domicilio inadecuado, etc.), o bien porque el paciente no colaboró por existir un proceso intercurrente inadvertido en aquel momento (depresión no tratada o delirium reciente). Esta reflexión obliga a indagar en la historia clínica previa, buscando si el programa de rehabilitación fracasó realmente por un déficit funcional irreversible, o bien por alguna causa intercurrente que en el momento actual podría estar resuelta. Finalmente, debe recordarse que la intervención en ancianos con discapacidad tras un ictus no siempre debe ir exclusivamente dirigida a mejorar la capacidad funcional, pues existen otros aspectos de la rehabilitación dirigidos al mantenimiento y el bienestar, ya comentados anteriormente (tabla 2), y que deben ser tenidos en cuenta al valorar las necesidades del paciente.
Niveles asistenciales y rehabilitación del paciente anciano con un ictus
Con frecuencia el médico responsable de un anciano que ha padecido un ictus se pregunta cómo y dónde debe iniciar su programa de rehabilitación. La respuesta a esta pregunta está en gran medida condicionada por el entorno sanitario en el que se encuentre y los recursos de que se dispongan. La rehabilitación integral de un anciano con ictus requiere recursos costosos y servicios especializados no siempre disponibles. Por otro lado, no todos los ancianos tras un ictus están en condiciones de seguir un programa de rehabilitación estandarizado y, con frecuencia, éste debe adaptarse a las necesidades del paciente y a su entorno. La utilización racional de los recursos de rehabilitación en ancianos con ictus depende básicamente de dos aspectos: en primer lugar, de las condiciones generales en que esté el anciano (lo que puede tolerar) y, en segundo lugar, la intensidad del programa de rehabilitación que puede ofrecerse (recursos disponibles). Lo ideal sería poder adecuar la intensidad de la rehabilitación a los recursos disponibles y a la tolerancia del paciente. Existen diferentes niveles asistenciales en los que es posible llevar a cabo la rehabilitación de un paciente con un ictus. En primer lugar, los servicios de rehabilitación hospitalarios que disponen de mayores recursos técnicos y pueden ofrecer programas de «alta intensidad» de rehabilitación. En segundo lugar, los centros sociosanitarios y otras instituciones geriátricas de media estancia, que ofrecen programas de rehabilitación de menor intensidad pero tienen la ventaja de ofrecer cuidados geriátricos interdisciplinarios las 24 h del día, con estancias más prolongadas. Finalmente, la rehabilitación domiciliaria que permite mantener al anciano en su entorno familiar y comunitario18. La elección del nivel asistencial ideal para efectuar la rehabilitación dependerá de tres variables: a) intensidad de la rehabilitación que sea necesaria, medida por el número de horas al día y por el número de técnicas que se precisen (fisioterapia, terapia ocupacional, logopedia); b) necesidad adicional de cuidados de enfermería durante las 24 h restantes del día; c) soporte familiar y social que tenga el paciente. En las tablas 5 y 6 se exponen las características de cada nivel asistencial de rehabilitación y los perfiles de los pacientes candidatos18.
Complicaciones durante la rehabilitación a medio y largo plazo
Dada la mayor prevalencia de enfermedades crónicas en pacientes ancianos, el período de rehabilitación puede verse interrumpido o complicado por la aparición de enfermedades u otros procesos intercurrentes (tabla 7), algunos de los cuales ya han sido comentados en apartados anteriores.
Síndromes dolorosos asociados al ictus
La presencia de dolor en un anciano con un ictus puede ser debida a enfermedades coexistentes altamente prevalentes (p. ej., osteoartrosis de grandes articulaciones, enfermedad vascular periférica, aplastamientos vertebrales por osteoporosis, etc.); también puede deberse a rigidez articular en casos de inmovilidad crónica. Un cuadro clínico característico es el llamado «hombro doloroso», que puede estar presente hasta en el 70% de los pacientes con hemiplejía; su etiología es variada y parece estar relacionado con la hipotonía de la musculatura periarticular que favorece la aparición de subluxaciones, malas posturas o estiramientos con las movilizaciones. El tratamiento se basa en medidas posturales, la protección con cabestrillo y las movilizaciones pasivas para evitar la rigidez. Otro proceso doloroso es la llamada distrofia simpaticorrefleja, o síndrome hombro-mano, que puede estar presente entre el 12 y el 25% de los pacientes. Consiste en un dolor rebelde del hombro con tumefacción y edema de la extremidad, que puede acompañarse de cambios vegetativos (hipersudación); la causa es desconocida y parecen intervenir factores como la inmovilidad, la estasis venosa y tal vez la inflamación de la cápsula articular. Su tratamiento se fundamenta en movilizaciones pasivas, la administración de analgésicos y otros fármacos coadyuvantes, y con frecuencia es necesaria la intervención de especialistas en dolor crónico (clínica del dolor). Finalmente, existe un último síndrome que consiste en la presencia de un dolor que se distribuye en todo el lado hemipléjico (dolor en hemicuerpo); suele ser de características neuropáticas (lancinante, de predominio nocturno), su tratamiento resulta dificultoso y, con frecuencia, exige un enfoque multidisciplinario, así como la utilización de relajantes musculares y analgésicos.
Manejo del ictus en pacientes geriátricos deteriorados
La aparición de un ictus en pacientes geriátricos gravemente incapacitados, con un deterioro previo de su capacidad funcional y/o deterioro mental (demencia avanzada, inmovilidad secundaria a otras enfermedades, neoplasias, etc.), contribuye notablemente a empeorar su estado de salud. Estos casos son frecuentes en residencias de ancianos, instituciones geriátricas y, en ocasiones, también en los domicilios. Aunque el ictus es una urgencia médica, en estos pacientes el médico deberá valorar cuidadosamente la conveniencia de derivar al anciano a un hospital, ya que es muy probable que en estas condiciones no pueda beneficiarse de la práctica de una TC urgente, de los tratamientos de la fase aguda (trombólisis, anticoagulación o neurocirugía) ni tampoco de los programas de rehabilitación19; es más apropiado en estos enfermos un enfoque de bienestar y con paliación de síntomas, hidratación y cuidados generales. Estas decisiones clínicas siempre resultan complejas en la práctica diaria y deben tener en cuenta las opiniones y expectativas del paciente y/o de sus familiares.
Prevención del ictus en el anciano
El ictus isquémico está provocado por la arteriosclerosis en el territorio vascular cerebral y por la existencia de embolia de origen cardíaco en el caso de que exista fibrilación auricular. Por ello, su prevención está relacionada con la prevención de la enfermedad arteriosclerótica, en general, y el control de todos sus factores de riesgo (hipertensión, diabetes, hipercolesterolemia y tabaquismo).
Prevención de la recurrencia del ictus
Los antiagregantes plaquetarios ejercen un papel importante en la prevención secundaria del ictus isquémico arteriosclerótico. La aspirina (ácido acetilsalicílico) es el más ampliamente utilizado y ha demostrado ser eficaz en pacientes con arteriosclerosis. La aspirina, en general, es bien tolerada; sus efectos indeseables más frecuentes son los gastrointestinales y parecen estar relacionados con la dosis utilizada. La dosis óptima de aspirina en la prevención de las enfermedad cerebrovascular es motivo de controversia; su eficacia ha sido demostrada en diferentes estudios con dosis de entre 30 y 1.600 mg. La dosis más utilizada en EE.UU. es 325 mg/día.
Otro fármaco antiagregante es la ticlopidina, cuya eficacia en la prevención de la recurrencia del ictus también ha sido demostrada a dosis de 250 mg administradas dos veces al día. Como efecto indeseable puede causar neutropenia (2,4% de los pacientes); por ello, obliga a un control frecuente del hemograma; asimismo, puede causar molestias gastrointestinales, diarrea y erupciones cutáneas. Aunque la ticlopidina ha demostrado ser ligeramente superior a la aspirina en la prevención secundaria del ictus, no se la suele considerar como primera elección a causa de sus efectos indeseables y se la suele prescribir en pacientes con alergia o intolerancia a la aspirina, o bien en aquellos que desarrollan ictus a pesar del tratamiento con aspirina (fallo de la aspirina). Finalmente, el clopidogrel es un fármaco químicamente relacionado con la ticlopidina y que no causa neutropenia, cuya eficacia en la prevención secundaria del ictus también ha sido demostrada a dosis de 75 mg/día. Hoy día, puede ser una buena alternativa preventiva en pacientes que no toleran la aspirina o la ticlopidina7.
Hipertensión y prevención del ictus
En la actualidad existen múltiples evidencias de que la hipertensión arterial (HTA) en ancianos debe ser tratada para prevenir sus consecuencias. La HTA, tanto la sistólica y diastólica como la sistólica aislada, es el factor de riesgo más importante para el ictus, y existe consenso acerca de que su tratamiento reduce de forma significativa la probabilidad del mismo. La mayoría de los estudios demuestran que los efectos beneficiosos del tratamiento se mantienen incluso hasta los 80 años de edad (es difícil demostrar beneficios por encima de esta edad). La razón es que la mayoría de los estudios prospectivos controlados no incluyen el suficiente número de ancianos en estas edades tan extremas. Parece razonable afirmar que los ancianos con edades avanzadas y con un estado de salud razonablemente conservado serían candidatos a tratamiento de su HTA, mientras que en los ancianos muy deteriorados y con enfermedades crónicas muy evolucionadas que conlleven una expectativa de vida inferior a 4-5 años, los beneficios del tratamiento riguroso de la HTA estarían cuestionados7.
Endarterectomía carotídea en la prevención
del ictus en ancianos
Estenosis carotídea en pacientes con síntomas de isquemia cerebral
El estrechamiento de la arteria carótida es el proceso resultante de la arteriosclerosis en la misma. Este proceso suele ser asintomático hasta que aparecen signos de isquemia en el territorio distal de la carótida, los cuales se manifiestan en forma de accidente isquémico transitorio o ictus establecido. Aunque la endarterectomía no es una técnica quirúrgica exenta de morbilidad, su eficacia en la prevención del ictus isquémico ha sido puesta de manifiesto en diversos estudios clínicos aleatorizados (p. ej., en el European Carotid Surgery Trial [ECST]), la incidencia de ictus discapacitante en el grupo en que se practicó la endarterectomía fue del 6%, mientras que en el resto de los individuos fue significativamente superior (11%)20.
Las indicaciones de la endarterectomía en la mayoría de los estudios clínicos efectuados en pacientes sintomáticos han sido la existencia de estenosis significativa de la carótida (> 70%) y la presencia de síntomas de isquemia cerebral del mismo lado de la carótida afectada (episodio de AIT hemisférico, ictus no discapacitante o amaurosis fugaz). Aunque algunos de los estudios excluían a pacientes mayores de 80 años, en el caso del ECST no hubo límites de edad y las razones más comunes para no indicar la endarterectomía fueron: hipertensión o diabetes mal controladas, enfermedad pulmonar obstructiva crónica discapacitante, existencia de otras enfermedades médicas potencialmente discapacitantes (o mortales) a corto-medio plazo, y pacientes ancianos muy deteriorados, tanto por sus condiciones físicas como mentales20.
Estenosis carotídea en pacientes asintomáticos
Desde que se ha extendido la práctica de las técnicas de ultrasonografía (Doppler carotídeo), se ha observado que existen pacientes con estenosis significativas de la arteria carótida y que no han presentado nunca síntomas de isquemia cerebral. Los estudios observacionales en estos pacientes ponen de manifiesto que la incidencia de ictus isquémico ipsolateral a la estenosis carotídea se sitúa entre el 1 y el 2% anual. Algunos de estos estudios sugieren que la posibilidad de ictus es más alta en el caso de estenosis graves (> 80%) y en los pacientes en que la estenosis progresa, en comparación con aquellos en los que la estenosis permanece estable. Algunos de los estudios clínicos aleatorizados efectuados en estos pacientes demuestran que es posible reducir la incidencia de ictus mediante la endarterectomía profiláctica; sin embargo, en general estos resultados son controvertidos. Dado que la incidencia de ictus en pacientes asintomáticos es relativamente baja, que las complicaciones derivadas del propio riesgo quirúrgico no son despreciables y que resulta difícil identificar subgrupos de pacientes de alto riesgo, la indicación de endarterectomía en estos casos debe individualizarse en función de los deseos y expectativas del paciente y de la existencia de otras enfermedades concomitantes que puedan condicionar el riesgo quirúrgico.
Finalmente, dado que la prevalencia de estenosis carotídea asintomática es baja en la población y que la incidencia anual de ictus, aun en presencia de la citada estenosis, sigue siendo baja (en pacientes asintomáticos), el cribado general con Doppler carotídeo no está recomendado de forma rutinaria en la población general20.
Consideraciones sobre la endarterectomía carotídea en pacientes ancianos
Aunque en la mayoría de los estudios aleatorizados sobre la eficacia de la endarterectomía las edades medias de los pacientes incluidos oscilaban entre 60 y 75 años, existe poca evidencia sobre el beneficio potencial en ancianos mayores de 79 años. Por otro lado, la frecuencia de complicaciones perioperatorias se incrementa con la edad, siendo elevada en ancianos. Se debe agotar las posibilidades del tratamiento médico preventivo y, sobre todo, efectuar una valoración geriátrica completa que permita conocer el estado de salud general del anciano, la comorbilidad, el estado mental y la expectativa de vida antes de plantear la posibilidad de cirugía carotídea.
Prevención del ictus cardioembólico en ancianos con fibrilación auricular
La fibrilación auricular (FA) es muy frecuente en la población anciana. Se estima que casi el 6% de las personas mayores de 65 años tienen FA. En EE.UU. el 70% de los pacientes con FA tienen entre 65 y 85 años de edad. Aproximadamente, el 70% de los ictus que ocurren en individuos con FA están relacionados con embolias de origen cardíaco21.
Prevención primaria del ictus en pacientes con fibrilación auricular
El riesgo de ictus relacionado con la FA es aproximadamente del 4,5% al año; sin embargo, existe gran variación individual dependiendo de la existencia de otros factores de riesgo. Aunque todos los pacientes con FA tienen mayor riesgo de ictus, existe un subgrupo en los que el riesgo relativo de presentar un ictus es mucho mayor. Éstos son los que presentan alguna de los siguientes trastornos: hipertensión arterial, diabetes, episodios previos de AIT o de ictus y disfunción ventricular izquierda. En la tabla 8 se refleja cómo la existencia de estos factores añadidos a la FA incrementan progresivamente el riesgo de ictus. Todos los ensayos clínicos coinciden en afirmar que el tratamiento anticoagulante (warfarina, dicumarínicos) reduce de manera significativa el riesgo relativo de padecer un ictus cardioembolígeno. Dicha reducción puede llegar a ser de hasta un 69% (1,4 frente al 4,5% al año). El nivel óptimo de anticoagulación para reducir el riesgo de ictus se sitúa en un INR entre 2,0 y 3,021.
Prevención secundaria del ictus en pacientes con fibrilación auricular
En el European Atrial Fibrillation Trial (EAFT) se demostró que la probabilidad de recurrencia de un ictus en pacientes con FA que ya habían tenido un ictus era elevada (12% al año). La anticoagulación puede obtener una reducción absoluta del riesgo de ictus del 8% por año; o sea, tres veces mayor que la de los individuos con FA que no habían sufrido nunca ictus (3% al año). Por ello, es posible afirmar que los beneficios de la anticoagulación en la prevención secundaria del ictus en pacientes con FA son aún más intensos que en la prevención primaria.
Aspirina (ácido acetilsalicílico). La aspirina ha demostrado ser eficaz para reducir el riesgo relativo de ictus en pacientes con FA; sin embargo, esta reducción del riesgo es considerablemente inferior a la obtenida con anticoagulación. Sin embargo, en los individuos que no toleren los dicumarínicos, los que presenten enfermedades con alto riesgo de hemorragia, o en los ancianos cuyas condiciones físicas, mentales o sociales no garanticen un seguimiento adecuado del tratamiento, la aspirina puede ser una alternativa razonable. Asimismo, algunos autores sugieren la utilización de aspirina en los individuos con FA asintomáticos y sin ningún otro factor de riesgo elevado de ictus (tabla 8); sin embargo, esta indicación sigue siendo controvertida.
Tratamiento anticoagulante en ancianos con fibrilación auricular. A pesar de que la anticoagulación preventiva con warfarina o dicumarínicos en pacientes con FA es muy efectiva, existen estudios que demuestran que está infrautilizada y que hay muchos pacientes con beneficio potencial que no están recibiendo el tratamiento. En general, los pacientes suelen aceptar bien el riesgo de hemorragia a cambio de prevenir la aparición de un ictus; no obstante, diversos estudios demuestran que existe reticencia por parte de muchos médicos a prescribir terapia anticoagulante en ancianos por temor a las complicaciones hemorrágicas que puedan aparecer. Aunque es cierto que el mayor riesgo de hemorragias se produce por encima de los 75 años, también es cierto que éste se relaciona con un valor de INR elevado (> 3,5); por ello, la edad en sí misma no debe ser una contraindicación para la anticoagulación en ancianos. Lo más importante en estos casos es asegurar los mecanismos de control y cumplimiento del tratamiento por parte del paciente y/o sus familiares.