El envejecimiento puede definirse como un período de declive progresivo y escalonado de las funciones orgánicas que precede a la muerte de los organismos. Según las proyecciones demográficas de la Organización Mundial de la Salud, el aumento de la esperanza de vida en países desarrollados llevará en los próximos años a un incremento importante en la proporción de individuos mayores de 65 años. Con este aumento se espera un incremento de las enfermedades ligadas a la edad, entre ellas la demencia. La enfermedad de Alzheimer (EA), el tipo más frecuente de demencia, conlleva unas elevadas necesidades sanitarias, sociales y económicas, y constituye uno de los retos a los que tendrán que enfrentarse las sociedades futuras. Existe, por tanto, una gran necesidad de desarrollar estrategias que frenen o retrasen la progresión de la EA. En este sentido, un tratamiento que retrase el inicio de la enfermedad durante 5 años podría reducir el coste en un 50%.
En el presente capítulo, dado el elevado número de demencias degenerativas existentes (tabla 1), nos centraremos en la descripción de las características de las más frecuentes, así como de su manejo. En este sentido, el tratamiento y el manejo de un paciente con deterioro cognitivo debe fundamentarse en un diagnóstico sindrómico y etiológico precoz1,2. Tras éste, en función del grado de evolución, se deberá aplicar los recursos sociosanitarios y el tratamiento pertinente.
Demencia: concepto y evaluación
La demencia es un síndrome caracterizado por el deterioro de la memoria y de otras funciones cognitivas, demostrado mediante una evaluación clínica y neuropsicológica, y que afecta a las actividades funcionales de la vida diaria1. El deterioro, según los criterios del Diagnostic and statistical manual of mental disorders, American Psychiatry Association (DSM-IV), debe incluir la memoria y al menos otro dominio cognitivo, como el lenguaje, la orientación, las habilidades constructivas, el pensamiento abstracto y las praxis. Además, la pérdida debe ser lo suficientemente importante como para interferir con la actividad funcional y ocupacional del individuo. Este diagnóstico no puede realizarse cuando exista una alteración del nivel de conciencia, estupor, coma u otras alteraciones que impidan una adecuada evaluación de las funciones cognitivas. Este último punto tiene especial relevancia en el ámbito de los servicios de urgencias, donde no es infrecuente confundir el síndrome confusional agudo con la demencia.
La evaluación se inicia con la historia clínica, que se debe realizar con el paciente y la familia, y debe recoger información sobre la función cognitiva, como los fallos de memoria, los trastornos del lenguaje, los problemas en la orientación o las alteraciones en la atención3. También se debe investigar la repercusión de los síntomas en el ámbito funcional u ocupacional del individuo, como las actividades del hogar, el manejo de dinero, la conducción y la actividad social o laboral. La anamnesis debe incluir preguntas sobre los cambios de personalidad, de conducta y afectivos del sujeto. Por último, el patrón temporal es de gran importancia en la determinación de la causa de la demencia. Un inicio insidioso y un curso progresivo sugiere una causa degenerativa, mientras que un inicio brusco y curso escalonado apoya un componente vascular. Un curso rápido en semanas sugiere una causa infecciosa, metabólica o neoplásica.
La exploración física debe incluir una valoración sistémica y neurológica completa. Dentro de esta última se debe poner especial atención en la búsqueda de signos piramidales (que pueden alertar de una causa vascular), la presencia de un parkinsonismo, mioclonías (pueden indicar una demencia con cuerpos de Levy o una causa infecciosa o metabólica), signos de hipertensión endocraneal (pueden sugerir una causa tumoral) o una neuropatía periférica (puede apoyar una causa tóxica o metabólica). Deben explorarse también los reflejo primitivos, como el reflejo glabelar, el hociqueo, el palmomentoniano o el grasping.
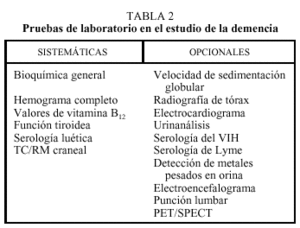
El examen de las funciones cognitivas es de particular importancia en el diagnóstico de la demencia, y es preciso explorar cada una de ellas: atención, lenguaje, memoria, habilidades visuoespaciales y abstractivas. Uno de los tests más utilizados en el examen inicial es el Mini Mental Test de Folstein, que es un instrumento breve, sencillo y sensible en la detección de la demencia que evalúa cinco dominios cognitivos. No obstante, una vez realizado el diagnóstico, el paciente suele requerir un examen cognitivo más exhaustivo. Finalmente, la evaluación etiológica requiere la realización de pruebas de laboratorio, algunas de rutina y otras opcionales (tabla 2).
Enfermedad de Alzheimer
La EA es el tipo de demencia más frecuente, y se caracteriza por una pérdida progresiva de memoria y otras funciones cognitivas. Esta enfermedad afecta a quince millones de personas en el mundo y su frecuencia aumenta gradualmente con la edad, de manera que a los 65 años es del 3%, y después de los 85 años la prevalencia aumenta hasta el 47%.
Anatomía patológica y fisiopatología
Los hallazgos neuropatológicos característicos de la EA son los ovillos neurofibrilares, las placas neuríticas, la angiopatía amiloide y la pérdida sináptica y neuronal4. Estos cambios fueron descritos por primera vez por Alois Alzheimer en 1907. Las placas neuríticas son el resultado de la acumulación extracelular de varias proteínas alrededor de un núcleo de betaamiloide, acompañado de una reacción inflamatoria y de neuritas distróficas. Los ovillos neurofibrilares son agregaciones intracelulares de una proteína asociada a microtúbulos, la proteína tau, que se encuentra en estado hiperfosforilado. La distribución de los ovillos es sistemática; empieza en el córtex entorrinal, progresa a las regiones límbicas corticales y, finalmente, alcanza áreas neocorticales. A medida que estos cambios progresan, se produce una pérdida de las neuronas del hipocampo, el córtex entorrinal y las áreas de asociación del neocórtex. Este patrón se correlaciona con la presencia clínica en la fase inicial de alteraciones mnésicas, seguidas en fases más avanzadas de rasgos afásicos y apráxicos, que reflejan la afección de neuronas con largas proyecciones intrahemisféricas. En la EA el amiloide no sólo se deposita en las placas sino también lo hace en los vasos sanguíneos, formando la llamada angiopatía amiloide.
Los cambios neuropatológicos de la EA, principalmente en el núcleo basal de Meynert y en los lóbulos temporales, producen una disminución de un neurotrasmisor, la acetilcolina (ACh), cuya reducción se correlaciona con la gravedad de la demencia. Sin embargo, además de la ACh, en la EA existe también una reducción de otros neurotrasmisores, como la noradrenalina o la serotonina5. Por otro lado, varios genes se han implicado en la génesis de la EA, como el gen de la presenilina 1, la presenilina 2 y la proteína precursora de amiloide6,7. Mutaciones en estos genes se asocian a una infrecuente forma familiar de EA, que habitualmente se inicia antes de los 60 años de edad y sigue un patrón de herencia autosómico dominante. Además de mutaciones causales, se han identificado varios factores de riesgo asociado a la forma más común de EA, la forma esporádica. El más importante de estos factores de riesgo lo constituye el gen de la apolipoproteína E (Apo E), cuyo locus se encuentra en el cromosoma 19. Este gen codifica para una proteína transportadora de colesterol, que se encuentra también en el interior de las placas neuríticas. A pesar que su papel en la patogenia de la EA no ha sido establecido todavía, está claro que los individuos portadores del alelo ε4 del gen de la Apo E tienen un riesgo más alto de desarrollar la EA. Además, a mayor número de alelos ε4 se corresponde una edad de inicio más temprano y mayor número de depósitos de amiloide.
Cuadro clínico
Los síntomas de la EA son variables y se pueden agrupar en tres esferas: cognitiva, conductual y funcional. Desde el punto de vista cognitivo, el síntoma más frecuente es la pérdida de memoria, con olvidos frecuentes de citas o hechos recientes. La memoria episódica (reciente) suele ser la más afectada inicialmente, mientras que la memoria a largo plazo (remota) se conserva hasta estadios avanzados. Posteriormente, aparecen otros síntomas, como dificultad para orientarse en lugares familiares, problemas en el manejo de dinero o instrumentos cotidianos (p. ej., un teléfono o una lavadora), dificultad para leer y escribir o para reconocer caras familiares. Estos síntomas reflejan la afección de otros dominios cognitivos como orientación, praxis, lenguaje y gnosis. A pesar de que estos síntomas son los más conocidos, la EA cursa con frecuencia con síntomas conductuales y afectivos, como alucinaciones visuales o auditivas e ideas delirantes (en el 40-70% de los casos), generalmente de robo o infidelidad. No obstante, el síntoma conductual más frecuente es la apatía, sin una clara alteración del estado de ánimo, que permite su diferenciación del síndrome depresivo. Otros síntomas conductuales son: agitación psicomotriz, irritabilidad y desinhibición. Como hemos mencionado, el concepto de demencia requiere una merma en la actividad funcional u ocupacional del individuo. En la EA las actividades de la vida diaria se van afectando progresivamente. Primero se afectan las actividades avanzadas, como las relaciones sociales o la actividad laboral, y le siguen las actividades instrumentales, como el manejo de objetos domésticos, dinero, la cocina o el cuidado del hogar. Finalmente, se alteran las actividades básicas de la vida diaria como la higiene, el vestir, la alimentación o el control de los esfínteres. El paciente acaba evolucionando a un estado vegetativo y fallece por una enfermedad intercurrente.
Hasta aquí hemos descrito la forma más frecuente de EA, pero esta enfermedad es clínicamente heterogénea y su expresión clínica puede variar ampliamente. Además del inicio con un síndrome amnésico típico, existen casos de EA con confirmación histopatológica que se presentan como una afasia progresiva que, a su vez, puede ser fluente o no, como una atrofia cortical posterior (término acuñado por Benson en 1988) en forma de déficit visuales mayores (forma occipitotemporal) o como un síndrome parietal (forma parietal).
La evaluación neuropsicológica constituye un elemento esencial en la evaluación del paciente con demencia y suele presentar alteración de la memoria, trastornos del lenguaje con dificultad para denominar objetos, reducción de la fluencia verbal, apraxias de tipo ideomotriz y constructiva, trastorno de la atención y problemas visuoespaciales. Se han elaborado varias escalas para cuantificar el deterioro neuropsicológico de los pacientes con EA; los más utilizados son el MiniMental Test y la Alzheimer's Disease Assessment Scale (ADAS). El examen neurológico puede revelar diferentes signos: reflejo de succión, reflejo mentoniano vivo, grasping, paratonía, rigidez o mioclonías.
Diagnóstico
Dado que no existen pruebas específicas para el diagnóstico de EA, éste se basa en criterios clínicos8. Los más utilizados son los elaborados por el grupo de trabajo del National Institute of Neurological and Communicative Disorders ans Stroke-Alzheimer's Disease and Related Disorders Association (NINDS-ADRDS) resumidos en la tabla 3. El diagnóstico definitivo requiere la confirmación histopatológica, mientras que el diagnóstico de EA probable puede realizarse si existe una demencia de inicio insidioso con progresión, en ausencia de otras enfermedades sistémicas o cerebrales que puedan explicar el trastorno cognitivo. Cuando existan otras enfermedades que puedan explicar el deterioro (p. ej., sífilis, infartos cerebrales, etc.), pero se considera la EA como la principal responsable, el diagnóstico será de EA posible.
Existen, por tanto, una serie de pruebas complementarias que deben realizarse para descartar otras causas de demencia:
Laboratorio. Deben realizarse las siguientes determinaciones: hemograma, urea, electrólitos, función hepática, función tiroidea, valores séricos de vitamina B12 y folatos, serologías de lúes y virus de la inmunodeficiencia humana (VIH).
EEG. En la EA suele observarse un enlentecimiento difuso que suele progresar a medida que avanza la enfermedad.
Potenciales evocados. Consisten en ondas que se registran en el cerebro, producidas por diferentes estímulos, fundamentalmente visuales, sensitivos o auditivos. Los potenciales endógenos o cognitivos, como la P300, se encuentran alterados en el 50-80% de los pacientes con EA comparados con controles sanos, pero estos cambios no son específicos. Sin embargo, dado que la onda P300 es normal en los pacientes con depresión, puede ser de utilidad para diferenciar la EA de un síndrome depresivo.
Tomografía computarizada craneal. En la EA se observa con frecuencia una atrofia cerebral, acompañada de un aumento del sistema ventricular y de los surcos de la convexidad cerebral. En los años ochenta también se observó que en la EA se produce una atrofia del hipocampo con una dilatación de la fisura hipocampal. Sin embargo, la especificidad de estos cambios se desconoce, y el principal papel de la TC es descartar otras causas de demencia, como la hidrocefalia normotensiva, el hematoma subdural, el tumor cerebral y los infartos cerebrales.
Resonancia magnética craneal. La mayor resolución de la RM respecto a la TC y la posibilidad de realizar cortes coronales, que permiten estudiar con mayor precisión el lóbulo temporal y en especial el hipocampo, han impulsado la realización de estudios en la EA. Diversos estudios realizados mediante análisis volumétrico han demostrado que el tamaño del hipocampo y las estructuras temporales mediales son menores en sujetos con EA que en los controles. No obstante, la superposición entre pacientes y controles sanos hace que su utilidad en la práctica diaria sea todavía incierta. Los estudios mediante espectroscopia por RM han demostrado que en la EA se produce una reducción del N-acetilaspartato, el principal marcador neuronal, y un aumento del mioinositol respecto a los sujetos controles.
Tomografía computarizada por emisión de fotón único (SPECT). Esta técnica consiste en la introducción de isótopos radiactivos que se distribuyen por el árbol cerebral vascular, dando una imagen que se relaciona con la actividad cerebral. El más utilizado es el SPECT cerebral de perfusión con 99mTc-HMPAO. En la EA se produce una reducción de la actividad en la regiones temporales y parietales, las zonas más afectadas histopatológicamente. El patrón que se observa en el SPECT es de utilidad en casos seleccionados para diferenciar entre EA y demencia vascular, o entre EA y demencia frontotemporal, mientras que es de menor utilidad para diferenciar entre EA y demencia con cuerpos de Levy.
Tomografía por emisión de positrones (PET). Esta técnica ofrece una medida directa del consumo de glucosa cerebral y, por tanto, de su metabolismo. El patrón que se observa en la EA es una disminución del metabolismo en regiones temporoparietales y frontales con relativa preservación de áreas visuales y el córtex sensitivomotor. Dado su elevado coste, su papel en la práctica diaria está por determinar.
Demencia con cuerpos de Levy
La demencia con cuerpos de Levy (DCL) es la segunda causa más frecuente de demencia degenerativa primaria, después de la EA. Los estudios mediante necropsias en pacientes con demencia han encontrado rasgos típicos de DCL en el 15-25% de los casos. Esta entidad hasta ahora era infradiagnosticada y ha recibido numerosos nombres como «variante de cuerpos de Levy de la EA», «EA con cambios de la enfermedad de Parkinson» o «enfermedad de cuerpos de Levy difusos».
Anatomía patológica
El hallazgo característico de esta entidad es la presencia de cuerpos de Levy (CL) en la corteza cerebral. Los CL constituyen inclusiones intraneuronales esféricas, que se identificaron inicialmente en núcleos subcorticales como uno de los marcadores de la enfermedad de Parkinson (EP). Estas inclusiones contienen agregados fibrilares de una proteína, la alfasinucleína, a los que se unen otras proteínas, particularmente ubicitina, cuya inmunorreactividad se ha utilizado como marcador de los CL. La diferencia de la DCL con la EP es que estas inclusiones se encuentran en el neocórtex, además de en otras áreas subcorticales y el tronco del encéfalo. Como se verá más adelante, la DCL comparte varias similitudes con la EP.
Cuadro clínico
La enfermedad suele iniciarse generalmente después de los 70 años de edad, y los varones parecen ser más susceptibles que las mujeres a padecerla. Los síntomas principales son el deterioro cognitivo progresivo de suficiente magnitud para interferir con las actividades sociales o laborales, con un trastorno de la memoria, de atención y problemas visuoespaciales. Es característico de este tipo de demencia la fluctuación que experimentan los pacientes de un día a otro o a lo largo del mismo día, que se atribuyen a un trastorno atencional. Dos rasgos típicos de la DCL son las alucinaciones y el parkinsonismo. Las alucinaciones suelen ser visuales y, con menor frecuencia, auditivas, muy detalladas y recurrentes. Las imágenes típicas que perciben los pacientes son gente y animales que entran en casa, pero también pueden percibirse formas más abstractas, como pinturas en las paredes. El patrón que presentan estas alucinaciones son similares a las producidas por los fármacos anticolinérgicos y diferentes de otros fármacos alucinógenos (p. ej., LSD). El parkinsonismo suele ser leve y se caracteriza por la presencia de rigidez y lentitud en los movimientos (bradicinesia), siendo menos frecuente el temblor. También puede cursar con facies inexpresiva, postura en flexión y marcha a pequeños pasos. Cabe citar que el parkinsonismo puede presentarse también en otras demencias como la EA, aunque suele hacerlo en estadios tardíos. Otros rasgos clínicos de la DCL son las caídas, las pérdidas de conciencia e hipersensibilidad a fármacos neurolépticos. Las caídas suelen ser secundarias a la alteración de la postura y la marcha secundaria al parkinsonismo, mientras que las pérdidas de conciencia representan una extensión de la enfermedad al tronco del encéfalo con afección del sistema nervioso autónomo. La hipersensibilidad a neurolépticos se ha relacionado con un bloqueo agudo de los receptores D2 postsinápticos en el estriado y suele ser irrreversible. Además de las alucinaciones, otras alteraciones conductuales frecuentes en la DCL son: ideas delirantes, depresión y apatía. La progresión puede ser rápida (1-5 años) hacia una demencia grave y parkinsonismo, a pesar de que en la mayoría de casos el curso es similar a la EA. Los varones tienen peor pronóstico que las mujeres.
Diagnóstico
El diagnóstico de la DCL se basa en criterios clínicos, ya que no existen pruebas específicas que permitan identificarla con precisión9,10. Los criterios diagnósticos se establecieron por consenso y se exponen en la tabla 4. Respecto a las pruebas complementarias, las técnicas de imagen no han demostrado su utilidad práctica a la hora de diferenciar la DCL de otros tipos de demencia. Un estudio demostró que los pacientes con DCL tienen en la RM craneal una atrofia del hipocampo y del lóbulo temporal menos importante que los pacientes con EA. Los pacientes con DCL suelen presentar en el SPECT una hipocaptación en regiones temporoparietales, al igual que los pacientes con EA. Recientemente, se han demostrado que los pacientes con DCL presentan una hipocaptación occipital en el SPECT con mayor frecuencia que en la EA.
Demencia frontotemporal
La demencia frontotemporal (DFT) constituye un grupo heterogéneo de demencias degenerativas que cursan con profundos trastornos de conducta y lenguaje asociados a atrofia frontal y temporal. La DFT es el tercer tipo de demencia cortical tras la EA y la DCL, y se ha estimado que puede afectar al 20% de pacientes con demencia. La DFT se ha clasificado desde el punto de vista clínico e histopatológico, sin que haya una correlación exacta entre ambas. Desde el primer punto de vista, se han definido tres síndromes clínicos: a) la demencia frontotemporal (DFT) variante frontal que constituye la forma más común y se caracteriza por una profunda alteración de la personalidad y conducta social, con distraibilidad, desinhibición y relativa preservación de la memoria; b) la afasia progresiva no fluente (APNF), que consiste en un trastorno progresivo del lenguaje con reducción de la fluencia, errores fonéticos y gramaticales, y c) la demencia semántica (SD) que se caracteriza por una dificultad grave en la denominación y la comprensión de palabras en el contexto de un lenguaje fluente y no dificultoso11.
Anatomía patológica
Desde el punto de vista patológico, se puede diferenciar la enfermedad con cuerpos de Pick, la degeneración corticobasal (DCB), la demencia sin histopatología específica y la demencia con cuerpos de inclusión basófilos. Macroscópicamente, la característica más llamativa de todas ellas es la atrofia lobar frontal, que al inicio suele ser asimétrica. La atrofia suele ser más grave y estar circunscrita en la enfermedad de Pick y menos acusada en el resto de variantes.
Desde el punto de vista microscópico, la enfermedad de Pick se caracteriza por pérdida neuronal en la corteza y estructuras subcorticales, gliosis y la presencia de cuerpos de Pick, inclusiones redondeadas citoplasmáticas en el interior de las neuronas. La DCB se caracteriza por la combinación de neuronas abalonadas con inclusiones argirófilas en neuronas corticales, subcorticales y en la glía. La enfermedad por cuerpos de inclusión basófilos se caracteriza por la presencia de dichos cuerpos en las neuronas de la corteza y los ganglios basales. Por último, la demencia sin histología específica engloba aquellos casos de DFT donde la atrofia lobar sólo se acompaña de pérdida neuronal, gliosis y espongiosis linear.
Los avances más importantes en los últimos años en la DFT han tenido lugar en el campo de su genética. Desde hace años era conocido que la proteína tau, asociada a los microtúbulos de las neuronas, era el principal componente de las inclusiones citoplásmicas que se observan en muchas enfermedades neurodegenerativas, como la DFT, la parálisis supranuclear progresiva, la DCB o la EA. En 1998 se identificaron varias mutaciones el gen tau, que codifica para la proteína tau, en familias con DFT que se transmitía con un patrón autosómico dominante. La similitud entre las formas familiares y esporádicas estableció la conexión entre la disfunción del gen tau y la neurodegeneración, implicando a este gen en la patogenia de esta enfermedad. Además, el depósito de proteína tau varía desde el punto bioquímico en cada una de estas enfermedades neurodegenerativas, de forma que los depósitos de la EA son diferentes desde el punto de vista bioquímico que las de la enfermedad de Pick y, a su vez, son diferentes de la DCB o PSP.
Cuadro clínico
La enfermedad suele iniciarse en la sexta década de la vida. Desde un punto de vista anatómico, la afección de las diferentes regiones del lóbulo frontal da lugar a diferentes grupos de síntomas en la DFT (tabla 5). La disfunción del córtex frontal dorsolateral produce una alteración en las funciones ejecutivas como planificación, abstracción, reducción de la fluencia verbal y perseveraciones. La disfunción del córtex orbitofrontal se asocia a desinhibición, impulsividad y conducta social inapropiada, y la disfunción del córtex cingulado anterior se asocia a apatía y pérdida de interés. Por último, la afección de la región anterior del lóbulo temporal se asocia a cuadros similares al síndrome de Kluver-Bucy, como hiperoralidad, aumento de peso y afecto bizarro. Generalmente, en los diferentes síndromes la afección patológica es simultánea, lo que produce una combinación de síntomas en la DFT. Generalmente, los pacientes se presentan con cambios conductuales insidiosos que les llevan, en ocasiones, a consultas psiquiátricas. Por este motivo no es infrecuente que cuando llega al neurólogo el paciente lleve varios años de enfermedad manifiesta y haya recibido múltiples tratamientos farmacológicos y, en ocasiones, hasta terapia electroconvulsiva. El paciente se puede presentar con una pérdida del interés por sus actividades habituales, pérdida de la iniciativa y del compromiso por su trabajo, con dependencia creciente del cónyuge. Los pacientes tienen dificultades para realizar tareas que antes hacían sin problema, con descuidos o errores derivados de la pobre planificación. Los problemas de memoria, en ocasiones, son el primer síntoma que se refiere, pero habitualmente no existen francos problemas mnésicos o visuoespaciales. Generalmente, el paciente no es consciente de su problema y existe una anosognosia del déficit. Estos síntomas conductuales, en general, persisten y aparecen otros nuevos, como desinhibición o conductas sociopáticas, agresividad o euforia, que se asocian a una lesión de la región orbitofrontal. Otros síntomas, como apatía, pérdida de interés o ausencia de implicación emocional, se relacionan con una afección del córtex cingulado anterior.
Las conductas repetitivas, como coleccionar objetos inútiles o pasar mucho tiempo en la misma actividad, u otras como pequeños hurtos, son también frecuentes. Por último, la alteración temporal anterior da lugar a síntomas similares al de Kluver-Bucy, como hiperoralidad con ingesta de todo tipo de alimentos y en ocasiones de productos no alimenticios, o conductas como mascar chicle o beber o fumar compulsivamente. Otras conductas dentro de este síndrome son la de imitación, donde el paciente copia la conducta de un familiar cercano, o la de utilización, donde el paciente utiliza indiscriminadamente los objetos a su alcance sin necesidad alguna.
En el examen neuropsicológico el deterioro de las funciones ejecutivas suele ser el rasgo más distintivo de la DFT, especialmente si el paciente es visitado en los primeros 2-3 años de evolución. El paciente puede presentar dificultad para cambiar de un test a otro y emplear estrategias limitadas en su realización. Por ejemplo, cuando se le pide que copie una figura compleja, como la de Rey-Osterrieth, el paciente puede empezar a copiar los detalles en lugar de la forma principal. También pueden mostrar dificultades en la inhibición de respuestas o perseveraciones motrices, que es la imposibilidad de detener o cambiar de tareas cuando se le pide. Esta respuesta se puede demostrar con la maniobra de Luria, en que se pide al paciente que realice una secuencia repetida de tres posiciones con la mano, o bien pidiéndole que copie un dibujo donde se alternan picos y cuadrados. Tanto las funciones ejecutivas como la programación motriz tienen lugar en el córtex prefrontal dorsolateral. El lenguaje puede ser normal en los estadios iniciales de la DFT, pero con frecuencia la fluencia espontánea está reducida y las respuestas son breves. Otros síntomas, como las dificultades en la denominación de objetos, los circunloquios y la reducción de la fluencia verbal, son frecuentes en la DFT.
Como hemos citado, además de la DFT se han definido dos cuadros clínicos dentro de este grupo: la afasia progresiva no fluente (APNF) y la demencia semántica (DS). La APNF se caracteriza por un lenguaje no fluente con parafasias fonémicas (uso incorrecto o trasposiciones de fonemas), dificultades en la denominación y agramatismo (utilización incorrecta de formas gramaticales, como artículos o preposiciones). Los síntomas afásicos son el rasgo principal en la APNF en ausencia de un trastorno amnésico o visuoespacial grave. Los trastornos conductuales pueden aparecer en el curso de la APNF pero no suelen ser los síntomas iniciales.
La DS se caracteriza por un lenguaje espontáneo fluente, pero vacío de contenido con poca información. Con frecuencia, el paciente utiliza conceptos genéricos y poco precisos y se acompaña de un defecto en la comprensión de palabras que, en ocasiones, el propio paciente pregunta. También es frecuente la presencia de parafasias semánticas (sustitución de una palabra por otra de significado parecido).
Diagnóstico
El diagnóstico de la DFT se basa en criterios clínicos. Los más utilizados son los criterios de Lund-Manchester y los criterios de consenso publicados en 199812,13. Según los primeros, los síntomas que mejor diferencian entre EA y DFT eran la pérdida de la conciencia personal, la hiperoralidad, la conducta estereotipada y perseverativa, la reducción progresiva del lenguaje y la preservación de la orientación espacial.
Las técnicas de neuroimagen, tanto estructurales como funcionales, pueden contribuir a apoyar el diagnóstico de DFT. Los pacientes con DFT presentan una atrofia en la región frontal medial y temporal anterior en la TC y la RM. En los casos de APNF, la atrofia se localiza en las regiones frontales y temporales izquierdas. En el SPECT con 99mTc-HMPAO en la DFT suele observarse una reducción de la captación en las regiones frontales uni o bilateral, que se correlaciona con las manifestaciones clínicas. Los trastornos conductuales se asocian a una hipoperfusión frontal derecha, mientras que la hipoperfusión frontal izquierda se asocia a los trastornos del lenguaje.
Manejo y tratamiento del paciente con demencia
La discapacidad generada por la demencia es permanente, produciendo un alto coste social y una repercusión ostensible en la estabilidad de la familia y el entorno sociolaboral próximo al enfermo. El diagnóstico de demencia genera, por tanto, gran angustia y ansiedad, tanto al paciente como a sus familiares.
En el caso de la demencia, no sólo van a ser necesarios recursos para aplicar tratamientos prolongados de forma ambulatoria (rehabilitación física y cognitiva), sino que el enfermo va a requerir una supervisión por parte de otras personas en tareas básicas; en los casos graves el cuidador va a necesitar, a su vez, recursos de apoyo (sanitarios, psicológicos y económicos) para que pueda llevar a cabo su tarea de manera continuada. Asimismo, la familia va a necesitar un apoyo psicológico y moral para ser capaces de entender la desintegración psíquica que se produce en un ser humano cercano y querido. Por todos estos motivos, el abordaje del paciente con demencia debe realizarse en función del grado de deterioro cognitivo.
Las necesidades tanto del paciente como del cuidador se van modificando a medida que avanza la enfermedad. En las fases iniciales el manejo del paciente debe realizarse de forma domiciliaria, recibiendo un tratamiento dispensarial. En esta primera fase el paciente, además de beneficiarse de un tratamiento farmacológico, puede comenzar a realizar ejercicios y terapias de rehabilitación cognitiva, como los talleres de memoria. Este doble abordaje favorece y potencia la plasticidad neuronal en fases precoces de la enfermedad. En fases moderadas, y sobre todo en aquellos casos en que existen trastornos conductuales, un recurso idóneo es el hospital de día. Éste proporciona una atención integral y personalizada, y permite la descarga familiar, con la consiguiente mejora de la atención al paciente, que asimismo participa en programas de estimulación cognitiva que retrasan la pérdida de su capacidad funcional. Estos programas han demostrado proporcionar un beneficio, mejorando el rendimiento en los tests neuropsicológicos, por lo que puede ser un tratamiento científicamente demostrado y complementario al tratamiento farmacológico. Finalmente, en las fases avanzadas de la enfermedad, y dadas las dificultades del manejo físico y psíquico de estos pacientes, es necesario recurrir a ingresos en centros sociosanitarios. Ello permite el manejo del paciente en su fase terminal sin detrimento de la relación afectiva familiar. La descripción de los programas y de las técnicas específicas de estimulación cognitiva supera los objetivos de esta monografía; no obstante, se puede consultar en textos especializados específicos.
En cuanto al tratamiento farmacológico, éste varía discretamente en función del tipo de demencia.
Tratamiento farmacológico de la enfermedad de Alzheimer14
Tratamiento colinérgico
Como ya hemos mencionado, en la EA la pérdida de neuronas colinérgicas ocasiona una disminución cerebral de acetilcolina. Con el fin de suplir esta pérdida, se han desarrollado sustancias con capacidad de aumentar su concentración a través de diferentes mecanismos. Los fármacos más utilizados son aquellos con actividad inhibidora de la acetilcolinesterasa, la enzima que degrada la acetilcolina, aumentando su concentración cerebral. Los fármacos de este tipo actualmente disponibles son: tacrina, donepezilo, rivastigmina y galantamina. Este tratamiento proporciona un beneficio modesto pero cuantificable en los tests utilizados, cuando se compara con placebo. Además, los trastornos conductuales, como agitación, delirios o alucinaciones, parecen aparecer con menos frecuencia en pacientes tratados con estos fármacos. El tratamiento puede iniciarse en cualquier momento tras el diagnóstico y requiere un aumento progresivo de la dosis. La tacrina, el primer fármaco desarrollado, ha dejado de utilizarse debido a su hepatotoxicidad. Los efectos secundarios del resto suelen ser de tipo colinérgico, como vómitos, dolor abdominal, diarrea y calambres musculares. Otros fármacos colinérgicos utilizados en el tratamiento, pero no aprobados, son el metrifonato y la eptastigmina.
Tratamiento para disminuir la progresión15
El alfatocoferol (vitamina E) y la selegilina, un inhibidor de la monoaminooxidasa con actividad antioxidante, se han utilizado en la EA moderada o grave y han demostrado que pueden reducir el deterioro funcional reflejado en el retraso en la necesidad de institucionalización. Sin embargo, no se ha observado una mejoría cognitiva, por lo que, aunque la vitamina E se administra en algunos centros conjuntamente con el tratamiento colinérgico, en general no se utilizan en la práctica diaria. Varios estudios han demostrado que las mujeres sometidas a tratamiento hormonal sustitutivo con estrógenos tienen un riesgo de padecer EA menor que las que no lo están. Además, la edad de inicio de la EA es menor en las que no toman estrógenos repecto a las que sí lo hacen. Los antiinflamatorios no esteroideos se han utilizado en al EA, pero en estudios clínicos no han demostrado un beneficio concluyente. Otras sustancias utilizadas pero sin resultados concluyentes son la idebenona, la propentofilina y un extracto de un árbol tropical llamado Ginkgo biloba.
Tratamiento de los trastornos conductuales y afectivos
La depresión mayor ocurre en el 5-8% de pacientes con EA y hasta el 25% presentan un ánimo deprimido al inicio de la pérdida de memoria. Los antidepresivos más utilizados son los inhibidores de la recaptación de serotonina, como la fluoxetina, la paroxetina y el citalopram. Los antidepresivos tricíclicos no han demostrado su eficacia comparada con placebo, y se asocian a frecuentes efectos secundarios. Las alucinaciones y delirios son frecuentes en la EA y aumentan a medida que progresa la enfermedad. El tratamiento consiste en el empleo de neurolépticos, y los más utilizados son haloperidol, risperidona, olanzapina y tioridacina. La carbamacepina y el ácido valproico, dos fármacos antiepilépticos, son útiles para el tratamiento de la agitación y agresividad en pacientes con EA.
Tratamiento farmacológico de la DCL10
El parkinsonismo en la DCL puede mejorar con levodopa, aunque la eficacia suele ser menor que en la EP. El problema principal que limita su uso es el empeoramiento de las alucinaciones. Dada la hipersensibilidad a los fármacos neurolépticos que presentan estos pacientes, las alucinaciones se tratan con benzodiacepinas, clozapina, olanzapina o clormetiazol. El déficit extenso de la función colinérgica y la conservación de los receptores muscarínicos postsinápticos observada en la DCL han llevado al estudio de los fármacos colinérgicos. Un estudio reciente demuestra que la rivastigmina, un inhibidor de la acetilcolinesterasa, es efectiva en el tratamiento de los síntomas conductuales de la DCL.
Tratamiento farmacológico de la DFT16
A pesar de que en la DFT se encuentran alterados múltiples neurotransmisores, existen evidencias de que la disfunción frontal está asociada a una disfunción serotonérgica. Por este motivo, los fármacos serotonérgicos se han utilizado en el tratamiento de la DFT y los más utilizados son la fluoxetina, la paroxetina y la sertralina. Por el contrario, la ausencia de disfunción colinérgica en la DFT hace que el uso de fármacos colinérgicos sea innecesario. Aunque los fármacos agonistas dopaminérgicos, como la bromocriptina, pueden mejorar algunas funciones frontales, como la perseveración, su papel en la DFT está todavía por esclarecer. El tratamiento de los síntomas conductuales, como la agresividad, con frecuencia requieren tratamiento farmacológico. Los más utilizados son risperidona y olanzapina a dosis bajas, y antidepresivos atípicos como la trazodona. Deben evitarse las benzodiacepinas y los neurolépticos clásicos a dosis altas. Los fármacos antiepilépticos, como el valproato sódico o la carbamacepina, son útiles para tratar la agitación y agresividad. La carbamacepina también es efectiva para tratar el síndrome de Kluver-Bucy. Por último, al igual que en la EA, la atención del cuidador es de gran importancia en el tratamiento de la DFT, y es necesario fomentar el apoyo social y emocional del cuidador.