coste-beneficio en cuanto a supervivencia, por lo que el objetivo del médico debe ser la identificación de subgrupos de pacientes potencialmente tratables aunque, de forma infructuosa, el 60% de los pacientes no pertenece
a ninguno de ellos. Aun sin existir tratamiento específico frente a esta entidad, la utilización de nuevas combinaciones terapéuticas basadas en taxanos y gemcitabina parece asociarse a un mayor beneficio clínico y a una mayor supervivencia.
El carcinoma de origen desconocido (COD) representa según las series entre un 5 y un 10% de los tumores sólidos1. Básicamente, es un diagnóstico de exclusión que se establece cuando se detecta una enfermedad tumoral metastásica, sin poder determinar la localización del tumor primario, bien porque éste ha remitido espontáneamente (fenómeno muy infrecuente, pero descrito en melanomas y tumores renales metastásicos)2, o porque es indetectable con los métodos de evaluación diagnóstica disponibles.
Clínicamente, se caracteriza por la aparición temprana de enfermedad metastásica con localización atípica respecto a la que presentan las lesiones cuyo tumor primario se ha identificado. La ubicación de estas metástasis es frecuentemente múltiple, y su presencia determinará la aparición de los síntomas que constituirán el motivo de consulta por parte del paciente. Las localizaciones más comúnmente afectadas son: ganglios linfáticos, hígado, pulmón y hueso.
Estudios genéticos
Aunque la biología del tumor de origen desconocido es aún una incógnita, se han descrito algunas alteraciones genéticas que podrían explicar su comportamiento clínico tan agresivo. Entre estos estudios destaca el realizado por Abbruzzesse en el Hospital MD Anderson, donde se detectaron alteraciones en el brazo corto del cromosoma 1 (Cr1p), que serían responsables de la aparición precoz de un clon celular dominante cuyo fenotipo explicaría la presencia de enfermedad metastásica temprana y atípica3, dotando al tumor de mayor agresividad.
Aunque está por determinar de forma clara su frecuencia y relevancia clínica, se ha observado la existencia de sobreexpresión de p53, bcl-2, C-myc, Ras y Her-2-neu4,5. Los tumores que expresan p53 y bcl-2 podrían presentar una mayor tasa de respuesta a esquemas de tratamiento quimioterápico basados en cisplatino6. Por otro lado, se ha observado recientemente que un 10% de los carcinomas pobremente diferenciados sobreexpresan Her-2-neu, por lo que serían candidatos potenciales a tratamiento con inmunoterapia con anticuerpos monoclonales.
Estudio anatomopatológico
Ante una entidad clínica tan heterogénea como el COD, la información que pueda ofrecer el patólogo es muy valiosa, y adquiere mayor importancia que el conocimiento del tumor primario, en cuanto al pronóstico y actitudes terapéuticas posteriores.
Es preferible que la muestra que se va a estudiar se obtenga mediante biopsia, y no por aspiración con aguja fina (PAAF), puesto que con la primera técnica conseguimos mayor cantidad de tejido que, en muchas ocasiones, es necesario para la realización de estudios complejos7. Además, en algunos casos el diagnóstico inicial sugerido tras el estudio citológico de la muestra obtenida por PAAF se ha modificado tras estudiar el tejido biopsiado.
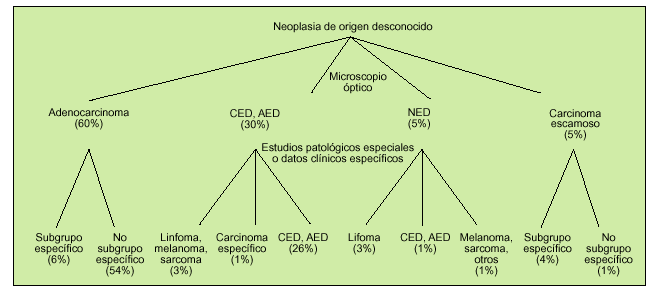
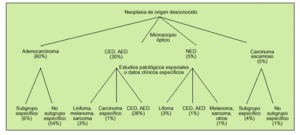
En función de las técnicas diagnósticas utilizadas, y la información que deriva de cada una de ellas, se establecen dos grados dentro de la valoración patológica. En un primer grado se encuentra el estudio mediante microscopia óptica con el que se obtiene el diagnóstico de «neoplasia» y, en la mayoría de ocasiones, aunque dependa del grado de diferenciación celular, se puede englobar en alguna de las categorías que se detallan en la figura 1.
Fig. 1. Principales subgrupos clínicos en el carcinoma de origen desconocido. CED: carcinoma escasamente diferenciado; AED: adenocarcinoma escasamente diferenciado; NED: neoplasia escasamente diferenciada. (Modificado de Hainsworth JD, Greco FA. Treatment of patients with cancer of unknown primary site. N Engl J Med 1995;329:357.)
El siguiente grado diagnóstico se establece utilizando otras técnicas, como son:
Inmunohistoquímica (tinción de inmunoperoxidasa)
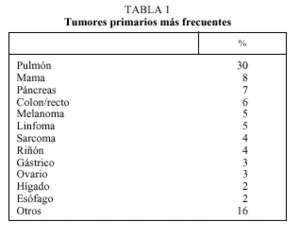
La determinación de marcadores tumorales no debe ser nunca la base del diagnóstico, puesto que no existen marcadores específicos de tumor. Debe entenderse como una información orientativa en cuanto al posible origen del mismo, y completarse con los hallazgos clínicos. En la tabla 1 se exponen los marcadores tumorales más frecuentemente utilizados.
Microscopia electrónica
Es una técnica compleja y de elevado coste, que permite un estudio celular ultraestructural (p. ej., gránulos de secreción en tumores neuroendocrinos, premelanosomas en melanomas, tonofilamentos en tumores epidermoides). No obstante, no existen determinantes específicos de malignidad que se puedan detectar mediante microscopia electrónica8.
Análisis citogenéticos
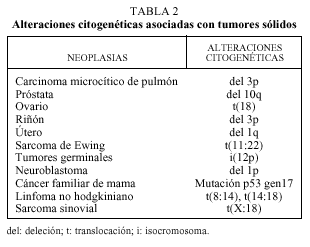
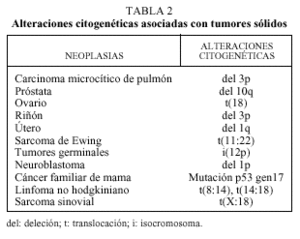
Aunque con un valor diagnóstico todavía limitado, la identificación de anormalidades cromosómicas asociadas a distintas neoplasias representa un paso importante en el estudio de tumores de origen desconocido. En la tabla 2 se resumen algunas de las alteraciones cromosómicas y su asociación con distintos tumores sólidos.
Evaluación clínica
Dentro del estudio básico y la valoración de estos pacientes se deben incluir: historia clínica y exploración física minuciosas, radiología convencional de tórax, analítica básica de sangre y orina, mamografía en mujeres, tomografía computarizada (TC) abdominopélvica, test de sangre oculta en heces, determinación en varones del antígeno prostático específico (PSA), alfafetoproteína (*-FP) y subunidad beta de gonadotrofina coriónica humana (ß-HCG)9. En una serie analizada en el Hospital MD Anderson con 879 pacientes, tras la realización de este estudio básico, se identificó el tumor primario en un 26% de los casos, y sus localizaciones más frecuentes fueron: páncreas, pulmón, melanoma y sarcoma. La realización de más pruebas raras veces es útil en su identificación, e incluso puede concluir en resultados falsamente positivos que condicionen estrategias terapéuticas erróneas. Por tanto, y ante la limitada relación coste-beneficio por la escasa rentabilidad diagnóstica de esta actitud, el objetivo fundamental debe ser englobar al paciente en alguno de los subgrupos de enfermedades potencialmente tratables.
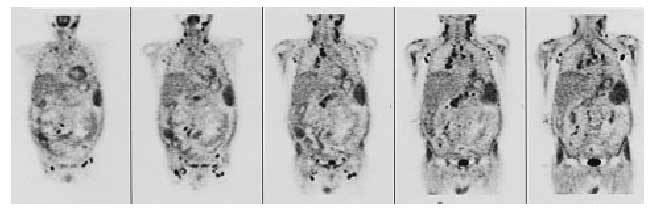
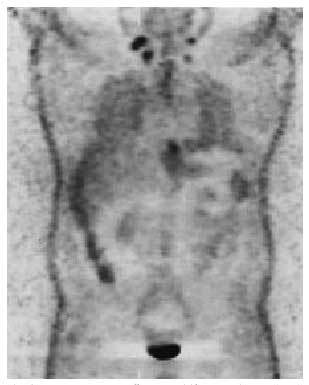
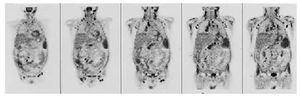
Aunque la tomografía por emisión de positrones (PET) todavía no está considerada como una técnica de aplicación sistemática en el estudio del paciente oncológico, probablemente en un futuro próximo sea un elemento fundamental en el manejo de estos pacientes, puesto que posee una gran sensibilidad para detectar
hipercaptaciones en lesiones tumorales, con un alto valor predictivo negativo, y permite una exploración de cuerpo entero10 (fig. 2).
Fig. 2. Imagen de tomografía por emisión de positrones (PET) de cuerpo entero, que revela múltiples hipercaptaciones patológicas. (Cortesía del Dr. F. Lomeña del Servicio de Medicina Nuclear. Hospital Clínic. Barcelona.)
Adenocarcinoma bien o moderadamente diferenciado
Representa el grupo más frecuente dentro del COD (60%). Su diagnóstico anatomopatológico se realiza según la identificación con microscopia óptica de estructuras glandulares, los estudios con inmunohistoquímica o microscopia electrónica tienen poco valor. Se deben determinar los valores de PSA y receptores hormonales y realizar mamografias, para descartar una neoplasia de próstata y mama, respectivamente, puesto que, aun representando un porcentaje reducido de pacientes dentro del total (3%), en caso de confirmarse su diagnóstico, disponemos de un tratamiento efectivo. La TC abdominal identifica el tumor primario en un 10-35% de los casos.
Clínicamente, suelen ser pacientes mayores de 60 años, que presentan metástasis ganglionares múltiples y con frecuencia extraganglionares (hígado, pulmón y hueso). La localización del tumor primario sólo se consigue en un 15-20% de los casos; con el estudio autópsico se detectan el 70-80% de estos tumores, y sus localizaciones más frecuentes son el páncreas y el pulmón con un 40% cada una de ellas, y con menor frecuencia se locali-
zan los tumores gastrointestinales (estómago, hígado y
colon).
Si tenemos en cuenta que la mayoría de estos pacientes presenta una gran diseminación metastásica y un deterioro importante del estado general (PS, performance status), y que los tumores primarios más frecuentemente identificados se localizan en las zonas gastrointestinal o pulmonar, no nos debe extrañar su rápida progresión clínica, y su mal pronóstico con una supervivencia media de 3-4 meses.
El objetivo debe ser identificar aquellos pacientes con entidades clínicas potencialmente tratables, como son:
1. Paciente de sexo femenino con carcinomatosis peritoneal. Se debe descartar un carcinoma de ovario. En aquellas pacientes con citología de líquido ascítico positiva, estudio histológico compatible (carcinoma seroso papilar), y laparoscopia exploradora normal, estamos ante una carcinomatosis peritoneal primaria extraovárica. Su historia clínica es similar a la del carcinoma de ovario, con valores de CA 125 frecuentemente elevados. El tratamiento, en estos casos, debe ser la máxima cirugía citorreductora, seguida de quimioterapia postoperatoria basada en esquemas con ciplatino o carboplatino + taxanos, que consiguen hasta un 20% de respuestas completas (RC), y un 16% de casos con larga supervivencia. El pronóstico es peor que la carcinomatosis peritoneal secundaria a carcinoma de ovario.
2. Paciente de sexo femenino con metástasis ganglio-
nar axilar. Se debe sospechar un carcinoma de mama, siendo aconsejable la realización de una mamografía, una resonancia magnética (RM) de mama e incluso una PET que, en ocasiones, ha identificado un tumor de mama con mamografías normales11. La determinación de receptores hormonales en el tejido biopsiado apoya el diagnóstico. En ausencia de otras localizaciones metastásicas lo consideraremos como un tumor de mama en estadio II, realizándose una linfadenectomía axilar amplia asociada a un tratamiento local con radioterapia, o una mastectomía radical modificada que pone de manifiesto la presencia de un tumor oculto en un 44-65% de los casos. La quimioterapia o la hormonoterapia con tamoxifeno adyuvante son también opciones terapéu-
ticas.
3. Paciente de sexo masculino con posible carcinoma de próstata. Los pacientes con valores de PSA elevados, aun sin clínica sugestiva de enfermedad prostática, o los que presenten metástasis óseas osteoblásticas independientemente de los valores de PSA, son candidatos a tratamiento hormonal con análogos de LHRH y antiandrógenos.
La mayoría de pacientes diagnosticados de adenocarcinoma bien o moderadamente diferenciado no se incluyen en ninguna de las entidades anteriores, y el objetivo prioritario será alcanzar un buen control de los síntomas. Respecto al tratamiento sistémico, una de las combinaciones más estudiadas ha sido el regimen FAM (5-FU, adriamicina, mitomicina-c), que alcanza una tasa de respuestas en torno al 20%, y una supervivencia mediana de 6 meses. Nuevas combinaciones con taxanos, cisplatino y VP-16 obtienen, en algunas series, un 48% de respuestas globales y un 15% de respuestas completas.
Carcinoma y adenocarcinoma escasamente diferenciado
Representa el 30% de los pacientes con COD (dos tercios de los carcinomas, y un tercio de los adenocarci-
nomas). Clínicamente, si lo comparamos con el ade-
nocarcinoma bien o moderadamente diferenciado, se presenta en pacientes más jóvenes, en torno a los 40-50 años, con rápida progresión de los síntomas (aproximadamente 30 días), una alta velocidad de crecimiento tumoral y una mayor frecuencia de afección ganglionar periférica, mediastínica y retroperitoneal. El estudio con microscopia óptica no es suficiente y es obligada la realización de técnicas de inmunohistoquímica para confirmar el diagnóstico de carcinoma e identificar a aquellos pacientes que puedan presentar tumores de estirpe no epitelial, como linfomas, tumores germinales o melanomas. Incluso en algunos casos será necesario efectuar estudios con microscopia electrónica y análisis citogenéticos (p. ej., estudio del cromosoma 12 para tumores germinales donde es posible alcanzar remisiones completas de larga duración con cisplatino). A diferencia de lo que ocurre con el adenocarcinoma bien diferenciado, el estudio autópsico sólo identifica el tumor primario en un 40% de los casos. Dada la elevada prevalencia de afección mediastínica y retroperitoneal, se debe realizar una TC toracoabdominal y la determinación de *-FP y ß-HCG, puesto que su elevación sugiere la presencia de un tumor de células germinales.
En cuanto al tratamiento, en los casos en los que hayamos podido identificar un tumor específico, como linfoma, sarcoma, etc., lo trataremos como tal. Los casos con afección retroperitoneal o mediastínica y valores elevados de *-FP y ß-HCG se tratarán como tumores germinales, incluso sin diagnóstico patológico. En cuanto al resto de pacientes, que representan la mayoría, la serie más ampliamente estudiada corresponde a es-
quemas de tratamiento basados en cisplatino12 (PVB: cisplatino, vimblastina y bleomicina, o cisplatino + etopósido ± bleomicina), que consiguen un 26% de respuestas completas, con un 12% de pacientes libres de enfermedad a los 6 años, y una supervivencia mediana de 20 meses. En casos de enfermedad residual, se planteará la cirugía. Los esquemas de tratamiento que utilizan taxanos también han demostrado cierta actividad13. Nuevos fármacos como la gemcitabina, activa frente a adenocarcinomas, se han utilizado como tratamiento de segunda línea, ofreciendo una discreta mejoría clínica14.
Carcinoma escamoso
Representa un 5% del COD, con varias formas de presentación clínica.
Adenopatías laterocervicales o supraclaviculares
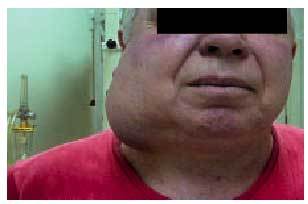
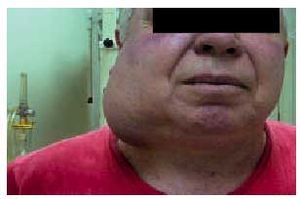
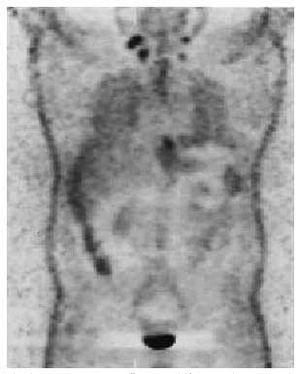
Cuando su localización sea laterocervical media o alta, se debe realizar un estudio endoscópico de orofaringe, hipofaringe y nasofaringe, laringe y esófago proximal, biopsiando todas las áreas sospechosas (fig. 3). La ampliación del estudio mediante TC cervical y PET en ocasiones ha identificado el tumor primario, pudiendo la PET diferenciar entre el tejido cicatricial tras la terapia y el tumor residual (fig. 4). En caso de no identificarse el tumor, se deben realizar biopsias seriadas de nasofaringe, base de lengua, fosas amigdalinas, senos piriformes e incluso amigdalectomía; con este estudio, sólo en un pequeño porcentaje de pacientes (3-9%) no se identificará el tumor primario.
Fig. 3. Paciente afectado de adenopatía laterocervical de gran tamaño.
Fig. 4. Imagen de tomografía por emisión de positrones (PET) que revela una hipercaptación laterocervical correspondiente a adenopatías laterocervicales. (Cortesía del Dr. F. Martín, del Servicio de Medicina Nuclear. Hospital Clínic. Barcelona.)
Si las adenopatías se sitúan a nivel laterocervical inferior o supraclavicular, se debe realizar una TC de tórax y una fibrobroncoscopia para descartar un tumor pulmonar.
Cuando no se detecta el tumor primario, se realiza un tratamiento local, obteniéndose resultados similares con cirugía, radioterapia o la combinación de ambas, sobre todo cuando exista afección ganglionar N2/N3 (N2: metástasis en un único ganglio homolateral con diámetro máximo mayor de 3 cm pero menor o igual a 6 cm; o afección de ganglios linfáticos bilaterales o contralaterales ninguno mayor de 6 cm; N3: metástasis en un ganglio con diámetro máximo mayor de 6 cm). En los pacientes tratados con cirugía aparecerá el tumor primario hasta en un 40% de los casos, porcentaje que se reduce si se administra radioterapia postoperatoria. Aunque el papel de la quimioterapia es controvertido, algunos estudios no aleatorios en los que se ha comparado un tratamiento local exclusivo (cirugía con o sin radioterapia) frente a tratamiento local más quimioterapia con cisplatino y 5-FU, han demostrado en los pacientes que reciben quimioterapia una mayor tasa de respuesta completa (81 frente al 64%) una supervivencia mediana (más de 37 frente a 24 meses)15. Los nuevos esquemas de tratamiento con taxanos también han demostrado ser eficaces.
La supervivencia media a los 5 años es del 50% y se ve influida por la extensión de la enfermedad ganglionar16.
Adenopatías inguinales
Se deben descartar los tumores en la zona genital y anorrectal, puesto que disponemos de tratamientos potencialmente curativos para algunos de ellos. En caso de no localizar el tumor primario, su tratamiento consiste en la linfadenectomía con o sin radioterapia.
Metástasis de carcinoma escamoso
en otras localizaciones
La localización más frecuente será pulmonar, por lo que debe realizarse una TC y una fibrobroncoscopia para descartarlo. Su tratamiento se basará en los esquemas de quimioterapia utilizados en el carcinoma de pulmón no microcítico. No es infrecuente que las metástasis de adenocarcinoma, sobre todo de mama, tengan una diferenciación escamosa, por lo que ante presentaciones clínicas atípicas (paciente joven no fumador, etc.), consideraremos la realización de estudios con inmunohistoquímica o microscopia electrónica para descartarlo.
Neoplasia escasamente diferenciada
Representa el 5% del COD. En este caso, el patólogo informa de la presencia de una neoplasia, pero no puede establecer su estirpe celular (melanoma, sarcoma, linfoma, carcinoma). La ampliación del estudio diagnóstico con técnicas más complejas es fundamental, puesto que muchos de ellos presentan tumores potencialmente tratables. Aproximadamente el 35-65% corresponden a linfomas identificados mediante la tinción del antígeno leucocitario común y que presentan buena respuesta al tratamiento utilizado en el linfoma no hodgkiniano de células grandes. Un 20-50% corresponden a carcinomas y un 15% a melanomas o sarcomas.
Carcinoma neuroendocrino de origen desconocido
Los tumores con diferenciación neuroendocrina, caracterizados desde el punto de vista ultraestructural por la presencia de gránulos de neurosecreción, también pueden presentarse como tumores de origen desconocido, formando parte de alguna de las siguientes entidades clínicas:
Carcinoma neuroendocrino de bajo grado
Se presenta con metástasis hepáticas, óseas, o ambas, y puede asociarse a síndromes derivados de la secreción de sustancias bioactivas, como son el síndrome carcinoide y el Zollinger-Ellison. En ocasiones, se detecta un tumor primario en el intestino delgado, el pulmón o el páncreas. Su evolución es lenta, y presentan escasa respuesta al tratamiento con cisplatino17. Dependiendo de la situación clínica del paciente, se pueden resecar las metástasis hepáticas, utilizar análogos de somatostatina, 5-FU, estreptozocina o doxorrubicina, o realizar un tratamiento puramente sintomático.
Carcinoma de célula pequeña
En pacientes fumadores se realizará un estudio mediante TC y FBS para descartar enfermedad pulmonar. En caso de no identificarse, está indicado iniciar tratamiento utilizando las combinaciones recomendadas en el carcinoma de pulmón de célula pequeña con platino-etopósido. Ante la presencia de una única metástasis se puede valorar tratamiento quirúrgico o radioterápico.
Carcinoma neuroendocrino pobremente diferenciado
Un 10% de los carcinomas escasamente diferenciados presenta gránulos de neurosecreción. El estudio inmunohistoquímico suele ser positivo para la enolasa neuronal específica (NSE), sinaptofisina y cromogranina A, y la citogenética puede revelar datos orientativos, como la presencia de isocromosoma 12p (i12p) en tumores germinales. Son tumores de localización mediastínica, retroperitoneal o de ganglios periféricos, que alcanzan un 77% de respuestas globales y un 26% de respuestas completas con tratamientos basados en cisplatino. Algunos estudios recientes apoyan el uso de combinaciones con taxanos, carboplatino y etopósido.
Entidades clínicas especiales
Carcinoma de origen desconocido de localización única
Una vez descartado un tumor primario, se tratan con cirugía o radioterapia radical, añadiéndose cisplatino en caso de histología de carcinoma o adenocarcinoma escasamente diferenciado.
Derrame pleural aislado
Se debe descartar la presencia de un tumor de ovario o mama realizando una TC abdominopélvica, la determinación de CA 125 y mamografías. Tanto en varones como en mujeres, el adenocarcinoma pulmonar periférico puede presentarse así. En pacientes con buen estado general, en los que no se descubra el origen del derrame, puede realizarse tratamiento con cisplatino y taxanos, mientras que pacientes con un deterioro importante del mismo son candidatos a tratamiento con tamoxifeno o acetato de megestrol.
Melanoma metastásico de origen desconocido
Aproximadamente, en un 10-15% de los pacientes diagnosticados de melanoma no se encuentra el tumor primario. La realización de una exploración física detallada es fundamental, y se debe interrogar al paciente sobre la realización de procedimientos terapéuticos no diagnósticos realizados con anterioridad sobre alguna lesión cutánea. Su tratamiento es la cirugía, con o sin radioterapia.
Tumor germinal con metástasis de otras histologías
Los pacientes afectados de tumores germinales, sobre todo extragonadales, pueden presentar metástasis de estirpe únicamente somática (neuroendocrina o sarcomatosa). La presencia de masas mediastínicas, retroperitoneales o testiculares, y los valores elevados de *-FP y ß-HCG sugieren el diagnóstico. El tratamiento de elección en estos pacientes será la quimioterapia basada en cisplatino.
Enfermedad trofoblástica gestacional
Son mujeres con antecedentes de abortos espontáneos, embarazo o amenorrea, que presentan nódulos pulmonares. Los valores de ß-HCG siempre están elevados, aunque la histología no sea la típica de coriocarcinoma. La mayoría de pacientes son curables con metotrexato.
Pronóstico
En general, el COD tiene mal pronóstico, presentando una supervivencia media de 9-11 meses, con una supervivencia global al año inferior al 25% e inferior al 10% a los 5 años. Se han definido una serie de factores pronóstico18:
Factores pronóstico favorables
Sexo femenino, Karnofsky > 70, afección metastásica única, no fumador, afección retroperitoneal o ganglionar periférica, LDH normal, histología de carcinoma escasamente diferenciado, escamoso, o diferenciación neuroendocrina.
Factores pronóstico desfavorables
Sexo masculino, fumador, Karnofsky < 70, metástasis hepáticas o supraclaviculares, histología de adenocarcinoma, LDH elevada.