Aunque la tuberculosis (TB) es una enfermedad conocida desde antiguo, su tratamiento farmacológico es relativamente reciente. Los progresos en la terapéutica se han sucedido de forma lenta pero continua desde que Waksman descubrió la estreptomicina en 1944. A partir de ese momento, en el tratamiento de la TB existen 3 fechas decisivas: el descubrimiento de la isoniacida en 1952, la introducción de la rifampicina en 1967 y la incorporación de la pirazinamida al tratamiento como medicamento de primera línea al final de la década de los años setenta, lo que permitió acortar el tratamiento a 6 meses. Sin embargo, la tuberculosis continúa siendo un importante problema de salud en todo el mundo puesto que, pese a tener estas combinaciones efectivas de medicamentos, al ser el tratamiento tan prolongado se produce una elevada proporción de mal cumplimiento por los enfermos. Este hecho, unido a la negligencia en el control de la infección y la enfermedad, según la Organización Mundial de la Salud (OMS), está ocasionando la aparición de multirresistencias en todo el mundo, principalmente en países de la antigua Unión Soviética y Asia como consecuencia del desmantelamiento de los servicios de salud pública y la crisis económica1.
En España, la incidencia de la TB se mantiene en cifras muy elevadas que no están de acuerdo con nuestro nivel de desarrollo económico y sanitario2. Los factores más importantes de la falta de control de la enfermedad son, por una parte, las incorrecciones en la práctica médica en cuanto al manejo de la enfermedad (retrasos diagnósticos que condicionan un aumento del riesgo de transmisión de la enfermedad e importantes incorrecciones en cuanto al manejo de las pautas terapéuticas instauradas) y, por otra parte, el abandono del tratamiento por parte del paciente, que se ha mostrado como el problema más serio para el control de la TB y el mayor obstáculo para la eliminación de la enfermedad. La acción sanitaria más importante para acelerar el declive de la TB y conseguir el control de la misma es el tratamiento precoz de todos los enfermos y la correcta cumplimentación de la pauta terapéutica instaurada. Para garantizar esta última se debería intentar conseguir la instauración de un porcentaje creciente de tratamientos directamente observados (TDO), como recomienda la OMS, que incluso preconiza su universalización.
Principios generales del tratamiento
Una terapia farmacológica eficaz reduce rápidamente la población de bacilos viables y, con ello, el riesgo de transmisión. El tratamiento de los casos de esputo positivo debe realizarse con la máxima premura3. La hospitalización debe evitarse y sólo será necesaria en casos muy graves (particularmente como resultado de una complicación grave, como hemoptisis copiosa o pioneumotórax) o en enfermos que se encuentran postrados en cama con una paraparesia grave. A casi todos los demás es posible tratarlos de manera satisfactoria en su domicilio llevando a cabo un seguimiento del cumplimiento del tratamiento. Los corticoides no se recomiendan para el tratamiento ordinario de la TB, pero en el medio hospitalario pueden ser útiles pautas breves en los casos de pericarditis, derrame pleural, meningitis tuberculosa, tuberculosis miliar aguda con disnea y, excepcionalmente, en casos de reacciones severas de hipersensibilidad a los medicamentos antituberculosos5,6.
El conocimiento de los principios bacteriológicos que rigen la quimioterapia de la TB es imprescindible para evitar errores en el planteamiento terapéutico, lo que podría conducir al fracaso y al desarrollo de resistencias a los fármacos antibacilares. Los fármacos empleados en la pauta corta de 6 meses son isoniacida (H), rifampicina (R), pirazinamida (Z), etambutol (E) y estreptomicina (S). Son considerados fármacos de primera línea en función de su eficacia y tolerabilidad. Sin embargo, el tratamiento de pacientes tuberculosos plantea diversas dificultades: los bacilos son sólo sensibles a los fármacos bactericidas cuando están activos metabólicamente y en replicación; además, durante períodos indefinidos permanecen subpoblaciones de bacilos que sólo se activan de modo transitorio durante lapsos muy cortos y, por último, puede haber mutantes farmacorresistentes incluso en poblaciones de bacilos que nunca han estado previamente expuestas a los antibióticos.
Así pues, las características fundamentales en las que se basa la quimioterapia corta son su elevado poder bactericida contra bacilos metabólicamente activos y una actividad esterilizante contra los bacilos que persisten en estado semilatente, así como su capacidad para prevenir las resistencias mientras dure el tratamiento. Consiste en el uso simultáneo de varios fármacos (R, H y Z) para que se produzca la eliminación de las distintas poblaciones bacilares y en una duración suficiente (6 meses) para evitar la aparición de recidivas. La R es el único medicamento bactericida contra las 3 poblaciones antes mencionadas. La H, S y otros aminoglucósidos son bacteridas contra los microorganismos que se localizan en el medio extracelular. La H también resulta bactericida contra los bacilos intracelulares. La Z sólo es bactericida contra aquellos intracelulares y actúa muy bien en medio ácido en la fase inflamatoria de la enfermedad (primera fase o 2 primeros meses). De los medicamentos de segunda línea o de elección, que se utilizan para las presentaciones de tuberculosis resistentes a los de primera o como alternativa en situaciones clínicas aisladas, las fluoroquinolonas (FQ) tienen actividad bactericida. Otros medicamentos de segunda línea son: ácido paraaminosalicílico (PAS), etionamida (Et), cicloserina (Cs), capreomicina (Cm), kanamicina (Km), protionamida (Pt), clofazimina (Cf), rifamicinas y macrólidos.
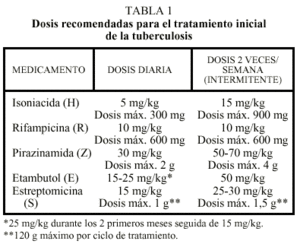
La eficacia de los medicamentos antituberculosos depende de la dosis, que debe realizarse de acuerdo con el peso y la edad. Siempre que sea posible se deben administrar en ayunas y en una sola toma y no debe ingerirse alimento hasta que no hayan pasado 15-30 min. Las dosis se especifican en la tabla 17-11.
Pautas de tratamiento
Continúan siendo válidos los criterios consensuados en 19917 para el tratamiento de enfermos iniciales, que son aquellos que no han recibido ningún tipo de tratamiento antituberculoso o lo han hecho durante menos de un mes: 2 meses con H, R y Z seguido de 4 meses con H más R. Siempre que sea posible se hará uso de especialidades farmacéuticas que combinen los 2 o 3 principales fármacos, pues evitan monoterapias y favorecen el cumplimiento, asegurando que cubran las dosis recomendadas (tabla 1). Las presentaciones actuales de estas asociaciones son: Rifater® (Aventis) que contiene 120 mg de R, 50 mg de H y 300 mg de Z (dosis diaria: 4 comprimidos para enfermos con peso menor a 40 kg, 5 entre 41 y 60 kg, y 6 más de 61 kg); Rifinah® (Aventis) y Rimactazid® (Novartis) que contienen 300 mg de R y 150 mg de H (dosis diaria: 2 comprimidos).
Estudios realizados en España han detectado resistencias primarias a H variables y más recientemente de sólo el 2,9% en la población reclusa4. Al ser inferior al 4%, esta prevalencia sugiere que pautas de 3 fármacos son suficientes, incluyendo siempre Z como tercero. No obstante, es aconsejable investigar esta prevalencia en diversas áreas geográficas para determinar la situación real de la resistencia y considerar la introducción de un cuarto fármaco, E o S. Estos dos compuestos deben formar parte de la pauta inicial en poblaciones con tasas superiores de resistencia primaria (inmigrantes de Europa del este, Latinoamérica, África y Asia).
El paciente debe ser siempre remitido a una unidad especializada ante un fallo terapéutico (fracaso, recidiva o abandono) o si tiene antecedente de contacto con pacientes con cepas multirresistentes, y el tratamiento debe basarse en los estudios de sensibilidad. Si se trata de un paciente con antecedente de tuberculosis (fallo terapéutico), el retratamiento se determinará a partir de la pauta previa y su cumplimiento. Las distintas pautas de tratamiento de TB no multirresistente se resumen en la tabla 2. Todas presentan una fase inicial «intensiva» de 2 meses con al menos 3 fármacos, con una administración diaria, seguida de una fase de mantenimiento con 2 fármacos en la que la administración puede ser diaria
o 2 veces a la semana (tratamiento intermitente). Esta última opción es igual de efectiva que la diaria12, pero siempre debe realizarse bajo estricta observación (TDO).
Tuberculosis multirresistente
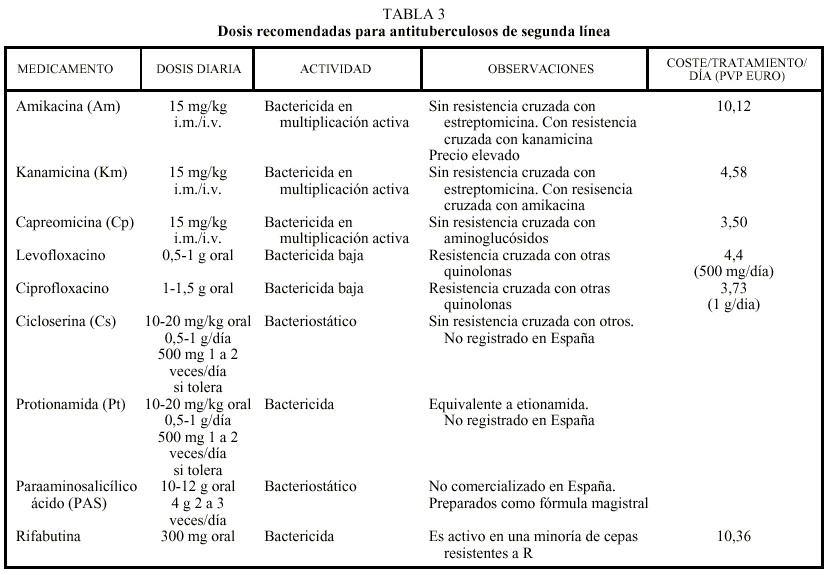
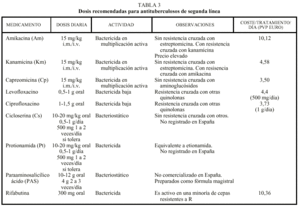
En general, en los casos de fracaso terapéutico o de recidiva tras el empleo de un régimen estándar es muy probable que aparezca una resistencia adquirida a la H y a la R. En estos casos, como se ha mencionado anteriormente, se debe derivar al paciente a centros especializados. En espera de los resultados de las pruebas de sensibilidad, no se debe prescribir un régimen que incluya ambos fármacos. Los regímenes elegidos deberán consistir en una combinación de medicamentos básicos (S, Z y E) y fármacos de segunda línea. No se debe utilizar para tratar una TB multirresistente los derivados de la R como la rifabutina, especialmente cuando hay resistencia a R, o la clofazimina, que es poco activa frente a M. tuberculosis. En la tabla 3 se recogen las dosificaciones recomendadas, los fármacos disponibles en España y el coste del tratamiento/día en precio de venta al público (euros) en envase normal13.
Los esquemas de tratamiento se basan en la sensibilidad y riesgo de toxicidad. Siempre que exista una resistencia a R los tratamientos serán de una duración mínima de 18 meses. Mientras no se disponga de los resultados de las pruebas de sensibilidad la OMS14 propone un «régimen tercera línea» que comprenda al menos 3 medicamentos no utilizados hasta entonces: kanamicina (o amikacina), etionamida (no está disponible en España, se está importando la protionamida que tiene estructura y actividad similar), ofloxacino (en España hay actualmente comercializadas otras quinolonas con igual o mayor eficacia: ciprofloxacino, levofloxacino) más pirazinamida (Z). Tras la conversión bacteriológica (generalmente a los 3 o 4 meses), si no se dispone de los resultados de la prueba inicial de sensibilidad se procederá a una fase de continuación de 18 meses, administrando al menos los 2 medicamentos mejor tolerados y de ordinario más activos: etionamida (protionamida) y ofloxacino (levofloxacino). Se recomienda valorar el tratamiento quirúrgico en casos de resistencias a 4 fármacos. En la tabla 4 se recogen algunas de las pautas posibles en función de los resultados de las resistencias detectadas14-17.
Tratamiento de tuberculosis latente
En la actualidad se prefiere utilizar la denominación tratamiento de TB latente a la de tratamiento preventivo o quimioprofilaxis, con el fin de promover un mayor entendimiento del concepto tanto en los pacientes como en los profesionales sanitarios. Este tratamiento se considera una medida esencial para el control epidemiológico de la TB18.
Hasta hace poco tiempo, la H era el único fármaco con evidencias clínicas de eficacia en el tratamiento de la TB latente. Durante la última década se han completado diversos estudios clínicos de tratamiento de TB latente en pacientes con infección por el virus de la inmunodeficiencia humana (VIH) que han establecido la posibilidad de tratamientos cortos como alternativa a la pauta clásica de H durante 6-12 meses18,19. El esquema de tratamiento habitual promovido por el Consenso4,7 es de H durante 6 meses y durante 9-12 meses en los infectados por el VIH, en los que puede utilizarse también R más Z durante 2 meses. La segunda pauta se reservará para pacientes que pueden retrasar 2 meses el inicio del tratamiento antirretroviral o que no reciben tratamiento triple con inhibidores de la proteasa20. Si se utiliza esta pauta se recomiendan controles a las 2, 4 y 6 semanas de las enzimas hepáticas y de la bilirrubina, ya que se han notificado casos de mortalidad por hepatitis severa21. Otra pauta ensayada en pacientes con VIH es la administración durante 3 meses de R más H22. Se puede administrar 2 veces a la semana (tratamiento intermitente), en cuyo caso se recomienda hacerlo en régimen de tratamiento directamente observado.
Aunque no existen evidencias clínicas al respecto, en los casos en los que no es recomendable usar R (pacientes con infección por el VIH en tratamiento con inhibidores de la proteasa), ésta se puede sustituir por rifabutina. La manera más segura de realizar este tipo de tratamiento sería monitorizando los valores de los inhibidores de la proteasa.
El régimen terapéutico de R con Z durante 2 meses no ha sido suficientemente evaluado en sujetos no infectados por el VIH, aunque parece razonable que sea igual o más eficaz que en estos pacientes18.
En la actualidad, la pauta clásica de 6 meses de H se está cuestionando. En 1999, la American Thoracic Society (ATS) y los Centers for Disease Control and Prevention (CDC) establecieron nuevas recomendaciones para las pruebas de tuberculinas y tratamiento de la TB latente según los resultados de ensayos clínicos. Consideran como recomendación «preferida» en pacientes inmumocompetentes un tratamiento de H durante 9 meses y como alternativa «aceptable», H durante 6 meses, R durante 4 meses diariamente y finalmente la combinación de R y Z durante 2 meses diariamente. En pacientes positivos para el VIH se consideran de elección tanto la H durante 9 meses como R con Z durante 2 meses y, como alternativa, R durante 4 meses23.
Control del cumplimiento y tratamiento directamente observado (TDO)
Se ha estimado que es habitual que un 20-50% de los pacientes tomen de forma incorrecta o no completen el régimen terapéutico prescrito. El riesgo de incumplimiento es mayor después de la fase inicial del mismo, transcurridas las primeras 6-8 semanas. Los fallos en la cumplimentación del tratamiento conllevan fracasos terapéuticos y aparición de resistencias secundarias. Dada la dificultad de prever el cumplimiento por parte del paciente se han desarrollado distintas técnicas para poder evaluarlo. Las técnicas indirectas, consistentes en recuento de comprimidos sobrantes, interrogatorios, etc. no aseguran la ingesta del tratamiento. Existen métodos directos que permiten la determinación de las concentraciones de los medicamentos en sangre o sus metabolitos en la orina, pero son difíciles de incluir en un programa de control rutinario. Sin embargo, existen métodos cualitativos sencillos de detección de H y metabolitos en orina que se están empleando en centros de salud y unidades de tuberculosis de Galicia de forma rutinaria24,25.
Los métodos anteriormente citados tampoco aseguran un completo cumplimiento. La única certeza de adhesión es el denominado tratamiento directamente observado (TDO), que consiste en observar cómo el enfermo toma la medicación, controlando si la ha ingerido. Su eficacia ha hecho que sea considerado en la actualidad el estándar del tratamiento antituberculoso y su implantación ha sido recomendada por la OMS11,26. Su instauración en España es poco común2,4; en Galicia representa un 12% de los casos tratados en 1999, con tendencia a incrementarse27. Su uso, en todo caso, es especialmente recomendable cuando el incumplimiento es previsible (alcoholismo, indigencia, prisión, desestructuración familiar o social, toxicomanías, trastornos mentales, antecedentes de abandono del tratamiento, prostitución, inmigrantes o retratamientos) y en algunos casos de tratamiento de TB latente. Debería ser obligatorio en incumplidores en los que se han intentado otras medidas de cumplimiento (amplia información, apoyo familiar, incentivos, entrega gratuita de la medicación, etcétera).
El Programa Gallego de Prevención y Control de la Tuberculosis plantea la instauración progresiva de TDO en los siguientes casos28: a) todos los retratamientos, en los que se incluyen los fracasos de tratamiento, las recidivas, los casos previamente tratados durante más de un mes y todos los abandonos recuperados; b) pacientes con factores asociados que hacen sospechar un mayor riesgo de abandono de tratamiento (usuarios de drogas por vía parenteral [UDVP], enfermos positivos para el VIH, individuos sin lugar de residencia fija, personas con problemática de tipo social y/o económica, alcohólicos, etc.); c) todos los pacientes con resistencia a la H y/o R; d) todos los pacientes con pautas de tratamiento intermitentes, y e) todos los pacientes con pautas de tratamiento autoadministrado que no han acudido a la consulta de seguimiento evolutivo y de control de adhesión al tratamiento.
En los pacientes más necesitados se puede favorecer el TDO en plazas de internamiento, habitualmente en centros sociosanitarios con estancias ilimitadas o mediante equipos ambulatorios que administran la medicación allí donde el paciente está (domicilio, pensión, la propia calle, etc.). El TDO también puede aplicarse en centros de atención primaria, dispensarios antituberculosos, programas de mantenimiento con metadona (muy útiles en UDVP), centros para alcohólicos y/o indigentes, etc. Se recomienda la creación de este tipo de centros y de equipos en aquellas zonas donde sean necesarios3.
También puede ser útil el tratamiento supervisado semanal (TSS) y el TDO intermitente desde el inicio (2 veces/semana), que operativamente es más fácil. Si el tratamiento no es aceptado o se abandona, debe pfrecerse de forma voluntaria el internamiento y, en bacilíferos que rechacen esta medida, debería procederse al TDO obligatorio o a ingreso por orden judicial si fuera necesario. Los enfermos suelen responder bien a los incentivos. Los más importantes son la metadona en los toxicómanos, el ingreso de indigentes en centros sanitarios, la comida, la vivienda y el transporte. En algunos pacientes bacilíferos que precisen TDO es útil el ingreso hospitalario durante 3 semanas, seguido del traslado a un centro sociosanitario hasta cumplir la fase intensiva del segundo mes de tratamiento (como mínimo) y después TDO ambulatorio. Si no se dispone de estos recursos, el TSS constituye una alternativa3. Se considera que estos programas presentan una buena relación coste-efectividad29.
Problemas relacionados con el tratamiento farmacológico
Interacciones
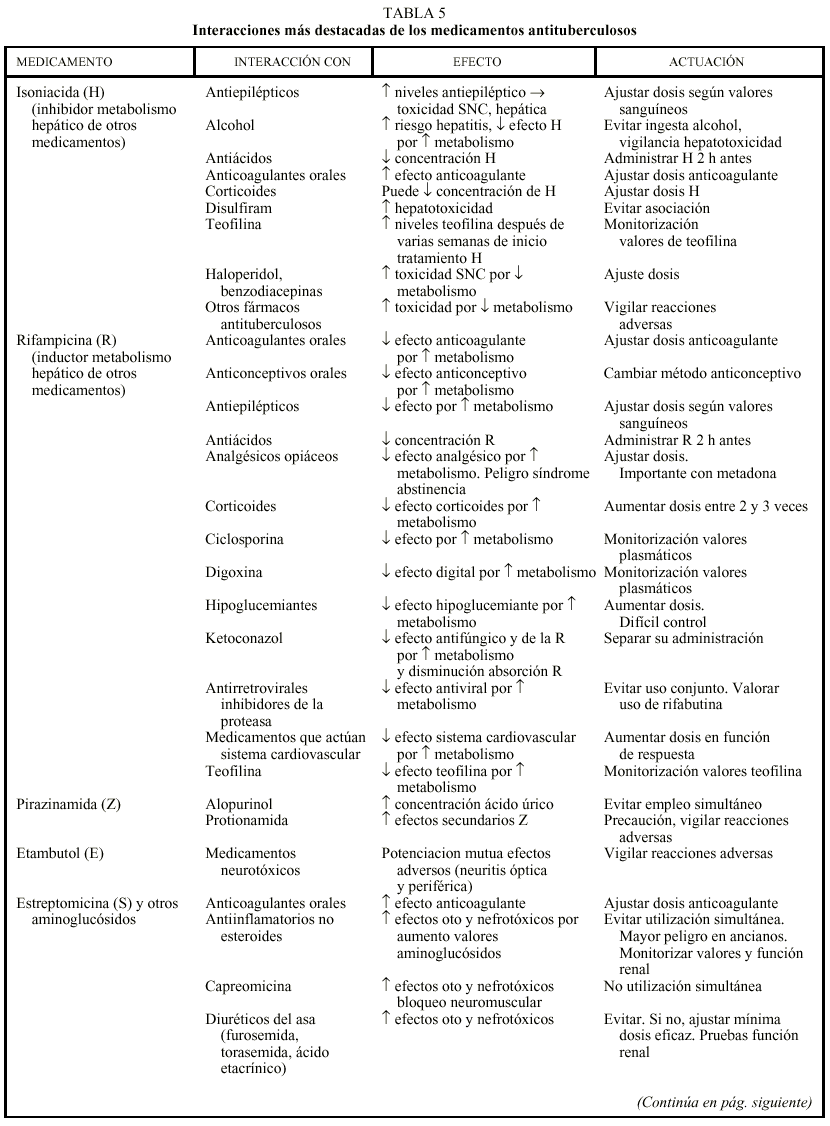
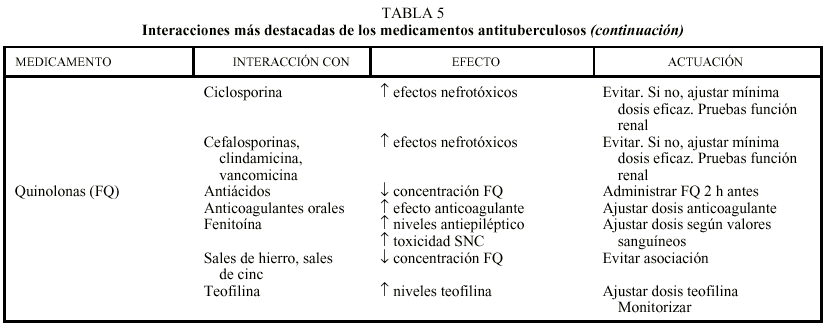
Los 2 medicamentos básicos del tratamiento de la TB, H y R, presentan numerosas interacciones que deben tenerse en cuenta, sobre todo cuando el paciente necesita la administración de otros medicamentos con un estrecho margen terapéutico. Las interacciones se producen en el sistema citocromo P-450 del hígado sobre el que actúan de forma distinta. La H es un inhibidor enzimático, que habitualmente provoca un aumento de los valores sanguíneos de los medicamentos que se metabolizan en esa localización con el consiguiente riesgo de toxicidad, mientras que la R es un inductor enzimático que acelera el aclaramiento de aquellos fármacos, pudiendo ocasionar concentraciones subterapéuticas de los mismos. En la tabla 5 se recogen las principales interacciones de los medicamentos antituberculosos y algunas acciones para minimizar sus efectos8,30,31.
Reacciones adversas
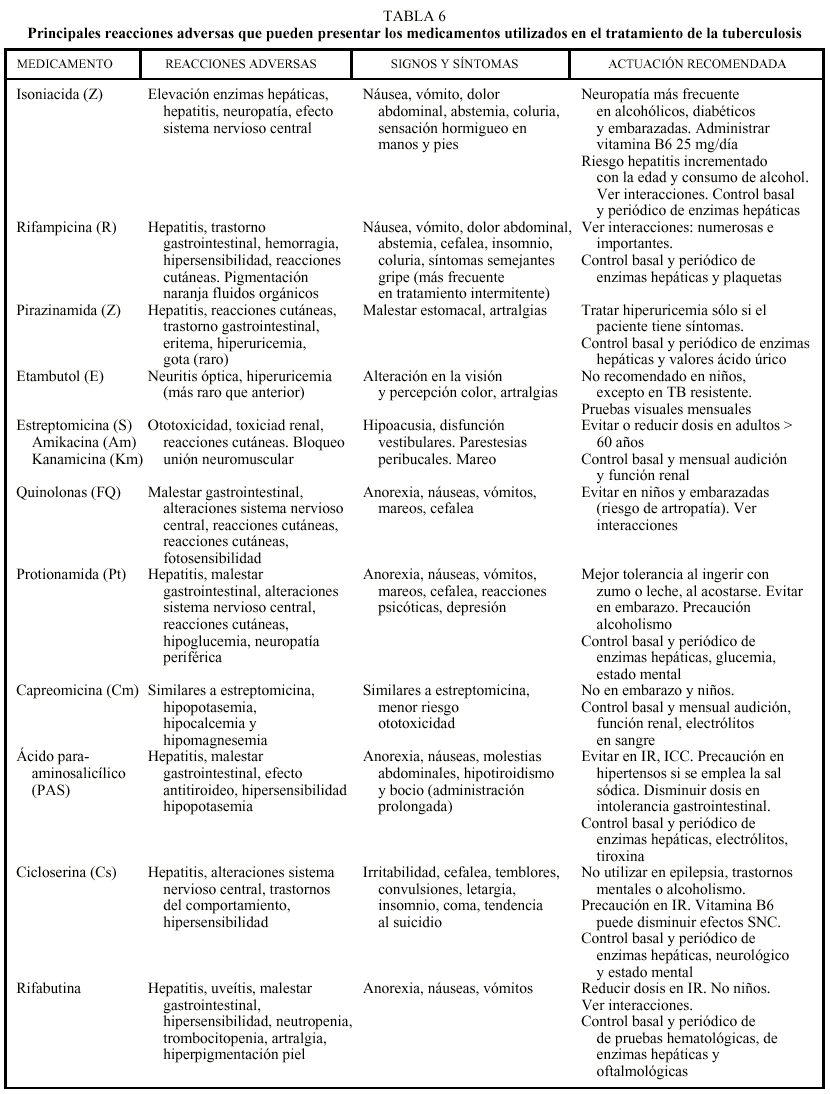
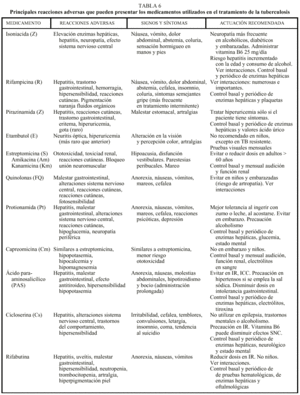
Los efectos adversos a los medicamentos antituberculosos pueden ser leves o bien poner en riesgo la vida. Todos los pacientes en tratamiento deben tener conocimiento acerca de los síntomas atribuibles a reacciones adversas graves, así como a aquellas modificaciones que resultan intrascendentes como los cambios de pigmentación de los líquidos corporales cuando se utiliza R. En la tabla 6 se resumen los principales efectos adversos de los medicamentos antituberculosos, tanto de primera como de segunda línea8,10,12. En general, ante síntomas menores la actuación sería:
1. Intolerancia digestiva: Se puede mejorar fraccionando la dosis los primeros días, ingiriendo el fármaco después del desayuno o administrándolo al acostarse.
2. Hiperuricemia: Si no hay molestias no se realizarán cambios. Ante una artralgia moderada se llevará a cabo control con antiinflamatorios. En caso de artralgia importante o crisis gotosa se suspenderá el fármaco causante durante 8 días y se reanudará el tratamiento después; si los síntomas regresaran se cambiaría la pauta de tratamiento.
3. Reacción cutánea: Si es moderada y no cede con antihistamínicos se suspenderá durante 8 días el tratamiento y se reintroducirá gradualmente: si reaparece se sustituirá el medicamento causante. Si la reacción es grave y no cede con antihistamínicos, se suprimirá el tratamiento, se identificará el fármaco causante y se cambiará definitivamente por otro.
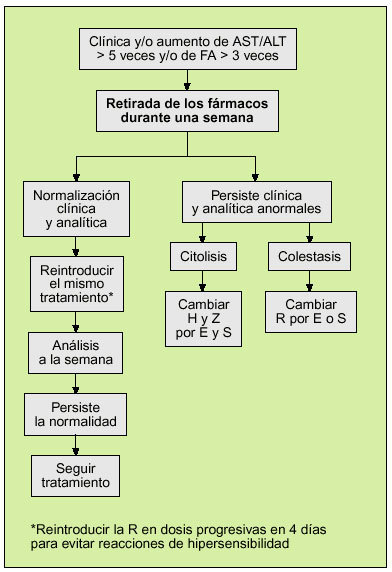
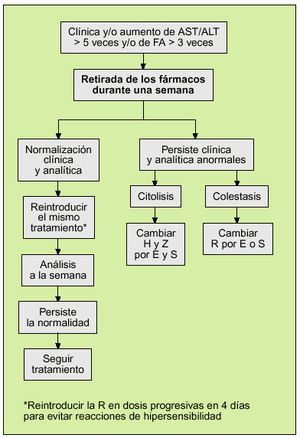
En caso de que se produzca algún efecto tóxico grave, como hepatitis, alteraciones hematológicas o neuropatía, el tratamiento deberá suspenderse de inmediato. En la figura 1 se recoge la actuación que debe realizarse ante una elevación de las enzimas hepáticas durante un tratamiento convencional de 6 meses32.
Situaciones especiales
Inmunodeficiencias
Los pacientes con insuficiencia renal crónica, desnutrición, tumores de origen hemático o reticuloendotelial e infección por el HIV, así como aquellos que reciben medicamentos inmunodepresores, tienen mayor riesgo de presentar TB en caso de estar infectados. Si se desarrolla la enfermedad presentan un riesgo más elevado de TB extrapulmonar y diseminada. En general, el tratamiento de la TB extrapulmonar es similar al de la TB pulmonar10.
Según el Consenso4, los enfermos infectados por el VIH deben ser tratados por un especialista y deben tenerse en cuenta las numerosas interacciones farmacocinéticas que existen entre las rifamicinas y los inhibidores de la proteasa (IP) y los inhibidores no nucleósicos de la trascriptasa inversa. Debe usarse TDO para asegurar el cumplimiento del tratamiento (de la tuberculosis y del VIH) en UDVP y en otros pacientes con previsible mal cumplimiento. Deben recomendarse pautas de 9 meses, ya que se han observado más recaídas en pautas de sólo 6 meses. También debe priorizarse el uso de fármacos combinados para evitar monoterapias. El Consenso propone4:
1. En pacientes sin tratamiento antirretroviral, prescribir una pauta de 9 meses (dos con H, R y Z más siete con H y R) y retrasar el inicio de tratamiento antirretroviral hasta pasado el segundo mes. A partir del tercer mes se puede optar por: a) sustituir la R por rifabutina a dosis de 150 mg/día (H más rifabutina hasta completar 9 meses) y utilizar como IP nelfinavir (750 mg/8 h) o indinavir (aumentar la dosis a 1.000 mg/8 h) o mantener la dosis de rifabutina de 300 mg/día y utilizar nevirapina (400 mg/día), y b) mantener H y R hasta completar 9 meses y seleccionar ritonavir como inhibidor de la proteasa o efavirenz como inhibidor no nucleósido de la transcriptasa inversa. En ambas situaciones deben monitorizarse la carga viral y los CD4.
2. En pacientes que ya reciben un tratamiento antirretroviral con el que se consigue controlar la infección por el VIH no se recomienda interrumpirlo, por lo que se realizarán los ajustes necesarios para adecuar los tratamientos a los esquemas enunciados con anterioridad. La R y la nevirapina son inductores del citocromo P-450 y en los UDVP interaccionan con la metadona acelerando su metabolismo, por lo que debe incrementarse la dosis de metadona. No existen datos con efavirenz, aunque también es un inductor del citocromo P-450.
Otra situación de inmunodeficiencia son los pacientes que reciben tratamiento inmunodepresor tras un trasplante de órgano. Habitualmente responden de manera adecuada a la quimioterapia antituberculosa convencional. Si se emplea ciclosporina como agente inmunodepresor, ésta interactúa con el metabolismo de la R (tabla 5). Se producen concentraciones más bajas de ciclosporina y, por tanto, se incrementa el riesgo de rechazo de trasplante. El tratamiento intermitente es difícil de aplicar cuando se intenta controlar los valores plasmáticos de ambos fármacos. Al igual que con los IP, la rifabutina tiene un menor efecto sobre la ciclosporina que la R. El régimen de administración diario con rifabutina puede resultar idóneo para tratar la TB en estos pacientes. El control de las concentraciones plasmáticas ayuda a optimizar el tratamiento farmacológico10.
Embarazo y lactancia
El riesgo de una TB no tratada en una mujer embarazada es mayor para ella y su feto que el tratamiento. Los 4 fármacos de primera línea de elección (R, H, E y Z) se consideran seguros y no se han asociado a malformaciones33, por lo que debe utilizarse el tratamiento convencional. Las pautas, el control y seguimiento han de ser los habituales. Se aconseja la adición de piridoxina a todas las embarazadas que ingieran H. No debe utilizarse S ni otro aminoglucósido por el riesgo de ototoxicidad (hipoacusia) que pueden producir en el feto. Como medicamento de segunda línea se considera que ciprofloxacino presenta el mejor perfil de seguridad.
Los niños recién nacidos de madre con una TB activa deben recibir tratamiento para una TB latente con H. Se evitará en estos casos la lactancia materna, puesto que la madre estará también tomando dicho medicamento como parte de su tratamiento. En caso de no estar activa la enfermedad en el momento del parto, la mujer puede iniciar la lactancia, ya que se excretan cantidades subterapéuticas en la leche. Algunos autores recomiendan amamantar al niño antes de la toma del tratamiento y sustituir la primera lactancia posterior por una artificial con el fin de evitar concentraciones séricas elevadas34.
Insuficiencia renal
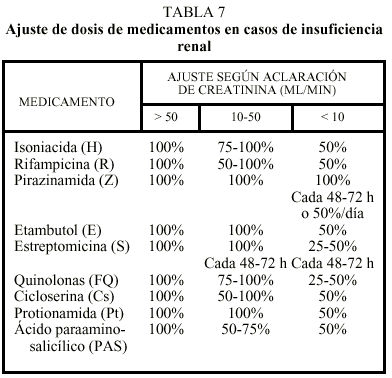
La OMS establece que en fallo renal puede utilizarse H, R y Z a dosis normales y recomienda como pauta más segura la de 2 meses de la triple asociación de los medicamentos antes citados y 6 meses de R y H11.
Deben evitarse fármacos nefrotóxicos o los que se eliminen por vía renal, como estreptomicina, kanamicina, capreomicina, etambutol, cicloserina y fluoroquinolonas. Si fuera necesaria su utilización, deben ajustarse las dosis a intervalos en función de los valores séricos determinados. Los medicamentos antituberculosos son aclarados de forma variable por hemodiálisis. En los días de diálisis, la toma del tratamiento debe hacerse habitualmente después de la diálisis. En la tabla 7 se expresan las ajustes en función del aclaramiento renal8,10.
Enfermedad hepática
En general, los pacientes con enfermedad hepática crónica (hepatitis crónica activa o cirrosis, portadores crónicos del virus de la hepatitis B y C) no necesitan un ajuste posológico de los fármacos antituberculosos9. No obstante, es necesario llevar a cabo una vigilancia más frecuente en los primeros meses del tratamiento, realizando controles de la función hepática semanales durantes las 2 primeras semanas y posteriormente cada 2 semanas35.
Si durante el tratamiento se observa una elevación de las transaminasas a 5 veces los valores normales se debe revaluar el tratamiento siguiendo el protocolo de la figura 1.
En caso de hepatopatía grave o descompensada se debe evitar en los medicamentos de primera línea la Z y, en los de segunda, la protionamida, por ser hepatotóxicos. Se puede utilizar las pautas recogidas en la tabla 89,11.
Perspectivas de tratamiento
Dentro del campo de la inmunoterapia están en estudio más de 100 vacunas animales de distintos tipos ensayadas en modelos. Unas son subunidades antigénicas proteicas, lipídicas o de carbohidratos de M. tuberculosis en varias formulaciones, que son potencialmente específicas, definidas y seguras, pero como desventaja presentan una limitada respuesta inmunológica. Otro tipo de vacunas consisten en ADN que codifica varios antígenos de M. tuberculosis y que son fáciles de producir, relativamente económicas e inducen respuestas inmunológicas duraderas mediadas por células. Por último, las vacunas vivas atenuadas que incluyen especies micobacterianas no patógenas y BCG genéticamente manipulada que expresan antígenos inmunodominantes de M. tuberculosis presentan la ventaja de la amplitud de rango antigénico y persistencia de la respuesta, pero su seguridad en inmunodeficientes no ha sido establecida36,37.
En el campo farmacológico se está investigando, por una parte, el desarrollo de formas farmacéuticas de acción sostenida o implantables que mejoren el cumplimiento terapéutico y, por otra, nuevos medicamentos con mecanismos de acción distintos a los clásicos para combatir las resistencias. En modelos animales se están probando nitroimidazopironas (de estructura similar al metronidazol) y oxazolidinonas entre las que se encuentra el linezolid38. En la actualidad, el conocimiento de la secuencia del genoma de M. Tuberculosis permitirá el desarrollo de nuevos fármacos. Sin embargo, la perspectiva de poder manejar a corto plazo nuevos tratamientos más eficaces y de menor duración para luchar contra la enfermedad tuberculosa no parece factible.