El absceso pulmonar es infrecuente en la actualidad, dado el avance en el proceso diagnóstico y correcto tratamiento de las enfermedades que inducen al mismo. Ocurre principalmente en pacientes con factores de riesgo predisponentes como inmunosupresión, infecciones de las vías respiratorias, procesos neoplásicos y disfunciones neurológicas, entre otros.
Se presenta el caso de una paciente de 70 años de edad, con antecedentes personales de hipertensión arterial y dislipidemia (sin tratamiento farmacológico), poliartrosis y fibromialgia, que consultó a su médico de atención primaria por un cuadro catarral. Tras el diagnóstico de absceso pulmonar corroborado con un estudio tomográfico, la evolución de la paciente fue satisfactoria con el tratamiento instaurado, consistente en administración empírica de antibióticos de primera elección.
Pretendemos destacar la importancia que tiene el control médico en pacientes mayores de 65 años con escasa comorbilidad y que presentan una infección respiratoria alta habitual, que puede llevar a complicaciones poco frecuentes cuando no se diagnostica ni se trata a tiempo.
Lung abscesses are currently uncommon due to the advances in the diagnostic process and correct treatment of the diseases in which they usually occur. They occur mainly in patients with predisposing risk factors, including, among others, immunosuppression, respiratory tract infections, neoplastic processes, and neurological dysfunctions.
The case is present of a 70 year-old patient with a personal history of arterial hypertension and dyslipidaemia (with no pharmacological treatment), polyarthritis, and fibromyalgia, who consulted his Primary Care physician due to having symptoms of catarrh. The pulmonary abscess diagnosis was confirmed by computed tomography scan, and the patient progressed satisfactorily with the empirical treatment with first line antibiotics.
Emphasis is placed on the important role of the medical review in patients over 65 years-old with little comorbidity and who present with a common upper respiratory infection that could lead to uncommon complications if they are not diagnosed or treated in time.
Mujer de 70 años de edad, con antecedentes personales de hipertensión arterial y dislipidemia sin tratamiento farmacológico, depresión, fibromialgia y poliartrosis. Antecedentes quirúrgicos: amigdalectomía, apendicectomía y síndrome del túnel carpiano bilateral. Tratamiento habitual: fluoxetina y paracetamol. No refiere hábitos tóxicos y no tiene reacciones alérgicas conocidas. No hay otros antecedentes de interés clínico; es independiente para las actividades básicas de la vida diaria.
Acude a la consulta de atención primaria (AP) por un cuadro de 8 días de evolución, con malestar general, estornudos, rinorrea acuosa, accesos de tos seca, sin fiebre ni otra sintomatología.
En la exploración la orofaringe está hiperémica. La auscultación pulmonar muestra murmullo vesicular normal y sin ruidos patológicos.
Se diagnostica en esta primera visita un cuadro catarral de vías altas y se pauta tratamiento sintomático.
En los últimos 4 días ha sufrido deterioro clínico. Presenta astenia, sensación distérmica no termometrada, sudoración profusa, tos con expectoración herrumbrosa y restos hemáticos, además de disnea de moderados esfuerzos, dolor pleurítico izquierdo y sin pérdida de peso.
En la exploración física posterior la auscultación pulmonar muestra crepitantes en la base pulmonar derecha.
La paciente no ha realizado tratamiento antibiótico y no existen antecedentes epidemiológicos de interés.
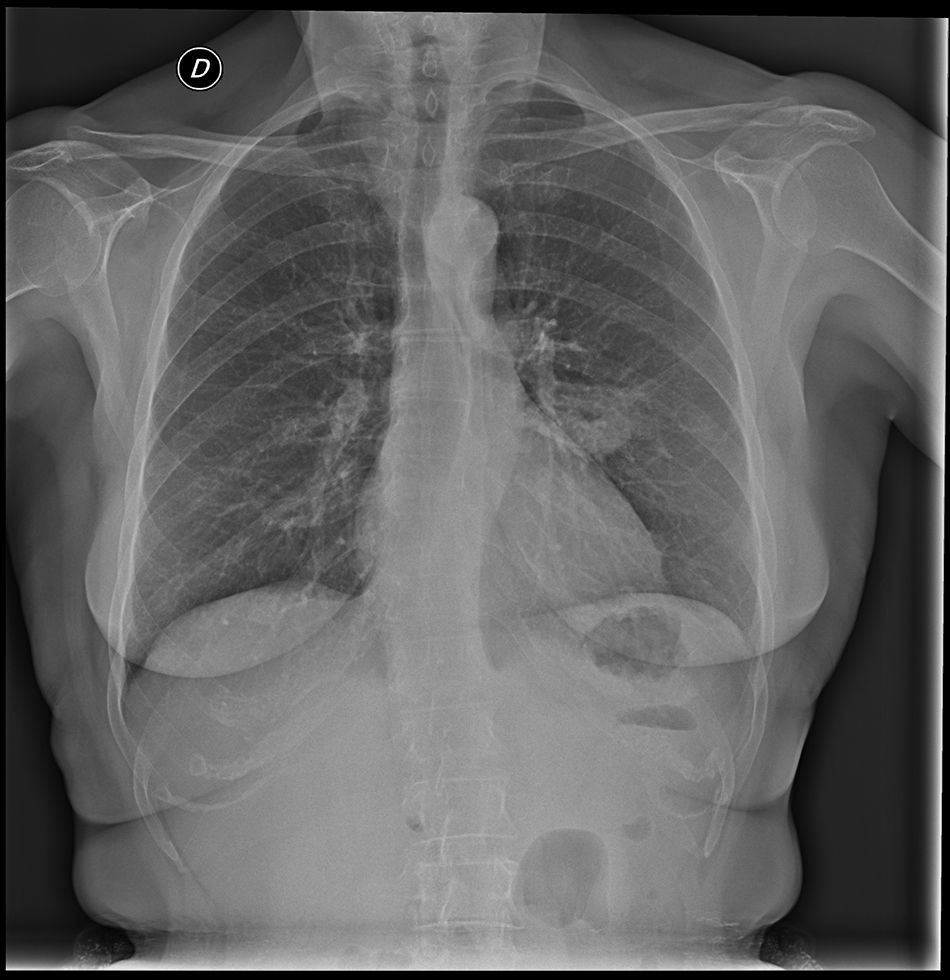
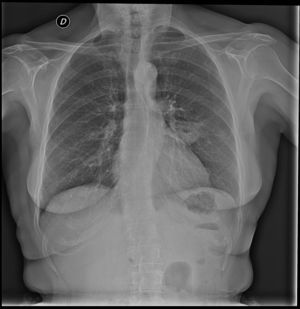
Ante este contexto su médico de AP (MAP) solicita una radiografía de tórax (fig. 1), en la que se evidencia un nódulo bien delimitado que sugiere una imagen de cavitación en su interior, en un contexto de infección; puede corresponder a un absceso pulmonar periférico (segmento apical del lóbulo inferior izquierdo), aunque no se observa consolidación parenquimatosa adyacente. Se revisan las radiografías previas, en las que no se observan imágenes de estas características.
Dada la tórpida evolución de la paciente y los hallazgos radiológicos, su MAP decide la derivación al servicio de urgencias hospitalarias, desde donde es ingresada en el servicio de medicina interna para realizar estudios complementarios e iniciar tratamiento intravenoso.
En la exploración física se observa una paciente consciente, colaboradora, con regular estado general. La presión arterial es de 151/72mmHg, frecuencia cardiaca 100lpm, sin fiebre, eupneica en reposo, saturación de oxígeno 97%, sin cianosis y bien perfundida. Cavidad oral sin caries ni halitosis; presenta rotura de un molar de la arcada superior derecha sin tratamiento, petequias en la orofaringe, no exudados ni moco en el cavum. Otoscopia normal bilateral. No adenopatías cervicales significativas. La auscultación cardiaca es rítmica y sin soplos, y la auscultación pulmonar con buena ventilación y crepitantes en la base pulmonar izquierda. En el abdomen no hay hallazgos relevantes. Extremidades inferiores sin edemas, sin signos de trombosis venosa profunda ni flebitis.
En el registro electrocardiográfico no se observan alteraciones valorables.
La analítica muestra elevación de proteína C reactiva (18,6mg/dl), leve leucocitosis con desviación izquierda, anemia leve normocítica normocrómica y leve trombocitosis. El estudio de coagulación y la gasometría arterial son normales.
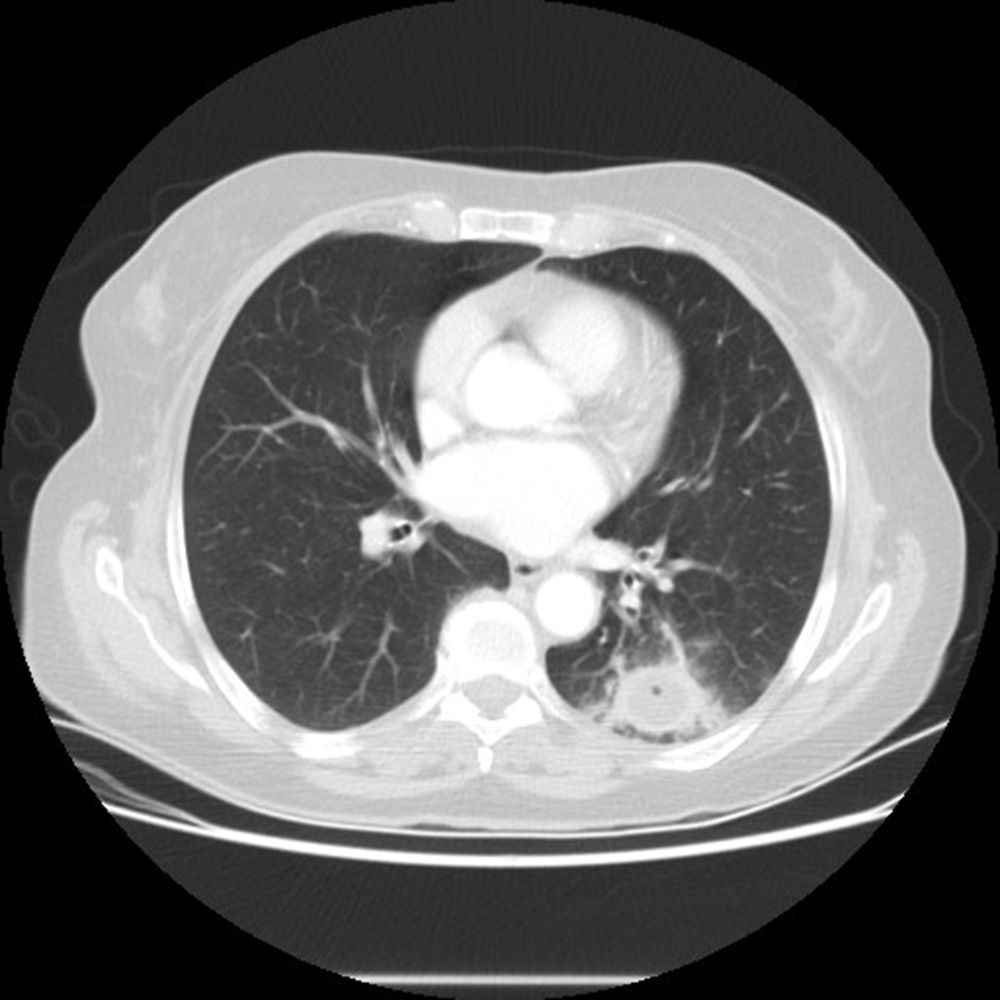
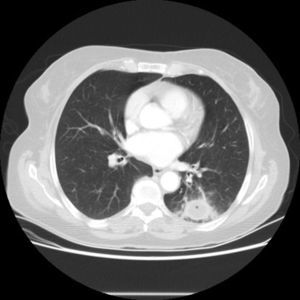
La tomografía axial computarizada toracoabdominal con contraste (fig. 2) muestra una masa pulmonar de aproximadamente 3cm de diámetro en el segmento 6 del lóbulo inferior izquierdo, y presenta en su interior atenuación líquida con una pequeña burbuja aérea. La pared es moderadamente gruesa, ligeramente irregular y se acompaña de afectación alveolar periférica, lo que sugiere un proceso inflamatorio. No se puede descartar completamente la posibilidad de un carcinoma de pulmón con cavitación. Los cultivos de esputo muestran flora saprofita. Mantoux negativo y hemocultivos negativos. Los marcadores víricos para hepatitis B, C y VIH son asimismo negativos. Ante el contexto clínico referido, compatible con absceso pulmonar, se decide iniciar tratamiento antibiótico empírico de amplio espectro.
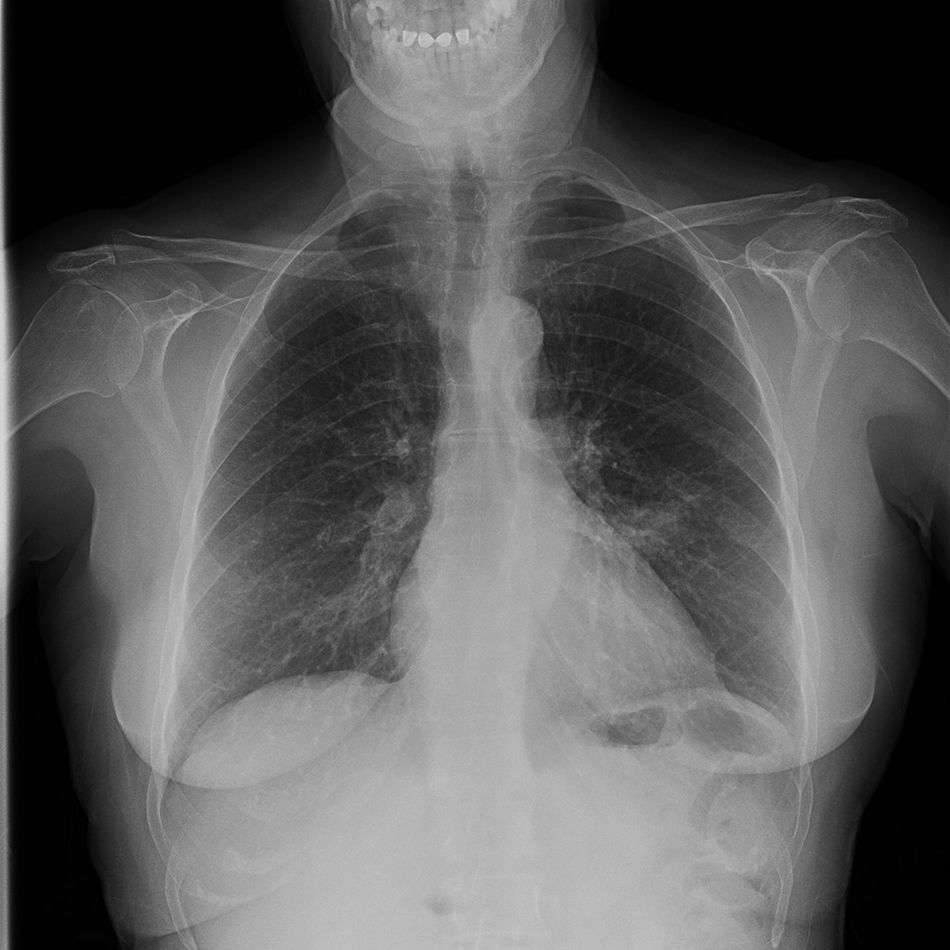
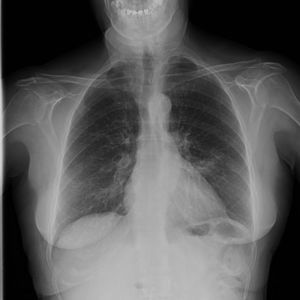
Tras 10 días de tratamiento intrahospitalario con imipenem (1g cada 6h) y clindamicina (600mg cada 8h) se objetiva mejoría radiológica significativa (fig. 3) y normalización analítica, por lo que se decide el alta hospitalaria para continuación de tratamiento en el domicilio, basado en cefditorén (200mg cada 12h) y clindamicina (300mg cada 8h) durante 20 días, además de medidas de control de síntomas. Se cita a la paciente para control evolutivo con neumología un mes más tarde.
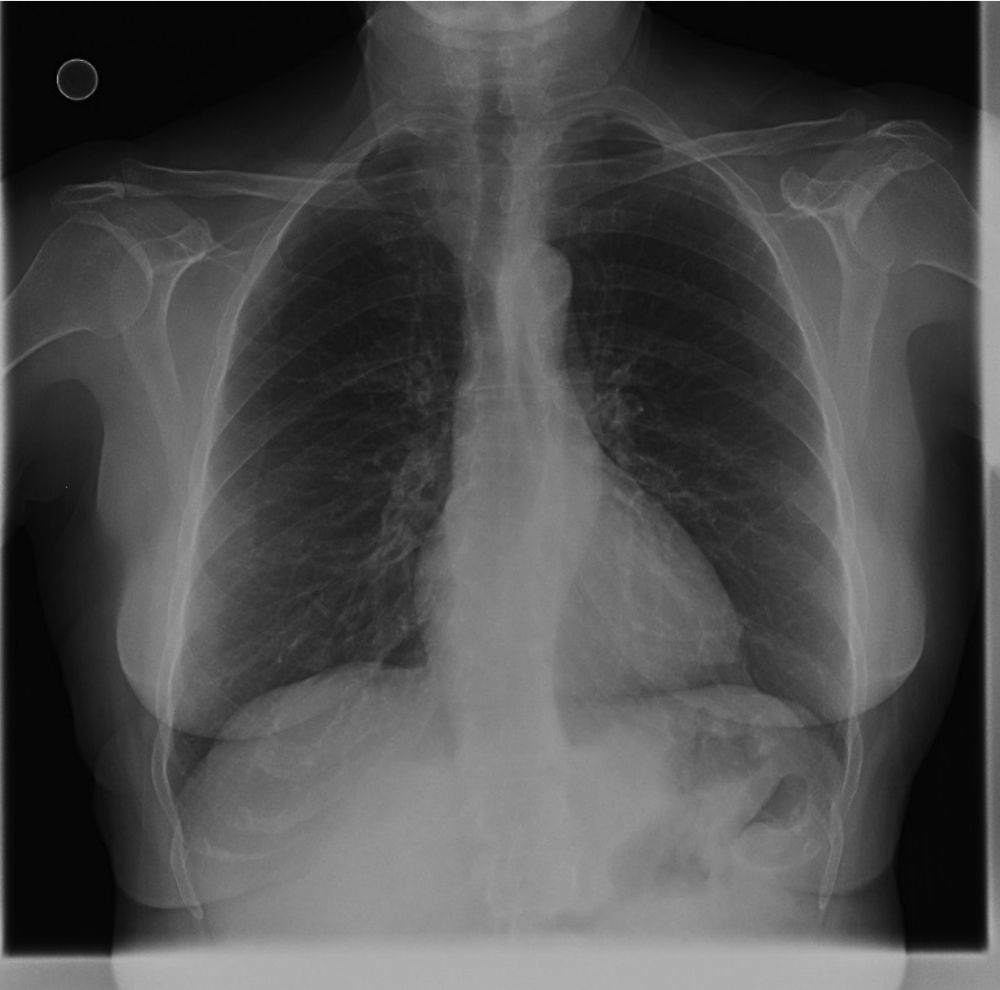
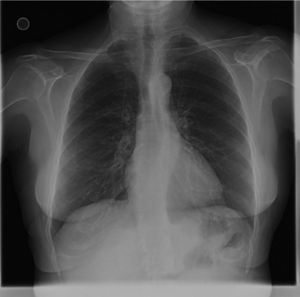
La evolución clínica de la paciente es favorable. En el control en la consulta externa de neumología se observa una resolución completa clínica y radiológica (fig. 4).
Actualmente la paciente se encuentra asintomática, con recuperación total del estado general y bajo control odontológico.
ComentarioEl absceso pulmonar se define como una infección microbiana localizada en una zona delimitada del pulmón, que comienza lesionando las paredes alveolares y lleva a la destrucción y la necrosis del parénquima pulmonar. Da lugar a la formación de una cavidad mayor de 1cm, con paredes propias, contenido purulento y neumonitis en regiones adyacentes. Cuando la cavidad se rompe hacia un bronquio se ocupa por aire (gas) y líquido (pus), que se manifiesta en las pruebas de imagen como un nivel hidroaéreo, y clínicamente como broncorrea. Si la cavidad se rompe hacia la pleura origina un empiema1–5.
Los abscesos pulmonares se pueden clasificar1,2,5,6 en:
- •
Agudos o crónicos en función del tiempo de evolución: crónico si es superior a un mes.
- •
Primarios o secundarios según la fuente de origen. Son primarios cuando la etiología afecta directamente al parénquima pulmonar, y secundarios si son complicación de una enfermedad preexistente. La principal causa de abscesos de origen primario es la broncoaspiración con gérmenes procedentes de infecciones de la cavidad bucal (gingivitis o enfermedad periodontal) favorecidas por procesos esofágicos concomitantes (reflujo gastroesfágico, divertículo de Zenker y obstrucción esofágica), disminución del nivel de conciencia (ictus, convulsiones, alcoholismo, abuso de drogas) y alteraciones de los mecanismos de defensa pulmonar (tos y aclaramiento mucociliar); se incluyen también en este grupo la neumonitis necrosante, la infección micótica y la tuberculosis. Son secundarios los debidos a estados comórbidos, tanto locales (enfisema, neoplasia del pulmón y bronquiectasias) como generales (enfermedades sistémicas que comprometen el sistema inmune, como la diabetes mellitus, el sida o el trasplante de órganos).
- •
Según el número de abscesos pueden ser simples o múltiples.
- •
Desde el punto de vista fisiopatológico, y en condiciones normales, la vía aérea debe estar desprovista de microorganismos patógenos desde la glotis hasta los alvéolos, y debe tener mecanismos de defensa que impidan la colonización del parénquima pulmonar. Cuando estos mecanismos fallan se producen infecciones en el tracto respiratorio inferior3.
- •
Entre los mecanismos por los cuales pueden llegar microorganismos patógenos a la vía respiratoria baja, invadir el parénquima pulmonar y ocasionar infección de la misma, destacan1–7:
- •
La aspiración de secreciones orofaríngeas, generalmente relacionada con piezas dentarias cariadas y bocas sépticas, que contienen una alta concentración bacteriana tanto aerobia como anaerobia.
- •
Los defectos en el sistema inmune tanto humoral como celular (esteroides, quimioterapia, malnutrición, VIH, diabetes) son un factor de riesgo importante y se observan con frecuencia entre los pacientes que presenten abscesos pulmonares, ya sean primarios o secundarios1–3,5.
- •
Penetración masiva de gérmenes por defecto del cierre de la glotis.
- •
Anormalidad del nivel de conciencia.
- •
La inhalación directa de patógenos.
- •
La vía hematógena (sepsis y endocarditis infecciosa).
- •
La invasión local por contigüidad.
- •
La obstrucción bronquial (neoplasias, cuerpos extraños, bronquiectasias).
- •
La presencia de lesiones cavitarias (neoplasias, infarto pulmonar).
- •
Traumatismos.
- •
Procesos infecciosos subdiafragmáticos por diseminación linfática o invasión directa a través del diafragma.
- •
Otras menos frecuentes son vasculitis, tromboembolismo, enfermedad granulomatosa y enfermedad pulmonar quística1,2,4,8.
El 75% de los abscesos pulmonares se desarrolla en el segmento posterior del lóbulo superior derecho, con menos frecuencia en el lóbulo superior izquierdo y en el segmento apical de los lóbulos inferiores. La configuración anatómica hace que estos segmentos sean los más afectados cuando el paciente está en decúbito supino y sufre una broncoaspiración. Se produce una neumonitis aguda; dependiendo de la virulencia del microorganismo de y la intensidad de la respuesta inflamatoria del individuo, induce necrosis del parénquima pulmonar, evoluciona posteriormente a una cavitación con fibrosis progresiva y origina un absceso pulmonar1,2,9.
Los microorganismos más frecuentemente identificados en su génesis son:
- •
Anaerobios grampositivos (Clostridium perfringens, Clostridium septicum y peptostreptococcus) suponen el 89% de los casos.
- •
Aerobios (estafilococos, estreptococos hemolíticos y no hemolíticos).
- •
Bacilos gramnegativos (Escherichia coli, Haemophilus influenzae tipo B, Klebsiella pneumoniae).
- •
Organismos oportunistas (sobre todo en pacientes inmunodeprimidos), como algunas especies de Candida, Legionella, micobacterias y hongos1–4,9.
La presentación clínica más común del absceso pulmonar es la forma aguda. Se manifiesta inicialmente con síntomas inespecíficos de comienzo brusco, como escalofríos, fiebre elevada, sudoración nocturna, cansancio y tos seca, que progresa a tos productiva con expectoración purulenta (75%). También se puede presentar de forma insidiosa: el paciente refiere malestar general de semanas e incluso meses de evolución, con tos y expectoración purulenta o hemoptoica, febrícula, dolor torácico, astenia, anorexia y pérdida de peso. La exploración física puede ser anodina, aunque en la auscultación pulmonar se suelen reconocer roncus y estertores. El 10% de los pacientes, especialmente los que han sufrido síntomas durante más de 3 semanas, presentan acropaquias1–3,5,10.
El diagnóstico se realiza mediante una historia clínica detallada (edad, nivel de conciencia buscando la posibilidad de una broncoaspiración, antecedentes de infecciones y enfermedades respiratorias, focos sépticos a distancia, hábitos tóxicos, comorbilidad, respuesta inmunológica, intervenciones de las vías respiratorias altas, uso de ventiladores a presión positiva, nebulizaciones) y una exploración física minuciosa en busca de la presencia de factores predisponentes1–3,5,7,10.
El análisis hematológico suele mostrar leucocitosis con desviación izquierda; en los casos de larga evolución la anemia es una constante. Los hemocultivos pueden ser positivos en pacientes con infección por Staphylococcus aureus y bacilos gramnegativos de diseminación hematógena1,7,10.
La radiografía de tórax no suele ser diagnóstica en las etapas tempranas de la enfermedad. A medida que progresa el cuadro se puede detectar una imagen redondeada, radiolúcida, con un infiltrado neumónico perilesional que lo diferencia de otras lesiones similares. Si dicha lesión se rompe hacia un bronquio, se forma una caverna con nivel hidroaéreo por el contenido líquido y gaseoso de su interior, que da una imagen radiológica típica.
En algunas ocasiones, si la imagen radiológica no es lo suficientemente clara, se puede utilizar la ultrasonografía como refuerzo diagnóstico, pero debemos tener en cuenta que las atelectasias, la condensación neumónica, el neumotórax o el engrosamiento pleural pueden enmascarar este signo radiológico característico.
El mejor rendimiento diagnóstico del absceso pulmonar y la mejor definición anatómica la tiene la tomografía computarizada (TC), también útil para demostrar abscesos en áreas de consolidación. La TC puede también identificar situaciones asociadas, como anomalías congénitas, obstrucción bronquial o malignidad, y además ayuda a realizar diagnósticos diferenciales1–5.
Se debe analizar el esputo (tinción de Gram y cultivo, tanto para gérmenes aerobios como anaerobios y micobacterias), aunque el rendimiento diagnóstico sea menor debido a la posible contaminación por gérmenes anaerobios habituales en la orofaringe. Si se considera necesario determinar el microorganismo patógeno se puede obtener una muestra mediante aspiración con aguja fina transtraqueal o transtorácica guiada por TC o por ecografía, o realizar una broncoscopia con cepillo protegido. Los cultivos cuantitativos de estas muestras son más precisos y fiables, aunque estas técnicas invasivas no se realizan habitualmente y se reservan para los casos de presentación atípica o que no responden adecuadamente a la antibioterapia empírica. Iniciado el tratamiento antibiótico, no existe ningún método para obtener muestras fiables en el cultivo bacteriano. La broncoscopia no es necesaria si la evolución es adecuada y no se sospecha la presencia de un cuerpo extraño o un tumor1–3,5.
Siempre se debe realizar el diagnóstico diferencial con el carcinoma broncogénico, las bronquiectasias, el empiema secundario a una fístula broncopleural, la tuberculosis, las micosis pulmonares, las bullas o los quistes aéreos infectados, el secuestro pulmonar, los nódulos silicóticos con necrosis central, los abscesos subfrénicos o hepáticos (amebianos o hidatídicos) con perforación hacia un bronquio y la granulomatosis de Wegener1,10.
El tratamiento inicialmente es hospitalario. Se debe empezar una vez se hayan recogido muestras para cultivos de esputo y hemocultivos. Como en todas las enfermedades, se deben tener en cuenta las medidas generales, como el reposo en cama, la dieta hiperproteica si no existe contraindicación, y el tratamiento de la anemia y de las enfermedades concomitantes. Se valorará según corresponda el uso de ejercicios respiratorios, la tos asistida y el empleo de expectorantes, de mucolíticos, de descongestionantes y de broncodilatores3,10.
Es de elección el tratamiento médico con antibióticos sistémicos de amplio espectro. Se consigue la resolución completa en 85-90% de los casos. La mejoría clínica en 90% de los pacientes se alcanza en 2-4 semanas; la resolución radiológica de la gran mayoría en 2-5 meses1–4,6,11.
Históricamente, la penicilina ha sido el antibiótico de elección; sin embargo, se ha demostrado que la clindamicina es superior cuando las bacterias implicadas son productoras de betalactamasas.
Actualmente el tratamiento empírico preferido del absceso pulmonar es la clindamicina intravenosa, porque se ha demostrado que proporciona una mayor rapidez en la resolución clínica, tiene una buena penetrancia en el parénquima pulmonar y los resultados observados en los estudios de imagen son satisfactorios. Se inicia con una dosis diaria total de 2,4g hasta un máximo de 4,8g en dosis divididas generalmente así: 600mg IV cada 8h y luego 300mg VO cada 6h.
Un régimen alternativo es la administración de 2-10 millones de unidades de penicilina cada 24h, seguidas de penicilina VO (500-750mg cada 6h).
Si se sospecha infección nosocomial se debe además proporcionar cobertura para bacterias gramnegativas, con antibióticos de primera elección como aminoglucósidos, quinolonas o cefalosporinas de tercera generación.
Los antibióticos intravenosos deben ser continuados hasta que haya una mejoría clínica y radiológica; luego conviene cambiarlos por tratamiento oral y domiciliario. Se ha demostrado que la duración insuficiente del tratamiento antibiótico conlleva una mayor tasa de recurrencia1–4,7,10.
La experiencia con metronidazol para el absceso pulmonar ha sido muy decepcionante: tasa de fracaso de 50% aproximadamente. Esto se explica mejor por la presencia concurrente de los estreptococos aerobios y microaerófilos que, presumiblemente, contribuyen a la patogénesis de estas infecciones en un número sustancial de casos. No obstante, el metronidazol es probablemente el fármaco más activo disponible contra las bacterias anaerobias, ya que es uniformemente activo contra cepas sensibles al oxígeno y tiene un perfil de tiempo de muertes que es único en comparación con otros fármacos, que no tienen actividad contra los estreptococos aerobios y microaerófilos. Si se utiliza metronidazol se debe combinar con penicilina.
Otra opción razonable es la combinación de un inhibidor de betalactamasas y betalactámicos, como por ejemplo ampicilina y sulbactam (3g IV cada 6h) o un carbapenem.
Cuando se trata de un Staphylococcus aureus meticilín-resistente se prefiere linezolid (600mg IV cada 12h); la vía IV se interrumpe y se inicia la VO en la misma dosis cuando el paciente se encuentra afebril y estable. La principal alternativa al linezolid es la vancomicina (15mg/kg IV cada 12h, ajustados a una concentración de 15-20mcg/ml, según el grado de la función renal)2,5.
El tratamiento de apoyo incluye la fisioterapia respiratoria y el drenaje postural. Este último actualmente constituye una opción controvertida, porque el intento enérgico de drenado puede ocasionar diseminación bronquial masiva de la infección. Cuando se trata de un paciente con una parálisis o debilitado para mantener posturas apropiadas para este tipo de procedimiento, puede ser necesaria una traqueostomía con aspiración de secreciones10.
Habitualmente el drenado quirúrgico no es necesario y queda reservado para aproximadamente el 10% de los casos, en los que los pacientes no mejoren con el tratamiento antibiótico en 6-8 semanas y muestren signos de cronicidad, como abscesos satélites y/o mayores de 6cm, neumonitis crónica con atelectasia y fibrosis, bronquiectasia, empiema encapsulado, cavidad de paredes gruesas, hemoptisis masiva y grave y sospecha de malignidad (aumento de tamaño y configuración irregular de la cavidad)1,2,4,5,11.
Cuando el absceso no responde a ningún tratamiento, la resección pulmonar es el procedimiento de elección, principalmente en los casos en que se sospecha la existencia de carcinoma broncogénico; la lobectomía es el procedimiento más habitual. Si las lesiones son pequeñas, la técnica más usada es la resección segmentaria. La neumonectomía se reserva para casos en que existen múltiples abscesos o una gangrena pulmonar refractaria al tratamiento médico5,8,10.
Aproximadamente un tercio de los pacientes con abscesos pulmonares fallece, otro tercio evoluciona favorablemente a la curación y el restante desarrolla secuelas como bronquiectasias, empiema crónico o abscesos recurrentes4,5.
La incidencia del absceso pulmonar ha disminuido desde la introducción del tratamiento con antibióticos y el pronóstico ha mejorado. Cuando el absceso es muy grande, múltiple, existe inmunodepresión, comorbilidades o edad avanzada, la mortalidad es de 5-15%1,2,12.
En nuestra paciente no están muy claros los factores de riesgo ni los mecanismos (expuestos en este artículo) por los que se pudo desarrollar el absceso pulmonar. No existía una propensión significativa para desarrollar una infección grave, a excepción de la edad mayor de 65 años, la pieza dentaria lesionada y la infección de vías respiratorias altas en los días previos; estos 3 fueron la posible causa de la predisposición inmunodeprimida para padecer una neumonía, probablemente estafilocócica o por anaerobios (gérmenes habituales y comensales de la orofaringe), y de la complicación posterior por un absceso pulmonar. En la literatura médica se ha informado de casos en los que el Staphylococcus aureus está dotado de una alta virulencia, dado que genera muchos tipos de toxinas y ocasiona una gran variedad de enfermedades con diferentes grados de gravedad6.
El absceso pulmonar no es muy común actualmente, debido al tratamiento médico adecuado y oportuno de las enfermedades que lo producen. En este artículo se justifica la necesidad de realizar control médico a los pacientes de edad avanzada con infecciones de vías respiratorias altas, porque sufren un incremento en la incidencia de enfermedad periodontal y mayor tendencia a la broncoaspiración, asociados a otros datos de comorbilidad11.
En la bibliografía revisada se han hallado casos de absceso pulmonar en pacientes con mucha predisposición, pero no con poca comorbilidad, como en el caso de nuestra paciente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.