Cada octubre, la Organización Mundial de la Salud publica el Informe Global de Tuberculosis (TBC)1. Esta enfermedad afecta anualmente a 10 millones de personas, de las cuales 1,5 millones mueren, teniendo 200.000 el virus de la inmunodeficiencia humana (VIH). Más del 95% de las muertes se producen en países de ingresos bajos y medianos. La incidencia disminuye un 1,5% anual desde 2000. Acabar para 2035 con la epidemia es una de las Metas del Desarrollo Sostenible. Pero la incidencia de TBC se ha duplicado en los últimos 4 años en Venezuela por el deterioro en las condiciones de vida y del sistema de salud, sufriendo un retroceso de 40 años, llegando a las cifras notificadas antes de los años 802.
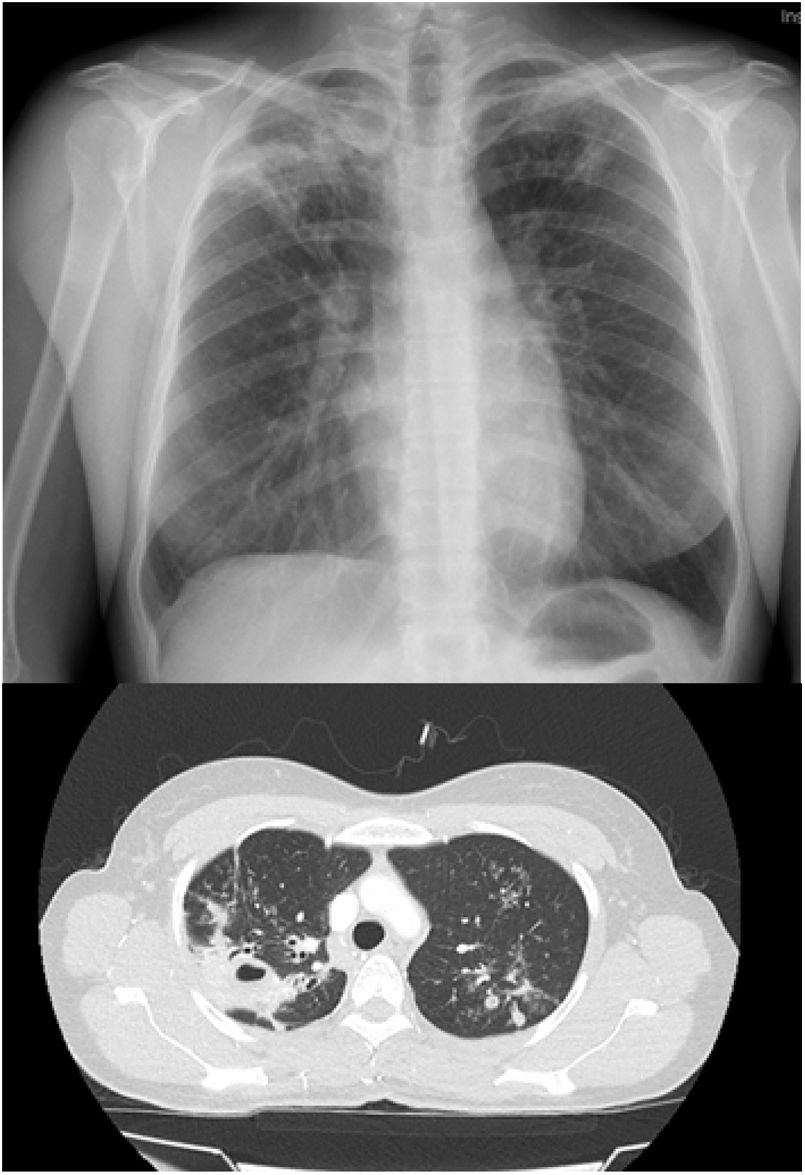
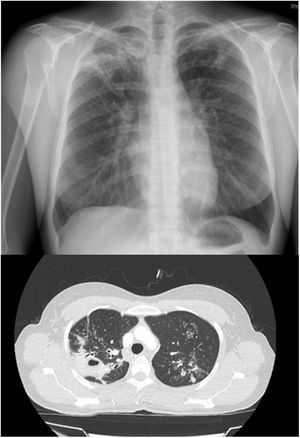
Presentamos el caso de una mujer venezolana de 34 años que reside en España desde hace 4 meses. Acudió a Urgencias en agosto de 2019, remitida por presentar desde hacía un mes febrícula y dolor torácico pleurítico derecho y hemoptisis leve ocasional. Había tenido varias hemoptisis sin estudio, hacía 7 y 4 años. Presentaba una exploración física y analítica normales, incluyendo serología negativa para hepatitis y el VIH. En radiografía y TAC de tórax tenía opacidades en los lóbulos superiores y cavitación de 2cm en el lóbulo superior (fig. 1). En esputo, mostraba 50-100 bacilos ácido-alcohol resistentes por campo (muy bacilífero si>10/campo). La paciente ingresó en aislamiento respiratorio e inició tratamiento con 4 fármacos (isoniacida, rifampicina, pirazinamida y etambutol), confirmando en cultivo Lowenstein Mycobacterium tuberculosis, sin resistencias. A los 20 días, ante 3 baciloscopias negativas consecutivas, se procedió al alta. Presentó resolución clínica y radiológica, completando 6 meses de tratamiento con buena tolerancia y sin efectos secundarios.
Se estudió a 10 contactos, todos vacunados de BCG en Venezuela (al nacimiento): 8 convivientes y 2 familiares que fueron de visita. Cuatro tuvieron Mantoux e interferon-gamma release assay positivos: padre de 56 años, hermanas de 27 y 19 años, e hijo de 15 años, sin datos de enfermedad tuberculosa activa pues la radiografía de tórax fue normal y las baciloscopias negativas, pero indicativos de infección tuberculosa latente, por lo que recibieron quimioprofilaxis. El interferon-gamma release assay es más específico de enfermedad TBC que el Mantoux: presenta resultado negativo en vacunados y en expuestos a micobacterias ambientales (que no tengan enfermedad TBC) y positivo en enfermos de TBC con anergia en Mantoux3.
Cada vez menos personas padecen TBC en el mundo. También en Venezuela fue así hasta el año 2015, pero desde entonces los enfermos no paran de aumentar. El Informe Global de Tuberculosis 2019 refiere que Venezuela registró 11.394 casos nuevos o recaídas en 20181. Hasta 2010, la TBC estaba controlada y se registraban 4.000 casos al año. Históricamente, Venezuela destacaba en la lucha antituberculosa: entre 1940 y 2005, por cada 100.000 habitantes/año, se pasó de una incidencia de 111 casos a 25, y de una mortalidad de 95 a 2. Comparado con el resto de los países del entorno, las tasas de incidencia estuvieron>10 puntos por debajo del resto del continente. Pero a partir de 2015 las cifras se acercaron por primera vez a las del resto del continente, y las sobrepasaron ampliamente en 20172. De no corregirse esta tendencia regresiva, será imposible alcanzar las metas del desarrollo sostenible en 2030, que para Venezuela deberían ser de una incidencia de 2,5 por 100.000 habitantes/año (y no la actual de 35 notificada o de 50 estimada)2. Pero además de haber más casos, estos son más graves, como las TBC miliares, y se concentran en grupos especialmente vulnerables: más del 25% fueron personas privadas de libertad, pueblos indígenas y coinfectados con VIH-sida4. La reaparición de enfermedades asociadas a la pobreza (como TBC, sarampión y difteria) es el resultado del colapso del sistema de salud por el abandono de las tareas de salud pública y Atención Primaria (saneamiento ambiental, vigilancia epidemiológica, medidas de promoción y prevención de la salud), así como la carencia de medios diagnósticos y terapéuticos, y la migración masiva de miles de profesionales de la salud2. Los datos que nos llegan de Venezuela exponen una situación de crisis política, social y, por ende, sanitaria, de gran calado. Esto supone un impacto global por la emigración a los países colindantes, pero también a España, por la vinculación lingüística e histórica con Venezuela.
En efecto, el caso que presentamos es una llamada de atención a los clínicos españoles para tener en cuenta aspectos claves de la TBC en población inmigrante5,6, a saber:
1. Elevada prevalencia de infección TBC en población inmigrante, siendo de un 30% en los inmigrantes que acuden a la unión europea7. Los inmigrantes de países con alta prevalencia de TBC (>100 casos/millón de habitantes) tienen más TBC que la población autóctona española (España es un país de baja incidencia: TBC<100), sobre todo si están de forma no regularizada: hay más retraso diagnóstico y peor cumplimiento terapéutico.
2. Mayor incidencia de enfermedad TBC en los primeros 5 años de la llegada a Europa. Se explicaría por el estrés del proceso migratorio, las pobres condiciones de vida en el país de acogida y la reinfección reciente en sus países de origen.
3. Mayor probabilidad de desarrollar enfermedad extrapulmonar (ganglionar y ósea), de más difícil diagnóstico que la pulmonar. Se alude a factores como la virulencia de M. tuberculosis, la mayor prevalencia de VIH y factores ambientales.
4. Mayor prevalencia de resistencias farmacológicas. Son muy superiores en inmigrantes con respecto a las de población autóctona porque España tiene una de las tasas de resistencia más bajas del mundo (4-5% para isoniacida y 0,5-2% para isoniacida y rifampicina, frente al 14,5 y 8,5% de Ecuador y Perú, por ejemplo).
5. Mayores formas de TBC por reactivación. El 70% son reactivaciones de infección previamente adquirida, a diferencia de la población autóctona, que desarrolla más primoinfecciones, por transmisión reciente de TBC.
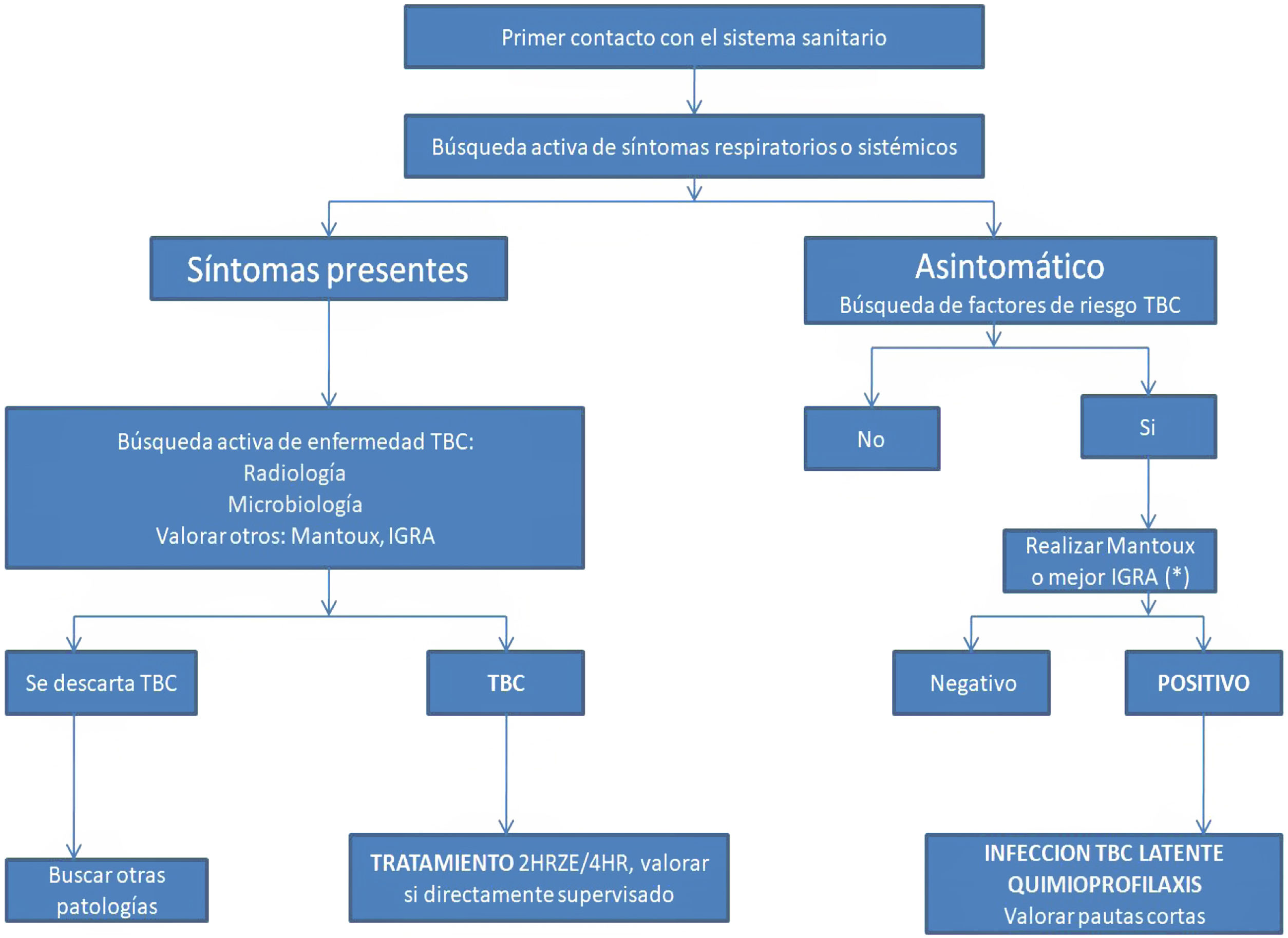
El manejo de la TBC en inmigrantes se basa en 3 pilares: diagnóstico precoz, tratamiento eficaz y cumplimiento terapéutico. Es fundamental aprovechar el primer contacto con el sistema sanitario que suele darse en Atención Primaria, para realizar una búsqueda activa de casos según el algoritmo adjunto8 (fig. 2). La estrategia más coste-efectiva sería realizar un interferon-gamma release assay en menores de 35 años procedentes de países de alta incidencia para TBC9.
Procotolo de actuación ante inmigrantes procedentes de países con elevada prevalencia de tuberculosis. Modificada de Grupo de Trabajo de los Talleres de 2001 y 2002 de la Unidad de Investigación en Tuberculosis de Barcelona8.
E: etambutol; H: isoniazida; IGRA: interferon-gamma release assay; R: rifampicina; TBC: tuberculosis; Z: pirazinamida. (*) Mejor IGRA para eliminar Mantoux+, que sean falsos positivos por vacunación con BCG previa.
Sería esencial conocer la incidencia de TBC (y de otras enfermedades como VIH, hepatitis, sarampión y difteria) de los países originarios de inmigrantes a Europa, para ofrecer rápidamente la detección, la vacunación cuando exista y el tratamiento de dichas afecciones. En especial, convendría observar los países de América Latina, donde están creciendo actualmente los enfrentamientos sociales o el empobrecimiento (Nicaragua, Ecuador, Bolivia, Costa Rica, Colombia o Argentina10) y que pueden determinar un flujo de inmigración importante hacia España.
ÉticaSe ha contado con el consentimiento verbal y escrito de la paciente y se han seguido los protocolos de los centros de trabajo sobre tratamiento de la información de los pacientes.
Declaraciones de autoríaMª Luisa García-Aguinaga: ha liderado el estudio del caso clínico y ha realizado la redacción e investigación principal de artículos.
Edgar Sabado-Angngasing: ha redactado el caso clínico y realizado búsqueda bibliográfica clínica.
Clara Tamiri Rodríguez-González: ha atendido al caso clínico y supervisado la redacción.
Luis Belda-Bilbao y Ana Cuenca-Abarca: han supervisado la redacción final del manuscrito.
FinanciaciónSin financiación
Conflictos de interesesNo hay conflicto de intereses de ningún autor.