El citomegalovirus (CMV) es un virus de baja contagiosidad perteneciente a la familia Herpesviridae. Es el principal responsable de la morbimortalidad infantil de origen congénito. La infección es muy frecuente, cursa de modo asintomático en la mayoría de las ocasiones y su importancia radica en la potencial gravedad cuando afecta a neonatos e inmunodeprimidos. El 4% de los recién nacidos sintomáticos y el 90% sufren secuelas. El 13% de los asintomáticos también desarrolla secuelas.
No hay datos globales de prevalencia de enfermedad congénita por CMV. En nuestro país no se realiza cribado serológico sistemático para CMV durante la gestación.
Cytomegalovirus (CMV) is a low infectivity virus of the Herpes virus family. CMV is the main cause of child morbidity and mortality of congenital origin. CMV infection is very frequent and generally asymptomatic. Its importance lies in the potential seriousness when it affects newborns and inmunocompromised patients. Four per cent of symptomatic newborns at birth die and 90 percent suffer sequelae (including 13 per cent of asymptomatic patients).
There are no comprehensive data on the prevalence of congenital disease. In our country not performed Systematic screening for CMV in pregnancy is not performed in our country.
El citomegalovirus (CMV) es el principal agente infeccioso causante de morbimortalidad infantil de origen congénito en los países desarrollados1. Las cifras de seroprevalencia en la población general son variables en todo el mundo. Se desconoce la prevalencia en gestantes y en recién nacidos, así como el número de niños con secuelas atribuibles a la infección congénita.
No obstante, se estima que la infección congénita por CMV afecta al 0,2-2,5% de los recién nacidos vivos. La primoinfección durante el embarazo ocurre en el 1-4% de las gestantes. El 40% de los fetos se afectará, siendo el 10% de estos sintomáticos al nacimiento. De los asintomáticos, el 13% desarrollarán secuelas permanentes, principalmente hipoacusia neurosensorial.
En España no se realiza el cribado serológico sistemático para CMV durante el embarazo debido a la ausencia de vacuna y tratamiento efectivos. Sin embargo, debería mejorar la información a la embarazada, potenciar el diagnóstico fetal y asegurar el tratamiento a los recién nacidos con infección sintomática para prevenir el retraso psicomotor.
Puesta al díaEl CMV es un virus de baja contagiosidad1 perteneciente a la familia de los Herpesvirus, junto con el virus de Epstein-Barr (VEB), virus herpes tipo 1 y 2 (VHS 1 y2) y virus varicela-zóster (VVZ).
La infección por CMV es muy frecuente pero cursa de modo asintomático la mayoría de las veces. Se puede producir tras el primer contacto con el virus –primoinfección– o como reactivación del virus latente –recurrencia–. Se transmite por distintas vías: a través de saliva, orina, lágrimas, sangre y leche materna. Necesita contacto directo para su transmisión y se destruye fácilmente con el calor, jabón, detergentes y desinfectantes2. La transmisión vertical de la madre al feto se produce por vía transplacentaria3.
La principal importancia de la infección por CMV radica en la gravedad con que puede afectar a neonatos e inmunodeprimidos4. El CMV es el principal causante de morbimortalidad infantil de origen congénito5,6. Es la infección congénita más frecuente en los países desarrollados y se detecta entre el 0,3 y 2,4% de los recién nacidos6,7. De los neonatos sintomáticos el 4% fallece y el 90% tendrá lesiones, neurológicas principalmente7–9.
En España se estima que la prevalencia de la infección por CMV en mujeres de 15 a 24 años es del 60%, alcanzando el 95% en mayores de 36 años9. No hay datos globales de prevalencia de enfermedad congénita por CMV.
El contagio se produce principalmente en la edad preescolar10,11. Casi la mitad de los niños escolarizados en guarderías excretan CMV por orina y saliva durante al menos 2 años de vida12. Esto explica que el principal factor de riesgo para la embarazada sea el contacto directo con estos niños13. En la tabla 1 se recogen consejos generales para evitar el contagio por CMV. Los condicionantes socioeconómicos adversos, la mayor paridad y edad en la gestación se encuentran entre los factores de riesgo para adquirir la infección por CMV1.
Medidas higiénico-dietéticas para prevenir infección por citomegalovirus en gestantes en contacto con niños
| 1. No compartir utensilios de higiene personal |
| 2. Lavar frecuente manos con agua y jabón |
| 3. Lavar con agua y jabón los juguetes |
| 4. Usar guantes para el cambio de pañales y el aseo de los niños |
| 5. Evitar los besos en labios o en mejillas |
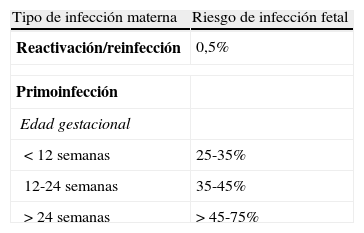
La transmisión intraútero se produce vía placentaria2 y está relacionada con la inmunidad materna, que no confiere protección absoluta. Así, puede producirse enfermedad neonatal por una primoinfección materna (lo más frecuente, en 25-75%) o por una recurrencia (0,2-2%)1. La tasa de transmisión aumenta en el transcurso del embarazo: 20-40% en el primer trimestre y 40-70% en el tercero. Sin embargo, los fetos expuestos en los 2 primeros trimestres tienen más probabilidad de presentar secuelas que los afectados en el último período de la gestación7,según se refleja en la tabla 2.
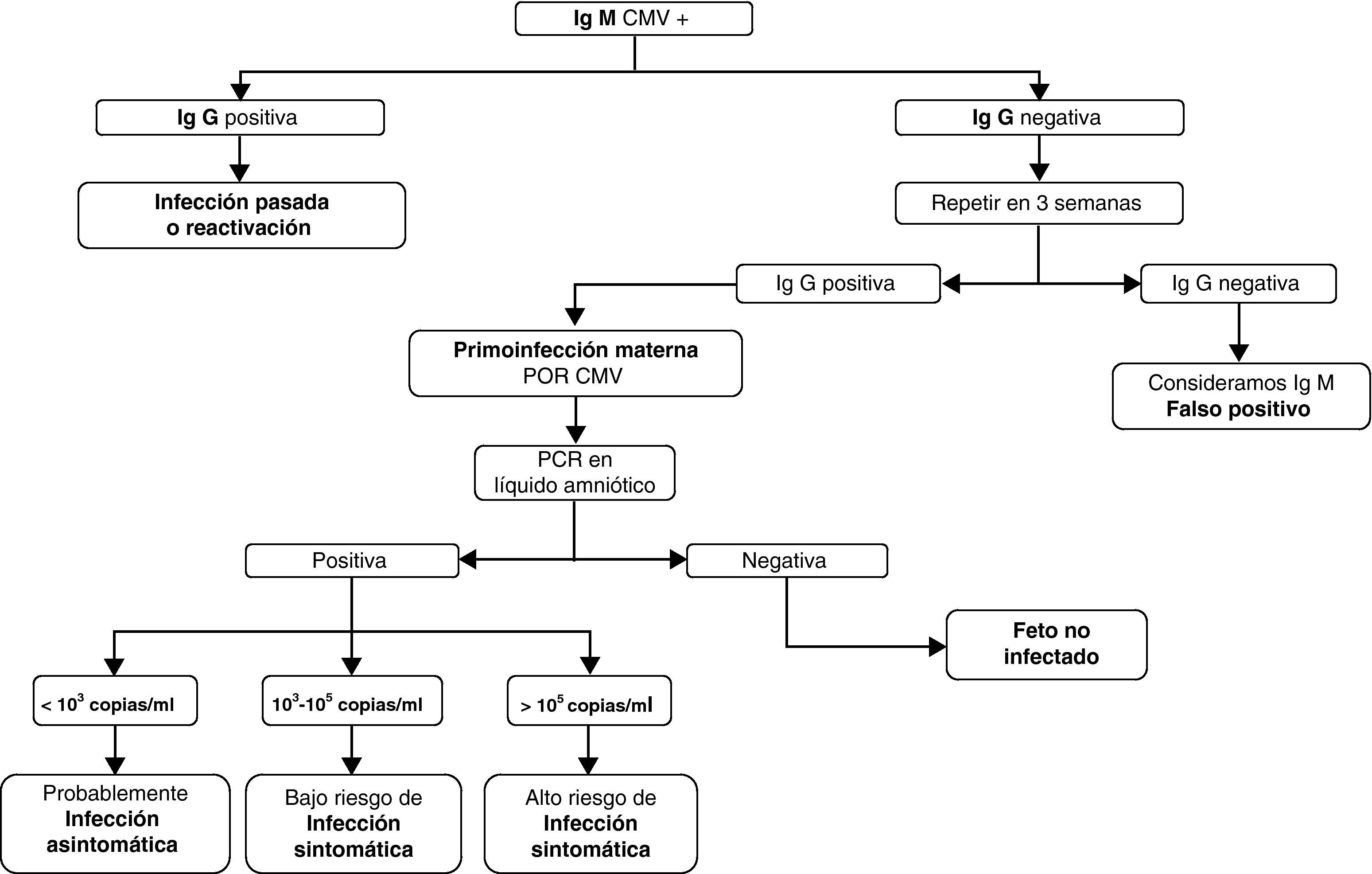
DiagnósticoLa primoinfección en la gestante, como en la población general, suele ser asintomática. Cuando aparecen síntomas son similares a un cuadro seudogripal, con fiebre, odinofagia, malestar general, astenia e hipertransaminasemia. La prueba diagnóstica de referencia es la serología (con la determinación de inmunoglobulinas IgG e IgM). La seroconversión es la forma más fiable de diagnosticar una infección primaria14 pero la falta de controles preconcepcionales hace difícil distinguir la primoinfección de una reactivación del virus15, por lo que habría que recurrir a técnicas más específicas para el diagnóstico serológico16,17, como los ensayos de avidez de IgG o la detección de anticuerpos neutralizantes.
La finalidad de hacer un diagnóstico prenatal de infección congénita por CMV está encaminada a conocer el estado de salud fetal y establecer un tratamiento lo más precoz posible, aunque no siempre será posible conocer el grado de afectación fetal. Las gestantes con seroconversión demostrada o anticuerpos IgM positivos (que pueden durar hasta 9 meses tras la primoinfección) son candidatas a realizar amniocentesis como técnica de diagnóstico prenatal14, una vez determinada la infección materna. La amniocentesis debe realizarse a partir de la semana 21, cuando el feto ya excreta orina en líquido amniótico18. Además, debe haber pasado suficiente tiempo tras la infección para evitar falsos negativos19,20 (al menos 7 semanas tras la fecha de infección de la embarazada, si esta es conocida).
La reacción en cadena de la polimerasa (PCR) cuantitativa en líquido amniótico a partir de la semana 21 permite el diagnóstico fetal y determina el grado de afectación fetal en gestantes con primoinfección de forma fiable21 (si hay menos de 10*3 copias/ml los niños resultarán asintomáticos, si hay más de 10*5 copias/ml la infección será sintomática), con una sensibilidad del 90-98% y una especificidad del 92-98%17,18. El cultivo del CMV en líquido amniótico es 100% específico pero es poco sensible18,22. En la figura 1 se indica la forma de diagnosticar la infección prenatal por CMV y su gravedad en función de la serología materna y el rango de PCR en líquido amniótico.
Una vez establecido el diagnóstico de infección fetal el objetivo será determinar si el feto desarrollará síntomas al nacimiento. Las alteraciones ecográficas son inespecíficas23,24 (microcefalia, atrofia cortical, dilatación ventricular, calcificaciones intracraneales y hepáticas, hepatoesplenomegalia, derrame pleural y pericárdico, crecimiento intrauterino retardado) y, a veces, tardías, lo que podría hacer inviable una interrupción voluntaria del embarazo (IVE)25. No obstante, cuando hay sospecha de infección fetal por CMV se aconseja un seguimiento ecográfico frecuente, cada 4 semanas26. Además, una ecografía normal no excluye infección ni afectación fetal. En ausencia de alteraciones ecográficas el verdadero grado de afectación solo podrá conocerse al nacimiento.
La detección de anemia, trombocitopenia y alteración de enzimas hepáticas en sangre de cordón es un buen predictor de infección sintomática27, pero la técnica tiene un riesgo elevado de complicaciones.
En el recién nacido con sospecha de infección por CMV el estudio se basa en el cultivo de orina en las primeras 2 semanas de vida28,29. De ser positivo han de realizarse pruebas para conocer la afectación orgánica: ecografía cerebral y abdominal, fondo de ojo, estudio hematológico y auditivo, ampliándose si estas fueran anormales.
Dado que el CMV es una de las causas más frecuentes de retraso psicomotor y sordera neurosensorial de origen viral3,30, la principal ventaja del cribado serológico en la gestante sería la detección precoz de niños con infección congénita, incluidos los asintomáticos. La detección sistemática de hipoacusia en el recién nacido solo detecta el 50% de las producidas por CMV31,32.
Las principales sociedades científicas no recomiendan el cribado sistemático para CMV durante el embarazo33–35 por no considerarlo coste-efectivo, ya que es una enfermedad de alta prevalencia, no existe vacuna eficaz, no está aprobado el tratamiento antiviral durante el embarazo, es difícil demostrar la primoinfección materna (curso silente y asintomático la mayoría de las veces) y existe la posibilidad de infección congénita en mujeres inmunes. A pesar de todo, el Colegio Americano de Obstetras y Ginecólogos recomiendan el cribado a petición de los pacientes si existen síntomas en la embarazada o alteraciones ecográficas fetales36,37. También se están incrementando las serologías solicitadas en países europeos a pesar de las recomendaciones oficiales38.
TratamientoExisten vacunas en fase de experimentación pero actualmente ninguna ha demostrado eficacia suficiente para justificar su administración. La vacuna ideal sería aquella que se pudiera administrar a una mujer seronegativa para CMV, con el propósito de evitar la primoinfección durante el embarazo14. La infección congénita por CMV en neonatos de gestantes con inmunidad preconcepcional existe, pero el riesgo es menor21.
El tratamiento de la gestante con primoinfección tendría como propósito impedir la transmisión al feto, mientras que el posnatal estaría encaminado a minimizar las alteraciones neurológicas de los neonatos seriamente afectados1.
De momento, la promoción de medidas higiénicas y hábitos de vida saludables en gestantes son el único y fundamental método en la prevención de la infección congénita por CMV14.
El empleo de antivirales como tratamiento posnatal debe ser valorado cuidadosamente debido al grado de toxicidad de estos medicamentos y a que, de momento, no se ha demostrado eficacia en el tratamiento prenatal ni posnatal salvo para la prevención de sordera32. Los antivirales frente a CMV (ganciclovir y foscarnet) no se recomiendan en el embarazo por su teratogenicidad demostrada en animales39,40. Los resultados obtenidos en un estudio con vanciclovir, que ha conseguido disminuir la carga viral fetal, son poco significativos41. Sin embargo, el tratamiento de la gestante con gammaglobulina específica frente a CMV sí ha demostrado utilidad −revirtiendo alteraciones ecográficas fetales demostradas− gracias a su efecto inmunomodulador22,28.
ConclusionesAunque la detección por CMV no está incluida en el cribado serológico de la gestante, los profesionales que atienden a estas mujeres deberían mejorar su conocimiento sobre esta enfermedad (hoy por hoy, la «gran desconocida») y su pronóstico.
Se debería informar a la embarazada de los riesgos de infección, máxime si está en contacto con niños en edad escolar o preescolar, así como las medidas profilácticas a su alcance.
Para sospechar infección por CMV en recién nacidos hay que tener gestantes diagnosticadas, lo que resulta difícil en la actualidad ya que no se realiza cribado sistemático para CMV en las mismas.
Ante el hallazgo de alteraciones ecográficas indicativas (microcefalia, calcificaciones intracraneales, etc.) en cualquier momento de la gestación, hay que aclarar si ha habido infección materna y establecer el grado de afectación fetal.
Deben universalizarse los programas de cribado auditivo a los neonatos, así como la detección de CMV en prematuros y recién nacidos con crecimiento intrauterino retardado o bajo peso.
Es necesario favorecer que los niños con infección sintomática por CMV puedan acceder al tratamiento antiviral para prevenir el desarrollo de hipoacusia y evitar alteraciones en su capacidad de desarrollo.
El cribado sistemático en orina al nacimiento no se considera coste-efectivo y, mientras siga siendo así, las secuelas tardías no serán detectables ni tratables de forma precoz. El diagnóstico de niños asintomáticos permitiría su seguimiento, la detección precoz de secuelas y la inclusión en programas de logopedia, rehabilitación auditiva y estimulación psicomotriz.
En España, salvo en unidades muy especializadas, existe un gran desconocimiento sobre la infección congénita por CMV. Esta es una enfermedad evitable, diagnosticable y abordable una vez conocida su existencia desde nuestras consultas, aunque solo sea a través del consejo y promoción de hábitos saludables.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Dr. Ruiz Contreras por sus conocimientos, experiencia y ayuda, y a las Dras. Argüelles Bustillos y Gutiérrez Gutiérrez por haberlo puesto en mi camino.
Al Dr. Rojo, la Dra. González Tomé y el Dr. de Vergas por sus cuidados periódicos.