Las heparinas no fraccionadas (HNF) y de bajo peso molecular (HBPM) son fármacos que se emplean ampliamente y que han permitido evitar y tratar incontables problemas trombóticos venosos y arteriales. Sin embargo, su uso también se asocia con una reacción paradójica que conlleva un estado protrombótico potencialmente muy grave, lo que ocasiona anualmente numerosas amputaciones o desenlaces fatales1. En Estados Unidos, aproximadamente 12 millones de personas, o un tercio de los pacientes hospitalizados, tiene alguna exposición anual a la heparina, con una frecuencia de trombocitopenia inducida por heparina (TIH) de 0,76% en pacientes que reciben dosis terapéutica de HNF vía intravenosa y menos de 0,1% los que reciben dosis profilácticas. Si bien no se conoce el número de amputaciones por TIH, estudios recientes describen una incidencia del 3-4%2.
La TIH es una reacción adversa farmacológica de carácter inmune en pacientes recientemente expuestos a heparina, que cursa con trombocitopenia asociada frecuentemente con trombosis venosa o arterial y conlleva morbilidad y mortalidad significativas. Actualmente su diagnóstico presenta dificultades y hasta hace poco no existían opciones terapéuticas eficaces.
Existen varias guías que abordan el diagnóstico y tratamiento de la TIH teniendo en cuenta los niveles de evidencia y grado de recomendación o siguiendo metodologías tipo GRADE. La escasez de estudios aleatorizados hace que, generalmente, el nivel de evidencia proporcionado por estas guías sea bajo. La mayoría recomienda el empleo de índices clínicos predictivos para determinar la probabilidad de TIH, seguido de pruebas analíticas que confirmen la presencia de anticuerpos anti-heparina/PF42–4.
Características de la trombocitopenia inducida por heparinaLa verdadera incidencia de la TIH es desconocida debido a la falta de estudios prospectivos. Ocurre en aproximadamente 0,5 a 1% de los pacientes expuestos a HNF por indicaciones médicas y quirúrgicas, con variabilidad en relación con el tipo de patología y fármaco utilizado. La incidencia es más baja (0,1-0,5%) en pacientes que reciben HBPM2. La TIH es más frecuente en pacientes sometidos a cirugía ortopédica o cardiaca y en los que requieren dispositivos de oxigenación por membrana extracorpórea (ECMO), en comparación con pacientes médicos o con enfermedad obstétrica, habiéndose sugerido que la inflamación postoperatoria y el hecho de administraciones más prolongadas de heparina serían responsables de su mayor incidencia. La fisiopatología de la TIH se caracteriza por la presencia de anticuerpos, generalmente tipo IgG, que reaccionan contra el complejo heparina-factor 4 plaquetario (PF4). Estos anticuerpos inducen un estado protrombótico, causando activación y agregación plaquetaria, así como activación endotelial y monocitaria y generación de micropartículas procoagulantes, con intensa formación de trombina1. Paradójicamente, la TIH es uno de los estados protrombóticos más potentes descritos, aunque está causado por un fármaco anticoagulante. A diferencia de otras situaciones clínicas caracterizadas por consumo o destrucción de plaquetas, no suele cursar con hemorragia.
Clasificación de la trombocitopenia inducida por heparinaSegún su origen, la TIH se divide en TIH de tipo I, no inmune, mucho más frecuente que la de tipo II, de naturaleza inmune, y que puede ocurrir desde el primer día de la terapia. La primera es una reacción leve (es infrecuente que la cifra de plaquetas sea inferior a 100×109/L), que no se asocia con ninguna complicación. Se produce por la formación de microagregados plaquetarios debido a su activación tras la administración generalmente de dosis altas de heparina intravenosa, y se recupera típicamente en 3-4 días a pesar de continuar con el fármaco.
Dentro de la TIH de tipo II, se distinguen ocho subtipos clasificados según el momento de inicio de la trombocitopenia y el tiempo de recuperación2–4. En la tabla 1 se muestran los cuatro tipos más frecuentes. Las otras cuatro presentaciones más inusuales son: i) la TIH persistente, definida como aquella en la que el ascenso de plaquetas no se observa hasta después de al menos una semana desde la retirada de la heparina; ii) la TIH inducida por fondaparinux; iii) la TIH inducida por exposición solo a la heparina empleada para la anticoagulación de catéteres, y iv) la TIH asociada a coagulación intravascular diseminada (CID). En cualquiera de estos casos, la media de desaparición de los anticuerpos es de 50-80 días5.
Clasificación de los subtipos de TIH más frecuentes
| Tipo | Prevalencia | Descripción |
|---|---|---|
| TIH de inicio típico | 70% | Desarrollo gradual de trombocitopenia al menos 5 días después del inicio y durante la administración de heparina. |
| TIH de inicio rápido | 25% | Desarrollo dentro de las 24 horas posteriores a la reexposición debido a anticuerpos circulantes por el uso reciente de heparina (en los 90 días anteriores, especialmente en el mes previo). Suele complicarse por una reacción anafilactoide durante los 30 minutos después de un bolo de heparina (se trata de una reacción inmunológica con formación de anticuerpos, en la que el papel de los linfocitos memoria sería menos relevante y no explicaría la rapidez de instauración del cuadro) |
| TIH de inicio retardado | <5% | Desarrollo de trombocitopenia y trombosis varios días después (desde 5 días hasta 3 semanas) de suspender la heparina. |
| TIH espontánea | ≈ 20 casos reportados | Desarrollo en pacientes sin antecedentes de exposición a heparina debido a anticuerpos inducidos por complejos de PF4 con otros polianiones no heparínicos, como superficies bacterianas y ácidos nucleicos y que suele afectar a enfermos con episodios recientes de infección o cirugía mayor. |
La presente revisión tiene como objetivo servir de ayuda al clínico para el correcto diagnóstico, prevención y tratamiento de pacientes con TIH en el ámbito de los hospitales españoles y se centra en la de tipo II.
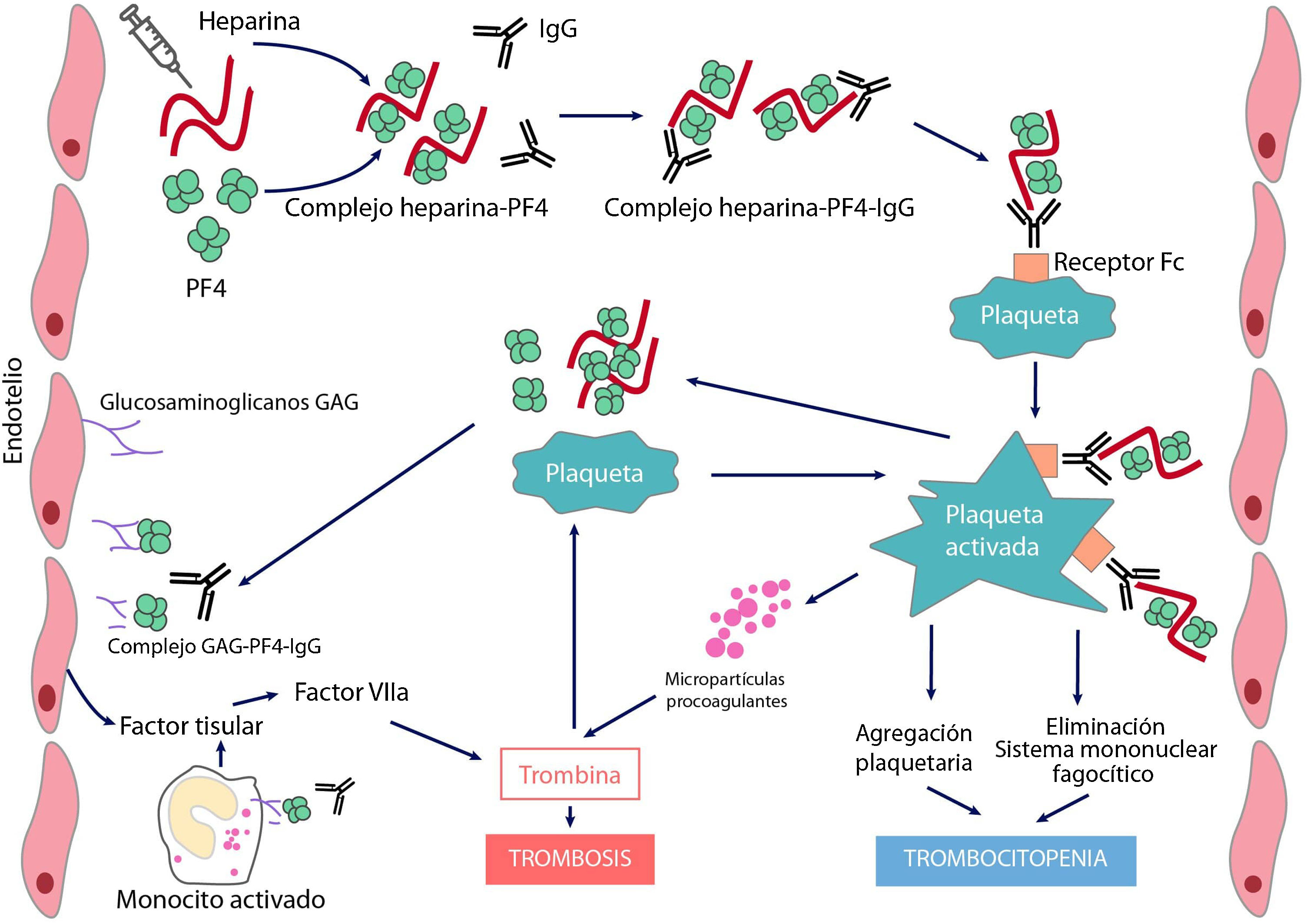
Patogenia y fisiopatología de la trombocitopenia inducida por heparinaEn condiciones normales, el PF4 se almacena en los gránulos α de las plaquetas y se libera tras su activación. Posee carga positiva y, por ende, puede unirse al heparán sulfato cargado negativamente (una sustancia de la superficie de las células endoteliales similar a la heparina); el PF4 también puede unirse a la heparina exógena con una afinidad mucho mayor que al heparán sulfato, lo que puede iniciar una respuesta inmune.
La TIH es inducida por anticuerpos de tipo IgG (más raramente IgA o IgM) producidos por células plasmáticas, que reconocen neoepítopos de complejos heparina/PF4. La heparina interactúa con el PF4 formando un neoantígeno, óptimamente a una concentración estequiométrica (1:1). El complejo resultante se une a receptores Fcɤ en plaquetas y monocitos, induciendo su activación y la generación de micropartículas procoagulantes. Las plaquetas activadas producen sustancias protrombóticas (como trombina) y PF4, lo que crea un estado de hipercoagulabilidad grave y un ciclo vicioso que solo puede romperse al interrumpir la heparina e iniciar el tratamiento adecuado. El PF4 puede también unirse a las cadenas de factor von Willebrand (FvW) liberadas tras la activación endotelial y formar complejos antigénicos reconocidos por los anticuerpos TIH, que favorecen la adhesión plaquetaria y la propagación de la trombosis6. Adicionalmente, los anticuerpos generados al unirse a las células endoteliales inducen la generación de factor tisular. Finalmente, los complejos inmunes activan a los neutrófilos favoreciendo la formación de trampas extracelulares de neutrófilos (NET) suponiendo otro estímulo procoagulante 7. Los recuentos de plaquetas disminuyen porque los macrófagos retiran las plaquetas recubiertas de IgG y, simultáneamente, a medida que las plaquetas se activan, se produce su consumo intravascular. Como consecuencia se generarán grandes cantidades de trombina que favorece la trombosis (fig. 1).
Fisiopatología de la trombopenia inducida por heparina
El tratamiento con el anticoagulante polianiónico heparina favorece la formación de complejos con el factor 4 plaquetario (PF4) cargado positivamente. Estos complejos expresan neoepítopos que inducen la formación de anticuerpos por las células plasmáticas. Los complejos inmunes resultantes activan las plaquetas y promueven la formación de micropartículas procoagulantes y la generación de trombina. Los anticuerpos patogénicos también reconocen PF4 ligado a heparán sulfato y otros glicosaminoglicanos, induciendo activación del endotelio y monocitos y promoviendo la generación de factor tisular. La consecuencia será la aparición de trombosis en pacientes con TIH.
Las complicaciones más frecuentes son trombosis venosa profunda (TVP), tromboembolismo pulmonar (TEP) o necrosis cutánea, particularmente importante si se administran antivitaminas K (AVK) en la fase aguda. El riesgo de estas complicaciones es mayor en los primeros 10 días de iniciar la heparina, pero persiste hasta 30 días después de suspenderla.
DiagnósticoLa TIH se debe sospechar ante descensos de más de un 50% en la cifra de plaquetas. La presencia de trombosis a los 5-10 días de la administración de heparina apoyaría esta sospecha, que inicialmente debe confirmarse mediante la determinación de anticuerpos anti-heparina/PF4. Las cifras de plaquetas no suelen ser inferiores a 20x109/L, si bien no se ha establecido con precisión si la reducción pudiera estar en relación con mayor agregación que destrucción plaquetaria1–4.
El diagnóstico de TIH se basa en tres criterios:
- 1)
El paciente está recibiendo o ha estado expuesto a HNF o HBPM.
- 2)
Existe al menos un dato clínico o analítico (descenso significativo del recuento de plaquetas, trombosis venosa o arterial de nueva aparición).
- 3)
Existe evidencia analítica de anticuerpos específicos de la TIH.
Los signos y síntomas de la TIH incluyen los que sugieran complicaciones trombóticas. Puede aparecer, además, eritema o dolor o incluso necrosis cutánea donde se inyectó la heparina subcutánea. Los enfermos que reciben heparina IV pueden presentar fiebre, hipertensión, taquicardia, disnea y dolor torácico, además de erupciones cutáneas.
La primera acción a realizar ante la sospecha de TIH es calcular su probabilidad de aparición mediante el índice 4T, basado en cuatro parámetros: i) descenso de la cifra de plaquetas (trombocitopenia), ii) tiempo en que se produce el descenso, iii) presencia o ausencia de trombosis y iv) otro diagnóstico alternativo posible (tabla 2). Un índice inferior a 4 puntos tiene un alto valor predictivo negativo (97-99%), pero un bajo valor predictivo positivo. La enfermedad se confirma en un 10-20% con un valor de 4-5 puntos y en hasta 40-80% para índices> 61,8. La probabilidad con las 4T debe servir de orientación, pero no sustituir el juicio clínico (tabla 2).
Índice de probabilidad clínica de TIH (4T)
| 4T | Puntuación |
|---|---|
| Trombocitopenia | |
| Descenso plaquetas> 50% en los 3 últimos días y nadir ≥20×109/L | 2 |
| Descenso plaquetas 30-50% o nadir 10-19×109/L | 1 |
| Descenso <30% o nadir de plaquetas <10×109/L | 0 |
| Tiempo de descenso del recuento plaquetario | |
| Inicio descenso plaquetas a partir 5-10 días (o a partir día 1 tras el inicio con exposición previa a heparina en los últimos 30 días) | 2 |
| Descenso a partir del día 1 tras el inicio y exposición previa en los últimos 30-100 días. Inicio del descenso a partir del día 14 | 1 |
| Descenso plaquetas <4 días sin exposición a heparina en los últimos 100 días | 0 |
| Trombosis u otras secuelas | |
| Nueva trombosis (confirmada); necrosis cutánea en lugar de inyección, reacción anafiláctica tras bolo de heparina; hemorragia adrenal | 2 |
| Trombosis progresiva o recurrente; lesiones cutáneas no necróticas; sospecha de trombosis (no confirmada) | 1 |
| Ninguna | 0 |
| Otras causas de trombocitopenia | |
| Ninguna otra causa evidente | 2 |
| Posible | 1 |
| Otra causa presente | 0 |
Probabilidad clínica: De acuerdo con la regla de la 4T se define la probabilidad clínica: Alta=6-8 puntos; Intermedia=4-5 puntos; Baja ≤ 3 puntos.
- •
Trombocitopenia: suele ser moderada (≥ 20×109/L). Un descenso de plaquetas> 30%, a los 5-10 días de exposición a HNF o HBPM es sugestivo de TIH, si bien puede existir una disminución más precoz (24 horas) en pacientes expuestos a heparina en los 3 meses previos. No suele cursar con hemorragia.
- •
Tiempo: típicamente, el cuadro aparece a los 5-10 días en pacientes tratados con HNF o HBPM o mucho más rápidamente si ha existido exposición previa (últimos 30-100 días).
- •
Trombosis: es el dato clínico característico y se desarrolla en el 30-50% de las TIH confirmadas. Puede ser venosa (como en extremidades inferiores, esplácnica o catéter venoso) o arterial (cerebral, gangrena de extremidades inferiores, entre otros). Puede ser la manifestación clínica inicial, aunque suele presentarse inmediatamente tras la aparición de trombocitopenia.
- •
Otras causas de trombocitopenia: deben contemplarse muchas enfermedades que cursan con trombocitopenia aislada (fundamentalmente secundarias a fármacos, de etiología inmune -PTI- o infecciosa, púrpura postransfusional) o asociada a fenómenos trombóticos (ver Diagnóstico diferencial).
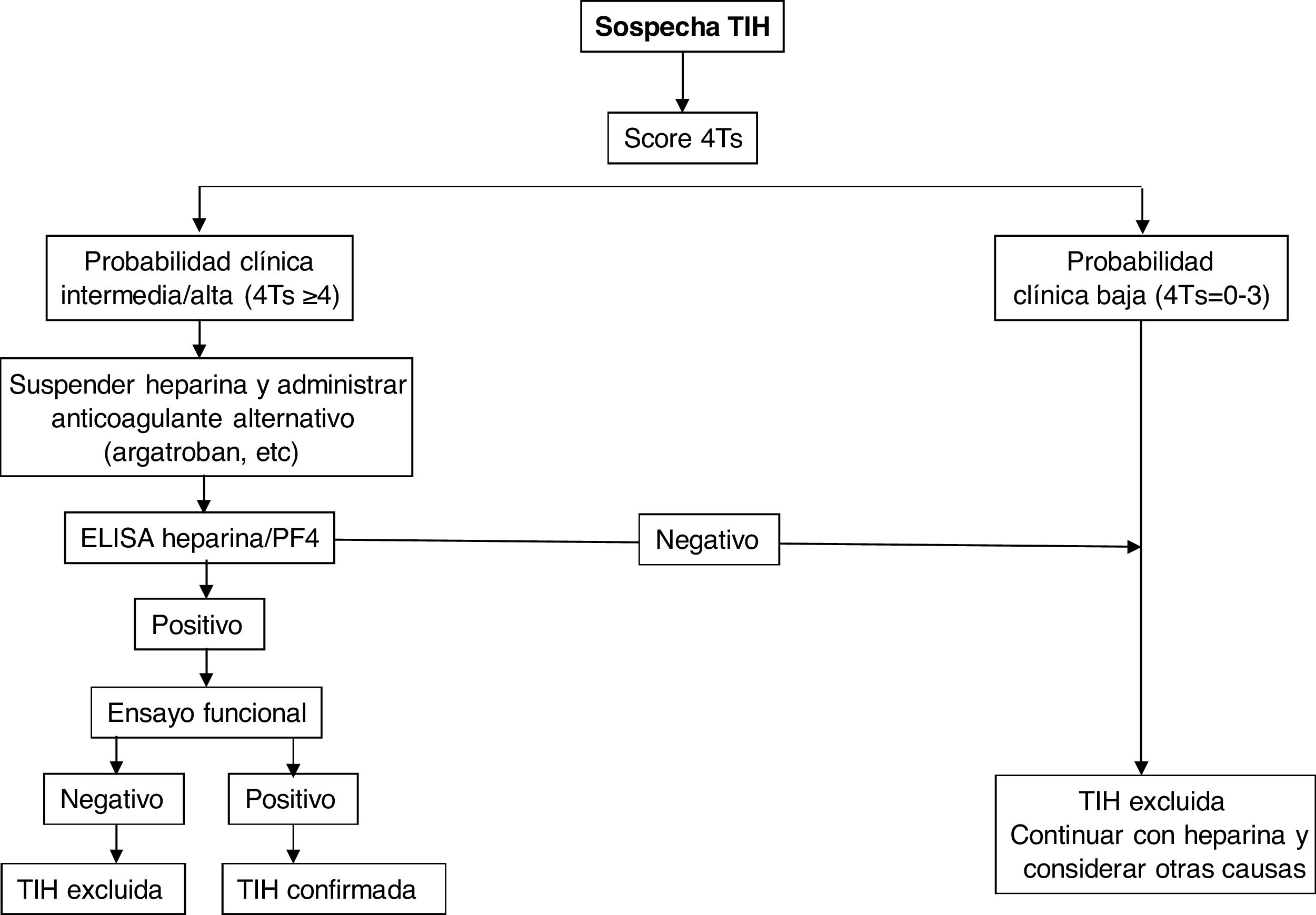
En general, si el índice calculado es ≥ 4, debe realizarse la determinación de anticuerpos mediante las técnicas detalladas a continuación. Para ello se deben extraer muestras de suero o plasma (dependiendo del análisis) luego de al menos 4 horas después de la última administración de heparina, y deben analizarse o almacenarse congeladas para su estudio posterior dentro de las 4 horas posteriores a la recolección.
Diagnóstico de laboratorioSe basa en la identificación y/o cuantificación de anticuerpos anti-heparina/PF4 con técnicas inmunológicas y funcionales, debiendo emplearse exclusivamente en pacientes con probabilidad intermedia o alta. Para las primeras se emplean ensayos de inmunoanálisis (ELISA) que detectan anticuerpos contra el complejo heparina/PF4 y muestran un excelente valor predictivo negativo (98-99%), pero bajo valor predictivo positivo para la detección de anticuerpos clínicamente relevantes. La fuente de PF4 difiere entre los análisis: PF4 recombinante unido a heparina, PF4 purificado unido a polivinil sulfonato, lisados plaquetares unidos a heparina inmovilizada en la superficie de microplacas o partículas que contienen heparina/PF4 en inmunoanálisis en fase sólida basados en la aglutinación de estas. A pesar de su poder predictivo negativo excelente, diversos estudios han evidenciado la limitación de estos métodos para el diagnóstico de TIH, ya que la enfermedad se confirmó en solo 2-15% de pacientes con anticuerpos positivos mediante ELISA8,9. Se han empleado estrategias para aumentar la sensibilidad del método, como la combinación de pruebas, restringir el análisis a subtipos de IgG o modificar diversas condiciones del estudio para incrementar la capacidad predictiva del análisis10.
La confirmación diagnóstica requiere la realización de estudios funcionales que detectan activación plaquetaria. La prueba funcional de liberación de serotonina (SRA) es la referencia frente a la que los demás métodos deben validarse, aunque para su determinación se precisa una instalación autorizada para trabajar con muestras radiactivas. Otros son los tests de activación plaquetaria inducida por heparina (HIPA), que utilizan técnicas de agregometría y citometría de flujo. Todos ellos son más específicos para anticuerpos clínicamente relevantes que los test inmunológicos, de forma que una prueba negativa excluiría el diagnóstico de TIH (sobre todo con un índice bajo de las 4T). La exclusión diagnóstica se haría mediante las pruebas de cribado, mientras que los test funcionales cuando son positivos confirmarían el diagnóstico de TIH, pero están restringidos a laboratorios especializados11,12. Se ha demostrado que la combinación del índice de las 4T y el título de los anticuerpos podría predecir el resultado del estudio funcional13.
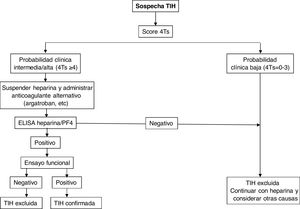
En la figura 2 se muestra un algoritmo diagnóstico/terapéutico para la TIH.
Otros estudios diagnósticosPara pacientes con sospecha clínica o confirmación de TIH se indica realizar una ecografía doppler para descartar una TVP, independientemente de la ausencia de clínica, ya que estos hallazgos tendrán implicaciones relacionadas con la duración del tratamiento. Si existe dolor abdominal con hipotensión, debe sospecharse un cuadro de hemorragia adrenal asociado a trombosis de vena adrenal. En pacientes con cefalea intensa debe considerarse la posibilidad de una trombosis del seno cavernoso2–4.
Diagnóstico diferencialEl diagnóstico diferencial de la TIH debe incluir otros escenarios clínicos que cursan con trombocitopenia, como la trombocitopenia inmune, la púrpura postransfusional o inducida por fármacos, o adicionalmente asociadas a complicaciones trombóticas, como la CID, las microangiopatías trombóticas y el síndrome antifosfolípido. La exposición previa a la heparina y la detección de anticuerpos anti-heparina/PF4 puede ayudar en el diagnóstico de TIH2–4.
TratamientoEl tratamiento de la TIH debe comenzar en cuanto se obtenga una puntuación 4T de 4 o más. Es crucial adoptar dos medidas inmediatas: suspender la heparina e iniciar un anticoagulante no heparínico1–4 (tabla 3). En pacientes con AVK se debe retirar dicha anticoagulación y administrar fitomenadiona (vitamina K) para reponer las reservas de proteína C y S. La anticoagulación con fármacos alternativos debe ser a dosis terapéuticas en la mayoría de los casos, incluyendo cualquier paciente con: puntuación 4T de alta probabilidad, puntuación 4T de probabilidad intermedia y otra indicación de anticoagulación terapéutica, o puntuación 4T de probabilidad intermedia y sin indicación de anticoagulación terapéutica que no presente alto riesgo de sangrado. Alternativamente, se puede iniciar una dosis profiláctica de otro anticoagulante en un pequeño grupo de pacientes considerados de alto riesgo de hemorragia, siempre que no requieran anticoagulación terapéutica por otro motivo y tengan una puntuación 4T de probabilidad intermedia. Si se inicia la anticoagulación profiláctica y el inmunoanálisis resulta positivo, el paciente debe cambiarse a anticoagulación terapéutica mientras se esperan los resultados del estudio funcional.
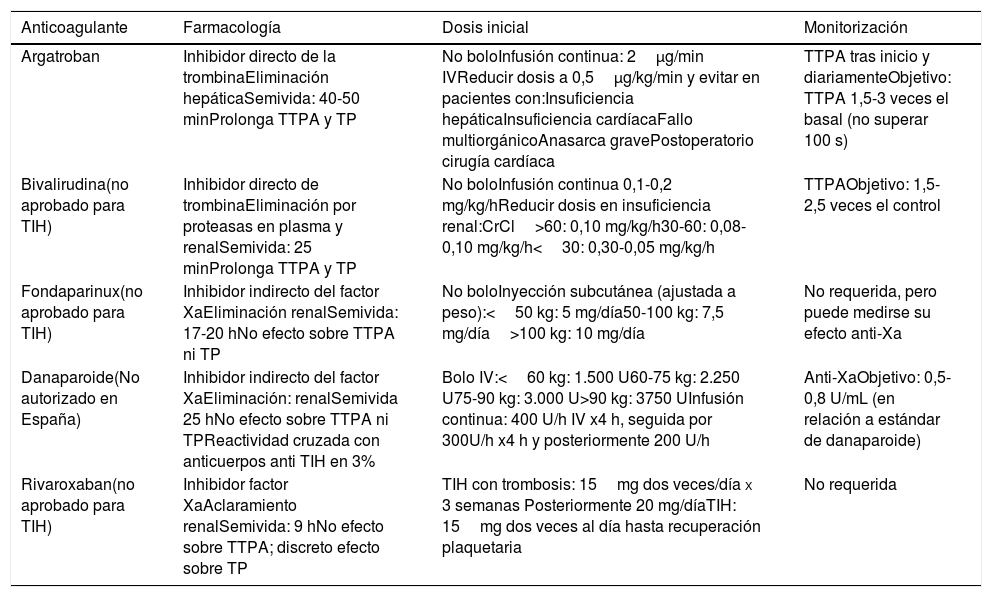
Anticoagulantes no heparínicos para el tratamiento de la TIH
| Anticoagulante | Farmacología | Dosis inicial | Monitorización |
|---|---|---|---|
| Argatroban | Inhibidor directo de la trombinaEliminación hepáticaSemivida: 40-50 minProlonga TTPA y TP | No boloInfusión continua: 2μg/min IVReducir dosis a 0,5μg/kg/min y evitar en pacientes con:Insuficiencia hepáticaInsuficiencia cardíacaFallo multiorgánicoAnasarca gravePostoperatorio cirugía cardíaca | TTPA tras inicio y diariamenteObjetivo: TTPA 1,5-3 veces el basal (no superar 100 s) |
| Bivalirudina(no aprobado para TIH) | Inhibidor directo de trombinaEliminación por proteasas en plasma y renalSemivida: 25 minProlonga TTPA y TP | No boloInfusión continua 0,1-0,2 mg/kg/hReducir dosis en insuficiencia renal:CrCl>60: 0,10 mg/kg/h30-60: 0,08-0,10 mg/kg/h<30: 0,30-0,05 mg/kg/h | TTPAObjetivo: 1,5-2,5 veces el control |
| Fondaparinux(no aprobado para TIH) | Inhibidor indirecto del factor XaEliminación renalSemivida: 17-20 hNo efecto sobre TTPA ni TP | No boloInyección subcutánea (ajustada a peso):<50 kg: 5 mg/día50-100 kg: 7,5 mg/día>100 kg: 10 mg/día | No requerida, pero puede medirse su efecto anti-Xa |
| Danaparoide(No autorizado en España) | Inhibidor indirecto del factor XaEliminación: renalSemivida 25 hNo efecto sobre TTPA ni TPReactividad cruzada con anticuerpos anti TIH en 3% | Bolo IV:<60 kg: 1.500 U60-75 kg: 2.250 U75-90 kg: 3.000 U>90 kg: 3750 UInfusión continua: 400 U/h IV x4 h, seguida por 300U/h x4 h y posteriormente 200 U/h | Anti-XaObjetivo: 0,5-0,8 U/mL (en relación a estándar de danaparoide) |
| Rivaroxaban(no aprobado para TIH) | Inhibidor factor XaAclaramiento renalSemivida: 9 hNo efecto sobre TTPA; discreto efecto sobre TP | TIH con trombosis: 15mg dos veces/día x 3 semanas Posteriormente 20 mg/díaTIH: 15mg dos veces al día hasta recuperación plaquetaria | No requerida |
Los tratamientos se resumen en la tabla 3:
- •
Argatroban: inhibidor directo de la trombina, es el único fármaco en España con la indicación de tratamiento de la TIH aprobada desde 2011. La Food and Drug Administration (FDA), después de una primera autorización en 2000 como profilaxis o tratamiento de la TIH en adultos, autorizó también en 2002 su uso como anticoagulante en pacientes sometidos a intervención coronaria percutánea (ICP).
- •
Danaparoide: inhibidor del factor Xa dependiente de antitrombina, está autorizado desde 1996 en la mayoría de los países europeos, pero no en España y en 2001 fue aprobado por la FDA.
- •
Bivalirudina: inhibidor selectivo directo de la trombina, análogo a la hirudina. La FDA autorizó su uso en 2000 como anticoagulante en pacientes que van a ser sometidos a una ICP. En Europa, la EMA aprobó la indicación en 2009 y en España está autorizado desde 2016 como anticoagulante en pacientes adultos que se someten a ICP o con angina inestable/infarto de miocardio sin elevación del segmento ST que serán sometidos a una intervención urgente o que no puede diferirse. En 2005, la FDA aprobó también su uso en TIH, indicación actualmente no autorizada en Europa.
Por la naturaleza de la enfermedad, el agente autorizado con esta indicación en España (argatroban) debería tener un acceso rápido y sencillo en el entorno hospitalario para su administración a pacientes con un diagnóstico de presunción de HIT.
Argatroban es un anticoagulante sintético con inicio de acción rápido, semivida de 1 hora y administración IV continua, consiguiéndose niveles estables en 1-3 horas. En TIH aguda la dosis es de 2μg/kg/min. En caso de insuficiencia hepática moderada conviene reducir la dosis a 0,5μg/kg/min, también en individuos con fallo multiorgánico, insuficiencia cardiaca o postcirugía cardíaca. Debido a que no se elimina por el riñón, es de preferencia en pacientes con insuficiencia renal. Un estudio prospectivo demostró que reducía significativamente la incidencia de trombosis, de muerte por esta complicación o de amputación relacionada con trombosis en comparación con controles históricos (HR 0,33, IC 95% 0,20-0,54)14, resultados posteriormente confirmados en un estudio multicéntrico realizado en Francia15. Sus niveles anticoagulantes se monitorizan con el tiempo de tromboplastina parcial activado (TTPA), buscando alcanzar un intervalo de 1,5-3 veces superior al valor basal, sin superar los 100 segundos. Si bien pueden existir diferencias en el intervalo terapéutico de TTPA entre los diferentes agentes, el objetivo es mantener un nivel aproximado del doble con respecto al control. Pueden observarse resultados artificialmente elevados al administrar a pacientes con coagulopatías (p. ej., hepatopatía) o a los que han recibido previamente AVK, por lo que en estos casos se ha sugerido el empleo de pruebas adicionales como el test de ecarina para monitorizar el efecto del fármaco. La eficacia de argatroban en relación con otros anticoagulantes alternativos ha sido ampliamente demostrada en contexto de TIH. En los ensayos clínicos que llevaron a la aprobación del fármaco, el argatroban redujo el riesgo del resultado combinado (nueva trombosis, muerte por trombosis, amputación por trombosis) en comparación con los controles históricos16–18.
Danaparoide es un heparinoide que contiene heparán, dermatán y condroitín sulfato. Posee actividad anti-Xa, se elimina por vía renal y no prolonga los tiempos de coagulación. Su semivida es aproximadamente 25 horas. Se administra por vía subcutánea o intravenosa, precedida de un bolo, con dosis que varían dependiendo del contexto médico o quirúrgico. También ha demostrado un efecto beneficioso en la TIH en pequeñas series de pacientes con mejoría del recuento plaquetario y reducción de la trombosis19. Sus niveles se monitorizan con análisis funcionales de la actividad anti-Xa. La monitorización puede necesitarse en pacientes con insuficiencia renal, dada su larga vida media. Está contraindicado en pacientes con aclaramiento de creatinina <30ml/min. En España no está autorizado.
Bivalirudina es otro inhibidor directo de la trombina que se puede utilizar en estos pacientes. Sin embargo, su indicación en España no incluye la TIH17.
Otro anticoagulante que puede utilizarse en una TIH es fondaparinux. Aunque no está aprobado para esta indicación, se considera seguro y eficaz20. Una consideración importante es que se elimina por vía renal y está contraindicado en caso de aclaramiento de creatinina <30ml/min. En algunos pacientes tratados con fondaparinux existe reactividad cruzada con anticuerpos anti-heparina/PF418 y, aunque poco frecuente, esto podría tener implicaciones clínicas (tabla 3).
Aunque la evidencia es escasa, teóricamente todos los anticoagulantes orales directos (ACOD) podrían utilizarse en el tratamiento de TIH, si bien se han publicado más casos con rivaroxaban21. Como ventaja, esta estrategia permitiría el tratamiento ambulatorio de los pacientes. Sin embargo, los ACOD no están aprobados para el tratamiento de la TIH. Se puede plantear su empleo en enfermos que han recuperado sus niveles de plaquetas con alguno de los agentes anteriores, para hacer la transición de fármacos parenterales a orales, fundamentalmente en enfermos que precisen anticoagulación durante meses para evitar los AVK.
Con la suspensión de la heparina y la utilización de un anticoagulante alternativo la TIH suele resolverse. No obstante, para casos de trombocitopenia/trombosis refractaria tras cinco días de tratamiento con anticoagulantes no heparinoides, se ha sugerido que un esquema con inmunoglobulinas IV (2g/kg dosis acumulada) sería seguro y eficaz, consiguiendo hasta un 77% de respuesta22.
Duración del tratamiento anticoagulanteComo regla general, se mantendrá la anticoagulación terapéutica hasta la estabilización del recuento plaquetario (>150x109/L o la cifra basal del enfermo) en pacientes con TIH sin trombosis. El cambio a un anticoagulante alternativo, y en especial argatroban que aumenta el INR, a un AVK es un desafío para el médico. Debe haber un periodo de superposición de 5 días entre el AVK y el anticoagulante parenteral elegido. La duración del tratamiento anticoagulante será como mínimo de 3 meses (preferiblemente 3-6 meses) si el enfermo ha experimentado episodios trombóticos.
Si bien la TIH no suele recurrir, los pacientes deben evitar la reexposición a heparina y el médico considerarla como fármaco alergénico en sus historias clínicas. Las secuelas trombóticas estarán relacionadas con la gravedad del episodio inicial. Un porcentaje elevado de enfermos sufre amputaciones si no se ha instaurado precozmente un tratamiento anticoagulante alternativo específico. Por ello se recomienda utilizar alternativas como fondaparinux, ACOD o argatroban en situaciones como perioperatorio, diagnóstico de trombosis.
Otras medidasNo se recomienda transfundir plaquetas para tratar la trombocitopenia si no existe clínica hemorrágica grave, ya que estas pueden unirse a IgG, activarse y liberar PF4, empeorando el estado de hipercoagulabilidad. Cuando sea posible, se retrasarán las cirugías, pero puede administrarse un anticoagulante alternativo de forma pre y postoperatoria.
Después de un episodio de TIH, los anticuerpos IgG pueden permanecer en el organismo hasta 3 meses; si el paciente recibe cualquier forma de heparina durante este período, el recuento de plaquetas puede descender en tan solo 12 horas. Tras los 3 meses de una TIH, el anticoagulante puede utilizarse con precaución si es necesario, bajo estricta monitorización. Idealmente, debe realizarse un análisis funcional para asegurarse que sea negativo antes de la administración; si esto no es posible, debe considerarse el uso de un inhibidor directo de la trombina o fondaparinux. La bivalirudina sería el fármaco preferido en pacientes que sean sometidos a intervencionismo coronario.
En pacientes con antecedentes de TIH debe evitarse el empleo injustificado de cualquier forma de heparina, incluyendo la utilizada en los lavados de catéteres.
Poblaciones especialesEnfermos renalesEn pacientes con TIH aguda y aclaramiento de creatinina <30mL/min se recomienda argatroban. Si el paciente está sometido a diálisis, puede utilizarse citrato para la anticoagulación del sistema 16.
Cirugía cardíacaExisten datos aislados sobre el empleo de anticoagulantes alternativos en cirugía cardíaca, pero se prefiere la HNF. En pacientes con historia de TIH o anticuerpos anti-heparina/PF4 positivos, se recomienda retrasar la cirugía si es posible, esperar a que los anticuerpos se negativicen (3 meses), y realizar la circulación extracorpórea con heparina de manera habitual. En el postoperatorio se recomienda utilizar anticoagulantes no heparínicos. Puede emplearse bivalirudina en pacientes sometidos a intervencionismo coronario23,24. El recambio plasmático solo o en combinación con inmunoglobulinas endovenosas también ha demostrado ser una estrategia segura y eficaz para eliminar rápidamente los anticuerpos anti-PF4 y realizar cirugía cardíaca con circulación extracorpórea utilizando heparina sódica como anticoagulante25,26.
PediatríaLa TIH puede ser una complicación en pacientes pediátricos, particularmente en aquellos expuestos a heparina como consecuencia de cirugías cardíacas (p. ej., bypass cardiopulmonar) o dispositivos extracorpóreos (p. ej.. ECMO), siendo argatroban y bivalirudina los fármacos más empleados27. Aunque la incidencia de TIH es menor que en adultos, el diagnóstico y tratamiento son similares, por lo que se recomienda el asesoramiento por pediatras con experiencia en el manejo de niños con problemas de tromboembolismo en combinación con el hematólogo.
EmbarazoLa TIH es infrecuente en el embarazo. El danaparoide, que no cruza la barrera placentaria, puede ser el anticoagulante de elección. El uso de fondaparinux es una opción, aunque el fármaco cruza la placenta y, con todo, la experiencia es escasa. No se deben emplear ACOD en mujeres gestantes con TIH28.
COVID-19Ha habido casos aislados de trombocitopenia asociada a anticuerpos anti PF4 en pacientes con COVID-19 y síndrome de distress respiratorio asociado con eventos trombóticos, lo que obliga a monitorizar cercanamente el recuento plaquetario, fundamentalmente en pacientes que reciben heparina. Argatroban puede representar una alternativa eficaz y segura en pacientes con COVID-19 y TIH29. Es interesante señalar que estudios recientes describen casos aislados de trombocitopenia trombótica inmune (denominada VITT, vaccine-induced immune thrombotic thrombocytopenia) inducida por la vacuna ChAdOx1 en COVID-19 con un mecanismo similar a la TIH; es decir, mediada por anticuerpos contra el PF4, y responsable de episodios trombóticos, fundamentalmente trombosis venosa cerebral y trombosis esplácnicas 30.
ConclusiónLa TIH es una grave complicación del tratamiento con HNF y, con menos frecuencia, tras HBPM. Es causada por anticuerpos anti-heparina/PF4 y se caracteriza por un descenso de plaquetas y un estado protrombótico grave a los 5-10 días de la exposición, que facilita el desarrollo de trombosis venosas o arteriales. En el diagnóstico, se recomienda el índice de las 4T para establecer la probabilidad clínica. Este debe confirmarse mediante ensayos inmunológicos, determinando anticuerpos contra el complejo heparina/PF4, o funcionales. Un resultado negativo de los primeros suele descartar el diagnóstico, mientras que la positividad de los segundos suele confirmar la sospecha. El tratamiento consiste en suspender la heparina y emplear un anticoagulante no heparínico a dosis terapéuticas (argatroban, danaparoide, bivalirudina, fondaparinux), como sugieren las guías mencionadas2–6. Los ACOD pueden emplearse fuera de indicación en lugar de AVK para el tratamiento a largo plazo, cuando se haya normalizado la cifra de plaquetas. Los pacientes con TIH deben evitar exposiciones ulteriores a heparina.
FinanciaciónEste manuscrito cuenta con el auspicio de la Sociedad Española de Trombosis y Hemostasia (SETH) y el aval científico de la Sociedad Española de Hematología y Hemoterapia (SEHH).
Conflicto de interesesLos autores han recibido honorarios de Aguettant Ibérica (Barcelona, España) por la redacción del artículo.