El ataque isquémico transitorio (AIT) es una situación de alto riesgo. Los autores se proponen estudiar las implicaciones diagnósticas del perfil de recurrencia a los 7 y a los 90 días.
Pacientes y métodoSe estudió de forma consecutiva a una cohorte de 210 pacientes con AIT reciente. Se recogieron datos sobre los estudios ultrasonográfico, de neuroimagen y cardiológico.
ResultadosSe obtuvo el seguimiento a 90 días en 209 casos y a 7 días en 210 casos. A los 90 días, 14 pacientes (6,7%; intervalo de confianza [IC] del 95%: 3,3 a 10,1) tuvieron un infarto isquémico cerebral (IIC), 9 pacientes (4,3%; IC del 95%: 1,5 a 7,1) tuvieron un AIT y 6 pacientes (2,9%; IC del 95%: 0,6 a 5,1) tuvieron un episodio de cardiopatía isquémica, mientras que 13 de los 210 pacientes (6,2%; IC del 95%: 2,8 a 9,6) con seguimiento mínimo de 7 días tuvieron un IIC. La presencia de estenosis intracraneal (razón de riesgos [RR] de 23,29; IC del 95%: 5,80 a 93,47; p<0,001) fue predictor independiente del IIC a los 7 días, mientras que la etiología aterotrombótica (RR de 7,16; IC del 95%: 3,01 a 17,04; p<0,001) lo fue de ictus a los 90 días. Se llegó a un nuevo diagnóstico de fibrilación auricular en 21 sujetos (10,0%), mayoritariamente mediante electrocardiograma basal (62%). Se observaron lesiones agudas en difusión (DF) en 81 (44,5%) de los 182 pacientes y se observaron lesiones crónicas en 110 pacientes (60,4%) mediante resonancia magnética craneal frente a 56 (26,7%) sobre 210 pacientes con tomografía computarizada craneal.
ConclusiónEl perfil de recurrencia tan precoz justifica la realización de estudios ultrasonográficos en las primeras horas tras el AIT. El estudio del valor predictivo de la DF sólo puede plantearse si se realiza de forma muy inmediata, mientras que el rendimiento de las exploraciones cardiológicas es bajo.
Early stroke recurrence risk alter a transient ischemic attack (TIA) is high. We studied the diagnostic implications of the recurrence pattern after TIA.
Methods210 consecutive TIA patients were studied. Ultrasonographic (US), neuroimaging and cardiologic data were collected.
ResultsAt 90 day follow-up, 14 patients (6.7%; 95% CI: 3.3–10.1) among 209 suffered an ischemic infarction (II), 9 (4.3%; 1.5–7.1) a TIA and 6 (2.9%; 0.6–5.1) a cardiac ischemic event. Moreover, 13 patients (6.2%; 2.8–9.6) among 210 with a seven-day follow-up had an II. Multivariate analyses only identified the presence of intracranial stenoses (HR, 23.29; 95% CI, 3.49 to 23.57; p<0.018) as independent predictors of stroke within the first 7 days, and large-artery occlusive disease (HR, 9.07; CI, 3.49 to 23.57; p<0.001) as a predictor of stroke recurrence at 90 day follow-up. A new diagnosis of atrial fibrillation was observed in 21 subjects (10.0%), and it was documented in the baseline ECG in 62% cases. Acute diffusion abnormalities were identified in 81 (44,5%) of 182 patients, and chronic ischemic lesions were observed in 110 (60.4%) on MRI vs 56 (26.7%) among 210 on CT scan.
ConclusionDue to very early recurrence, the routine use of ultrasonography within the first hours after an index TIA will be useful to identify those patients at high risk. The prognostic usefulness of diffusion-weighted studies will be only achieved if it is performed early. Routine noninvasive cardiac rhythm monitoring has a low detection rate.
El ataque isquémico transitorio (AIT) representa una oportunidad excelente para cambiar la historia natural de una de las principales causas de discapacidad en la sociedad moderna: la enfermedad cerebrovascular1,2. Entre un 15 y un 25% de los infartos cerebrales están precedidos por episodios neurológicos deficitarios transitorios3,4. El riesgo de recurrencia precoz de ictus tras un AIT es elevado. Una reciente revisión sobre un total de 9.433 pacientes procedentes de 15 cohortes estimó el riesgo de recurrencia de ictus durante los 2 primeros días tras el episodio índice en un 3,1% (intervalo de confianza [IC] del 95%: 2,0 a 4,1) y en un 5,2% (IC del 95%: 3,9 a 6,5) a los 7 días tras revisar 17 cohortes, que suman un total de 7.830 individuos5. En los primeros 3 meses de seguimiento, aproximadamente un 10% tendrá un infarto isquémico cerebral6,7,8,9. Este riesgo asciende a más del 20% en el caso de que la causante del episodio deficitario sea una estenosis grave carotídea7,8,10.
Pese a estos datos alarmantes, el tratamiento de estos pacientes no es homogéneo. Mientras en ciertas instituciones ingresan de forma sistemática, en otras el estudio se realiza de forma ambulatoria11,12,13. La publicación reciente de varios trabajos que demuestran el beneficio de la inmediatez en el diagnóstico7,14,15 y el tratamiento14,15,16 de estos pacientes puede haber abierto nuevos horizontes en su tratamiento.
En los últimos años se han publicado escalas de riesgo, como la escala ABCD (age, blood pressure, clinical features, duration ‘edad, presión sanguínea, características clínicas, duración’) y la escala ABCD2, basadas en variables clínicas (edad>60 años, hipertensión arterial [HTA], duración de los síntomas, déficit motor, alteración del lenguaje y antecedente de diabetes mellitus [DM]) para seleccionar los pacientes de mayor riesgo de recurrencia17,18. Sin embargo, independientemente de los síntomas, un estudio etiológico precoz que incluya una exploración ultrasonográfica tanto intracraneal como extracraneal parece ser imprescindible7,8,19.
Cabría resaltar que las pruebas de neuroimagen también pueden tener implicaciones pronósticas en estos pacientes. Pese a fundamentarse en cohortes no demasiado extensas, aquellos pacientes con episodios transitorios asociados a lesiones isquémicas agudas en las secuencias potenciadas en difusión (DF) parecen tener mayor riesgo de tener un nuevo episodio vascular isquémico durante el seguimiento a corto y a medio plazo20,21,22,23,24,25.
Con el presente trabajo se pretende estudiar la idoneidad de las exploraciones complementarias realizadas durante el ingreso de pacientes consecutivos con el diagnóstico de AIT y validar la utilidad de las escalas clínicas en el pronóstico de estos pacientes.
Paciente y métodoPoblación de estudioDe forma consecutiva y prospectiva se incluyeron en el estudio pacientes con el diagnóstico de AIT según el Grupo de Estudio de las Enfermedades Cerebrovasculares de la Sociedad Española de Neurología (disfunción cerebral focal o monocular con una duración de los síntomas menor de 24h causada por una insuficiencia vascular debida a trombosis o a embolia arterial)1 durante el período de tiempo comprendido entre enero de 2006 y julio de 2008. Un neurólogo con experiencia en el tratamiento del ictus atendió a todos los pacientes durante las primeras 48h tras el inicio de los síntomas. Igualmente, todos los pacientes ingresaron en la planta de Neurología y firmaron el consentimiento informado. El Comité Ético de este centro aprobó este estudio. La cohorte final estuvo constituida por 210 pacientes. Previamente se excluyeron 11 pacientes por episodios de déficit neurológico transitorio no atribuibles a isquemia cerebral: hiponatremia (un caso), trastorno psicosomático (2 pacientes), migraña (3 casos), epilepsia (3 casos), tumor cerebral (un caso) y angiopatía amiloidea cerebral (un caso). Finalmente, 2 pacientes con el diagnóstico de AIT no se incluyeron al no haber dado su conformidad al estudio.
Se les realizó un estudio sistemático que incluyó analítica general, electrocardiograma (ECG), una prueba de neuroimagen (tomografía computarizada [TC] craneal o resonancia magnética [RM]) y una evaluación sonográfica mediante dúplex de los troncos supraaórticos y Doppler transcraneal dentro de las primeras 48h tras el inicio de los síntomas.
Variables clínicas pronósticasSe recogieron las siguientes variables: sexo, edad, antecedentes de ictus previo, HTA, enolismo grave, cardiopatía isquémica, DM, tabaquismo, arritmia completa por fibrilación auricular (ACxFA), dislipidemia, arteriopatía periférica, insuficiencia cardíaca y valvulopatía.
La HTA quedó definida como la elevación persistente de la presión arterial por encima de 140/90mmHg. El enolismo se definió como el consumo de más de 75g de alcohol por día. El tabaquismo quedó determinado como el consumo habitual de tabaco, incluidos los exfumadores de menos de 5 años. La DM se definió como las cifras de glucemia basal mayores de 126mg/dl al menos en 2 ocasiones o por la toma de antidiabéticos orales o de insulina. La cardiopatía isquémica se determinó como el hecho de haber presentado episodios documentados de angina de pecho o infarto de miocardio. La ACxFA se definió como la arritmia cardíaca caracterizada por una actividad auricular desordenada que se manifiesta por la ausencia de ondas p en el ECG. La dislipidemia quedó determinada como las cifras documentadas de colesterol ligado a lipoproteínas de baja densidad >160mg/dl, de colesterol ligado a lipoproteínas de alta densidad <30mg/dl o el antedecente de toma de estatinas u otros hipolipidemiantes. La arteriopatía periférica quedó definida como historia clínica de claudicación intermitente o antecedentes de intervenciones relacionadas (amputación, bypass periférico, angioplastia, etc.).
La duración del episodio, la recurrencia de episodios transitorios durante la primera semana y las características clínicas del episodio (alteraciones sensitivas, déficit motor, alteración del lenguaje y sintomatología vertebrobasilar) también fueron recogidas. De forma prospectiva se cuantificó el valor en la escala ABCD (edad ≥60 años, un punto; presión arterial sistólica >140mmHg o presión arterial diastólica ≥90, un punto; duración de síntomas ≥1h, 2 puntos; entre 10 min y una hora, un punto, y menor de 10min, 0 puntos; déficit motor unilateral, 2 puntos; alteración del lenguaje aislada sin déficit motor, 1 punto) y en la escala ABCD2 (puntuación en la escala ABCD más un punto por el antecedente de DM) para cada sujeto.
Clasificación etiológicaLa etiología causante del AIT se estableció siguiendo los criterios del estudio TOAST (Trial of Org 10172 in Acute Stroke Treatment ‘Prueba de Org 10172 en el tratamiento de infarto agudo’)26 como aterotrombótica, cardioembólica, lacunar, de causa inhabitual o de causa indeterminada. El estudio extenso de una fuente cardioembólica mediante ecocardiograma, ECG Holter y estudio de shunt derecha-izquierda se realizó a criterio del facultativo a cargo del paciente siguiendo las recomendaciones del Grupo de Estudio de las Enfermedades Cerebrovasculares de la Sociedad Española de Neurología1. Así, en 70 pacientes (3,3%) se realizó una monitorización del ECG y 76 sujetos (36,2%) se estudiaron con un ecocardiograma. El estudio de una posible embolia paradójica se estableció en 24 pacientes (11,5%).
Variables de neuroimagenEn todos los casos se realizó una TC craneal dentro de las primeras 24h tras el inicio de los síntomas (media de 8,5h [desviación estándar {DE} de 6,9]). Se registraron datos sobre la presencia de lesiones isquémicas crónicas: leucoaraiosis, infartos lacunares crónicos y lesiones isquémicas crónicas corticales.
Se incluyeron los datos de la RM en 181 pacientes. Previamente se desestimaron los datos de 8 pacientes a los que se les realizó la RM tras presentar una recurrencia, en 7 casos la RM no se llevó a cabo por claustrofobia, en 2 casos por problemas técnicos, en 3 casos por negativa del paciente, en 3 casos por presencia de implantes metálicos, en otros 3 casos por ser portador de marcapasos y, finalmente, en 3 casos por criterio médico. Todas las RM incluyeron DF y se realizaron dentro de la primera semana de seguimiento (media de 3,8 días [DE de 1,7]). Las variables registradas fueron la presencia de áreas de restricción de DF compatible con isquemia aguda, así como la presencia de lesiones isquémicas crónicas (lesiones de hipoxia crónica, infartos lacunares antiguos e infartos territoriales crónicos).
Estudio ultrasonográfico intracraneal y extracranealEl estudio de Doppler transcraneal se realizó con la máquina Multi-Dop/TCD® (DWL Elektronische Systeme GmbH), Alemania. Se diagnosticó una estenosis intracraneal (EIC) en aquellos casos en los que la velocidad media en la profundidad insonada fue mayor de 80cm/s, con una asimetría derecha-izquierda superior al 30% y pérdida del patrón laminar27. La aterosclerosis de la arteria carótida interna cervical se categorizó mediante ecografía Doppler como: a) ausente; b) leve, si se apreció una estenosis menor del 50%; c) moderada, si había una estenosis menor del 70%, y d) grave, si había una estenosis mayor del 70%, siguiendo criterios de la Society of Radiologists in Ultrasound Consensus Conference28.
La etiología aterotrombótica se estableció en todos los pacientes en los que se pudo demostrar una EIC o una estenosis extracraneal (EEC) mayor del 50% sintomáticas.
Episodios vascularesEn todos los pacientes se valoró la recurrencia precoz de ictus isquémico mediante la visita médica en consultas externas, realizada por un neurólogo experto en enfermedad neurovascular, a los 7 y a los 90 días de seguimiento. Se consideró como recurrencia de ictus a los 7 días el hecho de haber tenido un infarto cerebral isquémico, mientras que la aparición de un nuevo AIT más allá de la primera semana de seguimiento y un infarto cerebral dentro de los primeros 3 meses tras el episodio índice se consideraron como recurrencia de ictus dentro de los 90 días de seguimiento. La evolución a los 7 días se pudo completar en todos los pacientes, mientras que hubo una pérdida de seguimiento a los 90 días en un paciente y 2 pacientes fallecieron a los 31 y a los 63 días tras el episodio índice.
Análisis estadísticoEl análisis estadístico de los datos se realizó con el programa SPSS 12.0.
En el estudio univariante se identificaron los factores de riesgo relacionados con la recurrencia de ictus a los 7 y a los 90 días: presencia de leucoaraiosis e infartos crónicos en la TC, lesiones isquémicas agudas en DF y lesiones isquémicas crónicas e infartos crónicos en la RM. Para la comparación entre variables categóricas se utilizaron el test de la χ2 de Pearson y el test exacto de Fisher. Cuando se compararon variables numéricas se utilizaron el test de la U de Mann-Whitney o el test de la t de Student para las muestras independientes. Las variables relacionadas en el estudio bivariante con alguno de los episodios estudiados se incluyeron en el estudio multivariante mediante la utilización de regresiones de Cox para ver los posibles factores que pudieran predecir de forma independiente cualquiera de los episodios. Los casos de fallecimiento se incluyeron en la regresión como casos censurados. Se utilizó el método de Kapplan-Meier para la comparación de curvas de supervivencia mediante el empleo del test Log-Rank. Un valor de significación de p<0,05 se consideró como estadísticamente significativo en todas las comparaciones. Para corregir el error de tipo i derivado de las comparaciones múltiples se utilizó el método de Bonferroni.
ResultadosLas variables clínicas basales de esta serie están reflejadas en la tabla 1. La edad media de los pacientes fue de 69,21 años (DE de 1,8). Hubo un predomino de varones (63,3%). La HTA (67,1%) se erigió como el factor de riesgo vascular más frecuente. La mediana de duración de los síntomas fue de 45 min. La puntuación media en la escala ABCD fue de 4,271,16 y en la escala ABCD2 fue de 4,541,30. En 203 de los 210 sujetos incluidos se realizó un estudio mediante dúplex de troncos supraórticos, en el que se detectó EEC en 95 casos (45,2%): leve en 70 casos, moderada en 9 casos, grave en 9 casos y oclusión en 6 casos. Igualmente, se detectó una EIC sintomática en 9 (4,7%) de los 192 sujetos a quienes se les completó un Doppler transcraneal con calidad óptima. En todos los casos con una exploración ultrasonográfica insuficiente se mejoró el estudio etiológico con la práctica de secuencias angiográficas de la RM.
Tabla 1. Análisis descriptivo
| Variable | n (%) |
| Antecedentes | |
| Ictus previo | 47 (30,4) |
| Cardiopatía isquémica | 29 (13,8) |
| Fibrilación auricular | 26 (12,4) |
| Enfermedad arterial periférica | 11 (5,2) |
| Factores de riesgo vascular | |
| Hipertensión | 141 (67,1) |
| Dislipidemia | 67 (31,9) |
| Diabetes mellitus | 56 (26,7) |
| Tabaquismo | 33 (15,7) |
| Características clínicas | |
| Alteración del lenguaje | 130 (61,9) |
| Déficit motor | 115 (55,1) |
| Territorio vertebrobasilar | 15 (7,1) |
| Etiología | |
| Etiología indeterminada | 103 (49,0) |
| Etiología cardioembólica | 43 (20,5) |
| Etiología lacunar | 25 (11,9) |
| Etiología aterotrombótica | 24 (11,4) |
| Etiología inhabitual | 13 (6,3) |
| Tratamiento al alta | |
| Antiagregación | 172 (81,9) |
| Inhibidores del eje renina angiotensina | 116 (55,2) |
| Estatinas | 81 (38,6) |
| Anticoagulación | 43 (20,5) |
| Endarterectomía carotídea | 7 (3,3) |
Se llegó a un nuevo diagnóstico de fibrilación auricular como causante del AIT índice en 21 sujetos (10,0%; IC del 95%: 5,9 a 14,1). La nueva arritmia se detectó en el ECG basal en 13 casos y en sólo 8 casos (13,8%) de las 58 monitorizaciones realizadas. La rentabilidad del ecocardiograma transtorácico fue baja. De las 75 exploraciones realizadas sólo 4 fueron determinantes para establecer una causa cardioembólica del episodio: hipocinesia inferior en 2 casos y valvulopatía en otros 2 casos.
Estudio de neuroimagenMediante la TC craneal se observaron lesiones isquémicas crónicas en 56 sujetos (26,7%). Las lesiones fueron compatibles con infartos isquémicos lacunares crónicos en 28 casos (13,4%), infartos corticales en 25 casos (12,0%) y leucoaraiosis en 36 casos (17,2%). Interesantemente, entre los 162 pacientes sin antecedente de ictus isquémico previo (infarto cerebral o AIT) se observaron lesiones isquémicas compatibles con un infarto isquémico crónico en 21 casos (13,0%) y lesiones de hipoxia crónica en 22 casos (13,6%). Se detectaron infartos isquémicos crónicos en 5 (21,7%) de los 23 pacientes con antecedente de AIT previo y lesiones de hipoxia crónica en 4 pacientes (17,4%). La presencia de leucoaraiosis se relacionó con el antecedente de ictus (el 29,8 frente al 13,6%; p=0,010), HTA (el 22,1 frente al 7,2%; p=0,007), EEC superior al 50% (el 39,1 frente al 14,0%; p=0,002) y la edad del paciente (73,3 ± 9,6 años frente a 68,4 ± 12,1 años; p=0,011). Igualmente, la detección de un infarto cortical se asoció con el antecedente de ictus (el 27,7 frente al 7,4%; p<0,001) y la presencia de la EEC superior al 50% (el 26,1 frente al 9,5%; p=0,018), mientras que el infarto subcortical se asoció también a ictus previo (el 25,5 frente al 9,9%; p=0,006), HTA (el 16,4 frente al 7,2%; p=0,067), DM (el 25,0 frente al 9,2%; p=0,003) y EEC superior al 50% (el 26,1 frente al 10,6%; p=0,034).
Se observaron lesiones isquémicas agudas en DF en 81 (44,5%) de los 182 pacientes a quienes se les realizó una RM craneal durante la primera semana tras el episodio índice. La única variable que se asoció con alteraciones en DF fue la sintomatología motora (el 58,2 frente al 28,6%; p<0,001). La RM evidenció lesiones isquémicas crónicas en 110 sujetos (60,4%): lesiones de hipoxia crónica en 90 sujetos (49,5%), infartos lacunares crónicos en 95 sujetos (52,2%) e infartos corticales en 12 sujetos (5,5%). Como en el caso de la TC craneal, las lesiones de hipoxia crónica se asociaron al antecedente de HTA (el 55,3 frente al 38,2%; p=0,037), la edad longeva (media de 72,7 [DE de 8,9] frente a 64,5 años [DE de 13,1]; p<0,001) y la presencia de EEC (el 61,3 frente al 40,0%; p=0,006). La existencia de infartos isquémicos cerebrales crónicos se asoció al antecedente de ictus previo (el 71,8 frente al 50,0%; p=0,016), a la HTA (el 59,6 frente al 45,5%; p=0,082), a la EEC superior al 50% (el 81,8 frente al 50,3%; p=0,006) y a la edad (media de 72,4 [DE de 9,4] frente a 63,9 años [DE de 13,0]; p<0,001).
Predictores de recurrenciaDe los 209 sujetos con seguimiento a 90 días, 14 sujetos (6,7%; IC del 95%: 3,3 a 10,1) tuvieron un infarto cerebral, 9 sujetos (4,3%; IC del 95%: 1,5 a 7,1) tuvieron un AIT y 6 sujetos (2,9%; IC del 95%: 0,6 a 5,1) tuvieron un episodio de cardiopatía isquémica. Trece de los 210 pacientes (6,2%; IC del 95%: 2,8 a 9,6) con un seguimiento mínimo de 7 días tuvieron una recurrencia de ictus en forma de infarto cerebral. Casi dos terceras partes de los episodios sucedieron durante las primeras 48h de evolución: 8 sujetos (3,8%; IC del 95%: 1,1 a 6,5).
Las variables asociadas de forma significativa (p<0,05) en el estudio bivariante a tener un infarto cerebral dentro de los 7 primeros días de seguimiento y a la aparición de un ictus isquémico a los 90 días (tabla 2) fueron la etiología aterotrombótica y la EIC.
Tabla 2. Factores asociados a la aparición de nuevos episodios cerebrales isquémicos
| Infarto cerebral isquémico (7 días) | Ictus isquémico (90 días) | |||||||||
| No (197) | Sí (13) | p | No (188) | Sí (21) | p | |||||
| n (%) | n (%) | n (%) | n (%) | |||||||
| Antecedentes | ||||||||||
| Ictus previo | 44 (22,3) | 3 (23,1) | 0,950 | 40 (21,3) | 7 (33,3) | 0,209 | ||||
| Cardiopatía isquémica | 27 (13,7) | 2 (15,4) | 0,865 | 24 (12,8) | 5 (23,8) | 0,165 | ||||
| Fibrilación auricular | 25 (12,7) | 1 (7,7) | 1 | 25 (13,3) | 1 (4,8) | 0,483 | ||||
| Enfermedad arterial periférica | 11 (5,6) | 0 (0) | 1 | 10 (5,3) | 1 (4,8) | 1 | ||||
| Factores de riesgo vascular | ||||||||||
| Edad media (DE), años | 68,9 (11,9) | 74,1 (9,3) | 0,126 | 69,0 (11,9) | 71,63 (9,6) | 0,342 | ||||
| Sexo varón | 126 (64,3) | 6 (46,2) | 0,189 | 120 (63,8) | 12 (57,1) | 0,547 | ||||
| Hipertensión | 131 (66,5) | 10 (76,9) | 0,698 | 126 (67,0) | 15 (71,4) | 0,683 | ||||
| Diabetes mellitus | 50 (25,4) | 6 (46,2) | 0,101 | 48 (25,5) | 8 (38,1) | 0,218 | ||||
| Tabaquismo | 32 (16,2) | 1 (7,7) | 0,697 | 29 (15,4) | 4 (19,0) | 0,666 | ||||
| Dislipidemia | 64 (32,5) | 3 (23,1) | 0,557 | 62 (33,0) | 5 (23,8) | 0,393 | ||||
| Características del episodio | ||||||||||
| Alteración del lenguaje | 122 (61,9) | 8 (61,5) | 0,978 | 114 (60,6) | 15 (71,4) | 0,335 | ||||
| Déficit motor | 106 (54,1) | 9 (69,2) | 0,288 | 101 (53,7) | 13 (65,0) | 0,335 | ||||
| Territorio vertebrobasilar | 15 (7,6) | 1 (7,7) | 0,603 | 15 (8,0) | 1 (4,8) | 1 | ||||
| Duración de los síntomas a | 0,75 (0,25-3,25) | 0,25 (0,08-2,00) | 0,116 | 0,75 (0,25-4,00) | 0,25 (0,15-2,00) | 0,075 b | ||||
| Episodio único | 147 (74,6) | 7 (53,8) | 0,101 | 141 (75,0) | 12 (57,1) | 0,080 b | ||||
| Etiología | ||||||||||
| Etiología aterotrombótico | 19 (9,6) | 5 (38,5) | 0,002 | 15 (8,0) | 9 (42,9) | <0,001 | ||||
| Etiología cardioembólico | 39 (19,8) | 3 (23,1) | 0,726 | 40 (21,3) | 3 (14,3) | 0,578 | ||||
| Etiología indeterminada | 99 (50,3) | 4 (30,8) | 0,253 | 98 (52,1) | 5 (23,8) | 0,020 | ||||
| Etiología lacunar | 24 (12,2) | 1 (7,7) | 11 | 22 (11,7) | 2 (9,5) | 1 | ||||
| Etiología inhabitual | 13 (6,6) | 0 (0) | 1 | 12 (6,4) | 1 (4,8) | 1 | ||||
| Escala de ABCD>5 | 29 (14,7) | 2 (15,4) | 0,948 | 29 (15,4) | 2 (9,5) | 0,746 | ||||
| Escala de ABCD2>5 | 94 (47,7) | 7 (53,8) | 0,668 | 45 (23,9) | 6 (28,6) | 0,639 | ||||
| EIC c | 5 (2,8) | 4 (36,4) | <0,001 | 5 (2,9) | 4 (44,4) | 0,004 | ||||
| Características de neuroimagen | ||||||||||
| Lesiones isquémicas crónicas en TC | 51 (25,9) | 3 (23,1) | 1 | 50 (26,6) | 6 (28,6) | 0,846 | ||||
| Lesiones isquémicas crónicas en RM | 106 (60,6) | 1 (25,0) | 0,304 | 103 (61,7) | 6 (50) | 0,288 | ||||
| Lesiones agudas en DF d | 77 (43,5) | 3 (75,0) | 0,210 | 74 (43,8) | 6 (50,0) | 0,675 | ||||
ABCD: age, blood pressure, clinical features, duration ‘edad, presión sanguínea, características clínicas, duración’; DE: desviación estándar; DF: difusión; EIC: estenosis intracraneal; RM: resonancia magnética; TC: tomografía computarizada.
a Mediana (rango intercuartílico).
b No significativo después del ajuste de Bonferroni.
c Sobre un total de 192 sujetos.
d Sobre un total de 181 sujetos.
Las puntuaciones elevadas en la escala ABCD y en la escala ABCD2 no se relacionaron con mayor riesgo de recurrencia.
El estudio multivariante mediante regresión de Cox identificó la presencia de EIC como único predictor independiente para la recurrencia de ictus dentro de la primera semana de seguimiento (razón de riesgos [RR] de 23,29; IC del 95%: 5,80 a 93,47; p< 0,001), mientras que la etiología aterotrombótica (RR de 7,16; IC del 95%: 3,01 a 17,04; p< 0,001) se erigió como único predictor independiente de recurrencia de ictus a los 90 días.
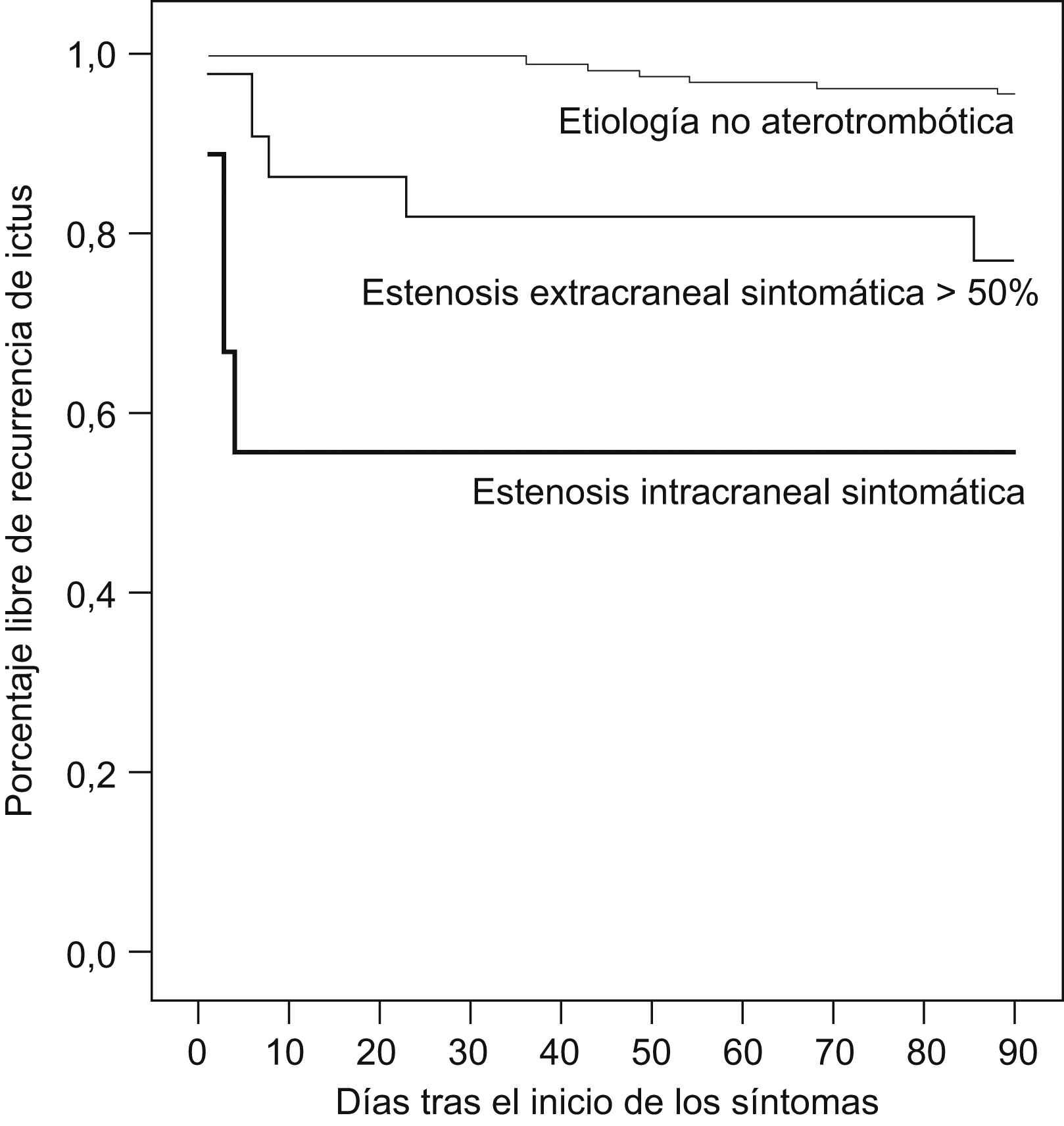
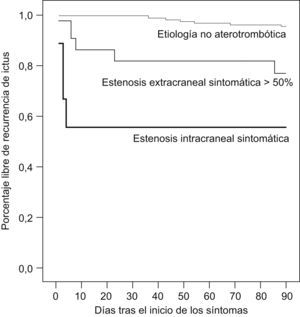
Las curvas de supervivencia Kaplan-Meier que se muestran en la figura 1 ponen de manifiesto el peor pronóstico de los pacientes con AIT y con EIC o EEC superior al 50%, aunque hay diferencias en el patrón de recurrencia entre los pacientes con EIC y los pacientes con enfermedad ateromatosa carotídea. La cohorte de pacientes con EIC tuvo 4 infartos cerebrales, todos éstos dentro de los primeros 7 días de seguimiento, mientras que entre los pacientes con EEC superior al 50%, uno tuvo un infarto cerebral dentro de la primera semana y otro más allá de los primeros 7 días de evolución. Tres recurrencias fueron en forma de AIT.
Figura 1. Curvas de supervivencia. El modelo Kaplan-Meier visualiza la recurrencia precoz de los pacientes con estenosis extracraneal (EEC) superior al 50% y, especialmente, los pacientes con estenosis intracraneal (EIC) sintomática. Hay una diferencia estadísticamente significativa entre la proporción de pacientes con EEC superior al 50% o con EIC libres de recurrencia de ictus y la de los pacientes de etiología no aterotrombótica (p<0,001; test Log-Rank).
DiscusiónEn el presente trabajo se estudió la evolución y el resultado de las exploraciones complementarias realizadas en una cohorte de pacientes con AIT atendidos por un neurólogo durante las primeras 48h tras el inicio de los síntomas.
De acuerdo con la bibliografía previa, se observó una peor evolución de los pacientes con etiología ateromatosa7,8,19,20,29. Además, aquellos pacientes con EIC sintomática se comportaron de forma más agresiva8,30. Todos estos datos justifican plenamente la realización precoz de un estudio ultrasonográfico tanto de troncos supraórticos como transcraneal8.
De forma global, el riesgo de recurrencia a los 2 y a los 7 días de esta serie es similar a los referidos en un reciente metaanálisis5; sin embargo, el riesgo de recurrencia de infarto cerebral isquémico sí es inferior a lo esperado por la literatura médica9,10,31,32. Este hecho podría justificarse por el inicio precoz de tratamientos combinados con antiagregantes y estatinas14,33 en altas dosis en los casos de EEC superior al 50% junto con la realización de tratamientos de revascularización en los casos de EEC superior al 70%. Como consecuencia de estos tratamientos, se evitó la recurrencia de infarto cerebral en todos los casos de estenosis crítica carotídea, no así en los casos de oclusión carotídea y EIC en los que las recurrencias fueron muy precoces. Esta situación podría poner en duda el enfoque terapéutico actual sobre las EIC basado en medidas farmacológicas como la antiagregación, las estatinas y los inhibidores del eje renina angiotensiva34,35,36. Teniendo en cuenta la gran intensidad observada, se podría plantear el beneficio de los tratamientos revascularizantes precoces37.
En muchos centros como éste, un especialista en Neurología no realiza la primera evaluación del paciente con un déficit neurológico. Asumiendo la heterogeneidad en la evolución de los pacientes con AIT7 y la dificultad diagnóstica del propio AIT38,39, resulta atrayente la selección de los pacientes basada en fáciles variables clínicas: la escala ABCD y la escala ABCD217,18,40. En esta cohorte, como en trabajos realizados con series españolas6,7, no se ha observado una relación entre los valores elevados de la escala ABCD y la escala ABCD2 y el mayor riesgo de recurrencia precoz. Este hecho podría justificarse por el diseño del estudio. Las escalas antes citadas se desarrollaron a partir de los datos obtenidos en estudios poblacionales en los que la valoración del paciente no se realizó por parte de un experto en el campo neurovascular. En cambio, un neurólogo experto ha examinado en esta serie a todos los pacientes y se han excluido los pacientes con clínica neurológica transitoria de dudoso origen isquémico.
A diferencia de otros trabajos20,21,22,23,24,25, no se han observado diferencias significativas entre la presencia de lesiones en las secuencias de DF y la evolución de los pacientes. Este hecho está en clara relación con el perfil temporal de las recurrencias. En la mayoría de los casos recurrentes no se pudo realizar una RM antes de la recurrencia. En investigaciones futuras es imprescindible realizar la RM dentro de las primeras horas de evolución de los síntomas. Pese a esto, sí se ha detectado una mayor capacidad de detectar lesiones isquémicas crónicas respecto a la TC, especialmente en los sujetos con enfermedad aterosclerótica.
La clasificación etiológica del estudio TOAST está pensada para pacientes con un infarto cerebral establecido26. En pacientes con episodios neurológicos, la clasificación del subtipo lacunar es dificultosa, por lo que comparativamente con los pacientes con un déficit establecido hay más sujetos clasificados como con etiologías indeterminadas41. Para disminuir el porcentaje de episodios indeterminados es importante estudiar la rentabilidad de las exploraciones cardiológicas. Entre los pacientes con AIT hay un número no despreciable de nuevos diagnósticos de fuente cardioembólica, especialmente de fibrilación auricular: un 10%. La mayoría de los nuevos diagnósticos se consiguen a través del ECG basal, mientras que el rendimiento de la monitorización del ECG y del ecocardiograma transtorácico es menor. Estos datos son similares a los publicados en un reciente metaanálisis42. El rendimiento se podría mejorar mediante la ampliación del tiempo de monitorización o con la simple repetición del ECG43,44. Igualmente, el estudio sistemático del arco aórtico podría incrementar los casos de fuentes de embolia ateroarterial.
Los resultados de este estudio son extrapolables. La edad media es similar a la reflejada en un reciente metaanálisis de Giles et al, mientras que el perfil de los factores de riesgo vascular es similar al de otras series publicadas5.
La principal limitación de este estudio es el tamaño muestral. Una mayor selección de pacientes permitiría estudiar mejor a los pacientes en función de su etiología, especialmente a los pacientes con EIC. Igualmente, un mayor número de pacientes podría establecer los factores predictores de recurrencia en función de la etiología de los episodios. Por otro lado, la demora en la realización de la RM con secuencias de DF no ha permitido extraer conclusiones sobre el papel predictivo de la aparición de lesiones agudas.
En resumen, el perfil de recurrencia tras un AIT condiciona las exploraciones complementarias por realizar. La recurrencia precoz justifica la realización urgente de exploraciones ultrasonográficas tanto intracraneales como extracraneales. Igualmente, la práctica de un ECG basal tiene mucha importancia en la detección de nuevas fuentes cardioembólicas. Son necesarios estudios más extensos para establecer el papel pronóstico de la realización de secuencias de DF y la mejor manera de aumentar el rendimiento del estudio cardiológico.
Conflicto de interesesLos autores no tienen ningún conflicto de intereses.