Identificar el patrón de utilización del carbón activado como tratamiento de las intoxicaciones, evaluar la prevalencia y la gravedad de sus reacciones adversas y definir los factores de riesgo asociados a su presentación.
Pacientes y métodoEstudio prospectivo y observacional realizado en urgencias durante un período de 7 años. Inclusión de pacientes que recibieron carbón activado como método de descontaminación digestiva. Se han investigado variables epidemiológicas, toxicológicas, terapéuticas y evolutivas. La variable dependiente fue la aparición de efectos secundarios relacionados con el uso del carbón activado.
ResultadosSe incluyó a 575 pacientes. La media (desviación estándar) de edad fue de 37,8 años (14,8) y el 65,7% fueron mujeres. El carbón se administró por vía oral al 88% de los pacientes y por sonda gástrica tras el lavado al 12% de los pacientes. El 2,4% de los casos había recibido carbón antes de su llegada al hospital. Se presentaron reacciones adversas en 41 casos (7,1%), en forma de náuseas o vómitos (36 pacientes), broncoaspiración (6 pacientes) y neumonía (2 pacientes). La presencia de vómitos espontáneos antes de dar el carbón (p<0,001), la administración prehospitalaria de carbón (p<0,05) o en dosis repetidas (p<0,01) y la necesidad de tratamiento sintomático del intoxicado (p<0,05) resultaron factores de riesgo independientes para la presentación de reacciones adversas al carbón, mientras que la edad superior o igual a 40 años (p<0,05) y haberse intoxicado con benzodiacepinas (p<0,01) se asociaron de forma independiente a una menor presentación de reacciones adversas. La estancia media en urgencias fue de 10,2h (18,6), y se prolongó de forma significativa (p<0,05) en los pacientes que presentaron reacciones adversas. El 75,4% de los casos se dio de alta a su domicilio, el 20,5% requirió ingreso psiquiátrico y el 3,9% ingresó por las consecuencias clínicas de la intoxicación. La prevalencia de ingreso en hospitalización convencional médica o en la unidad de cuidados intensivos fue mayor en los pacientes que presentaron reacciones adversas. No se registró ningún fallecimiento.
ConclusionesLas reacciones adversas al carbón son poco frecuentes y excepcionalmente graves, pero se asocian a una mayor estancia en urgencias e ingreso hospitalario. Son factores predisponentes los vómitos previos y la administración de dosis repetidas de carbón, mientras que son factores protectores la edad superior o igual a 40 años y la ingesta de benzodiacepinas.
To identify the pattern of use of activated charcoal in the treatment of poisonings, and to evaluate the prevalence and severity of adverse reactions and define the risk factors associated with them.
Patients and methodObservational, prospective 7-year study. Patients receiving activated charcoal for gut decontamination were included. Epidemiological, toxicological, therapeutic and evolutionary variables were studied. The dependent variable was the appearance of secondary effects related to the use of charcoal.
ResultsA total of 575 patients were included. The mean age was 37.8 (14.8) years and 65.7% were women. Activated charcoal was administered orally in 88% of the patients and by gastric tube after lavage in 12%, and 2.4% of patients received charcoal before hospital arrival. Adverse reactions occurred in 41 cases (7.1%) and included nausea or vomiting (36 patients), bronchoaspiration (6 patients) and pneumonia (2 patients). Spontaneous vomiting before administration of charcoal (p<0.001), pre-hospital administration of charcoal (p<0.05), repeated doses (p<0.01) and the need for symptomatic measures to treat intoxicated patients (p<0.05) were independent risk factors for adverse reactions, whereas age ≥40 years (p<0.05) and intoxication with benzodiazepines (p<0.01) were independently associated with a smaller risk of adverse reactions. The mean emergency department stay was 10.2 (18.6) hours, and was significantly longer (p<0.05) in patients suffering adverse reactions. A total of 75.4% of patients were discharged to home, 20.5% required psychiatric admission and 3.9% were admitted due to the clinical consequences of the poisoning. The prevalence of non-psychiatric admission to general hospital or intensive care was greater in patients suffering adverse reactions. No patient died.
ConclusionsAdverse reactions to charcoal are infrequent and rarely severe, but are associated with a greater emergency department stay and a trend to greater hospital admission. Predisposing factors are vomiting before administration of charcoal and administration of repeated doses. Age ≥40 years and ingestion of benzodiazepines are protective factors.
Las intoxicaciones agudas constituyen un motivo habitual de consulta en los servicios de urgencias (SU), y los medicamentos, el alcohol etílico y otras drogas de abuso son los agentes implicados con mayor frecuencia1,2.
La terapéutica de estos intoxicados se basa en el tratamiento de los signos, los síntomas y las alteraciones biológicas que el paciente pueda presentar, medidas para reducir la absorción del tóxico, antídotos y procedimientos que aumentan la eliminación del tóxico3. En la práctica clínica, las medidas sintomáticas y las que tratan de evitar la absorción digestiva del tóxico son las que se aplican con mayor frecuencia. Con relación a estas últimas, se dispone de varias opciones, pero en los últimos años diversas sociedades científicas han avalado al carbón como el método prioritario de descontaminación digestiva, y lo han convertido en la medida más utilizada para las intoxicaciones agudas4.
Pero la utilización del carbón no está exenta de efectos secundarios; los más frecuentes son las náuseas y los vómitos, que se han asociado ocasionalmente a complicaciones respiratorias que han llegado incluso a causar la muerte5. Sin embargo, no existen estudios amplios de la utilización del carbón en el ámbito de urgencias. Como objetivos del presente trabajo se plantearon la descripción del patrón de utilización del carbón en las intoxicaciones agudas, la evaluación de la frecuencia, la gravedad y las consecuencias de las reacciones adversas asociadas a su administración y, finalmente, la identificación de los factores de riesgo de su presentación.
Pacientes y métodoEstudio prospectivo y observacional realizado en el SU del Hospital Clínic de Barcelona. La recogida de datos se inició el 1 de diciembre de 2001 y finalizó el 30 de mayo de 2008. Se incluyó a los pacientes visitados uno de cada 3 días con representación equitativa de todos los días de la semana. Los días se escogieron en función de la disponibilidad de los investigadores. En total se evaluaron 823 días, durante los que se incluyó a los pacientes con diagnóstico de intoxicación aguda y a los que se les administró carbón activado.
Se diseñó una hoja para la recogida de datos que incluía variables epidemiológicas (sexo y edad), toxicológicas (tóxicos, número de pastillas y de principios activos en caso de ingesta medicamentosa), terapéuticas (medidas de descontaminación digestiva, tratamiento sintomático, antídotos y descontaminación prehospitalaria), tiempos asistenciales (ingesta-llegada al SU, llegada al SU-inicio de asistencia, llegada al SU-administración de carbón y horas de estancia en el SU), indicación correcta o incorrecta del carbón activado según los criterios de calidad CALITOX-2006 y destino final del paciente6. Todas estas variables se consideraron independientes.
Se definió como variable dependiente la presentación de efectos secundarios debidos al uso del carbón. Se consideraron efectos secundarios las náuseas o los vómitos aparecidos tras la administración del carbón así como la presentación de diarreas que el paciente no tuviese previamente y que no coincidiesen con la administración de un catártico. También se consideró un efecto secundario la aparición de carbón en el esputo o en las secreciones bronquiales, lo que se definió como una broncoaspiración. En estos casos se investigó también si aparecía una imagen de condensación pulmonar en la radiografía de tórax que no existiera previamente (neumonía). Se evaluó también la posible aparición de síntomas oculares inducidos por salpicaduras de carbón.
La administración de carbón está protocolizada en nuestro Hospital según una guía clínica descrita y publicada previamente7. Cuando se considera indicado, el carbón se administra por vía oral si el paciente está consciente, y si presenta una disminución de consciencia se administra por sonda tras realizar el lavado gástrico. La dosis estándar es de 25g de carbón, que solo se repite si el paciente ha ingerido más de 25g de producto tóxico, si la intoxicación es grave o si el tóxico tiene recirculación enterohepática. En todos los casos se utilizó un preparado (carbón ultra adsorbente Lainco®) que contiene 25g de carbón en polvo para suspensión extemporánea con glicerina, goma acacia, ácido cítrico y otros excipientes en cantidad suficiente para completar 30,8g.
A cada paciente se le asignó un código que solo conocía el investigador principal, y los resultados obtenidos se introdujeron en una base de datos SPSS versión 15.0 para su explotación estadística. Las variables cuantitativas se expresan como media con su desviación estándar o mediana con su intervalo y las cualitativas se expresan como número total de acontecimientos y porcentaje. La comparación entre variables cualitativas se ha hecho mediante el test de la ji al cuadrado o, en las tablas de 2×2, con el test exacto de Fisher cuando el número de efectivos calculados fue inferior a 5. Las variables cuantitativas se compararon mediante la t de Student o, alternativamente, mediante el test no paramétrico de la U de Mann-Whitney si se vulneraba el principio de normalidad, el que se comprobó mediante el test de Kolmogorov-Smirnov. Como posibles factores predictivos de las reacciones adversas al carbón, se estudió de forma univariante su asociación a la edad y al sexo del paciente, al tipo de tóxico, al número de fármacos diferentes o de pastillas implicadas en la intoxicación, al nivel de consciencia, a la presencia de vómitos previos a la administración del carbón, al uso prehospitalario del carbón, a la administración del carbón por vía oral o por sonda y a las dosis repetidas o no de carbón. Las variables en las que se obtuvo una relación significativa con la presentación de reacciones adversas se introdujeron en el análisis multivariante mediante una regresión logística. Se expresó el grado de asociación mediante la odds ratio con su intervalo de confianza del 95%. El nivel de significación estadística se estableció en una p<0,05 o cuando el intervalo de confianza del 95% excluía el valor uno.
ResultadosSe incluyó a 575 pacientes que recibieron carbón activado. Esta cifra representa el 35% de las intoxicaciones atendidas durante el mismo período de tiempo. Las características epidemiológicas de los pacientes y los principios activos implicados en las intoxicaciones se muestran en la tabla 1. Hubo 550 intoxicaciones medicamentosas puras (95,7%), es decir, no acompañadas de productos domésticos u otros, pero 115 de ellas (20,9%) se acompañaron de bebidas alcohólicas, y la alcoholemia media (desviación estándar) en los casos en que se determinó fue de 1,6g/l (1,3). En las intoxicaciones medicamentosas hubo hasta 97 combinaciones diferentes de principios activos, las más frecuentes fueron la ingesta exclusiva de benzodiacepinas (226 casos), benzodiacepinas e inhibidores de la recaptación de serotonina (43 casos), benzodiacepinas y neurolépticos (30 casos), neurolépticos solos (30 casos), inhibidores de la recaptación de serotonina solos (11 casos) y benzodiacepinas y antidepresivos cíclicos (10 casos). En las ingestas medicamentosas, el número medio de principios activos fue de 1,8 (1,2) con un intervalo entre 1–9, y en cuanto al número de pastillas ingeridas por cada paciente, la media fue de 32,1 (33,2) y la mediana de 21.
Características de los pacientes y de los tóxicos de esta serie (n=575)
| Edad media (DE), años | 37,8 (14,8) |
| Sexo, n (%) | |
| Mujer | 378 (65,7) |
| Varón | 196 (34,1) |
| Transexual | 1 (0,2) |
| Tipo de intoxicación, n (%) | |
| Medicamentosa aguda pura | 435 (75,7) |
| Medicamentosa acompañada del consumo de bebidas alcohólicas | 115 (20,9) |
| Medicamentosa acompañada del consumo de otras drogas de abuso | 11 (1,9) |
| Medicamentosa acompañada de productos no medicamentosos | 3 (0,5) |
| No medicamentosa | 11 (1,9) |
| Principios activos más frecuentemente implicados, n (%) | |
| Medicamentos | |
| Benzodiacepinas | 384 (66,8) |
| Neurolépticos | 93 (16,2) |
| Inhibidores selectivos de recaptación de serotonina | 90 (15,7) |
| AINE | 44 (7,7) |
| Antidepresivos cíclicos | 42 (7,3) |
| Paracetamol | 34 (5,9) |
| Aspirina | 14 (2,4) |
| No medicamentos | |
| Cocaína | 10 (1,7) |
| Cannabis | 3 (0,5) |
| Setas hepatotóxicas | 3 (0,5) |
| Setas nefrotóxicas | 2 (0,3) |
| Anfetaminas y derivados | 2 (0,3) |
| Insecticida piretroide | 1 (0,2) |
| Naftalina | 1 (0,2) |
| Número de comprimidos ingeridos, media (DE) | 32,1 (33,2) |
| Número de principios activos ingeridos, media (DE) | 1,8 (1,2) |
| Presencia de signos o síntomas a su llegada a urgencias, n (%) | |
| Cualquier signo o síntoma | 287 (49,9) |
| Alteración del nivel de consciencia | 185 (32,2) |
| Vómitos espontáneos | 33 (6,2) |
AINE: antiinflamatorio no esteroideo; DE: desviación estándar.
Respecto a la situación clínica, el 49,9% de los casos (287 pacientes) presentaba algún signo o síntoma derivado de la intoxicación aguda. El más frecuente fue la alteración del nivel de consciencia (Glasgow<15), presente en el 32,2% de los casos, aunque la puntuación media del Glasgow fue de 14,1 puntos (2,2) con un intervalo entre 3–15. Un 6,2% de los intoxicados presentó vómitos espontáneos, es decir, iniciados tras la ingesta del tóxico y previos a cualquier maniobra terapéutica.
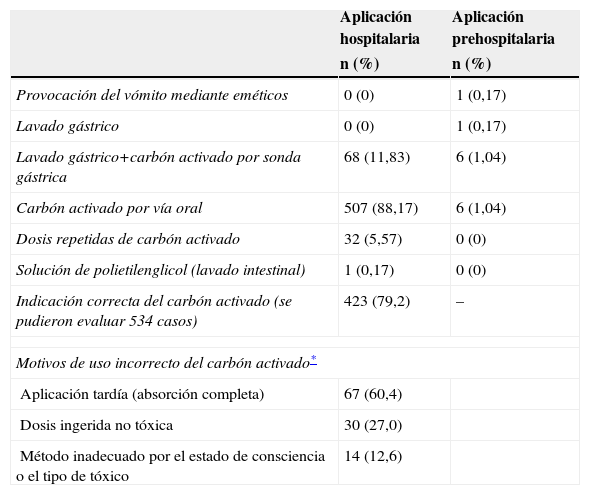
Las medidas terapéuticas utilizadas fueron sintomáticas e inespecíficas (hidratación intravenosa, antibióticos, inhibidores de la bomba de protones, sedantes, anticonvulsionantes, etc.), antidóticas (fundamentalmente flumazenilo o naloxona) y descontaminantes del tubo digestivo. Las primeras se aplicaron al 27,1% de los pacientes, y destaca la necesidad de practicar la intubación orotraqueal a 14 pacientes (2,4%). Los antídotos se administraron al 14% de los casos y las medidas de descontaminación digestiva al 100% de los casos (criterio de inclusión). El patrón de uso del carbón se muestra en la tabla 2. Tres pacientes rechazaron la toma del carbón por vía oral y hubo que colocar una sonda nasogástrica. Treinta y dos pacientes (5,6%) recibieron 2 o más dosis de carbón y un paciente, con una ingesta medicamentosa múltiple que incluía sales de litio, recibió también polietilenglicol para realizar un lavado intestinal. La utilización del carbón se consideró correcta en el 79,2% de los casos, y las causas de uso incorrecto se recogen también en la tabla 2, aunque solo se valoró la administración incorrecta de carbón por exceso, es decir, cuando se administró sin estar indicado, ya que el diseño del estudio no ha permitido valorar la incorrecta administración por defecto, o sea, los casos en los que estaba indicado el carbón y no se administró.
Patrón de uso del carbón activado y de otras medidas descontaminantes
| Aplicación hospitalaria | Aplicación prehospitalaria | |
| n (%) | n (%) | |
| Provocación del vómito mediante eméticos | 0 (0) | 1 (0,17) |
| Lavado gástrico | 0 (0) | 1 (0,17) |
| Lavado gástrico+carbón activado por sonda gástrica | 68 (11,83) | 6 (1,04) |
| Carbón activado por vía oral | 507 (88,17) | 6 (1,04) |
| Dosis repetidas de carbón activado | 32 (5,57) | 0 (0) |
| Solución de polietilenglicol (lavado intestinal) | 1 (0,17) | 0 (0) |
| Indicación correcta del carbón activado (se pudieron evaluar 534 casos) | 423 (79,2) | – |
| Motivos de uso incorrecto del carbón activado* | ||
| Aplicación tardía (absorción completa) | 67 (60,4) | |
| Dosis ingerida no tóxica | 30 (27,0) | |
| Método inadecuado por el estado de consciencia o el tipo de tóxico | 14 (12,6) | |
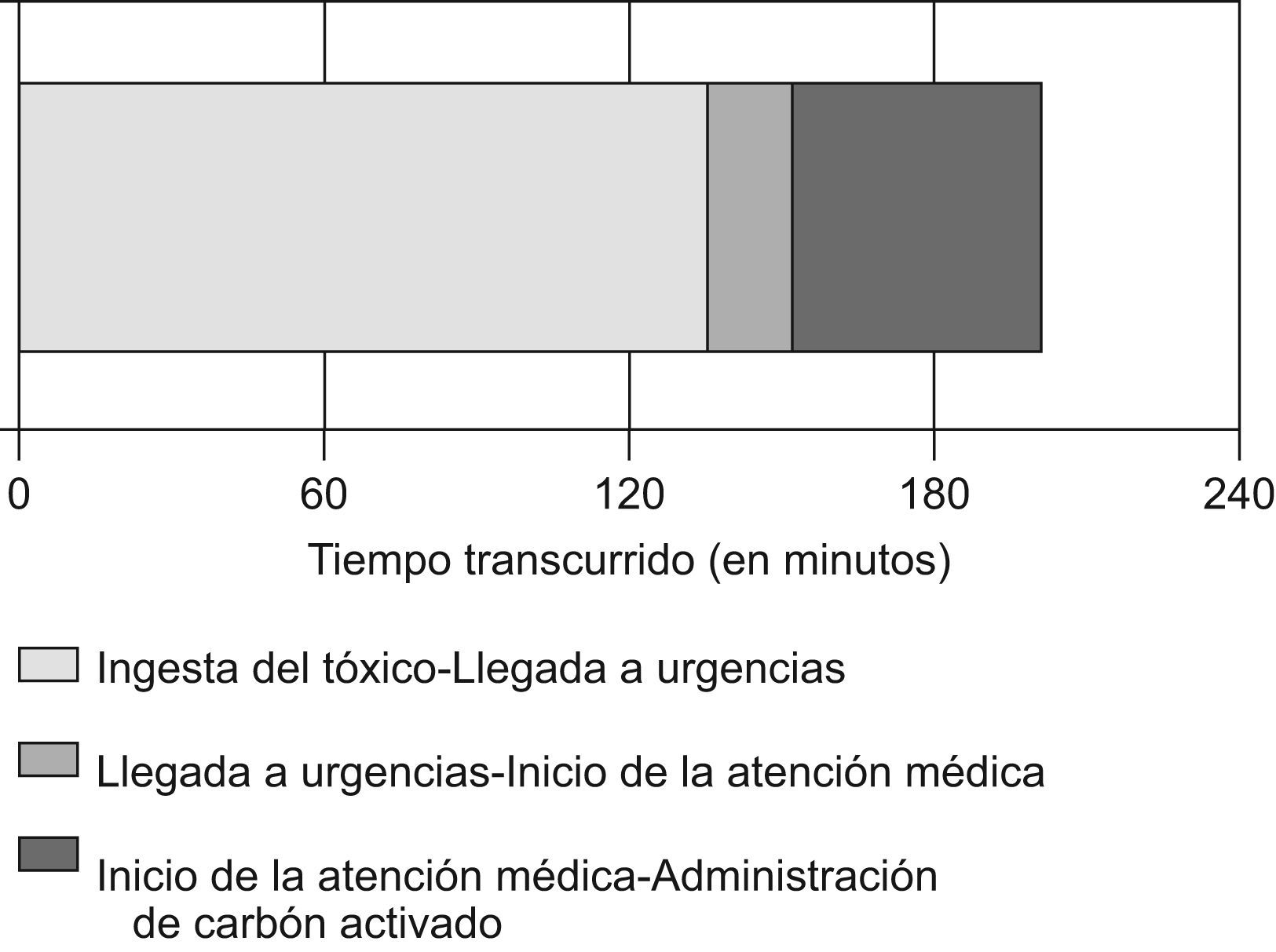
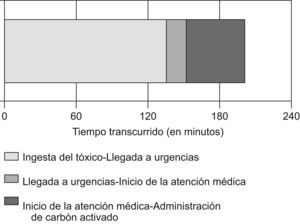
El tiempo medio transcurrido entre la ingesta del tóxico y la administración de carbón fue de 187min (325) con una mediana de 130min y un intervalo de 0–5,460min. El reparto de los tiempos asistenciales se presenta en la figura 1. Uno de los pacientes se intoxicó en el propio SU, lo que justifica que alguno de estos tiempos sea de 0min. En 37 de los 378 casos (9,8%) en los que se dispuso de este dato, el intervalo entre la ingesta y la administración de carbón fue inferior a los 60min recomendados por la European Association of Clinical Toxicologists y la American Academy of Clinical Toxicology y en 218 de los 479 casos (45,5%) la demora en la administración del carbón tras la llegada del paciente a urgencias fue inferior a 20min.
Presentaron reacciones adversas al carbón 41 pacientes (7,1%) (tabla 3). Treinta y seis intoxicados tuvieron náuseas o vómitos, 6 presentaron una aspiración bronquial y 2 desarrollaron una condensación pulmonar sin que hubiesen diferencias significativas en la incidencia de estas complicaciones entre la administración del carbón por vía oral o por sonda gástrica. A un paciente se le obturó la sonda por el carbón, por lo que se le retiró y se le colocó otra. Veintiséis pacientes (el 4,5% del total de la serie y el 63,4% de los que presentaron reacciones adversas) recibieron metoclopramida u ondansetrón por vía parenteral para el control de las náuseas o para evitar la repetición del vómito. No se observó ninguna oclusión intestinal por impactación del carbón. Ningún paciente presentó diarreas atribuibles al carbón ni refirió síntomas de queratoconjuntivitis potencialmente relacionables con salpicaduras oculares de carbón.
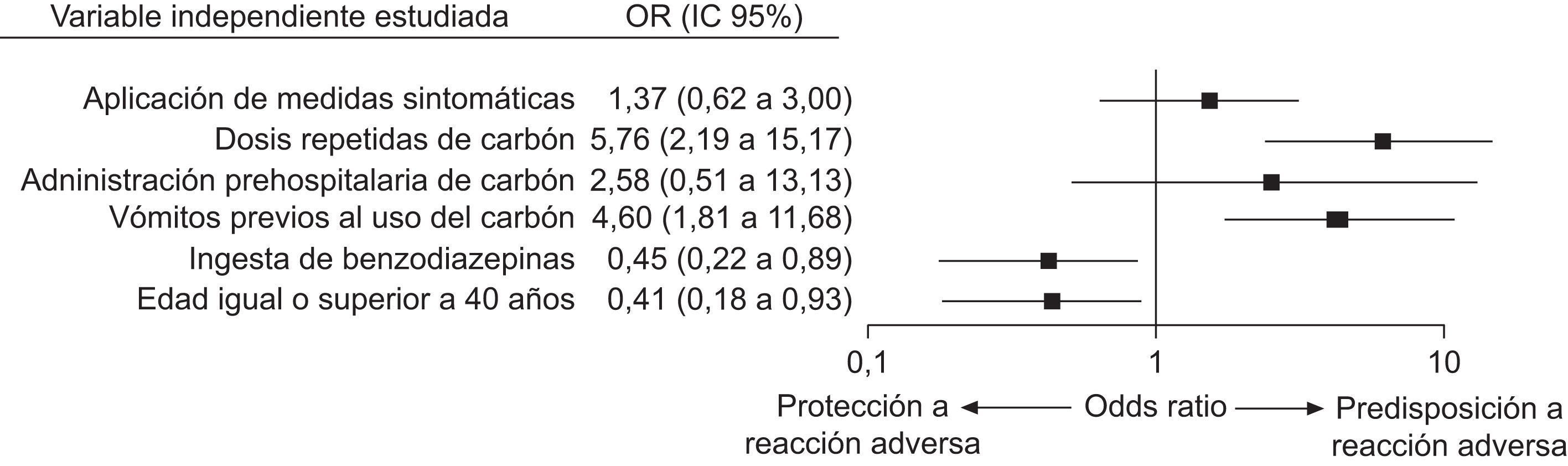
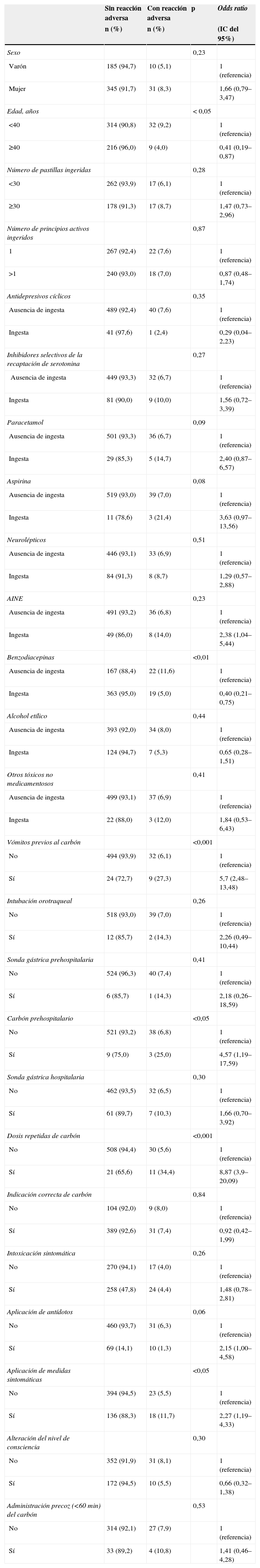
Se realizó un análisis univariante de los posibles factores asociados a la presentación de estas reacciones adversas al carbón (tabla 4). Se obtuvo una significación estadística como factor de riesgo con las siguientes variables: vómitos espontáneos previos a la administración del carbón, dosis repetidas, administración extrahospitalaria y aplicación de medidas sintomáticas; en cambio, actuaron como factores protectores la ingesta de benzodiacepinas y la edad igual o superior a 40 años. Cuando se analizaron estas 6 variables mediante una regresión logística se obtuvieron los resultados que se muestran en la figura 2. Como puede verse, los vómitos espontáneos previos al uso del carbón y la administración de dosis repetidas de carbón fueron factores de riesgo independientes, mientras que la ingesta de benzodiacepinas y la edad igual o superior a 40 años fueron factores protectores.
Análisis univariante de los factores asociados a la presentación de reacciones adversas por el carbón activado
| Sin reacción adversa | Con reacción adversa | p | Odds ratio | |
| n (%) | n (%) | (IC del 95%) | ||
| Sexo | 0,23 | |||
| Varón | 185 (94,7) | 10 (5,1) | 1 (referencia) | |
| Mujer | 345 (91,7) | 31 (8,3) | 1,66 (0,79–3,47) | |
| Edad, años | < 0,05 | |||
| <40 | 314 (90,8) | 32 (9,2) | 1 (referencia) | |
| ≥40 | 216 (96,0) | 9 (4,0) | 0,41 (0,19–0,87) | |
| Número de pastillas ingeridas | 0,28 | |||
| <30 | 262 (93,9) | 17 (6,1) | 1 (referencia) | |
| ≥30 | 178 (91,3) | 17 (8,7) | 1,47 (0,73–2,96) | |
| Número de principios activos ingeridos | 0,87 | |||
| 1 | 267 (92,4) | 22 (7,6) | 1 (referencia) | |
| >1 | 240 (93,0) | 18 (7,0) | 0,87 (0,48–1,74) | |
| Antidepresivos cíclicos | 0,35 | |||
| Ausencia de ingesta | 489 (92,4) | 40 (7,6) | 1 (referencia) | |
| Ingesta | 41 (97,6) | 1 (2,4) | 0,29 (0,04–2,23) | |
| Inhibidores selectivos de la recaptación de serotonina | 0,27 | |||
| Ausencia de ingesta | 449 (93,3) | 32 (6,7) | 1 (referencia) | |
| Ingesta | 81 (90,0) | 9 (10,0) | 1,56 (0,72–3,39) | |
| Paracetamol | 0,09 | |||
| Ausencia de ingesta | 501 (93,3) | 36 (6,7) | 1 (referencia) | |
| Ingesta | 29 (85,3) | 5 (14,7) | 2,40 (0,87–6,57) | |
| Aspirina | 0,08 | |||
| Ausencia de ingesta | 519 (93,0) | 39 (7,0) | 1 (referencia) | |
| Ingesta | 11 (78,6) | 3 (21,4) | 3,63 (0,97–13,56) | |
| Neurolépticos | 0,51 | |||
| Ausencia de ingesta | 446 (93,1) | 33 (6,9) | 1 (referencia) | |
| Ingesta | 84 (91,3) | 8 (8,7) | 1,29 (0,57–2,88) | |
| AINE | 0,23 | |||
| Ausencia de ingesta | 491 (93,2) | 36 (6,8) | 1 (referencia) | |
| Ingesta | 49 (86,0) | 8 (14,0) | 2,38 (1,04–5,44) | |
| Benzodiacepinas | <0,01 | |||
| Ausencia de ingesta | 167 (88,4) | 22 (11,6) | 1 (referencia) | |
| Ingesta | 363 (95,0) | 19 (5,0) | 0,40 (0,21–0,75) | |
| Alcohol etílico | 0,44 | |||
| Ausencia de ingesta | 393 (92,0) | 34 (8,0) | 1 (referencia) | |
| Ingesta | 124 (94,7) | 7 (5,3) | 0,65 (0,28–1,51) | |
| Otros tóxicos no medicamentosos | 0,41 | |||
| Ausencia de ingesta | 499 (93,1) | 37 (6,9) | 1 (referencia) | |
| Ingesta | 22 (88,0) | 3 (12,0) | 1,84 (0,53–6,43) | |
| Vómitos previos al carbón | <0,001 | |||
| No | 494 (93,9) | 32 (6,1) | 1 (referencia) | |
| Sí | 24 (72,7) | 9 (27,3) | 5,7 (2,48–13,48) | |
| Intubación orotraqueal | 0,26 | |||
| No | 518 (93,0) | 39 (7,0) | 1 (referencia) | |
| Sí | 12 (85,7) | 2 (14,3) | 2,26 (0,49–10,44) | |
| Sonda gástrica prehospitalaria | 0,41 | |||
| No | 524 (96,3) | 40 (7,4) | 1 (referencia) | |
| Sí | 6 (85,7) | 1 (14,3) | 2,18 (0,26–18,59) | |
| Carbón prehospitalario | <0,05 | |||
| No | 521 (93,2) | 38 (6,8) | 1 (referencia) | |
| Sí | 9 (75,0) | 3 (25,0) | 4,57 (1,19–17,59) | |
| Sonda gástrica hospitalaria | 0,30 | |||
| No | 462 (93,5) | 32 (6,5) | 1 (referencia) | |
| Sí | 61 (89,7) | 7 (10,3) | 1,66 (0,70–3,92) | |
| Dosis repetidas de carbón | <0,001 | |||
| No | 508 (94,4) | 30 (5,6) | 1 (referencia) | |
| Sí | 21 (65,6) | 11 (34,4) | 8,87 (3,9–20,09) | |
| Indicación correcta de carbón | 0,84 | |||
| No | 104 (92,0) | 9 (8,0) | 1 (referencia) | |
| Sí | 389 (92,6) | 31 (7,4) | 0,92 (0,42–1,99) | |
| Intoxicación sintomática | 0,26 | |||
| No | 270 (94,1) | 17 (4,0) | 1 (referencia) | |
| Sí | 258 (47,8) | 24 (4,4) | 1,48 (0,78–2,81) | |
| Aplicación de antídotos | 0,06 | |||
| No | 460 (93,7) | 31 (6,3) | 1 (referencia) | |
| Sí | 69 (14,1) | 10 (1,3) | 2,15 (1,00–4,58) | |
| Aplicación de medidas sintomáticas | <0,05 | |||
| No | 394 (94,5) | 23 (5,5) | 1 (referencia) | |
| Sí | 136 (88,3) | 18 (11,7) | 2,27 (1,19–4,33) | |
| Alteración del nivel de consciencia | 0,30 | |||
| No | 352 (91,9) | 31 (8,1) | 1 (referencia) | |
| Sí | 172 (94,5) | 10 (5,5) | 0,66 (0,32–1,38) | |
| Administración precoz (<60min) del carbón | 0,53 | |||
| No | 314 (92,1) | 27 (7,9) | 1 (referencia) | |
| Sí | 33 (89,2) | 4 (10,8) | 1,41 (0,46–4,28) |
AINE: antiinflamatorio no esteroideo; IC: intervalo de confianza.
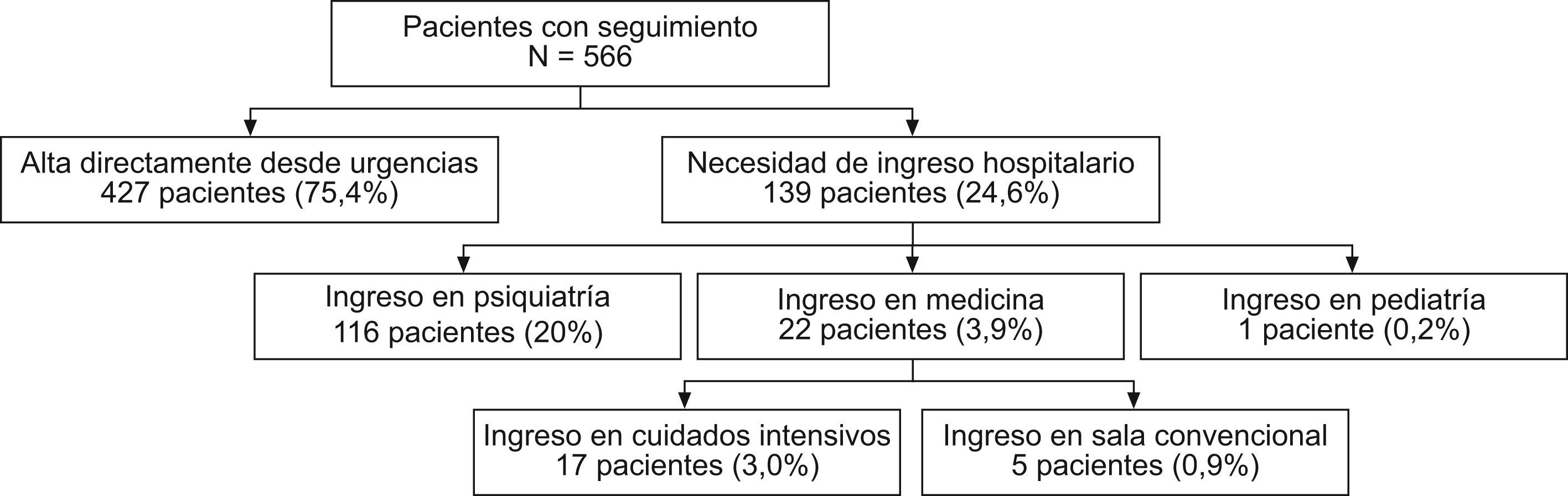
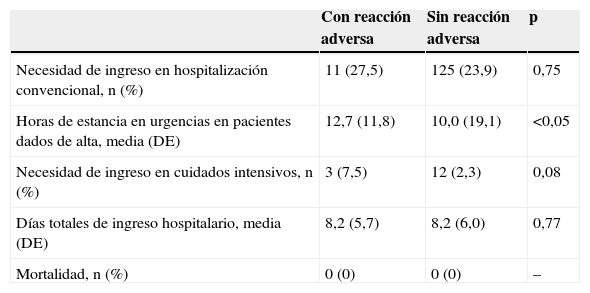
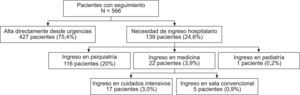
La evolución de los pacientes se muestra en la figura 3. El 75,4% de los intoxicados pudo darse de alta directamente desde urgencias sin precisar ingreso. El tiempo medio de estancia en el SU fue de 10,2h (18,6) (mediana de 5,4h) con un intervalo entre 1–248h, mientras que la duración de la estancia hospitalaria entre los 22 pacientes que requirieron ingreso médico fue de 8,2 días (5,5) (mediana de 6 días) con un intervalo entre 3–25 días. En los pacientes que presentaron reacciones adversas al carbón, la estancia en el SU fue significativamente más prolongada (p<0,05) y se observó una tendencia a una mayor necesidad de ingreso en salas convencionales o de cuidados intensivos (tabla 5). No se registró ningún fallecimiento.
Evolución de los pacientes en función de la presentación de reacciones adversas al carbón activado
| Con reacción adversa | Sin reacción adversa | p | |
| Necesidad de ingreso en hospitalización convencional, n (%) | 11 (27,5) | 125 (23,9) | 0,75 |
| Horas de estancia en urgencias en pacientes dados de alta, media (DE) | 12,7 (11,8) | 10,0 (19,1) | <0,05 |
| Necesidad de ingreso en cuidados intensivos, n (%) | 3 (7,5) | 12 (2,3) | 0,08 |
| Días totales de ingreso hospitalario, media (DE) | 8,2 (5,7) | 8,2 (6,0) | 0,77 |
| Mortalidad, n (%) | 0 (0) | 0 (0) | – |
DE: desviación estándar.
La evolución terapéutica en el campo de las intoxicaciones agudas tuvo un punto de inflexión a partir del año 1997 cuando las asociaciones europea y norteamericana de Toxicología empezaron a publicar unas guías clínicas sobre las indicaciones de la descontaminación digestiva y los métodos de elección, y que concluyeron en una clara dirección: por un lado, la reducción en las indicaciones de la descontaminación ante la falta de evidencia científica de su beneficio clínico y, por otro lado, la entronización del carbón como método preferente8–10.
El presente estudio muestra que el patrón de uso del carbón es fundamentalmente en las intoxicaciones medicamentosas y en particular por benzodiacepinas. Las consecuencias clínicas de estas intoxicaciones han sido fundamentalmente sobre el sistema nervioso central, de modo que casi un tercio de los pacientes presentaba una disminución del nivel de consciencia, hecho que se ha asociado a un riesgo elevado de broncoaspiración11,12.
El carbón se ha usado mayoritariamente por vía oral. Desde que diversos autores demostraron que el lavado gástrico no tiene una eficacia superior a la del carbón para frenar la absorción de tóxicos, la realización sistemática del lavado ha dejado de tener sentido, salvo para pacientes en coma o intoxicados por sustancias no adsorbibles por el carbón13,14. La sonda gástrica es incómoda para el paciente y su colocación se asocia a un riesgo de yatrogenia, ya sea por epistaxis, ubicación en la vía aérea o lesiones esofagogástricas, por lo que el carbón se recomienda, siempre que sea posible, por vía oral15. En este caso, su único inconveniente son sus características organolépticas, ya que su color negro, su sabor terroso y su consistencia de líquido espeso lo hacen poco apetitoso y genera dificultades para ser aceptado y deglutido. De hecho, 3 de los pacientes del estudio rechazaron la ingesta oral del carbón, por lo que se tuvo que colocar una sonda gástrica para su administración.
La dosis estándar de carbón que se usa en nuestro Hospital es de 25g. Las guías clínicas internacionales y la farmacopea norteamericana recomiendan entre 25–100g en adultos y 1g/kg en los niños, pero reconocen al mismo tiempo que falta evidencia científica sobre la dosis óptima16. Estas dosis no producen nunca estreñimiento, pero sí vómitos, especialmente si se asocian a un catártico, como el sorbitol17. En modelos experimentales, la relación carbón/tóxico que reduce significativamente (>50%) la absorción de fármacos oscila entre 4:1–8:1. Al hacer una extrapolación a la práctica clínica, si un paciente toma 30 comprimidos de diacepam de 5mg, equivalentes a 150mg, de 0,6–1,2g de carbón serían suficientes. Por tanto, una única dosis de 25g de carbón parece adecuada para la mayoría de las intoxicaciones que se presentan en los SU18.
Además del carbón, otros tratamientos se utilizaron con menor frecuencia en los pacientes de la presente serie, y consistieron fundamentalmente en medidas sintomáticas y antídotos. El flumazenilo y la naloxona son antídotos de fácil disponibilidad y uso muy prevalente en nuestro medio19. Cuando está indicada la descontaminación, el protocolo de administración de carbón en nuestro Hospital contempla el uso previo de estos antídotos en intoxicados con disminución de la consciencia y sospecha de ingesta benzodiacepínica o de opiáceos para, si se obtiene respuesta, prevenir las complicaciones de las reacciones adversas20.
Si tenemos en cuenta que todas las guías clínicas recomiendan que la descontaminación se realice dentro de los primeros 60min, los tiempos asistenciales relativos a la utilización del carbón en la presente serie generalmente se han prolongado, ya que ese intervalo solo se cumplió en el 6,4% de los pacientes21. Si se analiza en detalle, se observa que el tiempo medio que transcurrió desde la ingesta hasta la llegada al hospital fue de más de 2h. Por ello, la mayoría de los pacientes que llegaron al SU mediante un recurso extrahospitalario deberían haber recibido carbón antes de la llegada al Hospital, pero esto solo ocurrió en el 2,4% de los casos22.
Entre las posibles reacciones adversas al carbón, las más habituales son de tipo digestivo y en particular las náuseas y los vómitos, que pueden estar presentes entre un 7–56% de los casos en diversas series publicadas. En el presente trabajo, la incidencia se sitúa en el 7% y son mayoritariamente leves (náuseas y vómitos), por lo que puede considerarse como satisfactoria. Es posible que el usar dosis de solo 25g de carbón contribuya favorablemente a esto. Otras complicaciones que pueden presentarse al administrar carbón están muy relacionadas con el estado de consciencia y afectan directamente al aparato respiratorio, en forma de broncoaspiración, neumonía, bronquiolitis o empiema con una prevalencia que oscila en la literatura médica entre el 1,7–9,1% en pacientes estuporosos u obnubilados23–25. Los pacientes aquí presentados no han escapado tampoco a esta complicación (1%), en forma de broncoaspiración o neumonía, y aunque tuvieron en todos los casos una evolución favorable, es un motivo más para destacar la importancia de administrar carbón solo cuando está indicado26. Respecto a los factores asociados a la presentación de reacciones adversas, nuestro estudio ha definido como favorecedores a los vómitos previos y a la administración de dosis repetidas de carbón y, como protectores, la edad igual o superior a 40 años y la ingesta de benzodiacepinas. Por ello, puede deducirse que una intoxicación aguda en la que el paciente ya ha vomitado espontáneamente o se le administra más de una dosis de carbón tiene más probabilidades de presentar una reacción adversa, especialmente si es joven (menos de 40 años) y si no ha tomado benzodiacepinas. Si se dan todas estas circunstancias, parece razonable que se administre preventivamente un antiemético, y es de elección el ondansetrón por su eficacia ya contrastada para tratar las náuseas y los vómitos de las intoxicaciones y porque, además, se han descrito graves interacciones farmacológicas al administrar metoclopramida en algunas intoxicaciones27.
Se ha constatado una estancia significativamente mayor en el SU de aquellos pacientes que presentaron efectos adversos, pero solo se encontró una mayor tendencia, aunque no significativa, a la necesidad de ingreso en sala de hospitalización convencional o en la unidad de cuidados intensivos. En la literatura médica se encuentran muchas referencias de casos clínicos que precisan ingreso por complicaciones derivadas del uso del carbón28, pero solo se ha encontrado una serie que evalúe la repercusión global de estas reacciones adversas sobre la estancia en el SU o la necesidad de ingreso hospitalario y sin que sus autores encontrasen diferencias significativas29.
El presente trabajo tiene diversas limitaciones. Se trata de un estudio unicéntrico y sin un grupo control que no recibiese carbón, por lo que no ha podido excluirse que algunas manifestaciones clínicas aparentemente relacionadas con la administración del carbón fuesen en realidad consecuencias de la propia intoxicación. A pesar de esto, los resultados obtenidos permiten concluir que el uso hospitalario del carbón está bien asentado como tratamiento de las intoxicaciones agudas, pero hay una marcada ausencia de uso prehospitalario con la consiguiente reducción de su potencial efectividad. Los tiempos asistenciales son mejorables y la organización de los sistemas de triaje ha de tener en cuenta que en los intoxicados, a pesar de que muchos de ellos tienen a su ingreso pocas manifestaciones clínicas o de escasa gravedad aparente, hay que priorizar la asistencia para descontaminar el tubo digestivo con eficacia. Las reacciones adversas al carbón no son frecuentes ni suelen ser graves, pero deben extremarse las precauciones en pacientes que hayan vomitado previamente o si se administran dosis repetidas de carbón.
FinanciaciónEl Grupo de Investigación Consolidado «Urgencias: Procesos y Patologías» está reconocido y financiado por la Generalitat de Catalunya (2009 SGR 1385). El Dr. Òscar Miró ha disfrutado de una beca de intensificación investigadora del Instituto de Salud Carlos III durante el año 2009.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Trabajo galardonado con el Premio Lainco 2009 de Investigación en Toxicología Clínica.