A desertificação é reconhecida como uma das principais ameaças a zonas de clima seco em todo mundo. No Brasil, esse fenômeno tem atingido especialmente o bioma Caatinga, para o qual ainda existe pouca informação acerca de suas consequências na composição florística. O presente trabalho objetivou avaliar este efeito em sítios inseridos em três municípios da Paraíba (Nordeste, Brasil). Sítios de amostragem foram previamente selecionados por imagens de satélite usando a técnica IVDN, seguido de um levantamento vegetacional in locu (método transecto) abrangendo ambientes não-desertificados e desertificados. Análises univariadas (teste U) e multivariadas (nMDS) foram usadas a verificar diferenças nas variáveis vegetacionais e demonstrar padrões de dissimilaridades entre os ambientes contrastantes, respectivamente. A riqueza e diversidade de plantas diferiram significativamente entre os ambientes. O nMDS identificou três grupos de plantas: i) espécies associadas a áreas não-desertificadas (Anadenanthera columbrina, Bauhinia cheilantha e Tabebuia impetiginosa), ii) espécies relacionadas a áreas desertificadas (Aspidosperma pyrifolium, Jatropha molissima, Mimosa tenuiflorã e Pilosocereus gounellei) e iii) espécies presentes nos dois tipos de ambientes (Croton sonderianus, Piptadenia stipulacea e Poincianella pyramidalis). Os resultados apontaram que a desertificação desencadeou mudanças severas na composição florística da Caatinga, indicando também que as intervenções humanas foram determinantes no estabelecimento dos diferentes ambientes.
Desertification is recognized as the land degradation in arid, semiarid, and dry sub-humid zones, as a result from multiple anthropogenic impacts such as unsustainable natural resources management and land-use. In this context, the plant cover displays a crucial role due its capacity of soil protection against both terrestrial runoíFand high rates of rain infiltration. In Brazil, the desertification has reached mainly the Seasonally Dry Tropical Forest (STDF) biome, natively known as Caatinga, in which the major drivers are related to the historical severe deforestation and livestock expansion. In face of this alarming scenario, there is no or few information about direct effects driven by desertification, particularly those related to the floristic composition of aíFected areas or affected potentially areas. Herein, the aim was to assess the desertification eíFects on vegetation composition within three sites in the Brazilian semiarid zone. In order to ensure unbiased comparisons, the three sampling sites presented similar topographical, pedological and climate conditions, localized at distinctive municipality from Paraíba State, Northeastern region, Brazil. In each site, two contrasting situations were sampled, - desertified and non-desertified environments. These environments were previously selected though satellite images, using the NDVI technique, for identification of vegetation biomass level. In field, the floristic composition was surveyed by transect method, covering a patch of 50m x 4m delimitated with metric tape. In these perimeters, it was identified the specie and botanical family of each plant, richness (S) and abundance (N) of tree with DBH > 10 cm. Posteriorly, it was calculated the Shannon'sα diversity (H’) and Piellou's evenness (J’) by Primer β software (open access). Non-parametric univariate (U test) and multivariate (nMDS) analysis were performed to verify diíFerences in the vegetational variables (S, N, H’ and J’) and to demonstrate dissimilarities patterns (relative abundance) for the contrasting environments, respectively. In total, twenty-six plant species were identified, belonging to thirteen families. Of this set, seventeen species (65%) were exclusive of non-desertified areas and only two species were exclusive of desertified areas. U test showed that the both richness and diversity of plants species differed significantly between the two analyzed environments. Using a subset of 10 species most common in two environments, the nMDS discriminated three groups of plants: i) species associated to non-desertified areas (Anadenanthera columbrina, Bauhinia cheilantha and Tabebuia impetiginosa), ii) species related to desertified areas (Aspidosperma pyrifolium, Jatropha molissima, Mimosa tenuiflorã and Pilosocereusgouneleii) and iii) species with high density in both environments (Croton sonderianus, Piptadenia stipulacea e Poincianella pyramidalis). Dominant species in the non-desertified areas are restricted to the environments better preserved of Caatinga, which cannot to support strong degradation condition, whereas the species most common in the desertified areas are recognized as pioneer for the biome. Occurring to the two environments, such species harbors high capacity of settlement to the either impacted or preserved environments coupled to a strong resistance and resilience to disturbance (e.g. log and burn). Finally, the results obtained pointed out that the desertification triggered pervasive changes on the vegetational components (richness and diversity) and floristic composition of the Caatinga biome, suggesting also that human-induced disturbances were determinants to the establishment of the diíFerent environments.
Terras de clima seco em todo o mundo vêm sofrendo um progressivo processo de degradação ambiental, o qual, principalmente a partir da década de 1970, passou a ser conhecido internacionalmente como desertificaçáo. Por definiçáo formal, este tipo de degradação ocorre exclusivamente nas zonas de clima árido, semiárido e subúmido seco, em função das variações climáticas e das atividades humanas, atingindo os solos, os recursos hídricos, a vegetação, a biodiversidade e a qualidade de vida da população (CCD, 1995).
Atualmente, os dados conhecidos sobre a desertificaçáo revelam a gravidade desse problema já que, entre outras características (Roxo, 2006):
- -
afeta direta e indiretamente mais de 1 bilhão de pessoas;
- -
mais de 100 países sofrem com esse processo;
- -
são perdidos cerca de seis milhões de hectares de terra arável e produtiva todos os anos em função desse tipo de degradação;
- -
cerca de 1/4 da superfície terrestre sofre de degradação e erosão dos solos advindas da desertificaçáo;
- -
o solo arável por pessoa diminuiu de 0.32ha, em 1961-1962, para 0.21ha em 1997-1999, esperando que diminua para 0.16ha em 2030.
O Brasil tem acompanhado as discussões mundiais sobre a questão da desertificaçáo desde o seu início, sendo um dos países signatários da Convenção Internacional de Combate à Desertificaçáo e à Seca, em 1994. Mesmo assim, somente em 2004 concluiu o seu Programa de Ação Nacional de Combate à Desertificaçáo e Mitigação dos Efeitos da Seca/PAN-Brasil.
Em relação à distribuição desse tipo de degradação no país, o Ministério do Meio Ambiente (MMA) elaborou no ano 2004 um mapeamento das áreas susceptíveis à desertificaçáo (ASDs), servindo este de base para o desenvolvimento de Políticas Públicas que tenham o objetivo de combater o processo onde ele exista, assim como evitar a sua ocorrência em áreas ainda não atingidas. As ações desse programa governamental estão concentradas nas zonas de clima semiárido e subúmido seco da região Nordeste do país e uma pequena parte do norte do estado de Minas Gerais, na região Sudeste, onde domina o Bioma Caatinga (classificada internacionalmente como um tipo de Floresta Tropical Sazonalmente Seca — STDF, conforme Oliveira Filho et al., 2006; Pennington et al., 2000; Prado, 2000), além do noroeste do estado do Espírito Santo (região Sudeste), perfazendo uma superfície total de 1 338.076 km2, onde vivem 31 663 671 pessoas, em 1 482 municípios (BRASIL, 2004).
Apesar do quadro alarmante descrito anteriormente, como um reflexo da falta de conhecimento sobre a estrutura e funcionamento da Caatinga (Pinheiro et al., 2013), um quadro real sobre o quanto foi alterado desse bioma até o momento ainda não foi definido (Castelletti et al., 2005).
Levando em consideração a hipótese de que na Caatinga tivéssemos antes da colonização européia florestas secas bem mais desenvolvidas em quantidade e diversidade, comparando ao que temos dominando atualmente (Coimbra-Filho e Câmara, 1996), pensando em ações efetivas para a recuperação desses ambientes, tornase fundamental comparar as áreas relativamente bem preservadas ainda existentes com as que foram perturbadas, para que se possa detectar se houve mudanças na composição das espécies vegetais, como já foi identificado em outras florestas secas no mundo (Murphy e Lugo, 1986; Gentry, 1995; Medina, 1995) e, a partir daí, desenvolver ações melhor orientadas.
Apesar da insuficiência de dados mais precisos, Sá et al. (2004) destacam o Estado da Paraíba como aquele que apresenta os mais graves problemas gerados pela desertificaçáo no Brasil, tendo como causa principal as modificações seculares que vem atingindo as comunidades vegetais relacionadas ao Bioma Caatinga. Padrões similares são encontrados em outras regiões de clima seco do mundo, apresentando como consequência a perda de cobertura e riqueza nas comunidades de plantas (Hanafi e Ouled-Belgacen, 2006; Whitford, 1995), afetando também os solos com a diminuição da proteção contra o escoamento, redução na infiltraçáo e nutrição bioquímica (Papanastasis et al., 2003). Em se tratando da Paraíba, o desmatamento excessivo que vem ocorrendo na Caatinga é ainda mais preocupante em função da riqueza vegetal existente ser muito pouco conhecida (Araújo et al., 2005).
Com base no exposto, o objetivo desse trabalho foi identificar e avaliar a composição de espécies vegetais na Caatinga em áreas náo-desertificadas e desertificadas, aspectos ainda carentes de muitas informações quando se trata das pesquisas desenvolvidas no Brasil sobre esse tipo de degradação.
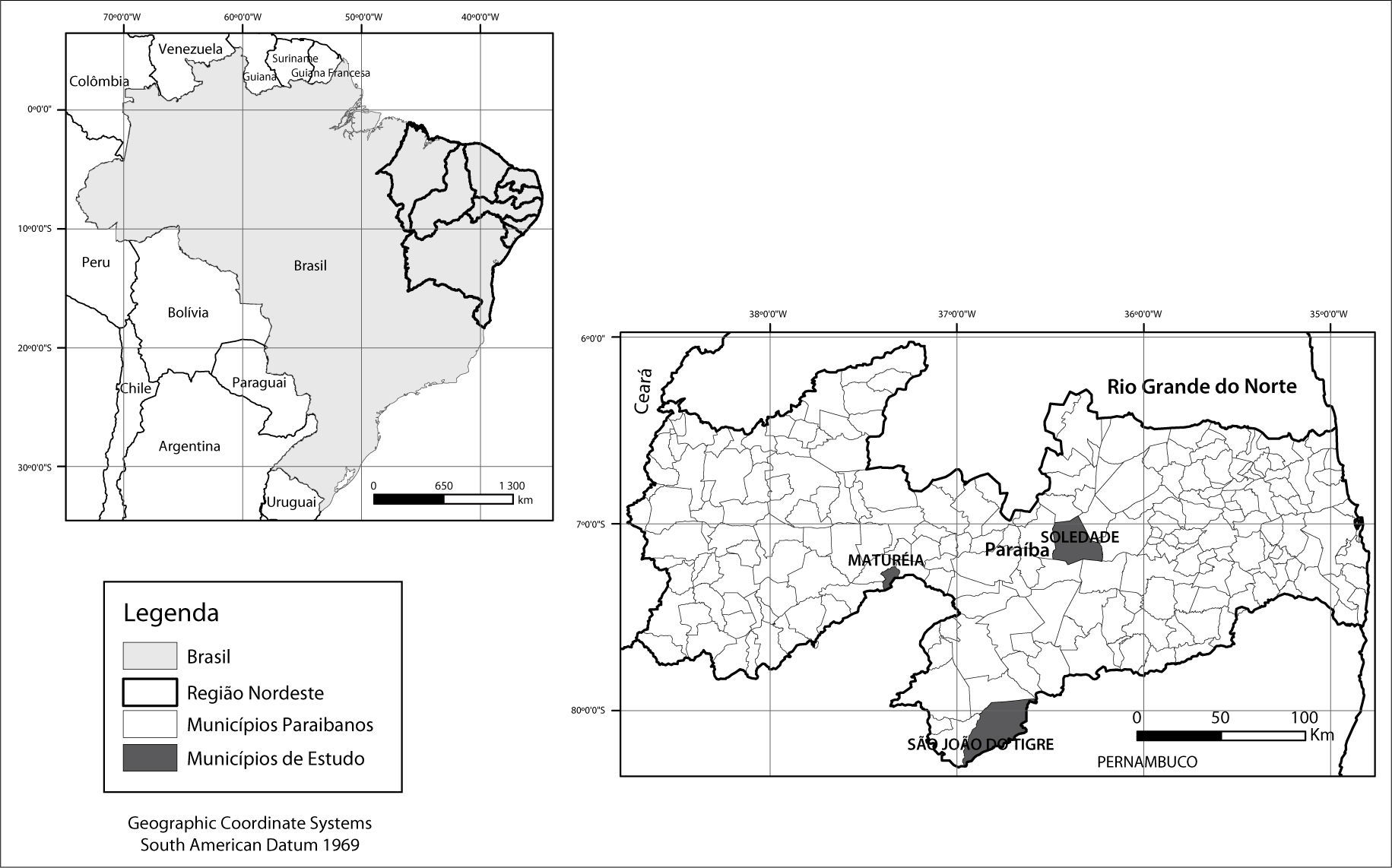
Materiais e métodosÁrea de estudo e critérios de seleçãoEsta pesquisa foi desenvolvida em áreas dos municípios de Maturéia, São João do Tigre e Soledade (Figura 1), localizados na parte semiárida da Paraíba.
Os critérios para seleção dos municípios e das áreas de estudo foram baseados nas características naturais dominantes e no uso e ocupação das terras.
As áreas amostradas estão inseridas em uma zona onde a pluviosidade média é de cerca de 600 mm/ano, com período chuvoso concentrado nos meses de fevereiro à maio, apresentando forte variação ao longo do tempo e do espaço. As temperaturas médias são de 27° C, o que torna o déficit hídrico presente a maior parte do ano. Os solos dominantes são do tipo Neossolo Regolítico, pouco profundos (menos de 1 m), arenosos, moderadamente ácidos, com boa reserva de minerais primários, baixos conteúdos de matéria orgânica e nitrogênio que decrescem com o uso (Cunha et al., 2010).
O uso e ocupação das terras nesses municípios, a exemplo do que domina nessa parte do Brasil, está fundamentado secularmente na agricultura (principalmente de subsistência), pecuária extensiva (particularmente caprina) e extrativismo vegetal (notadamente a produção de lenha e carvão vegetal), em propriedades que vem diminuindo de tamanho ao longo da história, devido as sucessivas divisões por questões de herança entre os familiares. Esse conjunto de fatores faz com que parte dos municípios analisados tenha seus territórios atingidos pela desertificaçáo, embora também apresentem algumas áreas com bons níveis de preservação da Caatinga e uso sustentável dos solos (Souza, 2011).
Vale ressaltar a importância das áreas analisadas estarem localizadas em municípios distantes entre si (mínimo de 130 km) o que, em termos de desenho amostral, evita efeitos negativos relacionados à pseudoreplicação e/ou autocorrelação espacial (Hurlbert, 1984; Legendre, 1993).
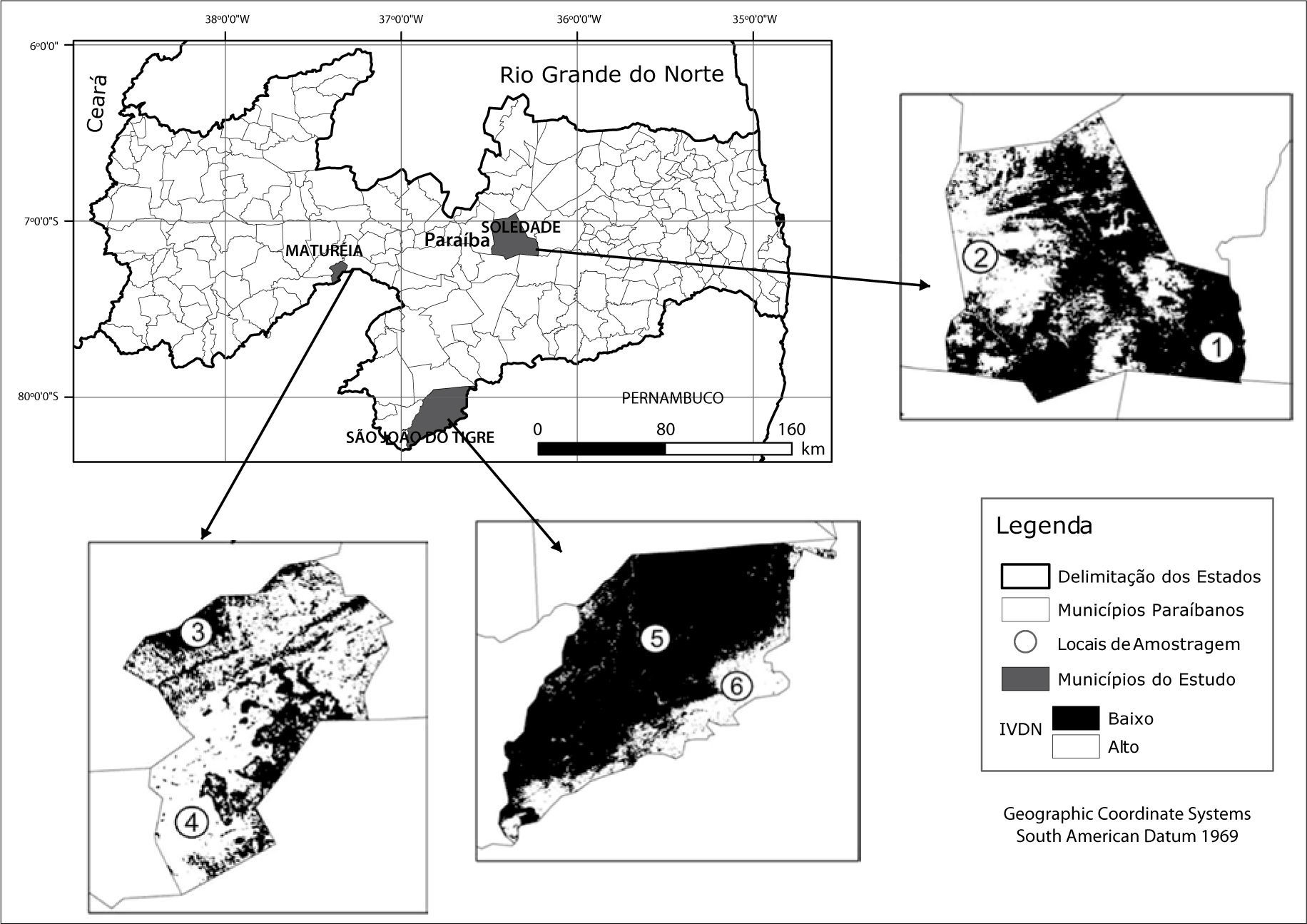
Em cada município foi selecionada como amostragem da situação encontrada uma condição de preservação e outra de degradação (chamadas aqui como “náo-desertificadas” e “desertificadas”). Essa distinção de ambientes foi baseada na maior ou menor densidade da cobertura vegetal, inicialmente a partir de observações em imagens de satélite. Para tanto, foram utilizadas imagens do satélite Land-sat5, disponibilizadas no site do Instituto Nacional de Pesquisas Espaciais (INPE). As datas das imagens foram 19/07/2007 para o município de São João do Tigre, 22/04/2010 para o município de Soledade e 28/08/2010 para o município de Maturéia, por serem períodos próximos ao ano de realização do trabalho (2011) e também pelo material disponível no site não apresentar cobertura de nuvens que pudesse comprometer a análise feita.
Para identificar as áreas com maior e menor densidade de cobertura vegetal, as imagens de satélite foram submetidas a uma análise de índices de vegetação, as quais são relacionadas a parâmetros biofísicos da cobertura vegetal, como biomassa e área foliar, optandose pelo Índice de Vegetação de Diferença Normalizada (NDVI), a mais frequentement utilizada nesses tipos de trabalho (Ponzoni e Shimabukuro, 2007). Para essa fase foi utilizado o software ARCGIS 10.2.
Também foi averiguado se nas áreas selecionadas as características de preservação e degradação estavam dessa forma há pelo menos 20 anos, com base em relatos da população que habitava o seu entorno. A adoção desse procedimento procurou assim seguir o que a CCD (1995) define como degradação da terra, onde uma das questões cruciais diz respeito à série temporal da aquisição de dados, evitando assim a categorização de uma paisagem dita como desertificada baseada somente em uma situação momentânea.
Coleta dos dadosO levantamento florístico foi realizado ao longo do ano 2011, ocorrendo nas áreas selecionadas através de transectos, com dimensões de 50m x 4m, delimitados por fita métrica. Dentro do perímetro de cada transecto, foi quantificada a abundância (N) e riqueza (S) das espécies arbustivas e arbóreas com Diâmetro a Altura do Peito (DAP) maior ou igual a 10cm e identificadas suas respectivas famílias botânicas.
Tratamento e análise dos dadosCom base nas medidas de abundância e riqueza de plantas amostradas in situ, foram incorporadas duas variáveis da diversidade alfa: a diversidade de Shannon (H’) e a equitabilidade de Piellou (J’). Ambos os índices foram calculados pelo programa Primer versão β (http://primere.com). Para o índice de diversidade de Shannon, valores menores que 1 representam baixa diversidade, enquanto os maiores que 3 indicam elevada diversidade. Já o índice de equitabilidade abrange valores entre 0, onde temos uma comunidade dominada por algumas espécies, a 1, onde temos uma comunidade equitativa na proporção de espécies (Magurran, 2004).
Procedimentos não-paramétricos foram usados para veriflcar tanto diferenças quanto padrões de similaridades nas comunidades de plantas entre as áreas náo-desertiflcadas e desertiflcadas. Assim, testes de Mann-Whitney (testes U) foram realizados a fim de veriflcar diferenças nas médias das variáveis vegetacionais (N, S, H’ e J’) entre os dois ambientes (Zar, 1999). Em adição, um Escalonamento Multi-dimensional Não-Métrico (nMDS), através do coe-flciente de Bray-Curtis, foi aplicado para sumarizar a dimensionalidade dos dados e criar um diagrama 2D mostrando como as variáveis estão espacialmente agrupadas (Kruskal, 1964). A medida utilizada para essa análise foi a abundância relativa (N%) das espécies de plantas sob cada ambiente. Valores de stress obtidos pelo teste indicam graus de similaridades (ou dissimilaridades), com elevados índices mostrando comunidades sobrepostas, enquanto baixos valores indicam comunidades segregadas.
A fim de evitar ruídos estatísticos, foi feita uma seleção das espécies que melhor caracterizaram as comunidades de plantas das áreas náo-desertiflcadas e desertiflcadas, conforme orientam Legendre e Legendre (1998). Nesta seleção, espécies ocorrentes em apenas um município fora 2m excluídas. Assim, um subconjunto de dez espécies (≈ 74% do total amostrado) foi selecionado para análise de nMDS.
As análises estatísticas foram calculadas pelo software livre R (pacotes Stat e Ecodist), adotando nível de signiflcância (valor p) menor que 0.05 para rejeição da hipótese nula.
ResultadosO IVDN apontou diversas áreas com alto e baixo nível de biomassa, concebendoas, respectivamente, como equivalentes a ambientes náo-desertiflcados e desertiflcados. Com base nesse quadro geral e no reconhecimento dessas paisagens em campo, foram estabelecidas as áreas onde ocorreram os levantamentos de vegetação, conforme pode ser observado na Figura 2.
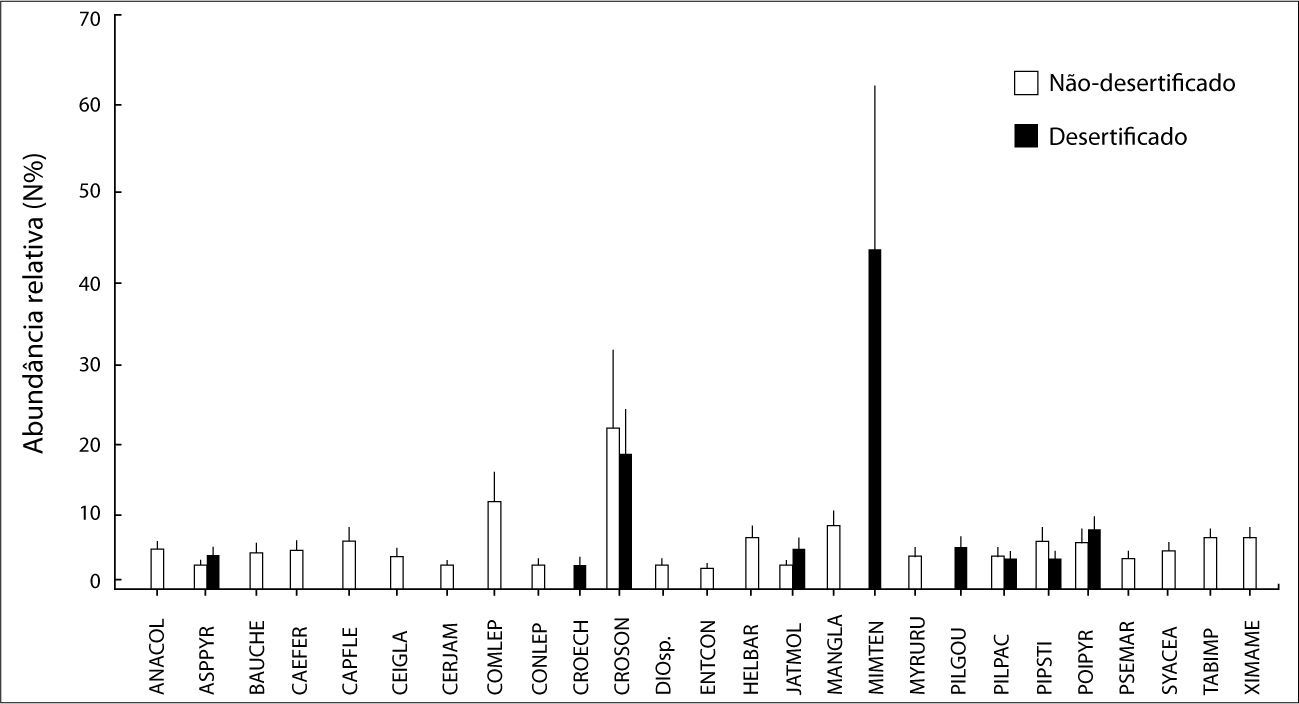
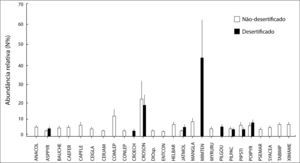
Considerando os dois ambientes em conjunto, foram identiflcadas 26 espécies de plantas, pertencentes a 13 famílias (Quadro 1). Deste número, 17 espécies (≈ 65%) foram exclusivas das áreas náo-desertiflcadas. Apenas duas espécies (Croton echioides e Pilosocereus gounellei) ocorreram exclusivamente nas áreas desertiflcadas. Nos dois ambientes as espécies mais abundantes foram Mimosa tenuiflora e Croton sonderianus (Figura 3), enquanto as famílias dominantes foram Fabaceae e Euphorbiaceae.
Lista de espécies de plantas com medidas de abundância absoluta e relativa (em parênteses) identificadas nos ambientes não-desertificados e desertificados, nos municípios analisados.
| Família/Espécie | Acrônimos | Ambientes Não-Desertificados: Abundância absoluta e relativa | Ambientes Desertificados: Abundância absoluta e relativa | ||||
|---|---|---|---|---|---|---|---|
| Maturéia | Soledade | São João do Tigre | Maturéia | Soledade | São João do Tigre | ||
| ANACARDIACEA | |||||||
| Myracroduon urundeuva Allemão | MYRURU | 1 (1.03) | 4 (4.82) | - | - | - | - |
| APOCYNACEAE | |||||||
| Aspidosperma pyrifolium Mart. | ASPPYR | - | 3 (3.61) | - | - | 4 (5.00) | 8 (21.05) |
| ARECACEAE | |||||||
| Syagrus cearenses Noblik | SYACEA | - | - | 4 (8.33) | - | - | - |
| BIGONONIACEAE | |||||||
| Tabebuia impetiginosa (Mart. ex DC) Standl. | TABIMP | 1 (1.03) | - | 8 (16.67) | - | - | - |
| BOMBACACEAE | |||||||
| Ceiba glaziovii (Kuntze) K. Schum. | CEIGLA | - | - | 3 (6.25) | - | - | - |
| Pseudobombax marginatum | PSEMAR | 1 (1.03) | 4 (4.82) | - | - | - | - |
| BURSERACEAE | |||||||
| Commiphora leptophloeos (Mart.) J. B. Gillett | CONLEP | 1 (1.03) | 1 (1.20) | - | - | - | - |
| CACTACEAE | |||||||
| Cereus jamaracu DC | CERJAM | 3 (3.09) | - | - | - | - | - |
| Pilosocereus gounellei (Weber) Byles & G. D. Rowley | PILGOU | - | - | - | - | 2 (2.50) | 4 (10.53) |
| Pilosocereus pachycladus F. Ritter | PILPAC | - | 3 (3.61) | - | - | - | 2 (5.26) |
| CAPPARACEAE | |||||||
| Capparis flexuosa (L.) L. | CAPFLE | 13 (13.40) | - | - | - | - | - |
| COMBRETACEAE | |||||||
| Combretum leprosum Mart. | COMLEP | 26 (26.80) | - | - | - | - | - |
| EUPHORBIACEAE | |||||||
| Croton echioides Baill. | CROECH | - | - | - | - | 3 (3.75) | - |
| Croton sonderianus Mull. Arg. | CROSON | 5 (5.15) | 47 (56.63) | 2 (4.17) | 1 (3.33) | 43 (53.75) | - |
| Jatropha molissima (Pohl) Baill. | JATMOL | 1 (1.03) | 1 (1.20) | - | - | 1 (1.25) | 4 (10.53) |
| Jatropha molissima (Pohl) Baill. | JATMOL | 1 (1.03) | 1 (1.20) | - | - | 1 (1.25) | 4 (10.53) |
| FABACEAE | |||||||
| Anadenanthera colubrina (Vell.) Brenam | ANACOL | 4 (4.12) | 2 (2.41) | 6 (12.50) | - | - | - |
| Bauhinia cheilantha (Bong.) Steud | BAUCHE | 10 (10.31) | - | 2 (4.17) | - | - | - |
| Caesalpinia ferrea Mart. ex Tul. | CAEFER | - | - | 4 (8.33) | - | - | - |
| Dioclea sp. | DIOsp. | 2 (2.06) | - | - | - | - | - |
| Enterolobium contortisiliquum (Vell.) Morong | ENTCON | - | - | 1 (2.08) | - | - | - |
| Mimosa tenuiflora (Wild.) Poir. | MIMTEN | - | - | - | 24 (80.00) | - | 20 (52.63) |
| Piptadenia stipulacea (Benth.) Ducke | PIPSTI | 7 (7.22) | 1 (1.20) | 3 (6.25) | 5 (16.67) | 1 (1.25) | - |
| Poincianella pyramidalis Tul | POIPYR | - | 3 (3.61) | 5 (10.42) | - | 26 (32.50) | - |
| MALVACEAE | |||||||
| Helicteres baruensis Jacq. | HELBAR | 15 (15.46) | - | - | - | - | - |
| OLACACEAE | |||||||
| Ximenia americana L. | XIMAME | - | - | 10 (20.83) | - | - | - |
| Total | 97 | 83 | 48 | 30 | 80 | 38 | |
Média (± Erro-Padrão) da abundância relativa (N%) das espécies de plantas registradas nos ambientes não-desertificados e desertificados. Acrônimos são descritos no Quadro 1.
Todas as variáveis vegetacionais mostraram maiores valores nos ambientes náo- desertificados (Quadro 2). Apesar de não significativa, a abundância de espécies de plantas apresentou um aumento de cerca de 35% no grupo não-desertificados. Quanto a equitabilidade, as comunidades de plantas dos ambientes não-desertificados indicaram uma distribuição relativamente homogênea, enquanto os desertificados tendenciaram a dominância de algumas espécies.
Teste U comparando os componentes da comunidade de plantas registradas nos dois ambientes. As variáveis são representadas como Média ± Erro-Padrão. Níveis p representam diferenças significativas.
| Variáveis | Ambientes | Teste U | ||
|---|---|---|---|---|
| Não-Desertificados | Desertificados | U | p | |
| Abundância (N) | 76.00 ± 14.57 | 49.33 ± 15.51 | 0 | 0,12 |
| Riqueza (S) | 13.00 ± 1.15 | 5.00 ± 1.15 | 1 | 0,04 |
| Diversidade (H’) | 1.99 ± 0.23 | 1.02 ± 0.21 | 1 | 0,04 |
| Equitabilidade (J’) | 0.78 ± 0.08 | 0.54 ± 0.10 | 0 | 0,12 |
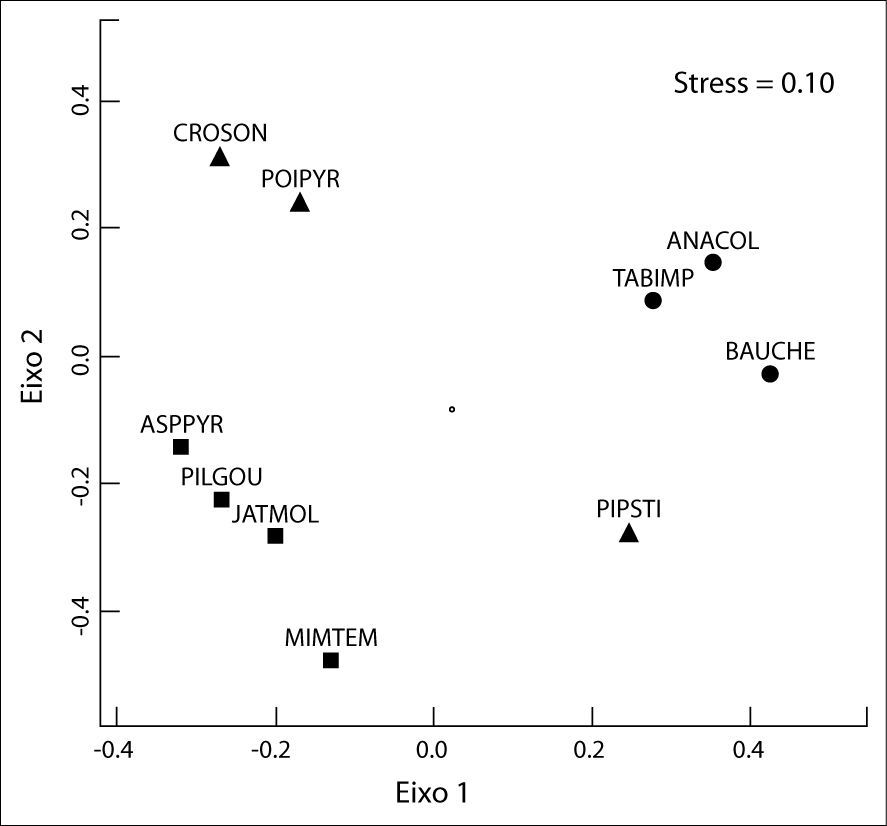
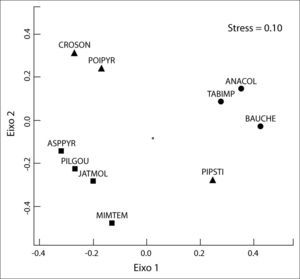
As variáveis que melhor representam a perda das características de uma comunidade (riqueza e diversidade) mostraram diferenças significativas entre os ambientes contrastantes. O grupo não-desertificado registrou mais que o dobro da riqueza de espécies em relação ao desertificado. Em adição, o índice de diversidade atingiu proporções similares à riqueza, quando comparados os dois ambientes. O nMDS registrou baixo valor de stress (0.10) mostrando que a composição de espécies de plantas difere substancialmente entre os ambientes estudados, como pode ser graficamente visualizado através do diagrama de ordenamento (Figura 4). Os dois primeiros eixos principais do nMDS identificaram três grupos de plantas. Escores positivos indicaram as espécies de plantas associadas a ambientes não-desertificados (Anadenanthera colubrina, Bauhinia. cheilantha e Tabebuia impetiginosa), enquanto que os escores negativos representaram as espécies relacionadas às áreas desertificadas (Aspidosperma pyrifolium, Jatropha molissima, Mimosa tenuiflora e Pilosocereus gounellei). Já o grupo das espécies que foram comuns aos dois ambientes ocupou um espaço mais abrangente, apresentando escores tantos positivos como negativos para os dois eixos (Croton sonderianus, Piptadenia stipulacea e Poincianella pyramidalis).
Escalonamento multidimensional não-métrico (nMDS) usando um subconjunto de dez espécies de plantas mais representativas dos ambientes não-desertificados (símbolo •), desertificados (símbolo
▪) e comuns aos dois ambientes (símbolo ▴). Acrônimos são descritos no Quadro 1.
A desertificaçáo é um processo que vem desencadeando sérias mudanças na estrutura de comunidades de plantas (Whitford, 1995), embora poucos trabalhos tenham avaliado em termos quantitativos e qualitativos essa questão, sobretudo no Brasil. Neste sentido, destacamos que a presença ou ausência de espécies pode ser uma ferramenta poderosa no que diz respeito aos bioindicadores de qualidade ambiental (Krogh et al., 2002). Além disso, o conhecimento das espécies colonizadoras de áreas antropizadas é uma ferramenta importante para orientar estratégias de reabilitação e recuperação das mesmas, assim como possibilitar avaliações quali-quantitativas de áreas em recuperação ambiental (Nappo et al., 2000; Tabarelli e Vicente, 2004)).
Em se tratando deste trabalho, as famílias dominantes para os dois ambientes analisados foram Fabaceae e Euphorbiaceae, o que corrobora com os antigos relatos de Cabrera e Willink (1973) e Sarmiento (1975) sobre a importância destas famílias nas formações xerófilas na América do Sul. No Brasil em específico, Fabaceae é considerada a família mais diversa na Caatinga (Cardoso e Queiroz, 2010).
Quanto às espécies, destacaramse a predo-minância daquelas consideradas pioneiras para o bioma Caatinga (Croton sonderianus, Mimosa tenuiflora, Combretum leprosum e Poincianella pyramidalis). Embora essas espécies tenham uma participação total bem menos acentuada nas áreas desertificadas, sua importância relativa nas áreas náo-desertificadas demonstra que também nesse ambiente ocorreu e possivelmente ainda vem ocorrendo algum tipo de alteração da vegetação, ainda que consideremos que nesse caso domine uma situação de avanço dos processos de sucessão ecológica, indicando boa recuperação desses ambientes, conforme também observado por Oliveira et al. (2009) em algumas áreas da região dos Cariris Velhos (Paraíba), próximas de onde foi realizado o presente trabalho.
A contribuição relativa das espécies pioneiras nas áreas desertificadas foi bem mais elevada que nas áreas náo-desertificadas, correspondendo a 76.35% do total das espécies identificadas, em função do nível de perturbação desse tipo de ambiente e do estágio sucessional inferior em que se encontram. Dessas espécies pioneiras, Croton sonderianus, Aspidosperma pyrifolium e Poincianella pyramidalis se destacam quanto ao número de indivíduos na maioria dos trabalhos de levantamento fitossociológico desenvolvidos em áreas de Caatinga (Sampaio, 1996), o que demonstra o quanto tem sido transformada a vegetação dessas terras em séculos de usos.
Quanto à riqueza de espécies de plantas, esta desempenha papel crucial na estrutura e processos ecossistêmicos, sobretudo nas zonas secas, como atuante na resistência e resiliência da desertificação (Maestre et al., 2002). No presente trabalho, a riqueza e diversidade de plantas dos ambientes náo-desertificados foi significativamente superior aos dos desertificados. Cabe ressaltar que as espécies Bauhinia cheilantha, Commiphora leptophloeos, Myracroduon urundeuva e Pseudobombax marginatum foram exclusivas das áreas não-desertificadas, o que possivelmente está relacionado ao fato destas não suportarem condições de forte degradação. Resultados similares foram encontrados nos trabalhos de Luna (1998), Pereira et al. (2003) e Andrade et al. (2005) em outras áreas semiáridas do Brasil, constatando uma variedade de espécies nativas da Caatinga expressivamente maior em locais preservados (ou de baixa pressão antrópica) quando comparada a ambientes sob forte intervenção humana.
Além dos trabalhos acima citados, merece destaque o estudo de Barbosa et al. (2007) em uma região próxima aos locais de amostragem desta pesquisa (Cariris Velhos). Os autores utilizaram um protocolo experimental semelhante, onde amostraram áreas sob intenso impacto antrópico e outras com relativa preservação. Na primeira situação, foram identificadas somente 26 espécies, com Poincianella pyramidalis ocupando a primeira posição em todos os parâmetros fitossociológicos, seguida de Croton sonderianus e Combretum leprosum. Em contrapartida, nas áreas preservadas foram registradas 67 espécies. Esses dados demonstram a elevada riqueza existente nos remanescentes de Caatinga melhor preservados da região, em contraste com a situação encontrada nos ambientes desertificados.
Similar à riqueza de espécies, o baixo valor na diversidade de Shannon encontrado nas áreas desertificadas em comparação ás áreas náo-desertificadas reflete o estado de degradação existente na primeira situação, o que também tem sido registrado em algumas áreas desertificadas distribuídas ao longo do globo, havendo melhoria desse padrão á medida que a pressão antrópica nas mesmas deixa de existir ou diminui (Kebin et al., 2004). Destacamos também que, como o índice de diversidade de Shannon é um balanço entre as medidas de abundância e riqueza (Magurran, 2004), a diferença registrada neste estudo pode ter sido inflada mais pela elevada variedade de espécies do que pelo número de indivíduos.
No caso da abundância, nenhuma diferença significativa foi vista, provavelmente porque a redução na competição interespecífica nos ambientes desertificados (ausência das espécies mais sensíveis) resulta em um fenômeno conhecido como “expansão de nicho” das espécies mais resistentes (Lister, 1976). Nesse estudo, essa expansão de nicho pode ter ocorrido para as espécies Aspidosperma pyrifolium, Croton sonderianus, Mimosa tenuiflora e Poincianella pyramidalis.
Quanto a equitabilidade, apesar de também não ter diferido, esta variável mostrou questões ecológicas interessantes. Nos locais preservados (não-desertificados) ocorreram poucas espécies com elevada abundância (Croton sonderianus, Combretum leprosum, Manihot glaziovii) e muitas espécies pouco abundantes (Ceiba glaziovii, Cereus jamaracu, Commiphora leptophloeos, Enterolobium contortisiliquum, Pilosocereus pachycladus). Já nos ambientes degradados, houve um aumento na amplitude das espécies muito ou relativamente abundantes (Aspidosperma pyrifolium, Croton sonderianus, Mimosa tenuiflora, Piptadenia stipulacea e Poincianella pyramidalis) e uma diminuição das espécies menos abundantes (Croton echioides e Pilosoceureus pachyladus). Dessa maneira, o padrão encontrado nas áreas não-desertificadas foi similar aos modelos de estrutura e dinâmica populacional em comunidades naturais bem preservadas (Magurran e Henderson, 2003).
Das dez espécies em destaque neste trabalho, foi constatada a elevada abundância de Anadenanthera columbrina, Bauhinia cheilantha e Tabebuia impetiginosa nas áreas não-desertificadas. Tal resultado foi corroborado parcialmente pelos levantamentos de Pereira et al. (2001), os quais constataram que tanto Bauhinia cheilantha como Tabebuia impetiginosa ocorreram apenas nas áreas moderadamente impactadas e nos remanescentes preservados da Caatinga na Paraíba. Uma vez que essas espécies são muito procuradas pela população para aproveitamento da sua madeira (Tabebuia impetiginosa), casca para uso no beneficiamento do couro (Anadenanthera columbrina) e como alimento para o gado (Anadenanthera columbrina e Bauhinia cheilantha), o fato de ainda serem encontrados diversos exemplares dessas espécies nessas áreas representa uma situação razoável de preservação das suas condições ambientais.
Apesar de Combretum leprosum ter ocorrido apenas em áreas náo-desertificadas, ela não entrou na análise do nMDS porque só foi registrada em um município (Maturéia). Sobre essa espécie, vários autores têm constatado sua densa cobertura sob locais impactados (e.g. Moreira et al., 2007; Costa et al., 2009), entretanto um recente estudo mostrou seu papel ecológico como facilitadora à colonização de outras espécies no Bioma Caatinga (Vieira et al., 2013). Levando em consideração essa observação, no presente trabalho o alto adensamento dessa espécie nas áreas náo-desertificadas, associada a coexistência de outras espécies mencionadas, pode corroborar com essa função ecológica em ambientes de baixa pressão antrópica.
Nas áreas desertificadas, por sua vez, a elevada abundância das espécies Aspidosperma pyrifolium, Jatropha molissima, Mimosa tenuiflora e Pilosocereus gounellei pode ser atribuída tanto pelo fato dessas espécies estarem entre as mais resistentes ás secas na região semiárida do Brasil (Silva et al., 2004) quanto, em relação as duas primeiras, por apresentarem algumas características que diminuem os impactos da pressão do uso pela população e pelos animais domésticos.
No caso de Aspidosperma pyrifolium, sua madeira não é considerada de boa qualidade para a construção de cercas ou produção de lenha e carvão, ao passo que, apresentando toxicidade para consumo de animais, em especial caprinos (Lima e Soto-Blanco, 2010), a ingestão das suas folhas somente ocorre quando estas caem no solo, perdendo essa característica, aspecto também existente em Jatropha molissima (Souza, 2008). No caso do elevado número de indivíduos de Mimosa tenuiflora, esse padrão já tem sido registrado em outras áreas antropizadas da Caatinga (Galindo et al., 2008; Pereira et al., 2003). Apesar dessa última espécie ser muito apreciada como alimento pelo gado, também apresenta toxicidade quando as suas folhas são consumidas em grande quantidade, sendo inclusive abortivas (Dantas et al., 2012), característica que inibe o seu uso excessivo pelos animais.
Comum aos dois tipos de ambientes, ocorreram Croton sonderianus, Piptadenia stipulacea e Poincianella pyramidallis, espécies pioneiras e de relativa resistência á antropização na Caatinga, o que faz com que colonizem ambientes submetidos a diferentes pressões antrópicas (Pereira et al., 2001). Neste sentido, ainda que as duas primeiras espécies sejam muito utilizadas pela população para a construção de cercas e produção de lenha, elas possuem alta capacidade de rebrota após submetidas a corte, destacandose assim nos dois tipos de situação (Sampaio et al., 1998).
Com base nos resultados obtidos podese afirmar que a distribuição espacial das plantas na Caatinga, para além dos fatores ecológicos, são grandemente dependentes das formas de uso dos solos nessas terras, onde muito da economia depende de uma agropecuária com bases rudimentares, da mesma maneira que ocorre em relação ao extrativismo vegetal. Particularmente em relação ao primeiro tipo de atividade, o corte seguido de queima da vegetação nativa para ceder espaço aos cultivos e ao gado é uma prática comum e centenária nesse Bioma (Sampaio e Salcedo, 1993). Nesse caso, dependendo da espécie, as diferentes respostas ao fogo são capazes de gerar mudanças na sua riqueza e diversidade, ao passo que algumas outras podem ser dizimadas nesse processo (Silva et al., 2005).
Outra questão importante observada nas áreas não-desertificadas e desertificadas analisadas nesse trabalho diz respeito a menor presença ou mesmo inexistência de caprinos nas primeiras, enquanto as segundas caracterizaramse pela presença desses animais, o que colabora decisivamente para o quadro encontrado nos dois tipos de ambientes. A prática da caprinocultura é uma atividade tradicional nessa parte do Brasil, influenciando de forma marcante a redução do crescimento, reprodução, diversidade vegetal e modificaçáo na estrutura da comunidade clímax em muitas áreas da Caatinga (Leal et al., 2005) bem como em outros biomas de climas secos existentes ao redor do globo (Coley, 1983; Krupnick et al., 1999; Lechemere-Oertel et al., 2005; Rosenthal e Kotanen, 1994).
Os caprinos são pouco seletivos em relação ás plantas que utilizam como alimento, fazendo uso de até 70% das espécies existentes na Caatinga, o que se torna potencializado por permanecerem junto a vegetação nativa consumindoa durante o ano inteiro (Araújo Filho et al., 1996, 1999a y b), só recebendo alimentação complementar nos casos de estiagens muito prolongadas.
Esses animais constituem importante fator de seleção natural, afetando principalmente arbustos e árvores perenifólias, como Ziziphus joazeiro e Spondias tuberosa, ou espécies decíduas com ciclo reprodutivo parcial ou completo na estação seca, como Comiphora leptophoeos e Myracroduon urundeuva, todas elas clímax na Caatinga. Além disso, ao darem preferência às folhas e brotos jovens, acabam influenciando negativamente o crescimento das espécies utilizadas, provocando muitas vezes o fenômeno de nanismo. De maneira semelhante, quando os caprinos consomem os frutos nativos, muitas sementes são totalmente trituradas, impedindo assim a germinação e reprodução das plantas (Leal et al., 2005).
Pelo exposto acima, a pecuária caprina, particularmente quando praticada com altas taxas de lotação em áreas de Caatinga e associadas a outras formas de pressão sobre a vegetação, tem o poder de empobrecer e reduzir o porte das plantas, levando à ocorrência da desertificaçáo (Leal et al., 2005), o que também já foi constatado em outras regiões semiáridas do mundo (e.g. Friedel et al., 2003; Li et al., 2006).
ConclusãoLevando em consideração que as observações feitas no presente trabalho compõem uma realidade cada vez mais presente nessa região do Brasil, os resultados encontrados revelaram uma relação estreita e dinâmica entre vegetação e uso das terras, a qual pode resultar no estabelecimento da desertificaçáo. Neste sentido, de forma geral, o trabalho constatou que a desertificaçáo desencadeou mudanças tanto nos componentes (riqueza e diversidade) quanto na composição florística da Caatinga. Destarte, a forma, a intensidade e o tempo de uso dessas terras, mediante as intervenções humanas, foram determinantes no estabelecimento das diferentes situações analisadas.