La creación de Grupos de Trabajo tanto a nivel nacional como internacional ha permitido históricamente gran parte del avance en el campo de la histocompatibilidad y el trasplante de órganos1.
La creación del Grupo Español de Trabajo en Histocompatibilidad e Inmunología del Trasplante (GETHIT) dentro de la Sociedad Española de Inmunología (SEI) se produjo durante el pasado Congreso Nacional de la SEI celebrado en Pamplona. Los primeros responsables del mismo fueron Manuel Muro Amador del Hospital Universitario Virgen de la Arrixaca de Murcia y Marcos López Hoyos del Hospital Universitario Marqués de Valdecilla de Santander, como vocales de la Junta Directiva y vinculados con el campo del trasplante.
Este informe recoge el resumen de la reunión anual del grupo GETHIT que se celebró el día 18 de junio de 2012 en la Facultad de Medicina de la Universidad Complutense de Madrid.
En esta reunión se expuso la estructura final del Grupo, las diferentes subcomisiones creadas, el reglamento del Grupo, las noticias más relevantes del mismo, así como un componente de estandarización de informes clínicos de alosensibilización HLA.
Estructura del Grupo Español de Trabajo en Histocompatibilidad e Inmunología del TrasplanteEn la reunión se informó del resultado de las encuestas recibidas durante todo el año de los diferentes miembros y su disponibilidad para formar parte del Grupo.
El Grupo quedó compuesto por 63 miembros pertenecientes a 40 centros. Se estableció una Junta Directiva provisional y cada miembro que lo solicitó entró a formar parte de diferentes subcomisiones creadas sobre temas concretos (polimorfismo HLA, aloanticuerpos, trasplante de progenitores hematopoyéticos, polimorfismos no HLA e inmunorregulación), siempre teniendo en cuenta que la creación de nuevas subcomisiones estará siempre abierta a cualquier tipo de ampliación propuesta por sus miembros.
Reglamento de funcionamiento del Grupo Español de Trabajo en Histocompatibilidad e Inmunología del TrasplanteEste documento se redacta como un conjunto de directrices para permitir un buen funcionamiento del grupo GETHIT, así como para proporcionar una guía para marcar objetivos y propuestas generales.
Ante cualquier divergencia con los miembros del Grupo prevalecerá este reglamento como elemento director del funcionamiento interno del mismo. El mantenimiento de este reglamento del Grupo lo realizará el secretario del grupo GETHIT.
¿Quién puede ser miembro?Cualquier persona implicada en el campo de la histocompatibilidad y el trasplante que solicite su inclusión dentro de este Grupo. El miembro incluido deberá proveer sus datos personales tales como dirección, correo electrónico, ámbito de trabajo y disponibilidad para formar parte de este Grupo y para que su nombre quede recogido en el directorio de miembros del Grupo.
¿Quién forma la Junta Directiva?Esta tomará la mayor parte de las directrices y propuestas que establezcan sus miembros como realmente importantes. La Junta Directiva provisional será votada como definitiva en el próximo congreso de la SEI que se celebrará en Salamanca. Estará formada por: A) Un presidente: elegido por votación de los miembros previa propuesta de candidatos. B) Un vicepresidente: elegido por votación de los miembros previa propuesta de candidatos. C) Un secretario: elegido por votación de los miembros previa propuesta de candidatos. D) 7 vocales: debería estar formado por, al menos, el coordinador de cada una de las subcomisiones de trabajo.
Cuando se produzcan cambios en el GETHIT la Coordinación intentará realizar una reunión para elegir a los nuevos miembros. A esta reunión se convocará tanto a los miembros salientes como a los entrantes del GETHIT. La Junta del GETHIT realizará tantas reuniones como sus miembros consideren necesarias. Estas reuniones se desarrollarán según el orden del día enviado por el secretario con 7días de antelación, permitiéndose modificaciones menores cuando los miembros lo crean conveniente. Al menos debe haber una reunión al año coincidiendo con el congreso de la SEI. En congresos de histocompatibilidad e inmunología del trasplante se podrán efectuar reuniones si existe una proporción significativa de la Coordinación del GETHIT. De estas reuniones serán informados todos los miembros del grupo.
Cada año, con un mes de anticipación al menos, se enviará a todos los socios la convocatoria de la Reunión o Asamblea General del GETHIT. La convocatoria se realizará también como noticia destacada en la página principal de la web de la SEI (www.inmunologia.org) y por correo electrónico a todos los miembros. El resto de resoluciones y debates se efectuarán mediante correo electrónico. Todo el reglamento queda sujeto al cumplimiento del propio reglamento de la Junta de la SEI al ser el GETHIT un grupo que emana de la misma Sociedad y que utiliza el soporte de la misma.
Dado que este reglamento se elabora con el objeto de lograr el buen funcionamiento de la Coordinación, de la Junta Directiva y del Grupo como tal, la experiencia de los mismos debe servir para ir mejorándolo. En consecuencia, en este apartado se harán constar las modificaciones que sobre el citado reglamento se vayan haciendo, así como una breve explicación del porqué de cada cambio efectuado.
Noticias del Grupo Español de Trabajo en Histocompatibilidad e Inmunología del TrasplanteSe informa en la reunión de la integración del grupo GETHIT de la SEI dentro de la Sociedad Española de Trasplante (SET). En el 2.° Congreso Nacional de la SET de este año celebrado en Madrid el grupo GETHIT, en representación de la SEI, fue invitado a establecer una sesión dentro de dicho congreso (Update en Inmunología), la cual fue celebrada con éxito y gran asistencia de congresistas.
Asimismo, se notifica la presentación de un miembro del Grupo (Marcos López Hoyos) a miembro de la Junta Directiva de la SET.
Se informa también de la nueva proposición del Real Decreto de Trasplantes, estableciendo una pequeña revisión y alegaciones.
Se informa de la proposición de objetivos de las diferentes subcomisiones. Como ejemplo se intentará definir un protocolo de trasplante de progenitores hematopoyéticos haploidéntico para la búsqueda del efecto injerto contra la leucemia. En este tema están trabajando José Luis Vicario, Rafael González, José Antonio Campillo y Rocío Álvarez.
Asimismo, se notifica la importancia de establecer criterios mínimos y protocolos de consenso para el trasplante renal de donante vivo.
Estandarización de informes clínicos de sensibilizaciónLa implementación de las nuevas tecnologías, tales como la tecnología Luminex®, y el análisis del antígeno aislado o Single Antigen (SA) ha generado un amplio conocimiento del campo de la sensibilización HLA como nunca antes se había producido2–5 pero, al mismo tiempo, genera una serie de problemáticas y una gran necesidad de estandarización entre los diferentes centros para que exista una homogenización entre los resultados, así como de la forma de emitir estos resultados a los servicios clínicos.
De esta manera cada laboratorio de histocompatibilidad peninsular realiza análisis de detección e identificación de anticuerpos de los pacientes en lista de espera de trasplante. Los informes emitidos por los diferentes centros son muy diversos a pesar de utilizar técnicas y métodos similares. Por ello, desde el grupo GETHIT creíamos interesante analizar la situación y diseñar un modelo de informe de consenso de sensibilización pre y/o postrasplante entre los diferentes laboratorios peninsulares.
Para ello se enviaron, por correo electrónico, a cada laboratorio encuestas con diferentes cuestiones relevantes a modo de informar sobre los resultados de la sensibilización HLA a los servicios clínicos, así como la petición del envío de informes anónimos por parte de los miembros que realizan estas determinaciones. De todo este material se han obtenido los resultados y datos interesantes que se comentan a continuación.
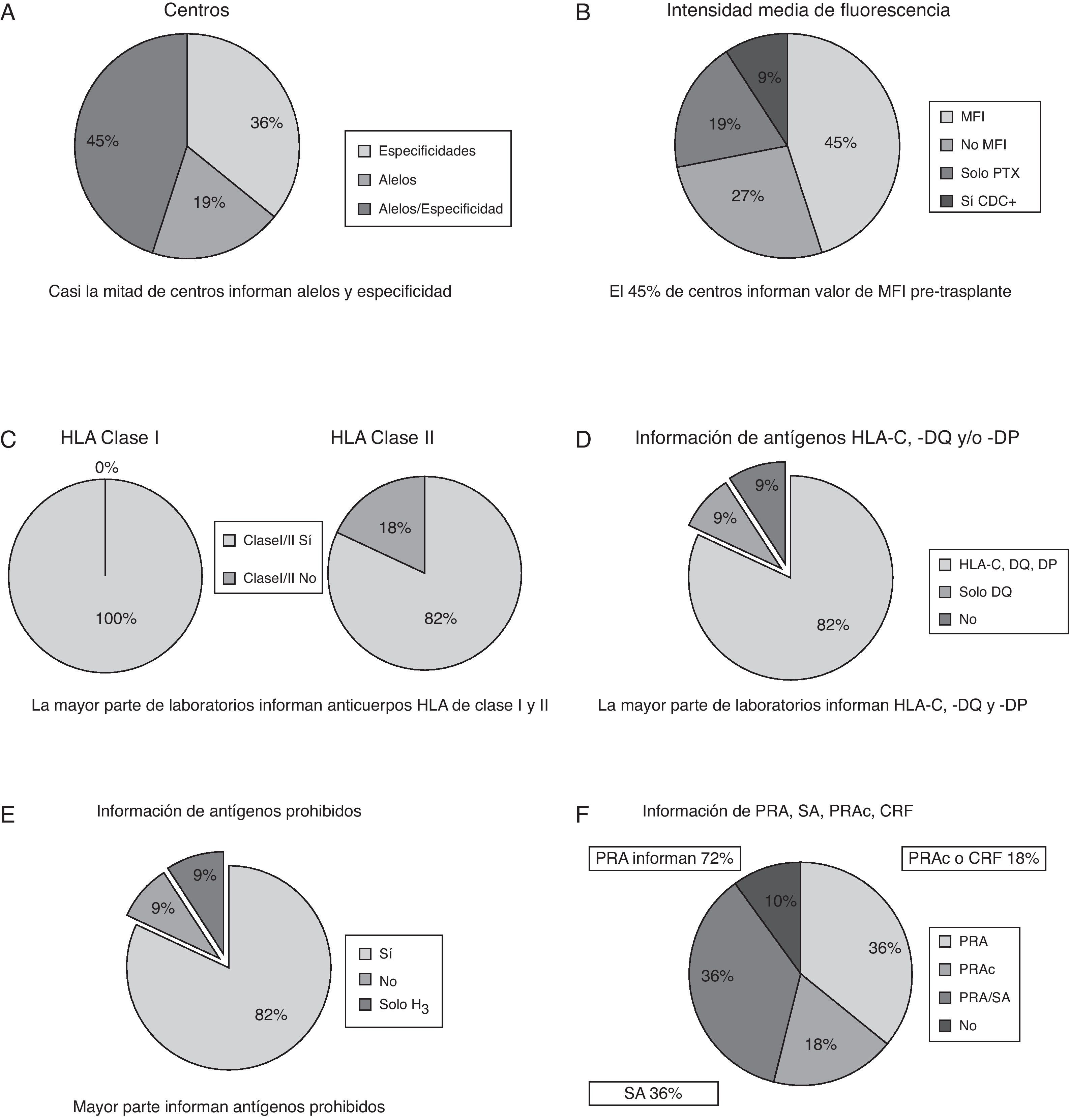
En primer lugar, se plantea la forma de informar sobre la sensibilización de los pacientes, si como especificidades antigénicas o como alelos. El 36% de los centros informan solo de especificidades, mientras que el 19% informan solo de alelos. Casi la mitad de los centros, el 45%, informan indistintamente de alelos y especificidades (fig. 1A).
A) Proporción de centros que informan de la sensibilización de los pacientes como especificidades antigénicas o como alelos. B) Porcentaje de centros que informan de valores de intensidad media de fluorescencia. C) Porcentaje de centros que informan de anticuerpos anti-HLA clase i y/o ii. D) Porcentaje de centros que informan de HLA-C, -DQ y/o -DP. E) Información sobre antígenos prohibidos. F) Información del porcentaje de positividad PRA/SA/PRAc/CRF.
En segundo lugar, analizamos si los centros informan, en el caso de utilización de tecnología Luminex®, de los valores de intensidad media de fluorescencia (MFI). El 45% de centros informan de valores de MFI, el 27% no informan nunca de los niveles de MFI, el 9% informan de MFI, si la determinación por CDC es positiva, y el 19% informan de MFI solo en el seguimiento postrasplante (fig. 1B).
Seguidamente, el porcentaje de centros que no informan de anticuerpos anti-HLA de clase ii es del 18%. Por tanto, la gran mayoría de los centros (82%) informan de anticuerpos anti-HLA clase i y ii (fig. 1C).
En cuanto a la inclusión en el informe a los servicios clínicos de anticuerpos frente a antígenos no clásicos de trasplante, tales como HLA-C, -DQ y -DP, obtuvimos los siguientes resultados: el 82% de los centros informan de estos anticuerpos, mientras el 9% no los informa y el 9% solo informa de anticuerpos anti-DQ (fig. 1D).
La siguiente cuestión planteada fue la relativa a si los centros informan de antígenos prohibidos. La mayoría de los laboratorios sí los informan. El 9% de los centros no los informan y otro 9% solo los informan en pacientes hiperinmunizados (fig. 1E).
Según qué porcentajes de positividad se informan, el 36% informan solo el %PRA (anticuerpos reactivos frente a un panel), otro 36% informan el %PRA/SA y el 18% informa el %PRA calculado. Un 10% no contesta (fig. 1F).
Respecto a la determinación de anticuerpos frente a otros antígenos como MICA, NA u otros anticuerpos endoteliales solo el 55% de los centros informan de la presencia de anticuerpos anti-MICA (fig. 2A). Asimismo, el 73% de los centros informan solo de la presencia de anticuerpos IgG y el 27% informan también de la presencia de IgM rutinariamente o bien de forma ocasional (fig. 2B).
A) Proporción de laboratorios que informan de otros antígenos no HLA. B) Laboratorios que informan de IgG y/o IgM. C) Centros que informan de análisis de fijación de complemento C1q o C3d. D) Porcentaje de centros que informan de la fórmula de análisis. E) Laboratorios que realizan informes pre y postrasplante. F) Laboratorios que informan de la prueba cruzada virtual.
Analizando la determinación de C1q o C3d para testar la fijación de complemento, la mayoría de los centros (64%) no realizan ninguna de estas determinaciones. El 18% determinan C1q y lo informan y otro 18% solo de forma ocasional (fig. 2C).
En cuanto a si se informa a los servicios clínicos de la fórmula de análisis efectuada, el 91% de los centros no reseñan la fórmula de análisis y el 9% reseñan el dato neto de fluorescencia (raw data) (fig. 2D).
Un punto importante es si se informa de la misma manera un análisis de sensibilización pretrasplante que un postrasplante. El 55% de los centros no informan de la misma manera por el 27% de centros que sí lo hacen. Un 9% informan de los niveles de MFI en el postrasplante y un 9% determinan HLA de clase ii en caso de postrasplante (fig. 2E). Además, la mayoría de los centros (82%) informan de la prueba cruzada virtual (fig. 2F).
La mayoría de los centros intercomparan los resultados de CDC/CF/Luminex®/ELISA (82%) (fig. 3A). En caso de discrepancia en esta intercomparación el 36% de los centros toman como prevalente el dato de SA, el 18% informan como prevalente el dato de CDC/CF, el 28% no contestan y el 18% informan del riesgo al clínico (fig. 3B).
A) Proporción de laboratorios que intercomparan los diferentes métodos de determinación de anticuerpos. B) Porcentaje de decisión tras discrepancia en la intercomparación de métodos. C) Porcentaje de laboratorios que informan de otros tipos de trasplante diferente al trasplante renal. D) Laboratorios que informan de la presencia de autoanticuerpos y realizan autocrossmatch. E) Porcentaje de laboratorios que informan de CREG o eplets. F) Porcentaje de centros que informan de niveles de MFI en el postrasplante tras un tratamiento antirrechazo humoral.
Una cuestión interesante es si el informe emitido es el mismo para cualquier tipo de trasplante distinto al renal. Así, casi todos los centros utilizan el mismo tipo de informe que el renal (64%) (fig. 3C), el 18% solo hacen trasplante renal y otro 18% de los centros no contestan con claridad.
La gran mayoría de los centros también informan de la presencia de autoanticuerpos y realizan la prueba cruzada autóloga (91%) (fig. 3D). De la misma manera, la mayoría de los centros no informan de la presencia de CREG (grupo de reacción cruzada) o eplets (73%) (fig. 3E).
Finalmente, la mayoría de los centros consultados informan de niveles de MFI tras un tratamiento antirrechazo con plasmaféresis/inmunoglobulina intravenosa y/o rituximab o bortezomic (91%) (fig. 3F).
Propuesta de modelo de informe de sensibilización pre y postrasplanteCon la recepción de los modelos de informes rutinarios de sensibilización por parte de los centros se han diseñado 2 tipos de modelos: un informe de alosensibilización clásica pretrasplante y otro postrasplante en caso de tratamiento de desensibilización antirrechazo.
El modelo de informe de alosensibilización pretrasplante se muestra en la figura 4 y el de postrasplante en la figura 5. Estos modelos que se proponen por parte del Grupo deberían ser discutidos en posteriores reuniones del GETHIT, tales como el próximo congreso de la SEI que se celebrará en Salamanca en 2013.
Conclusiones y recomendaciones finalesCon la determinación de la situación en los centros participantes y los datos analizados recomendamos informar de anticuerpos antiantígenos HLA de clase ii y frente a otros antígenos no clásicos tales como HLA-C y -DQ ya que en la bibliografía existen casos de rechazo agudo humoral, alguno de ellos irreversible. El caso de los anticuerpos anti-DP es más problemático, aunque un artículo muy reciente informa de un caso de rechazo agudo humoral con la presencia de un anticuerpo anti-DSA anti-DP.
Finalmente, se diseñan unos modelos de informe de alosensibilización pre y postrasplante que deberán ser discutidos por los diferentes miembros del Grupo en posteriores reuniones del GETHIT.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.