Factor activador de célula B perteneciente a la familia del TNF (BAFF) es una proteína que ejerce importantes funciones reguladoras en la supervivencia, maduración y diferenciación de células B, así como en el desarrollo de órganos linfoides, a través de su interacción con distintos receptores.
En el laboratorio, utilizando varios modelos animales se han caracterizado algunas de sus propiedades, sus mecanismos de señalización y la participación en la respuesta inmunológica. Por otro lado se ha demostrado en animales y humanos su expresión alterada en diversos contextos como enfermedades autoinmunes, neoplasias linfoides y susceptibilidad a infecciones.
La sobreproducción y la distribución sistémica de BAFF en modelos múridos y en algunos pacientes con enfermedades autoinmunes apoyan el papel de este factor en autoinmunidad. El análisis de cohortes de pacientes muestran que BAFF está sistémicamente elevado en enfermedades como lupus eritematoso sistémico, artritis reumatoide, síndrome de Sjögren, y granulomatosis de Wegener. En algunos de estos pacientes se ha reportado también incrementos locales de BAFF en tejidos afectados como las glándulas salivales de pacientes con Sjögren, líquido sinovial en pacientes con artritis reumatoide, y lesiones de pacientes con esclerosis múltiple. Igualmente se ha reportado aumento en los niveles séricos de BAFF en pacientes con esclerodermia. Todo esto sugiere un papel importante de esta molécula en la estimulación de las células T y B durante la enfermedad autoinmune.
Los mecanismos responsables de la sobreproducción de BAFF durante el desarrollo de enfermedad autoinmune no son claros. Por otro lado, los incrementos iniciales en los niveles de BAFF pueden ser generados por células del sistema inmunológico innato en respuesta a inflamación e infección. La potente inducción de BAFF en respuesta a estímulos proinflamatorios sugiere que BAFF es parte de la respuesta normal a agentes infecciosos, tal vez sirviendo para aumentar el número de células B durante la expansión clonal o favoreciendo la activación de células T durante una respuesta inmune.
Estos importantes logros de las ciencias básicas se están tratando de traducir al campo clínico con el desarrollo de fármacos que de una manera mucho más selectiva modulen la acción de estos ligandos en situaciones de enfermedad, y amplíen el arsenal terapéutico en beneficio de los pacientes.
B-cell activating factor of the tumor necrosis factor family (BAFF) is an important protein with regulatory functions in B-cell survival, maturation and differentiation, as well as the development of lymphoid organs through several receptors.
BAFF's features, mechanisms of signaling, and immune functions are being studied in murine models. Abnormal expression has been described in autoimmune, neoplastic and infectious diseases in both the mouse and the human being.
The overproduction and the systemic distribution of BAFF in murine models and some patients with autoimmune diseases support the role of this factor in autoimmunity. The analysis of cohorts of patients shows that serum levels of BAFF are higher in diseases like systemic lupus erythematous, rheumatoid arthritis, Sjögren's syndrome, and Wegener's granulomatosis. Local increases of BAFF in affected tissues of some of these patients have also been reported, like in the salivary glands of patients with Sjögren, in synovial fluid in patients with rheumatoid arthritis, and in lesions of patients with multiple sclerosis. In addition, an increase in the serum levels of BAFF in patients with scleroderma has been reported. All this suggests an important role of this molecule in the stimulation of T and B cells during the autoimmune disease.
The mechanisms responsible for the overproduction of BAFF during the development of autoimmune disease are not clear. On the other hand, the initial increases in BAFF levels can be generated by cells of the innate immune system in response to inflammation and infection. The powerful induction of BAFF in the presence of proinflammatory stimuli suggests that BAFF is part of the normal response to infectious agents, perhaps serving to increase the number of B cells during the clonal expansion or favoring the activation of T cells during an immune response.
Transfer of laboratory findings to state-of-the-art management is underway in order to make new and more selective drugs that improve the patients’ health.
BAFF es un miembro de la superfamilia de ligandos del TNF y fue descubierto a finales de los 90 por varios grupos investigadores(1-6), por lo cual no sorprende la diversidad de nombres con que cuenta: BAFF, BLyS, TALL-1, THANK, zTNF-4, TNFSF13B, TNFSF20.
La familia de ligandos del TNF son proteínas transmembrana de tipo II que espontáneamente forman homotrímeros, y pueden encontrarse en forma soluble o unidos a la membrana(7). Otros miembros de la familia de ligandos de TNF descritos son APRIL (A PRoliferation-Inducing Ligand), EDA (Ectodysplasin A) y TWEAK (TNF-Like Weak inducer of apoptosis)(8). BAFF contiene un dominio de homología al TNF (THD) característico de todos los ligandos del TNF que permite la unión a sus receptores en los dominios ricos en cisteína (CRD), y adopta la típica estructura trimérica común en todos los miembros de la familia(9,10). Está estrechamente relacionado con APRIL, con el cual comparte dos receptores y una homología aproximada del 50% en sus estructuras(1).
El BAFF activo puede ser liberado como una citocina soluble después de sufrir proteólisis de la forma unida a membrana por miembros de la familia de proteasas de furina. La regulación diferencial de formas solubles y unidas a membrana sugiere la posibilidad de funciones distintas, sin embargo sus acciones diferenciales aún no están aclaradas. Además, las funciones biológicas de BAFF pueden estar reguladas también por otros mecanismos tales como la formación de heterotrímeros, procesamiento alternativo y localización proteica(1). Una variante alternativa de BAFF, llamada BAFF delta, inhibe la molécula de BAFF normal mediante la formación de heterotrímeros inactivos(7).
A pH básico o neutro, veinte trímeros de BAFF humano recombinante soluble se asocian en una estructura sesentamérica de apariencia viral, la cual irreversiblemente se disocia en trímeros a pH ácido, o cuando se fusiona con extensiones N-terminal. Esta asociación es dependiente de un asa extendida, conocida como Flap, que es única para BAFF dentro de la familia del TNF. La importancia fisiológica del BAFF sesenta-mérico es incierta, pero es biológicamente activo y puede unirse a receptores, siendo un poco más activo que BAFF trimérico en ensayos in vitro(11).
Adicionalmente, BAFF forma heterotrímeros con APRIL, los cuales han sido identificados tanto in vitro como in vivo, en el contexto específico de algunas enfermedades autoinmunes(12).
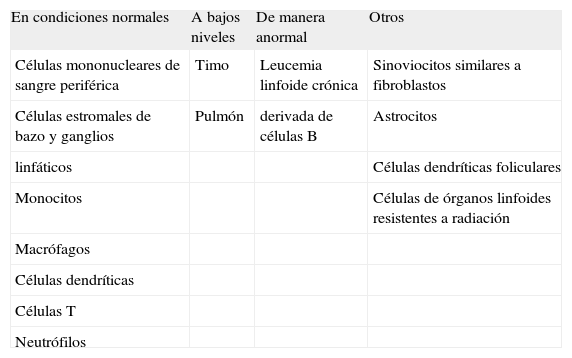
BAFF es expresado en una variedad de tipos celulares, principalmente células mononucleares de sangre periférica y células estromales del bazo y los ganglios linfáticos. Es expresado también por monocitos, macrófagos, células dendríticas y por células T(8). Se observan bajos niveles de expresión en otros tejidos como timo y pulmón(1). Normalmente BAFF no es expresado en células B, aunque ha sido detectado en células de leucemia linfoide crónica derivada de células B(8).
La producción de BAFF es inducida en los leucocitos a través de una variedad de estímulos proinflamatorios. Células dendríticas, monocitos y macrófagos estimulados con interferones tipo I y II, interleucina-10 (IL-10), y lipopolisacárido son potentes productores de BAFF. De manera similar, en presencia de factor estimulante de colonias de granulocitos (G-CSF) y de interferón gamma (IFNγ) los neutrófilos expresan BAFF en altos niveles(8).
Trabajos recientes han demostrado que BAFF también es expresado por sinoviocitos semejantes a fibroblastos, astrocitos, células dendríticas foliculares, y por células de órganos linfoides resistentes a radiación con características similares a células estromales(13-16). En la Tabla I se resume los tipos celulares y tejidos que expresan BAFF.
Células y tejidos que expresan BAFF
| En condiciones normales | A bajos niveles | De manera anormal | Otros |
| Células mononucleares de sangre periférica | Timo | Leucemia linfoide crónica | Sinoviocitos similares a fibroblastos |
| Células estromales de bazo y ganglios | Pulmón | derivada de células B | Astrocitos |
| linfáticos | Células dendríticas foliculares | ||
| Monocitos | Células de órganos linfoides resistentes a radiación | ||
| Macrófagos | |||
| Células dendríticas | |||
| Células T | |||
| Neutrófilos |
Se ha propuesto que existen dos modos importantes para la regulación de la expresión de BAFF, una expresión constitutiva por parte de células estromales radio-resistentes, posiblemente en órganos linfoides, que es crítica en la regulación de la homeostasis de la célula B, y una expresión inducible en mononucleares de sangre periférica en respuesta a un estímulo inflamatorio, presumiblemente importante en la depuración de patógenos(10).
RECEPTORES PARA BAFFBAFF interactúa con tres receptores de la superfamilia de ligandos del TNF: El receptor para BAFF (BAFF-R, CD268), el ligando de interacción de ciclofilina, activador transmembrana y calcio modulador (TACI, CD267), y el antígeno de maduración de célula B (BCMA, CD269) (Tabla II). Todos ellos son expresados principalmente por linfocitos B. BAFF es el único ligando para BAFF-R, mientras que comparte especificidad para los receptores TACI y BCMA con APRIL(1,17).
Expresión de receptores para BAFF y APRIL
| Receptor | Expresión |
| BAFF-R | Bazo, ganglios linfáticos, timo, linfocitos de sangre periférica, células B, bajos niveles en células T |
| TACI | Bazo, timo, linfocitos de sangre periférica, intestino delgado, células B, células T activadas |
| BCMA | Bazo, ganglios linfáticos, timo, linfocitos de sangre periférica, hígado, adrenales, células B |
Los receptores de la familia del TNF son generalmente proteínas transmembrana del tipo I consistentes de un dominio extracelular que contiene múltiples dominios de cisteína (cystein-rich domains, CRD) y secuencias intracelulares que contienen sitios de unión a proteínas TRAF (TNF receptor associated factor, factor asociado al receptor de TNF), y en algunos casos un dominio de muerte. Los receptores conocidos para BAFF y APRIL son inusuales porque ellos son proteínas transmembrana del tipo III, lo que significa que carecen de una secuencia de señal(8).
Estos tres receptores carecen de dominios asociados a muerte, comunes en algunas moléculas de la superfamilia de ligandos del TNF, y en lugar de esto interactúan con miembros de la familia de proteínas TRAF. Esto sugiere su participación en vías de supervivencia y diferenciación más que en muerte celular(1).
BAFF-R, TACI y BCMA muestran patrones de expresión únicos pero sobrepuestos, y el análisis funcional ha revelado papeles distintos para estos tres receptores en la mediación de las señales de BAFF y de APRIL. La expresión en la superficie celular de los tres receptores es modulada durante el curso del desarrollo de la célula B. La expresión de receptores es mínima sobre la célula B inmadura en la médula ósea. Cantidades significativas de mRNA BCMA y niveles más bajos de mRNA BAFF-R y mRNA TACI son detectados en los estadios tardíos del desarrollo de la célula B antes de la migración a los tejidos linfoides periféricos tales como el bazo. En ese momento, BAFF-R y TACI son regulados positivamente por células B inmaduras, en forma coincidente con la adquisición de respuesta a BAFF durante la etapa de desarrollo transicional de tipo 1 (T1). BAFF-R es subsecuentemente expresado en altos niveles sobre todas las células B periféricas maduras en bazo, ganglios linfáticos y sangre periférica(1).
TACI tiene un patrón de expresión distinto a BAFF-R, siendo altamente expresado en T2, zona marginal, y células B B-1, mientras es regulado negativamente sobre las células B de los centros germinales y foliculares. El patrón de expresión de BCMA es el más restringido de los receptores de BAFF, con una expresión en superficie celular confinada a las células B de los centros germinales y células plasmáticas de médula ósea(1).
Además de las células B, existe evidencia de la expresión por células T de receptores para BAFF. Algunos reportes describen expresión de TACI sobre células T activadas, y otros han indicado expresión de BAFF-R sobre células T vírgenes y de memoria, y sobre células T reguladoras CD4+CD25+(1,18).
FUNCIONES BIOLÓGICAS DE BAFFLas células B entran al bazo en un estado inmaduro y sufren allí diferenciación adicional, pasando por células T2 inmaduras, hacia células B maduras o hacia células B de zona marginal. Durante la diferenciación se requiere la participación del receptor de célula B (BCR) funcional. El BCR consiste de una inmunoglobulina de superficie, la cual no tiene capacidad de señalización, y de cadenas de Igα e Igβ, que realizan señalización a través de sus colas citoplasmáticas. Además de la señal del BCR, una señal de supervivencia proporcionada por BAFF es necesaria durante la diferenciación, por lo que una depleción de BAFF genera una pérdida de más del 90% de las células B maduras. Esta pérdida se produce por una supervivencia disminuida en todas las etapas más allá del período T1 inmaduro(11).
El receptor fundamental que media en las señales de supervivencia de BAFF en esta etapa es BAFF-R. En este estado de maduración de la célula B, TACI actúa como un regulador negativo. BCMA no está implicado en la supervivencia de las células B en esta etapa, sin embargo es un factor muy importante en etapas posteriores de la diferenciación de la célula B y ha mostrado ser importante para la supervivencia de células plasmáticas de médula ósea de vida larga, y quizás para la supervivencia de plasmoblastos. Esto se correlaciona con la expresión aumentada de BCMA durante la diferenciación terminal de la célula B. Ya que BCMA se une a APRIL con alta afinidad, el eje APRIL-BCMA podría predominar durante las etapas tardías de la diferenciación de la célula B, o al menos parcialmente reemplazar la dependencia por BAFF(11).
Para evitar la generación de autoanticuerpos patogénicos, los linfocitos autorreactivos son eliminados en varios puntos distintos durante su maduración. BAFF es necesario para el desarrollo y la supervivencia de la célula B madura, pero puede generar hiperplasia de células B y autoinmunidad cuando se sobreexpresa. Las células B autorreactivas tienen una respuesta reducida a BAFF y por lo tanto mueren debido a los bajos niveles de BAFF disponibles normalmente in vivo. La expresión elevada de BAFF altera este panorama y modifica el control de la autotolerancia mediante señales de supervivencia y rescate de estas células que normalmente deberían ser eliminadas durante su maduración tardía(17).
Experimentos in vitro revelaron un papel para BAFF en el incremento de la activación de células T. BAFF aumenta la proliferación de la célula T y la producción de citocinas en respuesta a un amplio rango de estímulos mitogénicos. In vivo, los niveles de BAFF pueden modular el desenlace de las respuestas de las células T. Por ejemplo, el bloqueo de BAFF evita la activación de la célula T; por otro lado, una defectuosa señalización de BAFF está asociada con un menor rechazo y una mayor supervivencia de aloinjertos cardíacos en modelos múridos. Esta información indica que BAFF es también un importante regulador de las respuestas de células T(1,18,19).
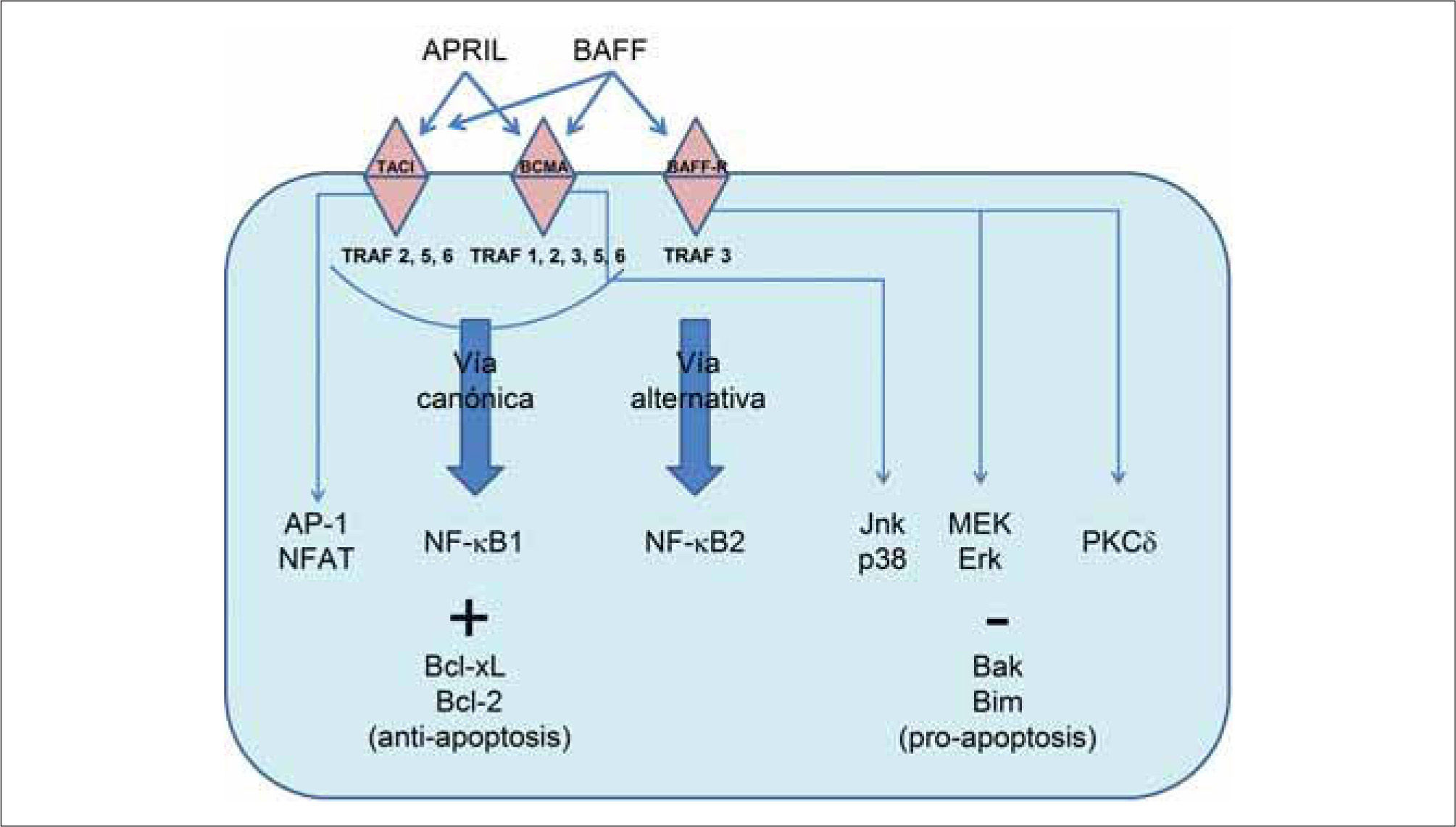
VÍAS DE SEÑALIZACIÓN UTILIZADAS POR LOS RECEPTORES PARA BAFFDiferentes aspectos de la señalización utilizada por el receptor para BAFF, el cual lleva a la supervivencia de la célula B, están empezando a comprenderse. La activación del factor nuclear kappa B (NF-κB) a menudo se correlaciona con desenlaces de supervivencia. La activación del factor de transcripción NF-κB dimérico en células B ocurre o bien a través de la vía convencional (dependiente de NEMO), o bien a través de la vía alternativa (independiente de NEMO). La vía canónica requiere del complejo IKK, compuesto de las cinasas IKKα e IKKβ, y del modulador esencial NEMO. Esta vía puede ser activada por varias proteínas incluyendo TRAF2, 5 y 6, y genera dímeros de NF-κB que contienen la subunidad p50. La vía alternativa puede ser activada por receptores ligados a la quinasa NIK y requiere IKKα (pero no IKKβ ni NEMO), y está caracterizada por el procesamiento inducible de la proteína p100 al fragmento p52, un componente de los dímeros de NF-κB(11).
El análisis de las vías de señalización activadas por los tres receptores para BAFF ha demostrado que cada uno interactúa con distintos intermediarios en la señalización, principalmente a través de interacciones con un espectro diferente de proteínas TRAF. El receptor para BAFF recluta solamente a TRAF3, TACI recluta a TRAF2, 5 y 6, y BCMA a TRAF1, 2, 3, 5 y 6. Estas interacciones diferenciales con moléculas de TRAF explican las diferentes habilidades de estos receptores para activar MAP-cinasas y NF-κB. Tanto TACI como BCMA activan la vía canónica de NF-κB, lo cual es bastante común para los miembros de la superfamilia de ligandos del TNF. BCMA activa las vías de las MAP-cinasas Jnk y p38, y la transcripción a través de Elk-1, mientras que TACI activa a los factores de transcripción AP-1 y NF-AT. En contraste, el receptor para BAFF no parece estimular las vías de las MAP-cinasas, NF-AT o NF-κB1, y en lugar de ello activa la vía alternativa NF-κB2(1,20). En la Figura 1 se presenta un esquema de las vías de señalización descritas.
Estudios funcionales han mostrado interacciones críticas entre BAFF-R, TRAF3 y NIK, que son esenciales para la activación inducida por BAFF de NF-κB2. TRAF3 interactúa con BAFF-R, a través de un motivo de secuencia único en la porción intracelular del receptor. En el estado latente, antes de la activación de BAFF-R, TRAF3 forma una asociación estable con NIK, dirigiendo a las moléculas de NIK recientemente traducidas hacia ubiquitinación y degradación constitutiva por medio del proteasoma. La adherencia de BAFF sobre la superficie celular genera un rápido reclutamiento de TRAF3 por BAFF-R, lo cual produce la degradación de TRAF3, permitiendo la activación de NIK y el procesamiento de p100. Se observan luego niveles aumentados de la proteína NIK, que llevan a la inducción del procesamiento de p100 y a la producción de subunidades p52 funcionales. De esta manera TRAF3 probablemente sea un factor regulador positivo crítico de la vía no canónica, lo cual es consistente con su reclutamiento por otros miembros de la superfamilia de receptores del TNF que activan a NF-κB2, tales como CD40 y LTβR(1).
La activación de la vía alternativa parece estar restringida a algunos miembros particulares de la familia de receptores del TNF, los cuales están involucrados en el desarrollo de órganos linfoides secundarios, la supervivencia y homeóstasis de células B, y osteoclastogénesis (LTβ R, CD40, BAFF-R, RANK). Además, la vía alternativa también es activada por algunos virus oncogénicos tales como virus de Epstein Barr y virus linfotrófico humano tipo 1(21).
La identidad de los genes relevantes regulados por NF-κB en respuesta a la señalización a través del receptor para BAFF permanece sin confirmar. BAFF induce la regulación positiva de miembros de Bcl-2 antiapoptóticos tales como Bcl-xL o Bcl-2, llevando a supervivencia aumentada. Bcl-xL es un blanco bien documentado de la vía clásica de NF-κB. Se especula que Bcl-2 podría ser un blanco de la vía alternativa inducida por BAFF en las células B, aunque esto sigue siendo controversial(11). De manera complementaria, BAFF también induce regulación negativa de genes pro-apoptóticos tales como BAK y BIM a través de la vía de quinasas MEK/Erk, aumentando así las señales de supervivencia celular(22).
Otras vías de señalización, como aquellas mediadas por PKCδ, un miembro de la familia de las proteínas quinasas C, son también importantes para la transducción de señales a través de BAFF-R. La estimulación de las células B a través de BAFF evita la translocación de PKCδ hacia el núcleo, un paso crítico para la inducción de muerte celular(1). Finalmente, la tirosin quinasa de Bruton (Btk) tiene un papel crítico en la regulación de célula B tanto a través del receptor de célula B por medio de la vía clásica NF-κB1, como a través de BAFF por medio de las vías clásica y alternativa NF-κB1 y 2(23).
MODELOS ANIMALES Y HUMANOS DE ENFERMEDADEn ratones se han caracterizado las propiedades de BAFF y sus receptores a través de varias aproximaciones tales como expresión transgénica de BAFF, modelos knock-out para BAFF y sus receptores, bloqueo específico de receptores en condiciones basales y sobre modelos de enfermedades autoinmunes, y medición de niveles de BAFF en ratones con autoinmunidad inducida(1,24-28).
Se han desarrollado varios modelos múridos de BAFF transgénico, todos los cuales muestran alteraciones importantes en el compartimiento de células B y desarrollan autoinmunidad espontánea, con hiperplasia profunda de células B, hiperglobulinemia y producción de diversos autoanticuerpos y complejos inmunológicos. Estas alteraciones llevan al desarrollo en ratones de enfermedades similares a lupus y síndrome de Sjogren, con proteinuria, nefritis con falla renal, e infiltración leucocitaria de glándulas salivales(24-26).
La sobreproducción sostenida de BAFF es suficiente para explicar el inicio y la perpetuación de esta autorreactividad, sin embargo se deben tener en cuenta también modificadores genéticos en el contexto de cada individuo que pueden aumentar la susceptibilidad al desarrollo de autoinmunidad. La expresión de BAFF transgénico en ratones con otros genes de susceptibilidad para lupus aumenta notablemente la posibilidad y la intensidad de la expresión de la enfermedad(26). Se sugiere entonces que la sobreexpresión de BAFF conduce a la inducción de autoinmunidad en presencia de factores genéticos permisivos que la predispongan. Puede también sugerir que BAFF no es el disparador de condiciones autoinmunes pero puede promover y perpetuar supervivencia de células B autorreactivas una vez la respuesta autoinmune se ha iniciado. La producción incrementada de autoanticuerpos en el ratón transgénico para BAFF sugiere que la sobreproducción de BAFF permite a las células B autorreactivas eludir los sitios de control de la autotolerancia normales(1).
La sobreproducción y la distribución sistémica de BAFF en modelos múridos y en algunos pacientes con enfermedades autoinmunes también apoyan el papel de este factor en autoinmunidad(29-34). Modelos de lupus en ratones como las cepas NZB/WF1 y MRLlpr/lpr muestran niveles altos de BAFF. El análisis de cohortes de pacientes muestran que BAFF está sistémicamente elevado en enfermedades como lupus eritematoso sistémico (LES)(29,30), artritis reumatoide (AR)(29,31), síndrome de Sjögren(31), y granulomatosis de Wegener(32). En algunos de estos pacientes se han reportado también incrementos locales de BAFF en tejidos afectados como las glándulas salivales de pacientes con Sjögren(33), líquido sinovial en pacientes con AR(29), y lesiones de pacientes con esclerosis múltiple(16). Igualmente se ha reportado aumento en los niveles séricos de BAFF en pacientes con esclerodermia(34). Todo esto sugiere un papel importante de esta molécula en la estimulación de las células T y B durante la enfermedad autoinmune(1).
Los mecanismos responsables de la sobreproducción de BAFF durante el desarrollo de la enfermedad autoinmune no son claros. Existe alguna evidencia que sugiere que la variación genética natural puede modular los niveles sistémicos de BAFF, por ejemplo polimorfismos en el gen BAFF han sido asociados con una producción aumentada de BAFF lo cual se correlacionó con la presencia de anticuerpos anti-Sm en pacientes japoneses con LES(35). Son necesarios más estudios con mayor número de individuos que permitan aclarar este componente genético de las enfermedades autoinmune.
Por otro lado, los incrementos iniciales en los niveles de BAFF pueden ser generados por células del sistema inmune innato en respuesta a inflamación e infección. La potente inducción de BAFF en respuesta a estímulos proinflamatorios sugiere que BAFF es parte de la respuesta normal a agentes infecciosos, tal vez sirviendo para aumentar el número de células B durante la expansión clonal o favoreciendo la activación de células T durante una respuesta inmune(1). La producción de BAFF en respuesta a la infección es sugerida por los altos niveles de BAFF en pacientes con enfermedad por el virus de inmunodeficiencia humana (VIH). De manera interesante, esto puede ser la causa de los altos niveles de autoanticuerpos y la incidencia aumentada de enfermedades autoinmunes (LES y síndrome antifosfolípido) y síndromes linfoproliferativos que se observa en algunos pacientes con VIH(36).
Se ha observado adicionalmente subgrupos de personas aparentemente sanas con altos niveles de BAFF tal como se encontró en un estudio al evaluar correlación entre BAFF y granulomatosis de Wegener comparado con controles sanos(32), lo cual nuevamente refuerza el concepto de que la enfermedad autoinmune solo se desarrolla a partir de un desencadenante cuando este se conjuga con un trasfondo genético permisivo.
Los pacientes que desarrollan síndromes autoinmunes tales como LES, síndrome de Sjögren y artritis reumatoidea tienen un mayor riesgo de desarrollar neoplasias de células B. Esto sugiere que mecanismos comunes pueden estar participando en el desarrollo tanto de autoinmunidad como de neoplasias linfoides. Estudios recientes han demostrado que la producción excesiva de BAFF está también asociada con el desarrollo de una variedad de neoplasias de células B maduras, indicando que BAFF puede ser un importante nexo molecular entre autoinmunidad y cáncer(37-42).
Los pacientes con linfoma no Hodgkin muestran niveles séricos elevados de BAFF y APRIL. En una cohorte de pacientes con linfoma no Hodgkin los niveles de BAFF tuvieron una correlación inversa con la respuesta al tratamiento y la supervivencia libre de enfermedad(38). La fuente de BAFF y APRIL probablemente proviene de múltiples tipos celulares, incluyendo las mismas células tumorales(1). También en pacientes con enfermedad de Hodgkin se observó un aumento de genes anti-apoptóticos y disminución de genes pro-apoptóticos mediados por NF-κB inducidos por BAFF y APRIL a través de expresión de receptores TACI y BCMA(39).
En pacientes con macroglobulinemia de Waldenstrom, BAFF estimula la producción de inmunoglobulinas y el crecimiento de células B malignas(40), y en pacientes con mieloma múltiple se observó un incremento en el nivel y en la acción de BAFF a través de la expresión también aumentada de sus tres receptores(41).
La acción autocrina y paracrina de BAFF y APRIL parece ser importante para la supervivencia de una variedad de neoplasias de células B y sugiere que estas moléculas y sus tres receptores son excelentes blancos para la generación de nuevos agentes terapéuticos contra cánceres linfoides(1,40,42).
También se han encontrado niveles altos de BAFF en pacientes con hepatitis autoinmune en quienes se correlaciona con los niveles de enzimas hepáticas, sugiriendo que BAFF podría contribuir en la lesión hepática y en el desarrollo de enfermedad(43). En pacientes con inmunodeficiencia común variable se han descrito niveles altos de BAFF y APRIL así como mutaciones en el receptor TACI hasta en un 10% de ellos(44). BAFF se encontró también alto en pacientes asmáticos en los cuales se encontró relación con actividad de la enfermedad, y se observó disminución de los mismos niveles después del tratamiento(45). Todos estos estudios continúan acrecentando las evidencias que posicionan a BAFF, APRIL y sus tres receptores conocidos, como importantes iniciadores o mediadores durante la patogénesis de diversas enfermedades autoinmunes, neoplásicas, alérgicas y relacionadas con inmunodeficiencias, lo cual los convierte en posibles blancos de intervención.
POTENCIALES BLANCOS TERAPÉUTICOSLos tratamientos inmunosupresores y quimioterapéuticos de amplio espectro disponibles ven opacada su efectividad con la aparición de efectos adversos severos y la poca respuesta en algunos pacientes. Se requieren nuevas terapias más específicas para blancos a escala celular y molecular que de manera más selectiva y efectiva bloqueen vías patogénicas y tengan menos toxicidad asociada(1). En la actualidad se cuentan con terapias más selectivas y altamente efectivas como los antagonistas del factor de necrosis tumoral con indicaciones clínicas crecientes(46).
A medida que se aclaran los mecanismos y la acción precisa de BAFF queda claro que esta molécula y sus receptores representan excitantes nuevos blancos para el desarrollo de nuevas terapias antiinflamatorias. Su rango estrecho de blancos celulares y su fuerte asociación con alteraciones autoinmunes, infecciosas y neoplásicas, hace prever que nuevas terapias dirigidas contra BAFF podrán mejorar nuestra habilidad para tratar muchos de estos pacientes(1,47).
El papel crítico de BAFF como un regulador de la supervivencia de la célula B periférica sugiere que su bloqueo puede ser una terapia útil en la mayoría de enfermedades que resulten de una mala regulación de las funciones de la célula B, ya sea como células productoras de autoanticuerpos o como células presentadoras de antígenos. El potencial terapéutico de las estrategias que disminuyen las células B ha sido demostrado en humanos con la efectividad de Rituximab (anti-CD20) en el tratamiento de enfermedades autoinmunes y neoplásicas(48,49). El tratamiento de ratones susceptibles a lupus NZB/WF1 y MRLlpr/lpr con anti-BAFF exitosamente redujo muchos de sus síntomas autoinmunes. La administración repetida de anticuerpos contra los receptores (TACI y BAFF-R) en modelos múridos de lupus redujo sustancialmente el número de células B totales en sangre periférica, redujo la proteinuria y aumentó la supervivencia promedio, además revirtió la detección de autoanticuerpos como anti-DNA(50).
Este tratamiento con anticuerpos contra receptores (TACI y BAFF-R) fue efectivo cuando se administró con autoinmunidad establecida y también antes del desarrollo de la enfermedad, lo que implica que puede ser útil para el tratamiento de enfermedad establecida en humanos. Se espera que estos nuevos tratamientos sean capaces de reducir las células B autorreactivas y los autoanticuerpos pero preservando las respuestas humorales normales(1,50).
Antagonistas de BAFF y APRIL también han mostrado efectividad en la prevención de enfermedad en modelos de artritis inducida por colágeno(27). Los bloqueadores de BAFF pueden también ser efectivos en el tratamiento de otras enfermedades autoinmunes que están caracterizadas por la presencia de autoanticuerpos y centros germinales ectópicos como por ejemplo LES, síndrome de Sjögren y miastenia gravis(1). Muy seguramente se podrán usar también en muchas enfermedades mediadas por células T según las evidencias presentadas previamente. El potencial terapéutico de los anticuerpos monoclonales contra BAFF o APRIL, o de anticuerpos bloqueadores de los receptores, es amplio y creciente por lo cual se esperan grandes avances para los próximos años.
CONCLUSIONESBAFF logra establecer una conexión cada vez más clara entre homeóstasis y enfermedad autoinmune y neoplásica. Su producción excesiva, ya sea como causa o como consecuencia, seguramente contribuye en la patogénesis de estas enfermedades perpetuando una estimulación inapropiada de células autorreactivas T, B o ambas. Los modelos actuales sugieren que el bloqueo de su producción o acción puede ayudar en el tratamiento de estados patológicos, tratando de no hacer un bloqueo completo que inhiba las respuestas inmunitarias normales y cause inmunosupresión.
Varios laboratorios farmacéuticos están llevando a cabo ensayos clínicos con agentes bloqueadores de BAFF y APRIL desarrollados para terapia en humanos como anticuerpos monoclonales o como proteínas de fusión de los receptores(1). Actualmente se encuentran en fase III de investigación y se ha informado en forma preliminar que son efectivos y bien tolerados por los pacientes(51).
Todavía falta aclarar si existen otros ligandos, receptores o ambos que participen en la supervivencia y maduración de células B y T, delinear con precisión los eventos iniciadores y perpetuadores de autoinmunidad y malignidad, explicar la falta de correlación entre niveles de BAFF y enfermedad autoinmune en algunos pacientes(52), e interpretar y aplicar los resultados de los ensayos clínicos en curso.
CONFLICTO DE INTERÉSLos autores declaran no tener ningún conflicto de interés financiero.