Estudio de las poblaciones linfocitarias y las inmunoglobulinas en pacientes anémicos graves, ingresados en una Unidad de Cuidados Intensivos (UCI).
Material y métodoSe estudian 34 pacientes anémicos ingresados en UCI, tras ser intervenidos de su proceso de base (patología tumoral, 22 pacientes) o por cuadro séptico grave (12 pacientes). Se hizo la valoración de la anemia (hemoglobina, sideremia, transferrina y ferritina) y de la situación inmunológica (hemograma, niveles de inmunoglobulinas, IgA, IgG, IgM) y cuantificación de las poblaciones de células mononucleraes sanguíneas, referidos a células T (CD3+, CD4+, CD8+), células B (CD19+) y células citolíticas NK (CD16+/CD56+). Se comparó con un grupo control de 36 pacientes, ingresados en UCI, tras ser sometidos a pruebas diagnósticas y/o terapéuticas de alto riesgo vital, y procedentes de cardiología, hemodinámica, neurología y del área de urgencias.
ResultadosLos pacientes del grupo control presentaron valores normales de su hemograma, incluido leucocitos y linfocitos totales, y del metabolismo del hierro. Los pacientes postoperados por cáncer y sépticos presentaron anemia, hipoferremia y altos niveles de ferritina sérica, más acusado en el grupo de pacientes sépticos. Había linfopenias marcadas en ambos grupos de pacientes, pero en cuanto al estudio de las células mononucleares expresivas de linfocitos T, estaban más bajas en los pacientes sépticos. La ratio CD4/CD8 era normal en ambos grupos. En cuanto a los linfocitos B, había aumento, mayor en los pacientes sépticos, y no había modificaciones en las células citoliticas NK. Había niveles bajos de IgG, aunque la expresión de linfocitos B estaba aumentada.
DiscusiónLos pacientes anémicos postoperados por cáncer y sépticos, ambos con linfopenias, presentaron alteraciones en sus poblaciones linfocitarias. Las alteraciones inmunitarias en pacientes anémicos pudieran acompañarse de una mayor frecuencia de infecciones postoperatorias y/o dificultad del control de la sepsis establecida. El tratamiento de estas anemias [hierro parenteral, con/sin eritropoyetina, (EPO), etc.], podría mejorar la respuesta inmunitaria de estos pacientes.
Study of lymphocyte populations and immunoglobulins in anaemic patients from critical care units.
Materials and MethodsOne group of 34 anaemic patients in ICU after surgical procedures (oncology, 22 patients) or upon a critical septic illness (12 patients) was studied. In addition to anaemia (haemoglobin, iron, transferrin, and ferritin), the immunological situation was evaluated (hemogram, levels of immunoglobulin, IgA, IgG, IgM), and different populations were quantified, including T lymphocytes (CD3+, CD4+, CD8+), B cells (CD19+), and natural killer (NK) cells (CD16+/CD56+). This group was compared to a control group of 36 patients, who were admitted in ICU after haemodinamic studies or interventional coronariography procedures from the haemodinamic laboratory, neurology ward, or emergencies.
ResultsPatients from the control group presented normal levels of their hemogram, including total leukocytes and lymphocytes, and normal numbers for iron metabolism. Patients under oncology surgery and septic patients presented anaemia, hypoferremia and higher serum ferritin concentration, which was even higher in the group of septic patients. Lymphopeny was marked in both groups of patients, with lower levels of T lymphocytes in septic patients. The CD4/CD8 ratio was normal in both groups. Higher levels of B lymphocytes were found, particularly in septic patients, with no differences in natural killer cells. Despite the increase in B lymphocytes, there were low levels of IgG.
DiscussionPatients under oncology surgery and septic anaemic patients presented lymphopeny and alterations in their lymphocyte populations. The immune alterations in anaemic patients could be accompanied by increased frequency of post-surgery infections and/or a difficult control of the established sepsis. The treatment of anaemia (iron, with/without EPO, etc) could improve the immune responses of these patients.
Las anemias son frecuentes en los pacientes críticos que ingresan en las Unidades de Cuidados Intensivos (UCI). Muchos de estos enfermos presentan anemia a su ingreso, que se mantiene, e incluso agrava, durante su estancia en la Unidad. Las alteraciones del metabolismo del hierro, con cifras bajas de hemoglobina, sideremia, transferrina y valores normales o altos de ferritina, son hallazgos frecuentes en estos pacientes(1-5). También se ha descrito la relación existente entre las anemias por déficit de hierro, las infecciones y las alteraciones inmunológicas, referidas a las poblaciones linfocitarias y a las inmunoglobulinas séricas. Analizamos las diferencias inmunológicas en pacientes postoperados por procesos tumorales y sépticos, ambos grupos anémicos, su posible incidencia en el curso clínico, y la alternativa terapéutica que se sugiere.
MATERIAL Y MÉTODOSe estudian 34 pacientes anémicos ingresados en la UCI del Hospital Regional Carlos Haya, de Málaga, tras ser intervenidos por su proceso de base, (cáncer) o por cuadro séptico grave. Analizamos 22 pacientes postoperados, 15 mujeres y 7 hombres, cuya edad media era de 60,6 años. Doce de ellos procedentes de Cirugía Torácica tras neumectomia izquierda (4); lobectomías pulmonares (4); resección pulmonar por metástasis (3), y timectomía (1 paciente). Ocho eran postoperados de Neurocirugía por glioblastoma multiforme (3), meningioma (2), astrocitoma (2) y metástasis cerebelosa de melanoma (1 paciente). Otros procesos quirúrgicos incluyeron 1 ameloblastoma y 1 carcinoma epidermoide del pie izquierdo. Fallecieron 2 pacientes, en el postoperatorio de neumectomia izquierda por cáncer de pulmón.
Su APACHE II (Acute Physiology And Chronic Health Evaluation) medio era de 11,9 ± 3,7, y la estancia media en la Unidad fue de 2,41 ± 3,5.
Analizamos 12 pacientes sépticos, 10 hombres y 2 mujeres, cuya edad media era de 51.5, 3 por cuadro clínico de: absceso cerebral [Neumococo, Proteus mirabilis y hongos (phaeohifomicosis)]; 3 por meningitis bacteriana [Neumococo, Klebsiella pneumoniae y cultivo (−)]; 2 por peritonitis aguda, 1 por mediastinitis necrotizante (Streptococcus viridans), y 1 por absceso odontógeno (Streptococcus + Peptoestreptococcus). Dos pacientes sufrían otros procesos (submaxilitis, epiglotitis).
Fallecieron 2 pacientes por mediastinitis necrotizante en fracaso multisistémico, y meningoencefalitis por Klebsiella pneumoniae en shock séptico, respectivamente. Su APACHE II medio era de 11.75, y la estancia media en la Unidad de 6.0 días.
A todos ellos, para la valoración de la anemia, se realizó hemograma, sideremia, transferina y ferritina, y para el estudio inmunológico, se realizó fórmula y recuento sanguíneos, niveles séricos de inmunoglobulinas (Ig´s), (IgA, IgG, IgM) y cuantificación de las poblaciones de células mononucleares sanguíneas, utilizando anticuerpos monoclonales como marcadores, y referidos a: células T (CD3, CD4, CD8); (CD3: anticuerpo OKT-3, Ortho; células T maduras. CD4: anticuerpo OKT-4A, Ortho; células T cooperadoras / inductoras. CD8: anticuerpo OKT-8, Ortho; células T citotóxicas y supresoras), células B (CD19) y células NK (Natural Killer, células citolíticas naturales; CD16/CD56).
El recuento de linfocitos "vivos" totales se realizó en sangre completa, (2 ml en un tubo de hematología) recién extraída y con un tiempo entre la recogida de muestra y el análisis por el Laboratorio de Inmunología menor de 2 horas, utilizando los valores de control linfocitario de nuestro hospital, referido al 15 de julio del 2005 y sobre 100 muestras de personas normales adultas por el citómetro Cytoron de Ortho, con reactivos Tríos de subpoblaciones linfocitarias.
El grupo de pacientes anémicos fue comparado con un grupo control de 36 pacientes, que ingresaron en la Unidad tras ser sometidos a pruebas diagnósticas y/o terapéuticas de alto riesgo vital y procedentes del Área de Cardiología (19 pacientes tras realización de estudios hemodinámicos: angioplastia coronaria transluminal percutánea (ACTP) y/o colocación de "stent"). Catorce pacientes procedían del Área de Neurología, 10 con cuadro clínico de hemorragia subaracnoidea y realización de arteriografías cerebrales; 4 pacientes con embolizaciones terapéuticas con "coils" de sus aneurismas cerebrales y de su malformación arteriovenosa cerebral; y 3 procedían del Área de Urgencias: por cuadro de intoxicación por fármacos antidepresivos de tipo benzodiacepinas; por antidepresivos tricíclicos, y por sustancia insecticida órgano-fosforada.
Se excluyeron del estudio pacientes sometidos a trasplantes de órganos sólidos o hematológicos, pacientes con insuficiencia hepática, con insuficiencia renal aguda y/o crónica agudizada, politraumatizados, embarazadas, con tratamientos anticoagulantes previos, con hemorragia activa con/sin repercusión hemodinámica y pacientes con desórdenes malignos hematológicos.
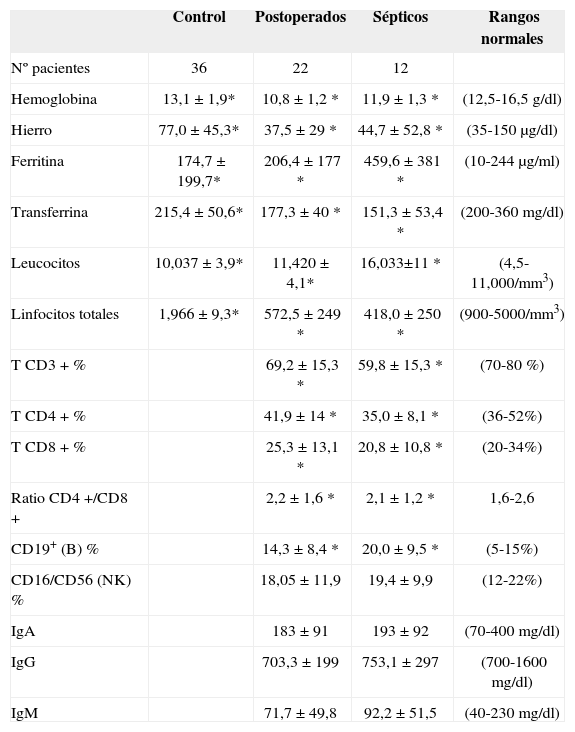
RESULTADOSEn la tabla I se exponen los valores obtenidos en los distintos parámetros analizados y su análisis estadístico. Los pacientes del grupo control no estaban anémicos, no presentaban alteraciones del metabolismo del hierro (hierro, ferritina y transferrina), y sus cifras de leucocitos y de linfocitos totales eran normales.
Valoración de la anemia, de las poblaciones de leucocitos, y de inmunoglobulinas en suero en los grupos de pacientes analizados
| Control | Postoperados | Sépticos | Rangos normales | |
| Nº pacientes | 36 | 22 | 12 | |
| Hemoglobina | 13,1 ± 1,9* | 10,8 ± 1,2 * | 11,9 ± 1,3 * | (12,5-16,5 g/dl) |
| Hierro | 77,0 ±45,3* | 37,5 ± 29 * | 44,7 ± 52,8 * | (35-150 μg/dl) |
| Ferritina | 174,7 ± 199,7* | 206,4 ± 177 * | 459,6 ± 381 * | (10-244 μg/ml) |
| Transferrina | 215,4 ± 50,6* | 177,3 ±40 * | 151,3 ±53,4 * | (200-360 mg/dl) |
| Leucocitos | 10,037 ±3,9* | 11,420 ±4,1* | 16,033±11 * | (4,5-11,000/mm3) |
| Linfocitos totales | 1,966 ± 9,3* | 572,5 ± 249 * | 418,0 ±250 * | (900-5000/mm3) |
| T CD3+ % | 69,2 ± 15,3 * | 59,8 ± 15,3 * | (70-80 %) | |
| T CD4+ % | 41,9 ± 14 * | 35,0 ± 8,1 * | (36-52%) | |
| T CD8+ % | 25,3 ± 13,1 * | 20,8 ± 10,8 * | (20-34%) | |
| Ratio CD4+/CD8+ | 2,2 ± 1,6 * | 2,1 ± 1,2 * | 1,6-2,6 | |
| CD19+ (B) % | 14,3 ± 8,4 * | 20,0 ± 9,5 * | (5-15%) | |
| CD16/CD56 (NK) % | 18,05 ± 11,9 | 19,4 ± 9,9 | (12-22%) | |
| IgA | 183 ± 91 | 193 ± 92 | (70-400 mg/dl) | |
| IgG | 703,3 ± 199 | 753,1 ± 297 | (700-1600 mg/dl) | |
| IgM | 71,7 ± 49,8 | 92,2 ± 51,5 | (40-230 mg/dl) |
El estudio estadístico fue realizado con el programa informático SPSS 14.0. Los valores muestran la media ± SD de cada grupo. Los asteriscos indican diferencias significativas con el grupo control.
En los 22 pacientes postoperados por cáncer y 12 pacientes sépticos, había anemia y alteraciones del metabolismo del hierro, [sideremia y transferrina sérica bajas en ambos grupos (p< 0,0001, p< 0,0001) con altos niveles de ferritina, sobre todo en el grupo afectado de sepsis (p< 0,04)]. Además, había diferencias significativas entre los pacientes postoperados y sépticos en los valores de hemoglobina (p< 0,031) y de la ferritina (p< 0,048).
Había diferencias en ambos grupos en el número de leucocitos totales (p< 0,04), y linfopenia total marcada, mucho mayor en el grupo de pacientes sépticos (p< 0,0001).
En cuanto al recuento de las subpoblaciones linfocitarias, observamos una disminución de los linfocitos CD3+ (T totales) en ambos grupos analizados, y de linfocitos T CD4+ en los pacientes sépticos (p< 0,08). Asimismo se observa aumento de los linfocitos B (CD19+), más acusado en el grupo de pacientes sépticos (p< 0,08). Los valores de las células citolíticas NK fueron normales. La ratio CD4/CD8 permanecía en rango normal, en ambos grupos.
Cuando hicimos este análisis en función de las determinaciones de inmunoglobulinas realizadas (IgA, IgG, IgM), todas las determinaciones, en ambos grupos, estaban dentro del rango de la normalidad, aunque con de IgG próximas al límite inferior del rango, siendo los resultados no significativos estadísticamente.
La estancia media y la tasa de infecciones son significativamente menores en el grupo control (p< 0,0001 y p< 0,044, respectivamente). Sin embargo, los APACHES II de ambos grupos no difieren significativamente (p< 0,064).
DISCUSIÓNEl sistema de defensa frente a la agresión se divide en 2 categorías principales: defensas inmunitarias innatas y adaptativas. La defensa inmunitaria innata permite una respuesta inmediata (inflamación), que comienza minutos después de que tenga lugar la agresión, no guardando memoria inmunológica del estímulo desencadenante. Forman parte de este sistema las llamadas células citolíticas naturales, los leucocitos polimorfonucleares, (PMN: neutrófilos, eosinófilos, basófilos), los macrófagos y diversas citocinas, que se activan o liberan de forma inmediata, produciéndose el fenómeno de fagocitosis y lisis intracelular.
La defensa inmunitaria adaptativa incluye la inmunidad celular y humoral. Los principales efectores de la inmunidad celular son los linfocitos derivado del timo, linfocitos T, en cuya superficie se expresan antígenos (CD4, CD8, entre otros) que identifican subpoblaciones funcionales específicas.
Los principales efectores de la inmunidad humoral son los linfocitos derivados de la médula ósea (linfocitos B) que son productores de inmunoglobulinas cuando se transforman en células plasmáticas tras de su activación por un estímulo antigénico.
Desde hace años están descritas los efectos deletéreos de las anemias –entre ellas las de tipo ferropénico- y la gran susceptibilidad de los pacientes anémicos a las infecciones así como las alteraciones que se producen en la inmunoregulación, principalmente en cuanto a sus efectores linfocitarios (linfocitos B y T).
La deficiencia de hierro afecta la función leucocitaria, a través de la disfunción del sistema enzimático que contiene hierro (mieloperoxidasas). La afectación de la función humoral (células B) se ha demostrado en el hombre y en ratas deficientes de hierro. La inmunidad mediada por células (células T) también está afectada, con una disminución en la producción de células T circulantes y de cambios diferenciales en las subpoblaciones linfocitarias. Los bajos niveles de hierro se han demostrado ligados a inhibición de las células T CD4+ y aumento de la función de las células T supresoras(6,7). En individuos con déficit nutricional de hierro hay disminución de la función linfocitaria (particularmente de linfocitos T) y de la función neutrófila. También disminuyen las inmunoglobulinas séricas, la producción de anticuerpos en respuesta a antígenos y el número y función de los linfocitos T y B, por la desnutrición calórico-proteica(8,9).
Las alteraciones del metabolismo del hierro por activación del sistema inmunitario también se han documentado en los pacientes quirúrgicos ingresados en la UCI(7,10). La anemia de las enfermedades crónicas es una anemia de activación inmunitaria, en respuesta a antígenos extraños (bacterias, parásitos, virus, neoplasias), con producción de citocinas, que inhibe la acción de la eritropoyetina (EPO) sobre las células de la medula ósea y la producción de EPO por el riñón, produciéndose una anemia hipoproliferativa(11).
También se ha descrito que modifican el comportamiento linfocitario los procesos de estrés quirúrgico o por otro tipo de agresión(12). La supresión de la inmunidad celular, secundaria a la disminución de la función inmunocítica, es uno de los mecanismos de la respuesta del huésped a la agresión quirúrgica. Cuando el organismo es expuesto al estrés quirúrgico, el sistema endocrino secreta varias hormonas, tales como la hormona adrenocorcitotropina (ACTH), cortisol y catecolaminas, en una respuesta mediada por el eje hipotálamo-hipófisis- glándulas suprarrenales, y el sistema nervioso autonómico.
Debido a que hay una clara relación entre los sistemas nervioso, endocrino e inmunológico, la inmunosupresión en respuesta a la agresión quirúrgica es causada por una compleja interacción de varias hormonas, particularmente corticoesteroides adrenales, citocinas y reactantes de fase aguda.
Cuando el huésped es expuesto al estrés quirúrgico, o a otro tipo de agresión, los granulocitos aumentan en sangre periférica, pero los linfocitos tienden a disminuir. La disminución de los linfocitos es atribuible a las disminuciones de linfocitos T CD3+ y CD4+. Con esta disminución de los linfocitos totales y los cambios en las subpoblaciones linfocitarias se altera negativamente la inmunidad celular (14). La supresión de la función linfocitaria periférica observada durante las intervenciones quirúrgicas, con supresión de la inmunidad celular, puede persistir hasta 2 semanas después de la intervención realizada. El incremento de los linfocitos que deprime la inmunidad celular y la disminución de los que la promocionan, son causados por el estrés quirúrgico.
Las células T CD4+ son células importantes en múltiples y variadas reacciones inmunitarias. Las células T CD4+ (Th) pueden ser clasificadas como células Th0, Th1 y Th2, de acuerdo con sus distintos patrones de producción de citocinas. Las células Th1 y Th2 son células T maduras, que se han diferenciado de las células Th0. Las primeras incrementan la inmunidad celular, con producción de IL-2, interferón gamma y factor de necrosis tumoral (TNF) beta, mientras que las segundas inducen producción de anticuerpos específicos de las células B, por la producción de IL-4, IL-5, IL-6, IL-10 e IL-13.
Así pues, las células Th1 y Th2 mantienen la homeostasis del sistema inmune y el balance de las Th1/Th2 es regulado por varias hormonas y citocinas; los cambios que se produzcan en el balance, favorables a las células Th2 a través de la actividad de la IL-6 provocado por la agresión quirúrgica, van a favorecer la supresión de la inmunidad celular.
Los niveles sanguíneos de citocinas, tales como la interleucina 1 (IL-1), el factor de necrosis tumoral, la IL-6 y la IL-8, también se incrementan en respuesta a la agresión (cirugía, tumores, sepsis), y pueden causar un aumento en las llamados reactantes de fase aguda, incluyendo entre otras la proteína ácida inmunosupresora, (immunosuppressive acid protein, IAP), o la proteína C reactiva. La IAP es una proteína con un peso molecular de 59.000 KDa, semejante a la α-1-ácido glicoproteína, que fue originariamente purificada a partir de ascitis cancerosa. Es un factor inmunosupresor no específico de gran potencia biológica, y modula la expresión de los antígenos CD4 por los linfocitos, pero los detalles de sus efectos inmunosupresores no son aún bien conocidos. El incremento de sus valores séricos esta relacionado con la progresión del tumor y refleja inmunodeficiencia en los pacientes cancerosos. Como reactante de fase aguda, la IAP es producida por los hepatocitos durante la inflamación aguda, después de la estimulación con IL-6, presentando una fuerte actividad inmunosupresora.
Varios autores han estudiado la asociación de hormonas, citocinas y reactantes de fase aguda con la supresión de la inmunidad celular. Nosotros hemos estudiado la asociación entre las anemias y las alteraciones inmunológicas en pacientes cancerosos y sépticos, obteniendo resultados similares en el análisis de las poblaciones linfocitarias(14). Hemos analizado a un grupo determinado de pacientes (postoperados por cáncer o sépticos), en los cuales valoramos la anemia y el metabolismo del hierro (hemograma, sideremia, ferritina, transferrina). Para la valoración de su estado inmunológico, estudiamos los linfocitos totales, distintas subpoblaciones linfocitarias (linfocitos T, CD4, CD8, linfocitos B, y células NK) y las inmunoglobulinas plasmáticas(13,14).
Nuestros datos reflejan que los pacientes postoperados y sépticos estaban anémicos, con valores bajos de hemoglobina y hierro, y altos niveles de ferritina sérica, especialmente en el grupo de pacientes sépticos, indicativas de anemias de enfermedades crónicas por procesos tumorales y/o anemias agudas por la inflamación o sepsis(15,16).
Si nos referimos a su situación inmunológica, la leucocitosis era más marcada en los pacientes sépticos y las linfopenias, muy acusadas, estaban presentes en ambos grupos, aunque los linfocitos T (CD3+, CD4+, CD8+) estaban más bajos en los pacientes sépticos (linfocitos T CD4). La ratio CD4/CD8 no estaba alterada en ningún grupo, ratio que en algunos procesos médicos, por ejemplo, infección por VIH, con severa afectación de los linfocitos T CD4+, están muy alterada y con valores bajos. En cuanto a los linfocitos B (CD19+), había aumento (mayor en los pacientes sépticos), y no había modificaciones en las células citolíticas NK en los 2 grupos analizados.
La linfopenia y las alteraciones en las poblaciones linfocitarias que observamos en el grupo de pacientes postoperados puede atribuirse a su proceso de base, por el cual fueron intervenidos, situación que no se da en el grupo de pacientes sépticos, con linfopenias y alteraciones de las subpoblaciones linfocitarias, -básicamente disminución de linfocitos T CD4+− y con clara alteración de la respuesta inflamatoria por la sepsis (alteraciones del metabolismo del hierro, con anemia, hipoferremia, hipotrasnferrinemia, hiperferritinemia)(3,4,6,7,10,11,18-20).
No observamos alteraciones significativas en los niveles séricos de las inmunoglobulinas, y esto puede ser atribuido a que para que se desarrolle la respuesta inmune humoral no solo es necesario el estímulo antigénico, sino también el estímulo de ciertas citocinas, ya mencionadas, como las interleucinas IL-7, IL-10, IL-13, e IL-15. Éstas moléculas son activadas en los procesos de agresión, y podrían interferir en la homeostasis de las células linfocitarias y del sistema inmunitario(14,17).
Entendemos que así como en la respuesta del huésped a la agresión se afecta el metabolismo del hierro como expresión de la alteración del estado inflamatorio que genera, en la respuesta del huésped a estas agresiones, en su componente inmunológico, va a presentar modificaciones inmunitarias, por medio de alteraciones de la homeostasis linfocitaria, en su brazo inmunosupresor, con afectación del sistema inmune. Esto puede condicionar o incidir en la evolución clínica de los pacientes. También hemos observado que estas alteraciones del metabolismo del hierro y de los linfocitos, expresadas en los altos niveles de ferritina sérica y las más acusadas alteraciones linfocitarias, eran más llamativas en los pacientes estudiados por sepsis, posiblemente como desarrollo del fenómeno "agudo" de la agresión (alteraciones del estado inflamatorio).
La interacción entre el sistema inmunitario y los fenómenos de agresión se puede ver reflejada en estas alteraciones cuantitativas (descenso de los valores de linfocitos totales y células T CD4+) y cualitativas (desequilibrios en las proporciones de las diversas subpoblaciones funcionales de linfocitos), alterándose la homeostasis del sistema inmunitario. Estas alteraciones linfocitarias pudieran acompañarse de una mayor frecuencia de infecciones postoperatorias y de dificultades en el control de la agresión ya establecida (sepsis). Creemos que el tratamiento de estas anemias (hierro parenteral, con/sin EPO añadido, etc.) puede mejorar la respuesta inmunitaria de estos pacientes.
CONFLICTO DE INTERÉSLos autores declaran no tener conflicto de interés.